Trắc nghiệm Tổng hợp bài tập muối aluminat tác dụng với axit - Hóa 12
Đề bài
Cho p mol Na[Al(OH)4] tác dụng với dung dịch chứa q mol HCl. Để thu được kết tủa thì cần có tỉ lệ
-
A.
p : q < 1: 4
-
B.
p : q = 1: 2
-
C.
p : q > 1: 4
-
D.
p : q = 1: 4
Hòa tan hỗn hợp gồm 0,27 gam bột Al và 2,04 gam bột Al2O3 trong dung dịch NaOH dư thu được dung dịch X. Cho CO2 dư tác dụng với dung dịch X thu được kết tủa X1, nung X1 ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn X2. Biết H = 100%, khối lượng X2 là
-
A.
2,55 gam
-
B.
2,31 gam
-
C.
3,06 gam
-
D.
2,04 gam
Cho 12,6 gam hỗn hợp X gồm Al và Al4C3 vào dung dịch KOH dư, sau khi các phản ứng xảy ra hoàn toàn thu được a mol hỗn hợp khí Y và dung dịch Z. Sục khí CO2 dư vào dung dịch Z thu được 31,2 gam kết tủa. Giá trị của a là
-
A.
0,25
-
B.
0,35
-
C.
0,30
-
D.
0,45
Cho hỗn hợp X gồm Ba và Al (đều có a mol) tan hoàn toàn trong nước dư thu được dung dịch Y và khí Z. Nhỏ tiếp a mol H2SO4 vào dung dịch Y thu được kết tủa T. Nung T ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn G. Thành phần của chất rắn G là
-
A.
Al2O3 và BaSO4
-
B.
Al2O3
-
C.
Al(OH)3 và BaSO4
-
D.
BaSO4
Sục từ từ tới dư khí CO2 vào 400 ml dung dịch Ba(AlO2)2 0,25M. Sau phản ứng hoàn toàn thu được kết tủa có khối lượng là
-
A.
7,8 gam
-
B.
15,6 gam
-
C.
25,4 gam
-
D.
11,7 gam
Cho m gam hỗn hợp X gồm Al và Ba có tỉ lệ mol 1 : 1 vào nước dư thu được dung dịch Y và V lít H2. Sục V lít CO2 vào dung dịch Y thu được 5,85 gam kết tủa. Thể tích các khí đo ở cùng điều kiện. Giá trị của m là
-
A.
9,84
-
B.
12,3
-
C.
20,5
-
D.
16,4
Cho V lít dung dịch NaOH 1M vào 200 ml dung dịch Al2(SO4)3 0,25M thì thu được kết tủa X và dung dịch Y. Sục khí CO2 tới dư vào dung dịch Y lại thu được 2,34 gam kết tủa. Giá trị của V là
-
A.
0,06
-
B.
0,23
-
C.
0,33
-
D.
0,43
Cần ít nhất bao nhiêu ml dung dịch HCl 1M cần cho vào 500 ml dung dịch Na[Al(OH)4] 0,1M để thu được 0,78 g chất kết tủa?
-
A.
10 ml
-
B.
100 ml
-
C.
15 ml
-
D.
170 ml
Cho dung dịch A chứa 0,05 mol Na[Al(OH)4] và 0,1 mol NaOH tác dụng với dung dịch HCl 2M. Thể tích dung dịch HCl 2M lớn nhất cho vào dung dịch A để xuất hiện 1,56 gam kết tủa là
-
A.
0,06 lít
-
B.
0,18 lít
-
C.
0,12 lít
-
D.
0,08 lít
Thêm dung dịch HCl vào dung dịch hỗn hợp gồm 0,1 mol NaOH và 0,1 mol Na[Al(OH)4] thu được 0,08 mol chất kết tủa. Số mol HCl đã thêm vào là:
-
A.
0,16 mol
-
B.
0,18 hoặc 0,26 mol
-
C.
0,08 hoặc 0,16 mol
-
D.
0,26 mol
Hòa tan hoàn toàn m gam hỗn hợp Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
-
A.
23,4 và 37,9
-
B.
5,2 và 37,9
-
C.
15,6 và 27,7
-
D.
15,6 và 55,4
Cho 12,9 gam hỗn hợp X gồm Al và Al2O3 vào 400 ml dung dịch NaOH 1M, đun nóng. Sau phản ứng hoàn toàn thu được dung dịch Y và thấy thoát ra 3,36 lít H2 (đktc). Thêm 150 ml dung dịch H2SO4 1M vào dung dịch Y, thu được kết tủa có khối lượng là
-
A.
7,8 gam
-
B.
23,4 gam
-
C.
19,5 gam
-
D.
15,6 gam
Cho 200 ml dung dịch X gồm Ba(OH)2 0,5M và NaAlO2 (hay Na[Al(OH)4]) 1,5M. Thêm từ từ dung dịch H2SO4 0,5M vào X cho đến khi kết tủa tan trở lại một phần, thu được kết tủa Y. Đem nung Y đến khối lượng không đổi được 24,32 gam chất rắn Z. Thể tích dung dịch H2SO4 0,5M đã dùng là
-
A.
0,55 lít
-
B.
1,34 lít
-
C.
0,67 lít
-
D.
1,10 lít
Cho từ từ dung dịch HCl loãng vào dung dịch chứa x mol NaOH và y mol NaAlO2 (hay Na[Al(OH)4]). Sự phụ thuộc của số mol kết tủa thu được vào số mol HCl được biểu diễn theo đồ thị sau:
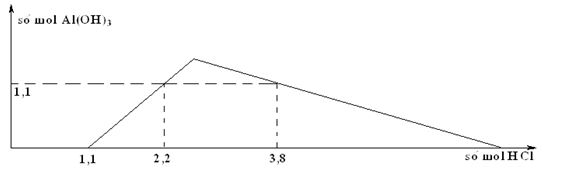
Giá trị của y là
-
A.
1,4
-
B.
1,8
-
C.
1,5
-
D.
1,7
Cho đồ thị biểu diễn mối liên hệ giữa lượng ion H+ và lượng kết tủa Al(OH)3 trong phản ứng của dung dịch chứa ion H+ với dung dịch chứa ion AlO2− như sau :
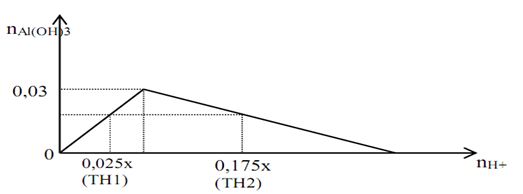
Với x là nồng độ mol/l của dung dịch HCl. Khối lượng kết tủa trong 2 trường hợp đều là a (gam). Dựa vào đồ thị, giá trị của a là
-
A.
0,780
-
B.
0,936
-
C.
1,950
-
D.
0,468
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol Ba(OH)2 và b mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
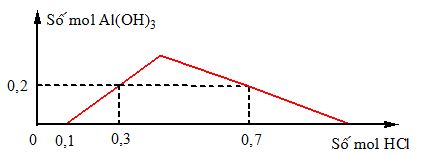
Tỉ lệ a : b là
-
A.
1:3
-
B.
1:2
-
C.
2:3
-
D.
2:1
Hỗn hợp X gồm CaC2 x mol và Al4C3 y mol. Cho một lượng nhỏ X vào nước rất dư thu được dung dịch Y, hỗn hợp khí Z gồm C2H2, CH4 và a gam kết tủa Al(OH)3. Đốt cháy hết Z rồi cho toàn bộ sản phẩm vào Y thu được 2a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tỉ lệ x : y bằng
-
A.
5:6
-
B.
1:2
-
C.
3:2
-
D.
4:3
Cho 200 ml dung dịch NaOH 3M vào 100 ml dung dịch AlCl3 1M thu được dung dịch X. Nhỏ từ từ đến hết V ml dung dịch HCl 1M vào dung dịch X thu được 5,85 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị lớn nhất của V là
-
A.
425
-
B.
275.
-
C.
175
-
D.
375
Lời giải và đáp án
Cho p mol Na[Al(OH)4] tác dụng với dung dịch chứa q mol HCl. Để thu được kết tủa thì cần có tỉ lệ
-
A.
p : q < 1: 4
-
B.
p : q = 1: 2
-
C.
p : q > 1: 4
-
D.
p : q = 1: 4
Đáp án : C
Ta có: Na[Al(OH)4]= NaAlO2 + 2 H2O
NaAlO2 + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + H2O
=> Thu được kết tủa thì quan hệ giữa H+ và NaAlO2
Na[Al(OH)4]= NaAlO2 + 2 H2O
NaAlO2 + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + H2O
=> Để thu được kết tủa thì nH+ (Hay nHCl)< 4.nNa[Al(OH)4] => q< 4p => p/q > 1/4
Hòa tan hỗn hợp gồm 0,27 gam bột Al và 2,04 gam bột Al2O3 trong dung dịch NaOH dư thu được dung dịch X. Cho CO2 dư tác dụng với dung dịch X thu được kết tủa X1, nung X1 ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn X2. Biết H = 100%, khối lượng X2 là
-
A.
2,55 gam
-
B.
2,31 gam
-
C.
3,06 gam
-
D.
2,04 gam
Đáp án : A
Bảo toàn Al
Thấy được chất rắn sau quá trình phản ứng là Al2O3
Bảo toàn Al: 2nAl2O3 sau phản ứng = nAl + 2nAl2O3 => nAl2O3 sau phản ứng = (0,01 + 0,02.2) / 2 = 0,025 mol
=> mX = 0,025.102 = 2,55 gam
Cho 12,6 gam hỗn hợp X gồm Al và Al4C3 vào dung dịch KOH dư, sau khi các phản ứng xảy ra hoàn toàn thu được a mol hỗn hợp khí Y và dung dịch Z. Sục khí CO2 dư vào dung dịch Z thu được 31,2 gam kết tủa. Giá trị của a là
-
A.
0,25
-
B.
0,35
-
C.
0,30
-
D.
0,45
Đáp án : D
+) Kết tủa thu được sau khi sục CO2 dư là Al(OH)3
+) Bảo toàn Al
+) Bảo toàn H
Gọi nAl = x mol; nAl4C3 = y mol => 27x + 144y = 12,6 (1)
Kết tủa thu được sau khi sục CO2 dư là Al(OH)3 => nAl(OH)3 = 0,4 mol
Bảo toàn Al: x + 4y = 0,4 (2)
Từ (1) và (2) => x = 0,2 mol; y = 0,05 mol
Khí thu được là H2 (1,5x mol) và CH4 (3y mol)
=> nkhí = a = 1,5x + 3y = 0,45 mol
Cho hỗn hợp X gồm Ba và Al (đều có a mol) tan hoàn toàn trong nước dư thu được dung dịch Y và khí Z. Nhỏ tiếp a mol H2SO4 vào dung dịch Y thu được kết tủa T. Nung T ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn G. Thành phần của chất rắn G là
-
A.
Al2O3 và BaSO4
-
B.
Al2O3
-
C.
Al(OH)3 và BaSO4
-
D.
BaSO4
Đáp án : A
xem lại lí thuyết muối aluminat tác dụng với H+
$\left\{ \begin{gathered}Ba:a\,\,mol \hfill \\Al:a\,\,m{\text{o}}l \hfill \\ \end{gathered} \right.\xrightarrow{{ + {H_2}O}}\left\{ \begin{gathered}ddY:\,\,\left\{ \begin{gathered}Ba{(Al{O_2})_2}:0,5a\,\,mol \hfill \\Ba{(OH)_2}:0,5a\,\,mol \hfill \\ \end{gathered} \right.\xrightarrow{{a\,\,mol\,\,{H_2}S{O_4}}}\left\{\begin{gathered}Al{(OH)_3}:\frac{{2a}}{3}\,\,mol \hfill \\BaS{O_4}:a\,\,mol \hfill \\ \end{gathered} \right.\xrightarrow{{{t^o}}}\left\{ \begin{gathered}A{l_2}{O_3} \hfill \\BaS{O_4} \hfill \\ \end{gathered} \right. \hfill \\Z:{H_2} \hfill \\ \end{gathered} \right.$
Sục từ từ tới dư khí CO2 vào 400 ml dung dịch Ba(AlO2)2 0,25M. Sau phản ứng hoàn toàn thu được kết tủa có khối lượng là
-
A.
7,8 gam
-
B.
15,6 gam
-
C.
25,4 gam
-
D.
11,7 gam
Đáp án : B
Bảo toàn Al
nBa(AlO2)2 = 0,1 mol
Bảo toàn nguyên tử Al: nAl(OH)3 = nAlO2- = 0,2 mol
=> m = 15,6 gam
+ tính nhầm số mol AlO2- là 0,1 mol => chọn nhầm A
Cho m gam hỗn hợp X gồm Al và Ba có tỉ lệ mol 1 : 1 vào nước dư thu được dung dịch Y và V lít H2. Sục V lít CO2 vào dung dịch Y thu được 5,85 gam kết tủa. Thể tích các khí đo ở cùng điều kiện. Giá trị của m là
-
A.
9,84
-
B.
12,3
-
C.
20,5
-
D.
16,4
Đáp án : B
Ba + H2O → Ba(OH)2 + H2
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
+) dung dịch Y gồm Ba(AlO2)2 (0,5a mol) và Ba(OH)2 dư (0,5a mol)
Sục V lít CO2 (hay 2,5a mol CO2) vào Y
2CO2 + Ba(AlO2)2 + 4H2O → 2Al(OH)3 + Ba(HCO3)2
a ← 0,5a → a
2CO2 + Ba(OH)2 → Ba(HCO3)2
a ← 0,5a → 0,5a
=> kết tủa thu được chỉ là Al(OH)3
Gọi nAl = a mol => nBa = a mol
Ba + H2O → Ba(OH)2 + H2
a → a
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
a → 0,5a → 0,5a → 1,5a
=> dung dịch Y gồm Ba(AlO2)2 (0,5a mol) và Ba(OH)2 dư (0,5a mol)
Sục V lít CO2 (hay 2,5a mol CO2) vào Y
2CO2 + Ba(AlO2)2 + 4H2O → 2Al(OH)3 + Ba(HCO3)2
a ← 0,5a → a
2CO2 + Ba(OH)2 → Ba(HCO3)2
a ← 0,5a → 0,5a
=> kết tủa thu được chỉ là Al(OH)3 => mkết tủa = 78a = 5,85 => a = 0,075 mol
=> m = 0,075.27 + 0,075.137 = 12,3 gam
Cho V lít dung dịch NaOH 1M vào 200 ml dung dịch Al2(SO4)3 0,25M thì thu được kết tủa X và dung dịch Y. Sục khí CO2 tới dư vào dung dịch Y lại thu được 2,34 gam kết tủa. Giá trị của V là
-
A.
0,06
-
B.
0,23
-
C.
0,33
-
D.
0,43
Đáp án : C
bài toán muối nhôm tác dụng với dung dịch kiềm
+ Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3
+ Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b
+ Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn
nAl2(SO4)3 = 0,2. 0,25 = 0,05 mol => n Al3+ = 0,05.2 = 0,1 mol
n↓ Al(OH)3 = 2,34: 78 = 0,03 mol
=> ↓ thực tế là : 0,1 – 0,03 = 0,07 mol Al(OH)3
Vậy dung dịch gồm: NaAlO2 : 0,03 mol và Na2SO4 : 0,05. 3 = 0,15 mol
=> ∑ nNa = 0,03 + 0,15.2 = 0,33 mol
=> V = 0,33 : 1 = 0,33 lít
Cần ít nhất bao nhiêu ml dung dịch HCl 1M cần cho vào 500 ml dung dịch Na[Al(OH)4] 0,1M để thu được 0,78 g chất kết tủa?
-
A.
10 ml
-
B.
100 ml
-
C.
15 ml
-
D.
170 ml
Đáp án : A
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a $\geqslant $ 4 thì không có kết tủa
Ta có: a = 0,05 mol; b = 0,01 mol => b < a
Đề bài yêu cầu tính VHCl nhỏ nhất có nghĩa là phải tính nH+ min thì nH+ = b = 0,01
=> V = 0,01 lít = 10 ml
Cho dung dịch A chứa 0,05 mol Na[Al(OH)4] và 0,1 mol NaOH tác dụng với dung dịch HCl 2M. Thể tích dung dịch HCl 2M lớn nhất cho vào dung dịch A để xuất hiện 1,56 gam kết tủa là
-
A.
0,06 lít
-
B.
0,18 lít
-
C.
0,12 lít
-
D.
0,08 lít
Đáp án : C
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a $ \geqslant $ 4 thì không có kết tủa
nHCl trung hoà NaOH = 0,1 mol.
a = 0,05 mol; b = 0,02 mol => b < a
Đề bài yêu cầu tính thể tích HCl lớn nhất có nghĩa là phải tính nH+ max thì nH+ = 4a – 3b = 0,14 mol.
=> VHCl = (0,1 + 0,14) / 2 = 0,12 lít
Thêm dung dịch HCl vào dung dịch hỗn hợp gồm 0,1 mol NaOH và 0,1 mol Na[Al(OH)4] thu được 0,08 mol chất kết tủa. Số mol HCl đã thêm vào là:
-
A.
0,16 mol
-
B.
0,18 hoặc 0,26 mol
-
C.
0,08 hoặc 0,16 mol
-
D.
0,26 mol
Đáp án : B
TH1: Al3+ chưa kết tủa hết: nHCl = nNaOH + nAl(OH)3
TH2: kết tủa bị hoà tan 1 phần
OH- + H+ → H2O
AlO2- + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3 H2O
Ta có: nHCl trung hoà NaOH = 0,1 mol.
TH1: Kết tủa chưa bị hòa tan:
OH- + H+ → H2O
AlO2- + H+ + H2O → Al(OH)3
nHCl = nNaOH + nAl(OH)3 = 0,1 +b = 0,1 +0,08 = 0,18 mol
TH2: Kết tủa bị hòa tan 1 phần
OH- + H+ → H2O
0,1 0,1
AlO2- + H+ + H2O → Al(OH)3
0,1 0,1 0,1
Al(OH)3 + 3H+ → Al3+ + 3 H2O
0,02 0,06
nHCl = 0,1 + 0,1 + 0,06 = 0,26 mol
Không cộng số mol NaOH sẽ tính ra đáp án C
Hòa tan hoàn toàn m gam hỗn hợp Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
-
A.
23,4 và 37,9
-
B.
5,2 và 37,9
-
C.
15,6 và 27,7
-
D.
15,6 và 55,4
Đáp án : C
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a $ \geqslant $ 4 thì không có kết tủa
+ Bảo toàn nguyên tố Na: 2nNa2O = nNaAlO2 + nNaOH dư
+ Bảo toàn nguyên tố Al: 2nAl2O3 = nNaAlO2
Dung dịch X gồm NaAlO2 và NaOH dư
nHCl trung hòa NaOH dư = 0,1 mol
+ Khi hết 300 ml dung dịch HCl => kết tủa chưa bị hòa tan, H+ hết, NaAlO2 dư
=> nAl(OH)3 = nHCl = 0,3 – 0,1 = 0,2 mol => mAl(OH)3 = 0,2.78 = 15,6 gam
+ Khi hết 700 ml dung dịch HCl => kết tủa bị hòa tan 1 phần
=> nAl(OH)3 = (4.nNaAlO2 - nHCl) / 3 => 0,2.3 = 4.nNaAlO2 – (0,7 – 0,1)
=> nNaAlO2 = 0,3 mol
Bảo toàn nguyên tố Na: 2nNa2O = nNaAlO2 + nNaOH dư => nNa2O = (0,3 + 0,1) / 2 = 0,2 mol
Bảo toàn nguyên tố Al: 2nAl2O3 = nNaAlO2 => nAl2O3 = 0,3 / 2 = 0,15 mol
=> m = 27,7 gam
+ Tính số mol NaAlO2 theo hòa tan hết 300 ml HCl => chọn nhầm B
+ Bảo toàn nguyên tố Al sai: 2nAl2O3 = nNaAlO2 + nAl(OH)3 => chọn nhầm A
Cho 12,9 gam hỗn hợp X gồm Al và Al2O3 vào 400 ml dung dịch NaOH 1M, đun nóng. Sau phản ứng hoàn toàn thu được dung dịch Y và thấy thoát ra 3,36 lít H2 (đktc). Thêm 150 ml dung dịch H2SO4 1M vào dung dịch Y, thu được kết tủa có khối lượng là
-
A.
7,8 gam
-
B.
23,4 gam
-
C.
19,5 gam
-
D.
15,6 gam
Đáp án : D
+ Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3
+ Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b
+ Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn
nH2= 0,15 mol ; nNaOH = 0,4 mol
Do phản ứng hoàn toàn tạo dung dịch Y => Al, Al2O3 hết
=> nAl = 2/3 nH2 = 0,1 mol => nAl2O3 = 0,1 mol
=> Dung dịch Y gồm : 0,3 mol NaAlO2 và 0,1 mol NaOH dư
nH2SO4 = 0,15 mol => nH+ = 0,3 mol
=> nAl(OH)3 = nH+ - nNaOH dư = 0,2 mol
=> mkết tủa = 15,6 gam
+ Quên phản ứng H+ với NaOH dư => nAl(OH)3 = nH+ => chọn nhầm B
Cho 200 ml dung dịch X gồm Ba(OH)2 0,5M và NaAlO2 (hay Na[Al(OH)4]) 1,5M. Thêm từ từ dung dịch H2SO4 0,5M vào X cho đến khi kết tủa tan trở lại một phần, thu được kết tủa Y. Đem nung Y đến khối lượng không đổi được 24,32 gam chất rắn Z. Thể tích dung dịch H2SO4 0,5M đã dùng là
-
A.
0,55 lít
-
B.
1,34 lít
-
C.
0,67 lít
-
D.
1,10 lít
Đáp án : B
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a $ \geqslant $ 4 thì không có kết tủa
nBa(OH)2 = 0,1 mol ; nNaAlO2 = 0,3 mol
Kết tủa tan trở lại 1 phần :
OH- + H+ → H2O
AlO2- + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
=> BaSO4 đạt kết tủa tối đa và còn một lượng Al2O3
=> nAl2O3 = 0,01 mol => nAl(OH)3 = 0,02 mol
=> nH+ = nOH- + 4nAlO2 – 3nAl(OH)3 = 1,34 mol
=> Vdd H2SO4 = 1,34 lít
Cho từ từ dung dịch HCl loãng vào dung dịch chứa x mol NaOH và y mol NaAlO2 (hay Na[Al(OH)4]). Sự phụ thuộc của số mol kết tủa thu được vào số mol HCl được biểu diễn theo đồ thị sau:

Giá trị của y là
-
A.
1,4
-
B.
1,8
-
C.
1,5
-
D.
1,7
Đáp án : C
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a $ \geqslant $ 4 thì không có kết tủa
Tại nHCl = 1,1 mol => Trung hòa hết NaOH => x = 1,1 mol
+)Tại nHCl = 2,2 mol => AlO2 dư
+) Tại : nHCl = 3,8 mol => Kết tủa tan 1 phần => 3nAl(OH)3 = 4nAlO2 – (nH+ - nOH-)
=> y = 1,5 mol
Cho đồ thị biểu diễn mối liên hệ giữa lượng ion H+ và lượng kết tủa Al(OH)3 trong phản ứng của dung dịch chứa ion H+ với dung dịch chứa ion AlO2− như sau :

Với x là nồng độ mol/l của dung dịch HCl. Khối lượng kết tủa trong 2 trường hợp đều là a (gam). Dựa vào đồ thị, giá trị của a là
-
A.
0,780
-
B.
0,936
-
C.
1,950
-
D.
0,468
Đáp án : B
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a $ \geqslant $ 4 thì không có kết tủa
Theo đồ thị ta có nAlO2− = nkết tủa max = 0,03 mol
=>TH1: AlO2− dư, còn TH2 thì kết tủa bị hòa tan 1 phần
=> nkết tủa = 0,025x = (4.0,03 – 0,175x) / 3
=> x = 0,48 mol
=> a = 0,025x.78 = 0,936 gam
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol Ba(OH)2 và b mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:

Tỉ lệ a : b là
-
A.
1:3
-
B.
1:2
-
C.
2:3
-
D.
2:1
Đáp án : A
+ Nếu b/a $ \leqslant $ 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a $ \geqslant $ 4 thì không có kết tủa
+ Trong khoảng từ 0 – 0,1 thì HCl làm nhiệm vụ trung hòa Ba(OH)2
=> nBa(OH)2 = a = nHCl / 2 = 0,05 mol
+ nHCl = 0,7 mol làm 2 nhiệm vụ: đưa kết tủa cực đại sau đó hòa tan kết tủa
=> nAl(OH)3 = (4.nAlO2- - nHCl phản ứng với AlO2-) / 3 => 3.0,2 = 4.2b – (0,7 – 0,1)
=> b = 0,15 mol
=> a : b = 1 : 3
+ Tính nhầm số mol Ba(OH)2 bằng số mol HCl => chọn nhầm C
Hỗn hợp X gồm CaC2 x mol và Al4C3 y mol. Cho một lượng nhỏ X vào nước rất dư thu được dung dịch Y, hỗn hợp khí Z gồm C2H2, CH4 và a gam kết tủa Al(OH)3. Đốt cháy hết Z rồi cho toàn bộ sản phẩm vào Y thu được 2a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tỉ lệ x : y bằng
-
A.
5:6
-
B.
1:2
-
C.
3:2
-
D.
4:3
Đáp án : D
Gọi nCaC2 = x mol
Bảo toàn Ca và bảo toàn C => nCa(OH)2 = nC2H2 = x mol
Gọi nAl4C3 = y mol
Bảo toàn Al : nAl(OH)3 = 4y mol
Bảo toàn C: nCH4 = 3y mol
2Al(OH)3 + Ca(OH)2 → Ca(AlO2)2 + 4H2O
2x ← x → x
=> Phần Al(OH)3 còn lại = 4y – 2x = a / 78 (1)
Đốt Z thu được nCO2 = 2x + 3y
Hấp thụ CO2 này vào phần dung dịch chứa Ca(AlO2)2 (x mol)
2CO2 + Ca(AlO2)2 + 4H2O → Ca(HCO3)2 + 2Al(OH)3
=> kết tủa chỉ còn Al(OH)3 = 2x = 2a / 78 (2)
Từ (1) và (2) => x = a / 78 và y = 3a / 312
=> x : y = 4 : 3
Cho 200 ml dung dịch NaOH 3M vào 100 ml dung dịch AlCl3 1M thu được dung dịch X. Nhỏ từ từ đến hết V ml dung dịch HCl 1M vào dung dịch X thu được 5,85 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị lớn nhất của V là
-
A.
425
-
B.
275.
-
C.
175
-
D.
375
Đáp án : D
Lập tỉ lệ nOH-/nAl3+ → xác định được phản ứng tạo ra muối AlO2‑, OH- còn dư sau phản ứng
Xác định thành phần các chất trong dd X gồm: AlO2-; OH‑ và Cl‑
Cho dd X + V ml HCl → tạo ra 5,85 gam kết tủa. V lớn nhất ứng với trường hợp tạo kết tủa Al(OH)3 sau đó kết tủa hòa tan 1 phần
CT nhanh: nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 còn lại
nNaOH = 0,2.3 = 0,6 (mol)
nAlCl3 = 0,1.1 = 0,1 (mol)
Ta có: \(\dfrac{{{n_{O{H^ - }}}}}{{{n_{A{l^{3 + }}}}}} = \dfrac{{0,6}}{{0,1}} = 6 > 4\)→ phản ứng tạo ra muối AlO2-, kết tủa Al(OH)3 tan hoàn toàn, dd sau pư dư OH-
Al3+ + 4OH- → AlO2- + H2O
0,1 → 0,4 → 0,1 (mol)
Vậy dd X thu được sau pư chứa: \(\left\{ \begin{gathered}Al{O_2}^ - :0,1\,(mol) \hfill \\O{H^ - }:0,6 - 0,4 = 0,2\,(mol) \hfill \\C{l^ - }:0,3\,(mol) \hfill \\ \end{gathered} \right.\)
Cho dd X + V ml HCl → tạo ra 5,85 gam kết tủa. V lớn nhất ứng với trường hợp tạo kết tủa Al(OH)3 sau đó kết tủa hòa tan 1 phần
nAl(OH)3 = 5,85:78 = 0,075 (mol)
H+ + OH- → H2O
0,2 ← 0,2 (mol)
AlO2- + H+ + H2O → Al(OH)3↓
0,1 → 0,1 → 0,1 (mol)
Al(OH)3 + 3H+ → Al3+ + 3H2O
(0,1 - 0,075)→ 0,075 (mol)
→ ∑ nH+ = 0,2 + 0,1 + 0,075 = 0,375 (mol)
→ VHCl = nHCl : CM = 0,375 : 1 = 0,375 (lít) = 375 (ml)
Luyện tập và củng cố kiến thức Tổng hợp bài tập phản ứng nhiệt nhôm hoàn toàn Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập phản ứng nhiệt nhôm không hoàn toàn Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Kim loại kiềm - kiềm thổ - nhôm hay và khó (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Kim loại kiềm - kiềm thổ - nhôm hay và khó (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 6 Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch kiềm Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 27. Hợp chất của nhôm Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 27. Nhôm và hợp chất Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập axit tác dụng với muối cacbonat Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập CO2 tác dụng với dung dịch kiềm Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 26. Nước cứng Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập kim loại kiềm và kiềm thổ tác dụng với nước Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 26. Kim loại kiềm thổ và hợp chất Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 25. Kim loại kiềm và hợp chất Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận