Trắc nghiệm Bài 9. Đốt cháy amin - Hóa 12
Đề bài
Đốt cháy 1 amin A thu được ${{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}=1,5{{n}_{a\min }}$ thì amin đó là
-
A.
amin no, hai chức, mạch hở.
-
B.
amin không no (trong phân tử có 1 liên kết đôi C=C), hai chức, mạch hở.
-
C.
amin no, đơn chức, mạch hở.
-
D.
bất kì amin nào.
Khi đốt cháy a mol amin X no, mạch hở ta thu được x mol CO2; y mol H2O; z mol N2. Biểu thức đúng là
-
A.
a = y – x – z.
-
B.
a = y – x + z.
-
C.
a = y – x.
-
D.
a = x + z – y.
Đốt cháy hoàn toàn 1 amin no, mạch hở, đơn chức X bằng một lượng khí oxi vừa đủ, thu được 8,96 lít khí CO2 và 9,9 gam H2O. CTPT của X là
-
A.
C2H7N.
-
B.
C4H11N.
-
C.
CH5N.
-
D.
C4H9N.
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,8 lít khí CO2; 2,8 lít khí N2 (các thể tích khí đo ở điều kiện tiêu chuẩn) và 20,25 gam H2O. CTPT của X là
-
A.
C4H9N.
-
B.
C3H7N.
-
C.
C2H7N.
-
D.
C3H9N.
Đốt cháy một hỗn hợp amin A cần V lít O2 (đktc) thu được N2 và 31,68 gam CO2 và 7,56 gam H2O. Giá trị V là
-
A.
25,536.
-
B.
20,160.
-
C.
20,832.
-
D.
26,880.
Đốt cháy hoàn toàn m gam một amin X bằng lượng không khí vừa đủ thu được 17,6 gam CO2, 12,6 gam H2O và 69,44 lít N2 (đktc). Giả thiết không khí chỉ gồm N2 và O2 trong đó oxi chiếm 20% thể tích không khí. X có công thức là :
-
A.
C2H5NH2.
-
B.
C3H7NH2.
-
C.
CH3NH2.
-
D.
C4H9NH2.
Đốt cháy hoàn toàn amin X bằng oxi vừa đủ, dẫn toàn bộ sản phẩm qua bình chứa dungdịch Ca(OH)2 dư thấy có 4 gam kết tủa và khối lượng bình tăng 3,2 gam và có 0,448 lít khí (đktc) thoát ra khỏi bình. X có CTPT là
-
A.
C2H8N2.
-
B.
CH5N.
-
C.
C3H10N2.
-
D.
C3H7NH2.
Đốt cháy hoàn toàn 6,2 gam một amin no, mạch hở đơn chức cần dùng 10,08 lít khí O2 (đktc). CTPT của amin là
-
A.
C2H5NH2.
-
B.
CH3NH2.
-
C.
C3H7NH2.
-
D.
C4H9NH2.
Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của 2 amin là :
-
A.
CH5N và C2H7N.
-
B.
C2H7N và C3H9N.
-
C.
C3H9N và C4H11N.
-
D.
kết quả khác.
Có hai amin bậc một gồm A (đồng đẳng của anilin) và B (đồng đẳng của metylamin). Đốt cháy hoàn toàn 3,21 gam amin A sinh ra khí CO2, hơi H2O và 336 cm3 khí N2 (đktc). Khi đốt cháy amin B thấy ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3$. Biết rằng tên của A có tiếp đầu ngữ “para”. Công thức cấu tạo của A, B lần lượt là :
-
A.
A. p-CH3-C6H4-NH2; C4H9NH2.
-
B.
B. p-CH3-C6H4-NH2; C3H7NH2.
-
C.
C. o-CH3-C6H4-NH2; C3H7NH2.
-
D.
D. o-CH3-C6H4-NH2; C4H9NH2.
Hỗn hợp X gồm ba amin đơn chức là đồng đẳng kế tiếp nhau. Đốt cháy hoàn toàn 11,8 gam X thu được 16,2 gam H2O, 13,44 lít CO2 (đktc) và V lít khí N2 (đktc). Ba amin trên có công thức phân tử lần lượt là :
-
A.
CH3NH2, C2H5NH2, C3H7NH2.
-
B.
CHC–NH2, CHC–CH2NH2, CHC–C2H4NH2.
-
C.
C2H3NH2, C3H5NH2, C4H7NH2.
-
D.
C2H5NH2, C3H7NH2, C4H9NH2.
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 là 22. Hỗn hợp khí Y gồm metylamin và etylamin có tỉ khối so với H2 là 17,833. Để đốt cháy hoàn toàn V1 lít Y cần vừa đủ V2 lít X (biết sản phẩm cháy gồm CO2, H2O và N2, các chất khí khi đo ở cùng điều kiện nhiệt độ, áp suất). Tỉ lệ V1 : V2 là :
-
A.
3 : 5
-
B.
5 : 3
-
C.
2 : 1
-
D.
1 : 2
Đốt cháy hoàn toàn hỗn hợp 2 amin no, đơn chức, bậc 1, là đồng đẳng kế tiếp nhau, thu được CO2 và H2O với tỉ lệ số mol là: ${n_{C{O_2}}}:{n_{{H_2}O}}$= 7 : 10. Hai amin trên là:
-
A.
CH3NH2 và C2H7NH2.
-
B.
C2H5NH2 và C3H7NH2.
-
C.
C3H7NH2 và C4H9NH2
-
D.
C4H9NH2 và C5H11NH2.
Đốt cháy hết 6,72 lít hỗn hợp khí (đktc) X gồm 2 amin đơn chức, bậc một A và B là đồng đẳng kế tiếp. Cho hỗn hợp khí và hơi sau khi đốt cháy lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH dư, thấy khối lượng bình 2 tăng 21,12 gam. Tên gọi của 2 amin là :
-
A.
metylamin và etylamin.
-
B.
etylamin và n-propylamin.
-
C.
n-propylamin và n-butylamin.
-
D.
iso-propylamin và iso-butylamin.
Đốt cháy hoàn toàn 7,6 gam hỗn hợp X gồm 2 amin no, đơn chức , mạch hở bằng không khí, sau đó cho hỗn hợp qua NaOH dư thấy khối lượng dung dịch tăng 24 gam và thấy thoát ra V lít khí hỗn hợp Y(đktc) gồm 2 khí có tỉ lệ mol là 1:9. Giá trị của V là
-
A.
126
-
B.
112
-
C.
130
-
D.
138
Khi đốt cháy một trong các chất là đồng đẳng của metylamin thì tỉ lệ thể tích ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}$ = a biến đổi như thế nào ?
-
A.
$0,4 \le a < 1,2$
-
B.
$0,8 \le a < 2,5$
-
C.
$0,4 \le a < 1$
-
D.
$0,4 \le a \le 1$
Hỗn hợp M gồm một anken và hai amin no, đơn chức, mạch hở X và Y là đồng đẳng kế tiếp (MX< MY). Đốt cháy hoàn toàn một lượng M cần dùng 4,536 lít O2 (đktc) thu được H2O, N2 và 2,24 lít CO2 (đktc). Chất Y là
-
A.
etylmetylamin.
-
B.
butylamin.
-
C.
etylamin.
-
D.
propylamin.
Đốt cháy hoàn toàn 12,95 gam hỗn hợp A (gồm amin no, mạch hở X và ankan Y) bằng oxi vừa đủ. Sau phản ứng thu được m gam H2O; 19,04 lít CO2 và 0,56 lít khí N2 (đktc). Giá trị của m là
-
A.
18,81 gam.
-
B.
18,45 gam.
-
C.
19,53 gam.
-
D.
19,89 gam.
Đốt cháy 50 ml hỗn hợp khí X gồm trimetylamin và 2 hiđrocacbon là đồng đẳng liên tiếp bằng oxi vừa đủ, thu được 375 ml hỗn hợp khí và hơi Y. Cho Y đi qua H2SO4 đặc dư thì còn lại 175 ml, các thể tích khí đo ở cùng điều kiện. CTPT của 2 hiđrocacbon là
-
A.
C2H6; C3H8.
-
B.
C2H4; C3H6.
-
C.
C3H6 và C4H8.
-
D.
C3H8 và C4H10.
Đốt cháy hoàn toàn hỗn hợp X gồm 1 amin no, mạch hở, đơn chức và 1 ancol no, mạch hở, đơn chức bằng 151,2 lít không khí (vừa đủ) thu được 17,92 lít khí CO2; 21,6 gam H2O; 123,2 lít khí N2 (các thể tích khí đo ở đktc). CTPT của ancol và amin là
-
A.
C3H8O; C3H9N.
-
B.
C2H6O; C3H9N.
-
C.
C3H8O; C2H7N.
-
D.
C2H6O; C2H7N.
Hỗn hợp X chứa 1 amin no mạch hở đơn chức, 1 ankan, 1 anken. Đốt cháy hoàn toàn 0,4 mol X cần dùng vừa đủ 1,03 mol O2. Sản phẩm cháy thu được có chứa 0,56 mol CO2 và 0,06 mol N2. Phần trăm khối lượng của anken có trong X gần nhất với :
-
A.
35,5%
-
B.
30,3%
-
C.
28,2%
-
D.
32,7%
Đốt cháy hòa toàn hỗn hợp hai amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng, thu được 1,568 lít khí CO2 (đktc) và 1,8 gam H2O. Số đồng phân cấu tạo thuộc loại amin bậc hai của hai amin đó là:
-
A.
4
-
B.
3
-
C.
6
-
D.
5
Đốt cháy hoàn toàn m gam C2H5NH2 thu được sản phẩm gồm H2O, CO2 và 1,12 lít khí N2 (đktc). Giá trị của m là
-
A.
9,0.
-
B.
13,5.
-
C.
4,5.
-
D.
18,0
13,35 gam hỗn hợp X gồm 2 amin no đơn chức mạch hở đồng đẳng kế tiếp tác dụng với dung dịch HCl vừa đủ thu được dung dịch chứa 22,475 gam muối . Nếu đốt 13,35 gam hỗn hợp X thì trong sản phẩm cháy có VCO2/VH2O bằng
-
A.
8/13.
-
B.
26/41.
-
C.
11/ 17.
-
D.
5/8.
Đốt cháy hoàn toàn 6,2 gam metylamin rồi cho sản phẩm cháy qua dung dịch Ca(OH)2 dư. Khối lượng bình đựng dung dịch Ca(OH)2 tăng là
-
A.
22 gam.
-
B.
20,6 gam.
-
C.
20 gam.
-
D.
17,8 gam.
Đốt cháy hoàn toàn m gam 1 amin no đơn chức mạch hở người ta thu được 6,72 lít khí CO2 (đktc); 9,45 gam H2O và 1,68 lít khí N2 (đktc). Giá trị của m là:
-
A.
6,75
-
B.
3,37
-
C.
4,65
-
D.
4,45
Đốt cháy hoàn toàn hỗn hợp M gồm hai amin no, đơn chức, mạch hở X và Y (có số mol bằng nhau, MX < MY) cần lượng vừa đủ 13,44 lít O2, thu được H2O, N2 và 6,72 lít CO2. Chất Y là:
-
A.
etylamin
-
B.
propylamin
-
C.
butylamin
-
D.
metylamin
Đốt cháy hoàn toàn 1 amin no đơn chức bậc 2 mạch hở thu được tỉ lệ mol CO2 và H2O là 4 : 7. Tên của amin là:
-
A.
Metyl amin
-
B.
Propyl amin
-
C.
Đimetyl amin
-
D.
Etyl amin
Hỗn hợp khí E gồm một amin bậc III no, đơn chức, mạch hở và hai ankin X, Y (MX< MY). Đốt cháy hoàn toàn 0,15 mol hỗn hợp E cần dùng 11,2 lít O2 (đktc), thu được hỗn hợp F gồm CO2, H2O và N2. Dẫn toàn bộ F qua bình đựng dung dịch KOH đặc, dư đến phản ứng hoàn toàn thấy khối lượng bình bazơ nặng thêm 20,8 gam. Số cặp công thức cấu tạo ankin X, Y thỏa mãn là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Hỗn hợp X chứa etylamin và trimetylamin. Hỗn hợp Y chứa 2 hiđrocacbon mạch hở có số liên kết pi nhở hơn 3. Trộn X và Y theo tỉ lệ mol nX : nY = 1:5 thu được hỗn hợp Z. Đốt cháy hoàn toàn 3,17 gam hỗn hợp Z cần dùng vừa đủ 7,0 lít khí oxi (đktc), sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua dung dịch NaOH đặc, dư thấy khối lượng dung dịch tăng 12,89 gam. Phần trăm khối lượng của etylamin trong X gần nhất với giá trị nào sau đây?
-
A.
21%.
-
B.
70%.
-
C.
79%.
-
D.
30%.
Cho 1,22 gam hỗn hợp X gồm hai amin bậc một (tỉ lệ mol là 1:2) tác dụng vừa đủ với 400 ml dung dịch HCl 0,1M thu được dung dịch Y. Mặt khác, khi đốt cháy hoàn toàn 0,09 mol hỗn hợp X thu được hỗn hợp khí và hơi. Dẫn toàn bộ hỗn hợp khí và hơi đó vào dung dịch Ba(OH)2 dư, lạnh thì thu được m gam kết tủa và thoát ra 1,344 lít (đktc) một khí duy nhất. Giá trị của m là
-
A.
23,64.
-
B.
78,8.
-
C.
11,82.
-
D.
39,40.
Hỗn hợp E chứa axetilen, propin và một amin no, đơn chức, mạch hở. Đốt cháy hoàn toàn 5,46 gam hỗn hợp E cần dùng 11,088 lít O2 (đktc) thu được hỗn hợp F gồm CO2, H2O và khí N2, trong đó tỉ lệ mol CO2: H2O là 1:1. Phân tử khối của amin là
-
A.
45
-
B.
31
-
C.
59
-
D.
73
Lời giải và đáp án
Đốt cháy 1 amin A thu được ${{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}=1,5{{n}_{a\min }}$ thì amin đó là
-
A.
amin no, hai chức, mạch hở.
-
B.
amin không no (trong phân tử có 1 liên kết đôi C=C), hai chức, mạch hở.
-
C.
amin no, đơn chức, mạch hở.
-
D.
bất kì amin nào.
Đáp án : C
Đốt cháy 1 amin A thu được ${{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}=1,5{{n}_{a\min }}$ thì amin đó là amin no, đơn chức, mạch hở
Khi đốt cháy a mol amin X no, mạch hở ta thu được x mol CO2; y mol H2O; z mol N2. Biểu thức đúng là
-
A.
a = y – x – z.
-
B.
a = y – x + z.
-
C.
a = y – x.
-
D.
a = x + z – y.
Đáp án : A
Bảo toàn nguyên tố : ${{n}_{C}}=\text{ }{{n}_{C{{O}_{2}}}};~~{{n}_{H}}=\text{ }2{{n}_{{{H}_{2}}O}};~~{{n}_{N}}=\text{ }2{{n}_{{{N}_{2}}}}$
Amin X no, mạch hở có CTPT dạng CnH2n+2+kNk (k là số chức amin)
Bảo toàn nguyên tố ta có :
\({n_{C{O_2}}} = {n_C}\,\, \to \,\,x = \,na (mol)\)
\({n_{{H_2}O}} = \dfrac{{{n_H}}}{2}\,\, \to \,\,y = \,na + a + a. \dfrac{k}{2}\,\,\,mol;\,\)
\({n_{{N_2}}} = \dfrac{{{n_N}}}{2} \to \,\,\,z = a. \dfrac{k}{2}\,\,mol\)
→ y = x + a + z hay a = y – x – z
Đốt cháy hoàn toàn 1 amin no, mạch hở, đơn chức X bằng một lượng khí oxi vừa đủ, thu được 8,96 lít khí CO2 và 9,9 gam H2O. CTPT của X là
-
A.
C2H7N.
-
B.
C4H11N.
-
C.
CH5N.
-
D.
C4H9N.
Đáp án : B
- Đốt amin no, đơn chức, mạch hở: n amin = (nH2O – nCO2)/1,5
- Bảo toàn nguyên tố: nC = nCO2; nH = 2nH2O
- Số C = nCO2/namin, số H = 2nH2O/namin
Cách 1: lập tỉ lệ nc : nH
Theo giả thiết ta có
\({n_C} = {n_{C{O_2}}} = \dfrac{{8,96}}{{22,4}} = 0,4\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{9,9}}{{18}} = 1,1\,\,mol;\,\,\)
→ nC : nH = 0,4 : 1,1 = 4 : 11
Dựa vào đáp án → CTPT của amin là C4H11N
Cách 2:
Vì amin no, mạch hở, đơn chức nên \({n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}\)
\( \to {n_{a\min }} = \dfrac{{{n_{{H_2}O}} - {n_{C{O_2}}}}}{{1,5}} = \dfrac{{0,55 - 0,4}}{{1,5}} = 0,1\,\,mol\)
→ Số C trong amin =\(\dfrac{{{n_{C{O_2}}}}}{{{n_X}}} = \dfrac{{0,4}}{{0,1}} = 4\)
Số H trong amin = \(\frac{{2{n_{{H_2}O}}}}{{{n_X}}} = \dfrac{{0,55.2}}{{0,1}} = 11\).
Vậy CTPT của X là C4H11N
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,8 lít khí CO2; 2,8 lít khí N2 (các thể tích khí đo ở điều kiện tiêu chuẩn) và 20,25 gam H2O. CTPT của X là
-
A.
C4H9N.
-
B.
C3H7N.
-
C.
C2H7N.
-
D.
C3H9N.
Đáp án : D
nC = nCO2
nH = 2nH2O
nN = 2nN2
Amin đơn chức => n amin = nN
=> Số C = nCO2/namin, số H = 2nH2O/namin
Cách 1 : lập tỉ lệ mol nC : nH : nN
Theo giả thiết ta có :
\(\begin{array}{l}{n_C} = {n_{C{O_2}}} = \dfrac{{16,8}}{{22,4}} = 0,75\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{20,25}}{{18}} = 2,25\,\,mol;\,\,\\{n_N} = 2.{n_{{N_2}}} = 2.\dfrac{{2,8}}{{22,4}} = 0,25\,\,mol.\end{array}\)
\( \Rightarrow {n_C}:{n_H}:{n_N} = 0,75:2,25:0,25 = 3:9:1\)
Vậy CTPT của X là C3H9N.
Cách 2 : bảo toàn nguyên tố N : \({n_X} = {n_N} = 2{n_{{N_2}}}\)
Đối với các amin đơn chức thì phân tử có một nguyên tử N :
Bảo toàn nguyên tử N : \({n_X} = {n_N} = 2{n_{{N_2}}} = 0,25\,\,mol\)
→ Số C trong amin =\(\dfrac{{{n_{C{O_2}}}}}{{{n_X}}} = \dfrac{{0,75}}{{0,25}} = 3\);
Số H trong amin = \(\dfrac{{2{n_{{H_2}O}}}}{{{n_X}}} = \dfrac{{2,25}}{{0,25}} = 9\)
Vậy CTPT của X là C3H9N
Đốt cháy một hỗn hợp amin A cần V lít O2 (đktc) thu được N2 và 31,68 gam CO2 và 7,56 gam H2O. Giá trị V là
-
A.
25,536.
-
B.
20,160.
-
C.
20,832.
-
D.
26,880.
Đáp án : C
Bảo toàn nguyên tử oxi ta có : $2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}$
\({n_{C{O_2}}} = \dfrac{{31,68}}{{44}} = 0,72\,\,mol;\,\,\,{n_{{H_2}O}} = \dfrac{{7,56}}{{18}}\)= 0,42 mol
Bảo toàn nguyên tử oxi ta có :\(2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} \to \,\,{n_{{O_2}}} = \dfrac{{2{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = \dfrac{{2.0,72 + 0,42}}{2} = 0,93\,\,mol\)
\(\to \,\,{V_{{O_2}}} = 22,4.0,93 = 20,832\) lít
Đốt cháy hoàn toàn m gam một amin X bằng lượng không khí vừa đủ thu được 17,6 gam CO2, 12,6 gam H2O và 69,44 lít N2 (đktc). Giả thiết không khí chỉ gồm N2 và O2 trong đó oxi chiếm 20% thể tích không khí. X có công thức là :
-
A.
C2H5NH2.
-
B.
C3H7NH2.
-
C.
CH3NH2.
-
D.
C4H9NH2.
Đáp án : A
- Bảo toàn nguyên tố O:\({n_{{O_2}}} = {n_{C{O_2}}} + \dfrac{{{n_{{H_2}O}}}}{2}\)=>\({n_{{N_2}(kk)}} = 4.{n_{{O_2}(p/u)}}\)
- Đốt amin ngoài không khí:
nN2 sau phản ứng = nN2 sinh ra từ phản ứng đốt cháy amin + nN2 có sẵn trong không khí
- nC = nCO2; nH = 2nH2O; nN = 2nN2
=> nC : nH : nN => CTPT
\({n_C} = {n_{C{O_2}}} = \dfrac{{17,6}}{{44}} = 0,4\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{12,6}}{{18}} = 1,4\,\,mol\).
Áp dụng định luật bảo toàn nguyên tố đối với oxi suy ra :
\({n_{{O_2}\,(kk)}} = \dfrac{{2.{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = 0,75\,\,mol \Rightarrow {n_{{N_2}\,(kk)}} = 0,75.4 = 3\,\,mol.\,\)\( \to \,\,{n_{N\,(hchc)}} = 2.(\dfrac{{69,44}}{{22,4}} - 3) = 0,2\,mol\, \Rightarrow {n_C}:{n_H}:{n_N} = 0,4:1,4:0,2 = 2:7:1.\)
Căn cứ vào các phương án ta thấy công thức của X là C2H5NH2.
Đốt cháy hoàn toàn amin X bằng oxi vừa đủ, dẫn toàn bộ sản phẩm qua bình chứa dungdịch Ca(OH)2 dư thấy có 4 gam kết tủa và khối lượng bình tăng 3,2 gam và có 0,448 lít khí (đktc) thoát ra khỏi bình. X có CTPT là
-
A.
C2H8N2.
-
B.
CH5N.
-
C.
C3H10N2.
-
D.
C3H7NH2.
Đáp án : A
- nN trong X = 2nN2
- nCO2 = n kết tủa, m bình tăng = mCO2 + mH2O
- Sử dụng định luật bảo toàn nguyên tố và lập tỉ lệ nC : nH : nN
Nito không bị hấp thụ bởi Ca(OH)2 => khí thoát ra khỏi bình là khí N2
Bảo toàn nguyên tử N : \({n_{N\,\,(trong\,\,X)}} = 2{n_{{N_2}}} = \frac{{0,448}}{{22,4}}\, = 0,02\,mol\)
mkết tủa = \({m_{CaC{{\rm{O}}_3}}} = \dfrac{4}{{100}} = 0,04\,\,mol\,\, \to \,\,{n_{C{O_2}}} = 0,04\,\,mol\)
mbình tăng = \({m_{C{O_2}}} + {m_{{H_2}O}} = 3,2\,\,gam\,\, \to \,\,{m_{{H_2}O}} = 3,2 - 0,04.44 = 1,44\,\,gam\,\, \to \,\,{n_{{H_2}O}} = 0,08\,\,mol\)
→ nC : nH : nN = 0,04 : 0,16 : 0,04 = 1 : 4 : 1
=> CTĐGN của X là CH4N
=> CTPT của X là C2H8N2
Đốt cháy hoàn toàn 6,2 gam một amin no, mạch hở đơn chức cần dùng 10,08 lít khí O2 (đktc). CTPT của amin là
-
A.
C2H5NH2.
-
B.
CH3NH2.
-
C.
C3H7NH2.
-
D.
C4H9NH2.
Đáp án : B
- Gọi số mol của CO2, H2O và N2
- Bảo toàn nguyên tố oxi : $2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}$
- Bảo toàn khối lượng : mamin = mC + mH + mO+ mN
- Đốt cháy amin no, mạch hở, đơn chức thu được :${n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}$
- Giải hệ phương trình
\({n_{{O_2}}} = \dfrac{{10,08}}{{22,4}} = 0,45\,\,mol\)
Gọi số mol của CO2, H2O và N2 lần lượt là a, b, c mol
Bảo toàn nguyên tố oxi : \(2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}\)→ 2a + b = 0,9 (1)
Bảo toàn khối lượng : mamin = mC + mH + mN → 12a + 2b + 28c = 6,2 (2)
Vì đốt cháy amin no, mạch hở, đơn chức nên ta có :
\({n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}\)và \({n_{{N_2}}} = \dfrac{1}{2}{n_{a\min }}\)→ \({n_{{H_2}O}} - {n_{C{O_2}}} = 3{n_{{N_2}}}\)
→ b – a = 3c (3)
Từ (1), (2) và (3) → \(\left\{ \begin{array}{l}a = 0,2\\b = 0,5\\c = 0,1\end{array} \right.\)
→ nC : nH : nN = 0,2 : 0,5.2 : 0,1.2 = 1 : 5 : 1
→ công thức phân tử của amin là CH3NH2
Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của 2 amin là :
-
A.
CH5N và C2H7N.
-
B.
C2H7N và C3H9N.
-
C.
C3H9N và C4H11N.
-
D.
kết quả khác.
Đáp án : A
gọi công thức phân tử trung bình
Sơ đồ phản ứng :
\(\begin{align}&\,\,\,\,\,\,\,\,\,\,\,\,\,{{C}_{\overline{n}}}{{H}_{2\overline{n}\,+\,3}}N\,\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,\,\overline{n}C{{O}_{2}}\,\,\,+\,\,\,\,\dfrac{2\overline{n}\,+3}{2}\,{{H}_{2}}O\,\,\,\,+\,\,\,\,\,\dfrac{1}{2}\,{{N}_{2}} \\ & mol:\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \\ \end{align}\)
Ta có: \(0,2\overline{n}\,=\,0,1.\dfrac{2\overline{n}\,+\,3}{2}\,\Rightarrow \,\overline{n}\,=\,1,5.\)
Vậy công thức phân tử của 2 amin là CH5N và C2H7N.
Có hai amin bậc một gồm A (đồng đẳng của anilin) và B (đồng đẳng của metylamin). Đốt cháy hoàn toàn 3,21 gam amin A sinh ra khí CO2, hơi H2O và 336 cm3 khí N2 (đktc). Khi đốt cháy amin B thấy ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3$. Biết rằng tên của A có tiếp đầu ngữ “para”. Công thức cấu tạo của A, B lần lượt là :
-
A.
A. p-CH3-C6H4-NH2; C4H9NH2.
-
B.
B. p-CH3-C6H4-NH2; C3H7NH2.
-
C.
C. o-CH3-C6H4-NH2; C3H7NH2.
-
D.
D. o-CH3-C6H4-NH2; C4H9NH2.
Đáp án : B
gọi công thức tổng quát của A là CnH2n-7NH2, B là CmH2m+1NH2
Bảo toàn nguyên tố N : \({{n}_{A}}\,=\,2.{{n}_{{{N}_{2}}}}\,\)
Tính theo sơ đồ phản ứng : \({{C}_{m}}{{H}_{2m\,+\,1}}N{{H}_{2}}\,\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,\,mC{{O}_{2}}\,+\,\dfrac{m\,+3}{2}\,{{H}_{2}}O\,+\,\dfrac{1}{2}{{N}_{2}}\)
A là đồng đẳng của anilin nên công thức của A là CnH2n-7NH2, (n ≥ 7, nguyên)
B là đồng đẳng của metylamin nên công thức của B là CmH2m+1NH2, (m ≥ 2, nguyên).
Ta có: \({{n}_{A}}=2.{{n}_{{{N}_{2}}}}=2.0,015=0,03\,mol\Rightarrow {{M}_{A}}=14n+9=\dfrac{3,21}{0,03}=107\,gam/mol\,\Rightarrow n=7.\)
Sơ đồ phản ứng :
\({{C}_{m}}{{H}_{2m+1}}N{{H}_{2}}\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,mC{{O}_{2}}+\dfrac{2m+3}{2}{{H}_{2}}O+\dfrac{1}{2}{{N}_{2}}\)
\({{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3\Rightarrow m=3\)
CTCT phù hợp của A, B lần lượt là :
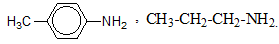
Hỗn hợp X gồm ba amin đơn chức là đồng đẳng kế tiếp nhau. Đốt cháy hoàn toàn 11,8 gam X thu được 16,2 gam H2O, 13,44 lít CO2 (đktc) và V lít khí N2 (đktc). Ba amin trên có công thức phân tử lần lượt là :
-
A.
CH3NH2, C2H5NH2, C3H7NH2.
-
B.
CHC–NH2, CHC–CH2NH2, CHC–C2H4NH2.
-
C.
C2H3NH2, C3H5NH2, C4H7NH2.
-
D.
C2H5NH2, C3H7NH2, C4H9NH2.
Đáp án : D
nC = nCO2
nH = 2nH2O
nN = 2nN2
lập tỉ lệ nC : nH : nN
Theo giả thiết ta có:
$\begin{array}{l}{n_{{H_2}O}} = 0,9\,\,mol\,\,;\,\,{n_{C{O_2}}} = 0,6\,\,mol\,\,;\,\,{n_N} = \frac{{11,8 - 0,9.2 - 0,6.12}}{{14}} = 0,2\,\,mol\\ \Rightarrow {n_C}:{n_H}:{n_N} = 0,6:1,8:0,2 = 3:9:1.\end{array}$
Vậy công thức phân tử trung bình của ba amin là C3H9N thuộc dạng CnH2n+3N, suy ra ba amin thuộc loại amin no đơn chức và phải có ít nhất một amin có số C lớn hơn 3.
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 là 22. Hỗn hợp khí Y gồm metylamin và etylamin có tỉ khối so với H2 là 17,833. Để đốt cháy hoàn toàn V1 lít Y cần vừa đủ V2 lít X (biết sản phẩm cháy gồm CO2, H2O và N2, các chất khí khi đo ở cùng điều kiện nhiệt độ, áp suất). Tỉ lệ V1 : V2 là :
-
A.
3 : 5
-
B.
5 : 3
-
C.
2 : 1
-
D.
1 : 2
Đáp án : D
Đặt CTPT trung bình của 2 amin là ${C_{\bar n}}{H_{2\bar n + 3}}N$
Quy đổi hỗn hợp O3, O2 thành O, bảo toàn khối lượng :${m_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = {m_O}$
Bảo toàn nguyên tố O : $2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}$
Đặt CTPT trung bình của 2 amin là \({C_{\bar n}}{H_{2\bar n + 3}}N\).
Theo giả thiết suy ra : \(14\bar n + 17 = 2.17,833 \Rightarrow \bar n = \frac{4}{3}\).
Quy đổi hỗn hợp O3, O2 thành O, theo định luật bảo toàn khối lượng ta có .
Sơ đồ phản ứng :
\(2{{C}_{{\bar{n}}}}{{H}_{2\bar{n}+3}}N\xrightarrow{{{t}^{o}}}2\bar{n}C{{O}_{2}}+(2\bar{n}+3){{H}_{2}}O+{{N}_{2}}\,\,\,\,(1)\)
mol : 1 \(\bar{n}\) \(\dfrac{2\bar{n}+3}{2}\)
Theo (1) ta có :
\({n_{O\,\,pu }} = 2\overline n + \dfrac{{2\overline n + 3}}{2} = 5,5\,\,mol \Rightarrow {m_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = {m_O} = 5,5.16 = 88\,\,gam \Rightarrow {n_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = \frac{{88}}{{2.22}} = 2\,\,mol.\)
Vậy VY : VX = 1 : 2.
Đốt cháy hoàn toàn hỗn hợp 2 amin no, đơn chức, bậc 1, là đồng đẳng kế tiếp nhau, thu được CO2 và H2O với tỉ lệ số mol là: ${n_{C{O_2}}}:{n_{{H_2}O}}$= 7 : 10. Hai amin trên là:
-
A.
CH3NH2 và C2H7NH2.
-
B.
C2H5NH2 và C3H7NH2.
-
C.
C3H7NH2 và C4H9NH2
-
D.
C4H9NH2 và C5H11NH2.
Đáp án : C
Gọi CTPT trung bình cho 2 amin là ${C_{\bar n}}{H_{2\bar n + 3}}N$
Bảo toàn nguyên tố : nC = nCO2; nH = 2nH2O
Gọi CTPT trung bình cho 2 amin là \({C_{\bar n}}{H_{2\bar n + 3}}N\)
Giả sử lấy 1 mol amin
Bảo toàn nguyên tố C : \({n_{C{O_2}}} = \bar n\)
Bảo toàn nguyên tố H : \({n_{{H_2}O}} = \dfrac{{2\bar n + 3}}{2}\)
Vì \({n_{C{O_2}}}:{n_{{H_2}O}}\)= 7 : 10 → \(10\bar{n}~=\text{ 7}\text{.}\dfrac{2\bar{n}+3}{2}\Rightarrow \bar{n}=3,5\)
→ 2 amin là C3H7NH2 và C4H9NH2
Đốt cháy hết 6,72 lít hỗn hợp khí (đktc) X gồm 2 amin đơn chức, bậc một A và B là đồng đẳng kế tiếp. Cho hỗn hợp khí và hơi sau khi đốt cháy lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH dư, thấy khối lượng bình 2 tăng 21,12 gam. Tên gọi của 2 amin là :
-
A.
metylamin và etylamin.
-
B.
etylamin và n-propylamin.
-
C.
n-propylamin và n-butylamin.
-
D.
iso-propylamin và iso-butylamin.
Đáp án : A
Khối lượng bình 2 tăng là khối lượng của CO2
sử dụng \(\bar C = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}}\)
Khối lượng bình 2 tăng 21,12 gam \(\to {m_{C{O_2}}} = 21,12gam\,\, \to \,\,{n_{C{O_2}}} = 0,48\,\,mol\)
namin = 0,3 mol
\( \to \,\,\bar C = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}} = \dfrac{{0,48}}{{0,3}} = 1,6\)
Vậy 2 amin là CH3NH2 và C2H5NH2
Đốt cháy hoàn toàn 7,6 gam hỗn hợp X gồm 2 amin no, đơn chức , mạch hở bằng không khí, sau đó cho hỗn hợp qua NaOH dư thấy khối lượng dung dịch tăng 24 gam và thấy thoát ra V lít khí hỗn hợp Y(đktc) gồm 2 khí có tỉ lệ mol là 1:9. Giá trị của V là
-
A.
126
-
B.
112
-
C.
130
-
D.
138
Đáp án : B
Đặt số mol của amin : x, trong không khí : O2 a mol, N2 4a mol
BTKL ${m_X} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}} + {m_{{N_2}}} \to {n_{{O_2}(p/u)}}$
Hỗn hợp Y gồm: ${n_{{O_2}}} = {\rm{a}} - {n_{{O_2}(p/u);}}\,\,\,\,{n_{{N_2}}} = 4{\rm{a}} + {n_{{N_2}(\sinh \,ra)}}\,$
${n_{{O_2}}}:{n_{{N_2}}} = 1:9 \to a \to {n_Y} \to V$
CnH2n+3N $ \to $nCO2 + (n+1,5)H2O + 0,5 N2
x nx (n+1,5)x 0,5x
Vì N2là khí trơ nên dung dịch NaOH chỉ hấp thụ CO2 và H2O
=> mdd tăng =${m_{C{O_2}}} + {m_{{H_2}O}} = 44n{\rm{x}} + 18x(n + 1,5) = \,\,(62n + 27)x = 24\,\,\,\,(1)$
mX=(14n+17)x =7,6 (2)
Từ (1) và (2) =>$\left\{ \begin{array}{l}n{\rm{x}} = 0,3\\x = 0,2\end{array} \right. \to \left\{ \begin{array}{l}n = 1,5\\x = 0,2\end{array} \right.$
Theo định luật BTKL
$\begin{array}{l}{m_X} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}} + {m_{{N_2}}} \to 7,6 + 32.{n_{{O_2}}} = 24 + 2,8\\ \to {n_{{O_2}}} = 0,6\,\,mol\end{array}$
Trong không khí : O2 a mol, N2 4a mol
Hỗn hợp Y gồm: ${n_{{O_2}}} = a - 0,6\,\,\,mol;\,\,\,\,{n_{{N_2}}} = 4a + 0,1\,\,\,mol$
$\begin{array}{l}{n_{{O_2}}}:{n_{{N_2}}} = 1:9 \to 9(a - 0,6) = 4{\rm{a}} + 0,1 \to a = 1,1\,mol\\{n_Y} = 1,1 - 0,6 + 4.1,1 + 0,1 = 5mol \to V = 22,4.5 = 112\,\,lit\end{array}$
Bỏ qua lượng N2 không khí trong hỗn hợp sản phẩm.
Khi đốt cháy một trong các chất là đồng đẳng của metylamin thì tỉ lệ thể tích ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}$ = a biến đổi như thế nào ?
-
A.
$0,4 \le a < 1,2$
-
B.
$0,8 \le a < 2,5$
-
C.
$0,4 \le a < 1$
-
D.
$0,4 \le a \le 1$
Đáp án : C
Biện luận theo giới hạn
Công thức chung của ankylamin là CnH2n+3N (n\( \ge 1\) )
\(\dfrac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \dfrac{n}{{n + 1,5}}\) . Biện luận khi n=1 và\(n \to + \infty \,\,\)
Công thức chung của ankylamin là CnH2n+3N (n\(\ge 1\) )
\(\dfrac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \dfrac{n}{{n + 1,5}}\)
Khi n=1 => a =0,4
Khi \(n \to + \infty \,\, \Rightarrow a = 1\)
Hỗn hợp M gồm một anken và hai amin no, đơn chức, mạch hở X và Y là đồng đẳng kế tiếp (MX< MY). Đốt cháy hoàn toàn một lượng M cần dùng 4,536 lít O2 (đktc) thu được H2O, N2 và 2,24 lít CO2 (đktc). Chất Y là
-
A.
etylmetylamin.
-
B.
butylamin.
-
C.
etylamin.
-
D.
propylamin.
Đáp án : C
- Gọi CTPT của anken là CnH2n, CTPT trung bình của 2 amin là \({C_{\bar m}}{H_{2\bar m + 3}}\)
- Sơ đồ phản ứng tổng quát :\(~{{C}_{n}}{{H}_{2n}}+\dfrac{3n}{2}{{O}_{2}}\to nC{{O}_{2}}+n{{H}_{2}}O\)
\({C_{\bar m}}{H_{2\bar m + 3}}N + \dfrac{{6\bar m + 3}}{4}{O_2} \to \bar mC{O_2} + \dfrac{{2\bar m + 3}}{2}{H_2}O + \dfrac{1}{2}{N_2}\)
- Lập hệ theo phương trình phản ứng
Gọi CTPT của anken là CnH2n
CTPT trung bình của 2 amin là \({C_{\bar m}}{H_{2\bar m + 3}}N\)
PTHH :
\(~{{C}_{n}}{{H}_{2n}}+\dfrac{3n}{2}{{O}_{2}}\to nC{{O}_{2}}+n{{H}_{2}}O\)
a → \(\dfrac{{3na}}{2}\) → an
\({C_{\bar m}}{H_{2\bar m + 3}}N + \dfrac{{6\bar m + 3}}{4}{O_2} \to \bar mC{O_2} + \dfrac{{2\bar m + 3}}{2}{H_2}O + \dfrac{1}{2}{N_2}\)
b → \(\dfrac{{(6\bar m + 3)b}}{2}\) → \(b\bar m\)
\(\left\{ \begin{array}{l}{n_{C{O_2}}} = 0,1 = an + b \bar m\\0,2025 = \dfrac{{3an}}{2} + \dfrac{{(6\bar m + 3)b}}{4}\end{array} \right. \Rightarrow b = 0,07\,\, \Rightarrow \,\,an + 0,07\bar m = 0,1\,\, \Rightarrow \,\,\bar m < 2\)
→ 2 amin là CH5N và C2H7N
Đốt cháy hoàn toàn 12,95 gam hỗn hợp A (gồm amin no, mạch hở X và ankan Y) bằng oxi vừa đủ. Sau phản ứng thu được m gam H2O; 19,04 lít CO2 và 0,56 lít khí N2 (đktc). Giá trị của m là
-
A.
18,81 gam.
-
B.
18,45 gam.
-
C.
19,53 gam.
-
D.
19,89 gam.
Đáp án : B
Bảo toàn nguyên tố : nC = nCO2; nH = 2nH2O; nN = 2nN2
- Bảo toàn khối lượng : mhhA = mC + mH + mN
\({n_{C{O_2}}} = \dfrac{{19,05}}{{22,4}} = 0,85\,\,mol;\,\,{n_{{N_2}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol\)
Bảo toàn khối lượng : mhhA = mC + mH + mN → 0,85.12 + mH + 0,025.2.14 = 12,95
→ nH = 2,05 mol \( \to \,\,{n_{{H_2}O}} = \dfrac{{{n_H}}}{2} = 1,025\,\,mol\,\, \to \,\,{m_{{H_2}O}} = 18,45\,\,gam\)
Đốt cháy 50 ml hỗn hợp khí X gồm trimetylamin và 2 hiđrocacbon là đồng đẳng liên tiếp bằng oxi vừa đủ, thu được 375 ml hỗn hợp khí và hơi Y. Cho Y đi qua H2SO4 đặc dư thì còn lại 175 ml, các thể tích khí đo ở cùng điều kiện. CTPT của 2 hiđrocacbon là
-
A.
C2H6; C3H8.
-
B.
C2H4; C3H6.
-
C.
C3H6 và C4H8.
-
D.
C3H8 và C4H10.
Đáp án : C
- đốt cháy amin no, mạch hở, đơn chức thì : ${n_{{H_2}O}} - {n_{C{O_2}}} - {n_{{N_2}}} = {n_{a\min }}$
- đốt cháy ankan thu được ${n_{{H_2}O}} - {n_{C{O_2}}} = {n_{ankan}}$→ đốt cháy hỗn hợp ankan + amin : ${n_{{H_2}O}} - {n_{C{O_2}}} - {n_{{N_2}}}$= nhỗn hợp
- đốt cháy anken thu được ${n_{{H_2}O}} = {n_{C{O_2}}}$→ đốt cháy hỗn hợp anken + amin : ${n_{{H_2}O}} - {n_{C{O_2}}} - {n_{{N_2}}}$= namin
- Đặt công thức chung của 2 anken là ${C_{\bar n}}{H_{2\bar n}}$
- Bảo toàn nguyên tố : nC = nCO2; nN = 2nN2
Ta có :\({V_{{H_2}O}}\)= 375 – 175 = 200 ml; \({V_{C{O_2}}} + {V_{{N_2}}} = 175\,\,ml\)
\({V_{{H_2}O}} - {V_{C{O_2}}} - {V_{{N_2}}} = 25\,\,ml\, = \,\,\dfrac{1}{2}\)nhỗn hợp
→ 2 hiđrocacbon chỉ có thể là anken và Vamin = Vanken = 25 ml
Đặt công thức chung của 2 anken là \({C_{\bar n}}{H_{2\bar n + 2}}\)
\(\begin{array}{l}{V_{C{O_2}}} = 25\bar n + 3.25 = 25\bar n + 75;\,\,\,\,\,\,\,{V_{{N_2}}} = 0,5.25 = 12,5\\ \to \,\,\,25\bar n + 75 + 12,5 = 175\,\, \to \,\,\bar n = 3,5\end{array}\)
Vậy 2 hiđrocacbon là C3H6 và C4H8
Đốt cháy hoàn toàn hỗn hợp X gồm 1 amin no, mạch hở, đơn chức và 1 ancol no, mạch hở, đơn chức bằng 151,2 lít không khí (vừa đủ) thu được 17,92 lít khí CO2; 21,6 gam H2O; 123,2 lít khí N2 (các thể tích khí đo ở đktc). CTPT của ancol và amin là
-
A.
C3H8O; C3H9N.
-
B.
C2H6O; C3H9N.
-
C.
C3H8O; C2H7N.
-
D.
C2H6O; C2H7N.
Đáp án : B
Gọi CTPT của ancol là CmH2m+2O; CTPT của amin là CnH2n+3N
Bảo toàn nguyên tố N : \({n_{{C_n}{H_{2n + 3}}N}} = 2{n_{{N_2}}}\)
Bảo toàn nguyên tố O : \({n_{{C_m}{H_{2m + 2}}O}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} - 2{n_{{O_2}}}\)
Bảo toàn nguyên tố C :
\({n_{C{O_2}}} = n.{n_{{C_n}{H_{2n + 3}}N}} + m.{n_{{C_m}{H_{2m + 2}}O}}\)
\({n_{C{O_2}}} = \dfrac{{17,92}}{{22,4}} = 0,8\,\,mol;\,\,{n_{{H_2}O}} = \dfrac{{21,6}}{{18}} = 1,2\,\,mol;\,\,{n_{{N_2}}} = \dfrac{{123,2}}{{22,4}} = 5,5\,\,mol\)
Gọi CTPT của ancol là CmH2m+2O; CTPT của amin là CnH2n+3N
nkhông khí = 6,75 mol \( \to \,\,{n_{{O_2}}} = \dfrac{{6,75}}{5} = 1,35\,\,mol;\,\,{n_{{N_2}(kk)}} = 6,75 - 1,35 = 5,4\,\,mol\)
\(\to {n_{{N_2}}}\)sinh ra do amin cháy = \({n_{{N_2}}}\)thu được - \({n_{{N_2}(KK)}}\)= 5,5 – 5,4 = 0,1 mol
Bảo toàn nguyên tố N :
\({n_{{C_n}{H_{2n + 3}}N}} = 2{n_{{N_2}}}\)= 0,2 mol
Bảo toàn nguyên tố O :
\({n_{{C_m}{H_{2m + 2}}O}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} - 2{n_{{O_2}}} = 2.0,8 + 1,2 - 2.1,35 = 0,1\,\,mol\)
Bảo toàn nguyên tố C : \({n_{C{O_2}}} = n.{n_{{C_n}{H_{2n + 3}}N}} + m.{n_{{C_m}{H_{2m + 2}}O}}\)
→ 0,2n + 0,1m = 0,8 → 2n + m = 8
→ m = 2 và n = 3 phù hợp với đáp án
Vậy CTPT của ancol và amin là C2H6O vàC3H9N
Hỗn hợp X chứa 1 amin no mạch hở đơn chức, 1 ankan, 1 anken. Đốt cháy hoàn toàn 0,4 mol X cần dùng vừa đủ 1,03 mol O2. Sản phẩm cháy thu được có chứa 0,56 mol CO2 và 0,06 mol N2. Phần trăm khối lượng của anken có trong X gần nhất với :
-
A.
35,5%
-
B.
30,3%
-
C.
28,2%
-
D.
32,7%
Đáp án : D
Sử dụng phương pháp bảo toàn nguyên tố O và C, bên cạnh đó khảo sát phương trình đốt cháy
namin = 0,12 mol ; nX = 0,4 mol
Bảo toàn oxi : 2nO2 = 2nCO2 + nH2O => nH2O = 0,94 mol
TQ : CnH2n+3N ; CmH2m+2 ; CtH2t
=> nH2O – nCO2 = 1,5namin + nankan
=> nankan = 0,2 mol => nanken = 0,08 mol
Bảo toàn C : 0,12n + 0,2m + 0,08t = 0,56
=> n = m = 1 ; t = 3
=> CH5N ; CH4 ; C3H6
=> %mC3H6 = 32,6%
Đốt cháy hòa toàn hỗn hợp hai amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng, thu được 1,568 lít khí CO2 (đktc) và 1,8 gam H2O. Số đồng phân cấu tạo thuộc loại amin bậc hai của hai amin đó là:
-
A.
4
-
B.
3
-
C.
6
-
D.
5
Đáp án : A
Đặt công thức trung bình của hai amin no, đơn chức, kế tiếp là \({C_{\overline n }}{H_{2\overline n + 3}}N\)
Tìm \(\overline n \) theo PTHH
=> CTPT của 2 amin và viết được các CTCT amin bậc 2.
Đặt công thức của hh 2 amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng là: \({C_{\overline n }}{H_{2\overline n + 3}}N\)
PTHH: \({C_{\overline n }}{H_{2\overline n + 3}}N + {O_2}\xrightarrow{{{t^0}}}\overline n C{O_2} + (\overline n + 1,5){H_2}O\)
nCO2(đktc) = 1,568/22,4 = 0,07 (mol)
nH2O = 1,8/18 = 0,1 (mol)
Ta có: namin = (nH2O – nCO2)/1,5 = 0,02 (mol)
\(\overline n = \frac{{{n_{C{O_2}}}}}{{n\,a\min }} = \frac{{0,07}}{{0,02}} = 3,5\)
Vì 2 amin đồng đẳng kế tiếp nên CTPT 2 amin là C3H9N và C4H11N
CTCT amin bậc 2 của C3H9N: CH3CH2-NH-CH3
CTCT amin bậc 2 của C4H11N: CH3-CH2-CH2-NH-CH3; CH3-CH(CH3)-NH-CH3; C2H5-NH-C2H5
→ Tổng có 4 CTCT thỏa mãn.
Đốt cháy hoàn toàn m gam C2H5NH2 thu được sản phẩm gồm H2O, CO2 và 1,12 lít khí N2 (đktc). Giá trị của m là
-
A.
9,0.
-
B.
13,5.
-
C.
4,5.
-
D.
18,0
Đáp án : C
Áp dụng bảo toàn nguyên tố N.
Bảo toàn nguyên tố N có: nC2H5NH2 = 2nN2 = 0,1 mol
⟹ mC2H5NH2 = 0,1.45 = 4,5 gam
13,35 gam hỗn hợp X gồm 2 amin no đơn chức mạch hở đồng đẳng kế tiếp tác dụng với dung dịch HCl vừa đủ thu được dung dịch chứa 22,475 gam muối . Nếu đốt 13,35 gam hỗn hợp X thì trong sản phẩm cháy có VCO2/VH2O bằng
-
A.
8/13.
-
B.
26/41.
-
C.
11/ 17.
-
D.
5/8.
Đáp án : B
Dùng định luật bảo toàn khối lượng để tìm số mol 2 amin.
Từ đó xác định được công thức chung của 2 amin.
Khi đốt hỗn hợp X gồm 2 amin no, đơn chức mạch hở thì \(\frac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \frac{{{n_{C{O_2}}}}}{{{n_{{H_2}O}}}}\)
Dùng bảo toàn khối lượng ta có: mHCl = mmuối - mamin = 9,125 (g)
→ nHCl = 0,25 (mol) → nAmin = nHCl = 0,25 mol
Gọi công thức chung của 2 amin có dạng CxH2x+3N
→ M2 amin = m : n = 13,35 : 0,25 = 53,4 (g/mol)
⟹ 14x + 3 + 14 = 53,4 ⟹ x = 2,6
Khi đốt hỗn hợp X thì:
CxH2x+3N + (1,5x + 0,75) O2 → xCO2 + (2x+3)/2 H2O + ½ N2
Vậy \(\frac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \frac{{{n_{C{O_2}}}}}{{{n_{{H_2}O}}}} = \frac{x}{{x + 1,5}} = \frac{{2,6}}{{2,6 + 1,5}} = \frac{{26}}{{41}}\)
Đốt cháy hoàn toàn 6,2 gam metylamin rồi cho sản phẩm cháy qua dung dịch Ca(OH)2 dư. Khối lượng bình đựng dung dịch Ca(OH)2 tăng là
-
A.
22 gam.
-
B.
20,6 gam.
-
C.
20 gam.
-
D.
17,8 gam.
Đáp án : D
Từ phản ứng đốt cháy amin tìm được số mol CO2 và số mol H2O.
Bình đựng dung dịch Ca(OH)2 hấp thụ cả CO2 và H2O ⟹ mbình tăng = mCO2 + mH2O
Ta có: nCH3NH2 = 6,2/31 = 0,2 mol
PTHH: CH3NH2 + 2,25 O2 → CO2 + 2,5 H2O + 0,5 N2
0,2 → 0,2 → 0,5 (mol)
Bình đựng dung dịch Ca(OH)2 hấp thụ cả CO2 và H2O
⟹ mbình tăng = mCO2 + mH2O = 0,2. 44 + 0,5.18 = 17,8 gam
Đốt cháy hoàn toàn m gam 1 amin no đơn chức mạch hở người ta thu được 6,72 lít khí CO2 (đktc); 9,45 gam H2O và 1,68 lít khí N2 (đktc). Giá trị của m là:
-
A.
6,75
-
B.
3,37
-
C.
4,65
-
D.
4,45
Đáp án : A
Bảo toàn nguyên tố O: 2nO2 = 2nCO2 + nH2O → nO2
Bảo toàn khối lượng: mamin + mO2 = mCO2 + mH2O + mN2 → m amin
nCO2 = 6,72 : 22,4 = 0,3 mol; nH2O = 9,45 : 18 = 0,525 mol; nN2 = 1,68 : 22,4 = 0,075 mol
Amin no đơn chức mạch hở có dạng CnH2n+3N
Bảo toàn nguyên tố O: 2nO2 = 2nCO2 + nH2O → nO2 = 0,5625 mol
Bảo toàn khối lượng: mamin + mO2 = mCO2 + mH2O + mN2
→ mamin = 44.0,3 + 18.0,525 + 28.0,075 - 0,5625.32 = 6,75 gam
Đốt cháy hoàn toàn hỗn hợp M gồm hai amin no, đơn chức, mạch hở X và Y (có số mol bằng nhau, MX < MY) cần lượng vừa đủ 13,44 lít O2, thu được H2O, N2 và 6,72 lít CO2. Chất Y là:
-
A.
etylamin
-
B.
propylamin
-
C.
butylamin
-
D.
metylamin
Đáp án : A
Bảo toàn nguyên tố O ta tính được số mol H2O.
Đặt công thức chung của 2 amin no, đơn chức, mạch hở X và Y là CnH2n+3N
CnH2n+3N + (3n/2+3/4) O2 → nCO2 + (2n+3)/2 H2O
→ nM = (nH2O - nCO2)/1,5 → số nguyên tử C = nCO2/nM
Từ đó tìm được công thức của X và Y trong hỗn hợp M.
Ta có: nO2 = 0,6 mol; nCO2 = 0,3 mol
BTNT O => 2nO2 = 2nCO2 + nH2O → nH2O = 0,6 mol
Đặt công thức chung của 2 amin no, đơn chức, mạch hở X và Y là CnH2n+3N
CnH2n+3N + (3n/2+3/4) O2 → nCO2 + (2n+3)/2 H2O
=> nM = (nH2O - nCO2)/1,5 = 0,2 mol
Suy ra số nguyên tử C = nCO2/nM =0,3: 0,2 = 1,5
=> X là CH5N và Y là C2H7N (etylamin).
Đốt cháy hoàn toàn 1 amin no đơn chức bậc 2 mạch hở thu được tỉ lệ mol CO2 và H2O là 4 : 7. Tên của amin là:
-
A.
Metyl amin
-
B.
Propyl amin
-
C.
Đimetyl amin
-
D.
Etyl amin
Đáp án : C
Công thức amin no đơn chức là CnH2n+3N
Dựa vào nCO2 : nH2O => n => CTPT
Amin bậc 2 => CTCT
Công thức amin no đơn chức là CnH2n+3N
Phản ứng cháy có nCO2 : nH2O = 4 : 7
=> nC : nH = 2 : 7 = n : (2n + 3) => n = 2
=> Amin đơn chức là C2H7N
Amin bậc 2 => CH3NHCH3 (đimetyl amin)
Hỗn hợp khí E gồm một amin bậc III no, đơn chức, mạch hở và hai ankin X, Y (MX< MY). Đốt cháy hoàn toàn 0,15 mol hỗn hợp E cần dùng 11,2 lít O2 (đktc), thu được hỗn hợp F gồm CO2, H2O và N2. Dẫn toàn bộ F qua bình đựng dung dịch KOH đặc, dư đến phản ứng hoàn toàn thấy khối lượng bình bazơ nặng thêm 20,8 gam. Số cặp công thức cấu tạo ankin X, Y thỏa mãn là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Đặt a, b là số mol CO2, H2O
Áp dụng BTNT => a = ? và b = ?(mol)
Hỗn hợp E gồm:
\(\left\{ \matrix{
{C_m}{H_{2m + 3}}N:v\,mol \hfill \cr
{C_{\overline n }}{H_{2\overline n - 2}}:\,u\,mol \hfill \cr} \right.\)
=> u, v
=> mối quan hệ m
=> chọn giá trị và viết các CTCT thỏa mãn
Đặt a, b là số mol CO2, H2O
mBình nặng = mCO2 + mH2O => 44a + 18b = 20,8 (1)
BTNT O: 2nO2 = 2nCO2 + nH2O => 2a+ b = 2.0,5 (2)
Từ (1) và (2) => a = 0,35 và b = 0,3 (mol)
Hỗn hợp E gồm:
\(\left\{ \matrix{
{C_m}{H_{2m + 3}}N:v\,mol \hfill \cr
{C_{\overline n }}{H_{2\overline n - 2}}:\,u\,mol \hfill \cr} \right.\)
Ta có:
\(\eqalign{
& \left\{ \matrix{
{n_E} = v + u = 0,15 \hfill \cr
{n_{C{O_2}}} = mv + \overline n u = 0,35 \hfill \cr
{n_{{H_2}O}} = v(m + 1,5) + u(\overline n - 1) = 0,3 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
v = 0,04 \hfill \cr
u = 0,11 \hfill \cr} \right. \cr
& \Rightarrow {n_{C{O_2}}} = 0,04m + 0,11\overline n = 0,35 \cr} \)
Vì m ≥ 3 và
\( \Rightarrow \left\{ \matrix{
m = 3 \hfill \cr
\overline n = {{23} \over {11}} \hfill \cr} \right.\) là nghiệm duy nhất thỏa mãn
Vậy 2 cặp ankin thỏa mãn là: (Vì MX < MY và các chất ở thể khí)
=> Các cặp CTCT thỏa mãn là:
Cặp 1: CH≡ CH và CH≡C-CH3
Cặp 2: CH≡ CH và CH≡ C-CH2-CH3
Cặp 3: CH≡ CH và CH3- C≡C -CH3
Hỗn hợp X chứa etylamin và trimetylamin. Hỗn hợp Y chứa 2 hiđrocacbon mạch hở có số liên kết pi nhở hơn 3. Trộn X và Y theo tỉ lệ mol nX : nY = 1:5 thu được hỗn hợp Z. Đốt cháy hoàn toàn 3,17 gam hỗn hợp Z cần dùng vừa đủ 7,0 lít khí oxi (đktc), sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua dung dịch NaOH đặc, dư thấy khối lượng dung dịch tăng 12,89 gam. Phần trăm khối lượng của etylamin trong X gần nhất với giá trị nào sau đây?
-
A.
21%.
-
B.
70%.
-
C.
79%.
-
D.
30%.
Đáp án : B
\(3,17\,g\,Z\left\{ \begin{array}{l}{C_n}{H_{2n + 3}}N:z\\{C_m}{H_{2m + 2 - 2\bar k}}:5z\end{array} \right. + {O_2}:0,3125\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:b\\{N_2}:0,5z\end{array} \right. + NaOH \to \Delta m = 12,89\,gam\)
+ mdd NaOH tăng = mCO2 + mH2O
BTNT O => nCO2, nH2O
+ BTKL (hoặc BTNT trong Z) => nN2 → Z
\(\begin{array}{l}3,17\,g\,Z\left\{ \begin{array}{l}{C_n}{H_{2n + 3}}N:z\\{C_m}{H_{2m + 2 - 2\bar k}}:5z\end{array} \right. + {O_2}: + 0,3125\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:b\\{N_2}:0,5z\end{array} \right. + NaOH \to \Delta m = 12,89gam\\ \Rightarrow \left\{ \begin{array}{l}{m_{C{O_2}}} + {m_{{H_2}O}} = \Delta m = 12,892\\{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}(BTNT)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}44a + 18b = 12,892\\a + b = 2.0,3125\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,205\\b = 0,215\end{array} \right.\\{m_Z} = {m_C} + {m_H} + {m_N} \Rightarrow {m_N} = 3,17 - (12.0,205 + 2.0,215) = 0,28gam\\ \Rightarrow {n_N} = 0,02\,mol \Rightarrow z = 0,02 \Rightarrow {n_Y} = 5z = 0,1\\{n_{{H_2}O}} - {n_{C{O_2}}} = 0,01 = 1,5z + 5z.(1 - \bar k) \Rightarrow \bar k = 1,2\\{n_Z} = 6z = 0,12\,mol \Rightarrow \bar C = \frac{{{n_{C{O_2}}}}}{{{n_Z}}} = 1,708;\,\bar H = \frac{{{n_H}}}{{{n_Z}}} = 3,583\end{array}\)
Vì X chứa 2 amin C2H7N và C3H9N, đều có số nguyên tử C > 1,708 và H > 3,583
→ Y chứa một hiđrocacbon có số nguyên tử C < 1,708 → Y chứa CH4.
Hai hiđrocacbon trong Y có số liên kết pi nhỏ hơn 3, mà CH4 (k=0) và = 1,2
→ hiđrocacbon còn lại Y2 có k = 2 và số nguyên tử H < 3,583 → Y2: C2H2
\(\begin{array}{l}\bar k = {\rm{ }}1,2\Rightarrow \frac{{{n_{C{H_4}}}(k = 0)}}{{{n_{{Y_2}}}(k = 2)}} = \frac{{\left| {2 - 1,2} \right|}}{{\left| {0 - 1,2} \right|}} = \frac{2}{3}\\ \Rightarrow {n_{C{H_4}}} = 2z = 0,04;\,{n_{{Y_2}}} = 0,06\,mol\\{n_{C{O_2}}} = 0,205 = n.x + {n_{C{H_4}}} + 2{n_{{C_2}{H_2}}} \Rightarrow n = \frac{{0,205 - 0,04 - 2.0,06}}{{0,02}} = 2,25\\X\left\{ \begin{array}{l}{C_2}{H_7}N:x\\{C_3}{H_9}N:y\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x + y = 0,02\\2x + 3y = 2,25.0,02 = {n_C}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,015\\y = 0,005\end{array} \right.\\ \Rightarrow \% {C_2}{H_7}N(X) = \frac{{0,015.45}}{{0,015.45 + 0,005.59}}.100\% = 69,59\% \end{array}\)
Cho 1,22 gam hỗn hợp X gồm hai amin bậc một (tỉ lệ mol là 1:2) tác dụng vừa đủ với 400 ml dung dịch HCl 0,1M thu được dung dịch Y. Mặt khác, khi đốt cháy hoàn toàn 0,09 mol hỗn hợp X thu được hỗn hợp khí và hơi. Dẫn toàn bộ hỗn hợp khí và hơi đó vào dung dịch Ba(OH)2 dư, lạnh thì thu được m gam kết tủa và thoát ra 1,344 lít (đktc) một khí duy nhất. Giá trị của m là
-
A.
23,64.
-
B.
78,8.
-
C.
11,82.
-
D.
39,40.
Đáp án : A
\(\begin{array}{l}T{N_1}:\,\,1,22\,gX + HCl:0,04\,mol \to \\ \Rightarrow {n_{N(hh1)}} = {n_{HCl}} = 0,04\,mol.\\T{N_2}:\,\,0,09\,mol\,X + {O_2} \to \left\{ \begin{array}{l}C{O_2}\\{H_2}O\\{N_2}\end{array} \right. + Ba{(OH)_2} \to \left\{ \begin{array}{l}m\,g \downarrow BaC{O_3}\\0,06\,mol\, \uparrow \end{array} \right.\\ \Rightarrow {n_{{N_2}}} = 0,06 \Rightarrow {n_{N{\kern 1pt} (hh2)}} = 0,12\,mol = 3{n_{N(hh1)}}\\ \Rightarrow {m_{X(T{N_2})}} = 3{m_{X(T{N_1})}} = 3,66\,gam.\end{array}\)
Ntb = 0,12/0,09 = 4/3 → X có chứa 1 amin đơn chức RNH2 (a mol); amin còn lại là amin đa chức R’(NH2)n (b mol) (Xét trong 3,66 gam X)
Tỉ lệ mol của 2 amin là 1: 2 → có 2 TH:
\(\begin{array}{l} + T{H_1}:\left\{ \begin{array}{l}a + b = 0,09\\b = 2a\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,03\\b = 0,06\end{array} \right.\\ \Rightarrow {n_N} = 0,12 = 0,03.1 + 0,06.n \Rightarrow n = 1,5\,(loai)\\ + T{H_2}:\left\{ \begin{array}{l}a + b = 0,09\\a = 2b\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,06\\b = 0,03\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}{n_N} = 0,12 = 0,06.1 + 0,03.n\\0,06(R + 16) + 0,03(R' + 16n) = 3,66\end{array} \right. \Rightarrow \left\{ \begin{array}{l}n = 22\\R + R' = 58\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}n = 2\\R = 15;R' = 28\end{array} \right.\\ \Rightarrow X\left\{ \begin{array}{l}C{H_3}N{H_2}:0,06\,mol\\{C_2}{H_4}{(N{H_2})_2}:0,03\,mol\end{array} \right. + {O_2} \to 0,12\,mol\,C{O_2} + Ba{(OH)_2} \to m\,g\,BaC{O_3}\\ \Rightarrow m = 0,12.197 = 23,64\,gam\end{array}\)
Hỗn hợp E chứa axetilen, propin và một amin no, đơn chức, mạch hở. Đốt cháy hoàn toàn 5,46 gam hỗn hợp E cần dùng 11,088 lít O2 (đktc) thu được hỗn hợp F gồm CO2, H2O và khí N2, trong đó tỉ lệ mol CO2: H2O là 1:1. Phân tử khối của amin là
-
A.
45
-
B.
31
-
C.
59
-
D.
73
Đáp án : A
\(5,46g\,E\left\{ \begin{array}{l}{C_n}{H_{2n - 2}}:x\\{C_m}{H_{2m + 3}}N:y\end{array} \right. + {O_2}:0,495\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:a\\{N_2}\end{array} \right.\)
Sử dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải bài toán này
\(\begin{array}{l}5,46g\,E\left\{ \begin{array}{l}{C_n}{H_{2n - 2}}:x\\{C_m}{H_{2m + 3}}N:y\end{array} \right. + {O_2}:0,495\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:a\\{N_2}\end{array} \right.\\BTNT\,oxi:2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} \Rightarrow 0,495.2 = 2a + a \Rightarrow a = 0,33\,mol\\5,46 = {m_E} = {m_C} + {m_H} + {m_N} = 0,33.12 + 0,33.2 + {m_N}\\ \Rightarrow {m_N} = 0,84 \Rightarrow y = 0,06\,mol\\{n_{{H_2}O}} - {n_{C{O_2}}} = 0 \Rightarrow x = 1,5y = 0,09\,mol\\\left\{ \begin{array}{l}nx + my = {n_{C{O_2}}} = 0,33\\2 < n < 3\end{array} \right. \Rightarrow \left\{ \begin{array}{l}0,09n + 0,06m = 0,33\\2 < n < 3\end{array} \right.\\ \Rightarrow 1 < m < 2,5 \Rightarrow n = 2 \Rightarrow A\min :\,{C_2}{H_7}N\end{array}\)
Luyện tập và củng cố kiến thức Tổng hợp bài tập amin phản ứng với axit và với các dung dịch muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập amin phản ứng với HNO2 và phản ứng thế ở nhân thơm của anilin Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Amino axit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Tính lưỡng tính của amino axit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Đốt cháy amino axit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Phản ứng khác của amino axit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập dẫn xuất của amin và amino axit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 11. Peptit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 11. Protein Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 11. Phản ứng thủy phân peptit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập đốt cháy peptit Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Amin - Amino axit (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Amin - Amino axit (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Peptit (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Peptit (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 3 Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Tính bazơ của amin Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Đồng phân và tính chất vật lí của amin Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Khái niệm, phân loại và danh pháp của amin Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận