Trắc nghiệm Tổng hợp bài tập điện phân hay và khó - Hóa 12
Đề bài
Cho m gam tinh thể CuSO4.5H2O vào dung dịch KCl thu được dung dịch X. Tiến hành điện phân dung dịch X với điện cực trơ, màng ngăn xốp và cường độ dòng điện không đổi, ở thời gian t giây thu được dung dịch Y đồng thời ở anot thu được 0,15 mol hỗn hợp khí. Nếu thời gian điện phân là 2t giây, tổng số mol khí thoát ra ở cả hai điện cực là 0,393 mol. Nhúng thanh Mg vào dung dịch Y, kết thúc phản ứng thấy khối lượng thanh không đổi so với trước phản ứng. Giá trị của m là
-
A.
70,5.
-
B.
71,0.
-
C.
73,0.
-
D.
73,5.
Điện phân dung dịch chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1: 3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện 2,68A. Sau thời gian điện phân t (giờ), thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Dung dịch Y phản ứng vừa hết với 2,55 gam Al2O3. Giá trị của t gần nhất với giá trị nào sau đây?
-
A.
4.
-
B.
5
-
C.
6.
-
D.
3,5.
Tiến hành điện phân dung dịch chứa 43,24 gam hỗn hợp gồm MSO4 và NaCl bằng điện cực trơ màng ngăn xốp với cường độ dòng điện không đổi. Sau thời gian t giây thì nước bắt đầu điện phân ở cả 2 điện cực, thấy khối lượng catot tăng so với ban đầu, đồng thời anot thoát ra một khí duy nhất có thể tích là 4,48 lít (đktc). Nếu thời gian điện phân là 2t giây thì khối lượng dung dịch giảm 25,496 gam. Kim loại M là :
-
A.
Ni
-
B.
Cu
-
C.
Fe
-
D.
Zn
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1 : 3) với cường độ dòng điện 1,34A. Sau thời gian t giờ, thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Cho bột Al dư vào Y, thu được 1,68 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước. Giá trị của t là
-
A.
7.
-
B.
6.
-
C.
5.
-
D.
4.
Điện phân dung dịch muối MSO4 (M là kim loại) với điện cực trơ cường độ dòng điện không đổi. Sau thời gian t giây thu được a mol khí ở anot. Nếu thời gian điện phân là 2t giây thì tống số mol khí thu được ở cả hai điện cực là 2,5a mol. Giả sử hiệu suất điện phân là 100%. Khí sinh ra không tan trong nước. Phát biều nào sau đây sai?
-
A.
Tại thời điểm t giây, ion M2+chưa bị điện phân hết
-
B.
Khi thu được 1,8a mol khí ở anot thì vẫn chưa xuất hiện bọt khí ở catot
-
C.
Dung dịch sau 2t giây điện phân có pH <7
-
D.
Tại thời điểm 2t giây, có bọt khí ở catot
Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau phản ứng xảy ra hoàn toàn thu được 0,336 gam hỗn hợp kim loại; 0,112 lít hỗn hợp khí Z (đktc) gồm NO và N2O có tỉ khối đối với H2 là 19,2 và dung dịch Y chứa 3,04 gam muối. Cho toàn bộ hỗn hợp bột kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lit khí H2 (đktc). Giá trị của t là :
-
A.
2267,75
-
B.
2895,10
-
C.
2316,00
-
D.
2219,40
Cho hai bình điện phân, bình (1) đựng 20 ml dung dịch NaOH 1,73M; bình (2) đựng dung dịch gồm 0,225 mol Cu(NO3)2 và 0,2 mol HCl. Mắc nối tiếp bình (1) và bình (2). Điện phân các dung dịch bằng dòng điện một chiều với cường độ dòng điện không đổi một thời gian. Khi dừng điện phân, tháo ngay catot ở các bình. Sau phản ứng thấy nồng độ NaOH ở bình (1) là 2M, Cho tiếp 14 gam bột Fe vào bình (2) đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn không tan. Biết NO là sản phẩm khử duy nhất N+5, khối lượng riêng của nước là 1 g/ml. Giá trị m là:
-
A.
9,8
-
B.
10,4
-
C.
8,3
-
D.
9,4
Điện phân dung dịch AgNO3 với điện cực trơ, sau một thời gian thu được dung dịch X chứa 2 chất tan có cùng nồng độ (mol/lít), và thấy khối lượng dung dịch giảm đi 9,28 gam so với ban đầu. Cho tiếp 2,8 gam bột Fe vào dung dịch X, thu được dung dịch Y và chất rắn Z và khí NO ( sản phẩm khử duy nhất của N5+). Biết các phản ứng xảy ra hoàn toàn. Tổng khối lượng muối trong dung dịch Y là:
-
A.
11,48.
-
B.
15,08.
-
C.
10,24.
-
D.
13,64
Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch chứa hỗn hợp CuSO4 và NaCl (tỉ lệ 1 : 1) bằng dòng điện một chiều có cường độ ổn định. Sau t (h), thu được dung dịch X và sau 2t (h) thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư, thu được a mol khí H2. Dung dịch Y tác dụng với bột Al dư thu được 4a mol khí H2. Phát biểu nào sau đây không đúng?
-
A.
Tại thời điểm 2t (h), tổng số mol khí thoát ra ở hai điện cực là 9a mol.
-
B.
Khi thời gian là 1,75t (h), tại catot đã có khí thoát ra.
-
C.
Tại thời điểm 1,5t (h), Cu2+ chưa điện phân hết.
-
D.
Nước bắt đầu điện phân tại anot ở thời điểm 0,75t (h)
Dung dịch X chứa m gam chất tan gồm Cu(NO3)2 (có mCu(NO3)2 > 5 gam) và NaCl. Điện phân dung dịch X với điện cực trơ, màng ngăn xốp và cường độ dòng điện không đổi. Sau thời gian t giây thì thu được dung dịch Y chứa (m – 18,79) gam chất tan và có khí thoát ra ở catot. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Z chứa z gam chất tan và hỗn hợp khí T chứa 3 khí và có tỉ khối hơi so với H2 là 16. Cho Z vào dung dịch chứa 0,1 mol FeCl2 và 0,2 mol HCl thì thu được dung dịch chứa (z + 16,46) gam chất tan và có khí thoát ra. Tổng giá trị m + z là
-
A.
73,42.
-
B.
72,76.
-
C.
74,56.
-
D.
76,24.
Hòa tan hoàn toàn m gam hỗn hợp Cu(NO3)2 và KCl vào H2O thu được dung dịch X. Điện phân dung dịch X (với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giờ thu được 1,12 lít (đktc) khí ở anot. Nếu điện phân trong thời gian 3,5t giờ thì thu được 2,8 lít khí (đktc) khí ở anot và thu được dung dịch Y. Cho 20 gam bột Fe vào Y, sau khi các phản ứng xảy ra hoàn toàn thu được khí NO (sản phẩm khử duy nhất của N+5) và 16,4 gam hỗn hợp kim loại. Biết hiệu suất điện phân là 100%, các khí không tan trong dung dịch. Giá trị của m là
-
A.
48,775
-
B.
58,175
-
C.
31,675
-
D.
69,350
Điện phân V lit dung dịch X (điện cực trơ, màng ngăn xốp , cường độ dòng điện không đổi) chứa đồng thời R(NO3)2 0,45M (R là kim loại có hóa trị không đổi) và NaCl 0,4M trong thời gian t(giây) thu được 5,376 lit hỗn hợp khí ở anot (dktc). Nếu thời gian điện phân là 2t (giây) thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 320 ml dung dịch chứa KOH 0,75M và NaOH 0,5M, không sinh ra kết tủa . Biết hiệu suất điện phân 100%. Các khí sinh ra không tan trong dung dịch. Giá trị của V là :
-
A.
0,60
-
B.
0,80
-
C.
0,40
-
D.
1,60
Điện phân dung dịch X chứa KCl và CuSO4 bằng dòng điện một chiều có cường độ 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị bên.
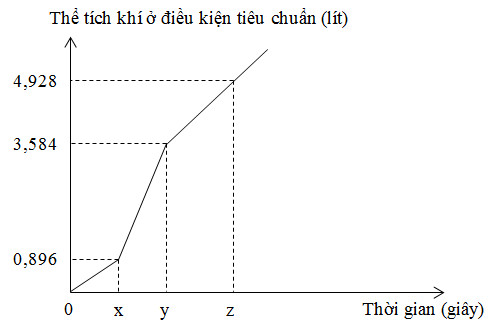
Phát biểu nào sau đây đúng?
-
A.
Tỉ lệ mol CuSO4 : KCl trong X là 2 : 5.
-
B.
Dung dịch sau điện phân có pH > 7.
-
C.
Tại thời điểm 2x (giây), tổng thể tích khí thoát ra ở hai cực là 2,8 lít (đktc).
-
D.
Tại thời điểm z (giây), khối lượng dung dịch giảm là 10,38 gam.
Cho hỗn hợp X gồm CuCl2 và FeCl3. Điện phân dung dịch chứa m gam hỗn hợp X với điện cực trơ, cường độ dòng điện 2,68A, trong thời gian là 4 giờ. Sau khi kết thúc điện phân thu được dung dịch Y có khối lượng giảm 20,6 gam so với trước khi điện phân. Toàn bộ dung dịch Y tác dụng với lượng dư dung dịch AgNO3 thu được 136,4 gam kết tủa. Mặt khác cho 14,88 gam bột Mg vào dung dịch chứa m gam hỗn hợp X ban đầu. Kết thúc phản ứng thu được m' gam kim loại. Giá trị của m' là
-
A.
26,88 gam.
-
B.
35,68 gam.
-
C.
19,2 gam.
-
D.
24,48 gam.
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện ly nóng chảy hoặc dung dịch chất điện ly nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
* Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
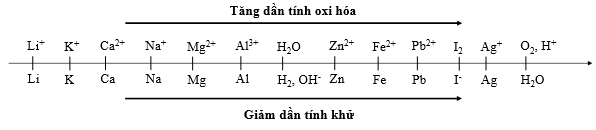
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Mg(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Bán phản ứng nào xảy ra ở anot?
-
A.
Pb \( \to\) Pb2+ + 2e
-
B.
Mg \( \to\) Mg2+ + 2e
-
C.
2H2O \( \to\) O2 + 4H+ + 4e
-
D.
\(4NO_3^ - \to 2{N_2}{O_5} + {O_2} + 4{\text{e}}\)
Bán phản ứng nào xảy ra ở catot?
-
A.
Pb2+ + 2e \( \to\) Pb
-
B.
Mg2+ + 2e \( \to\) Mg
-
C.
O2 + 4H+ + 4e \( \to\) 2H2O
-
D.
H2O + 2e \( \to\) H2 + 2OH-
Giá trị pH của dung dịch thay đổi như thế nào?
-
A.
pH tăng do OH- sinh ra ở catot
-
B.
pH giảm do H+ sinh ra ở anot
-
C.
pH không đổi do không có H+ và OH- sinh ra
-
D.
pH không đổi do lượng H+ sinh ra ở anot bằng với lượng OH- sinh ra ở catot
Nếu người sinh viên đổi 2 điện cực than chì bằng 2 điện cực kim loại Pb, phản ứng nào xảy ra ở catot và anot?
-
A.
Catot: Pb2+ + 2e \( \to\) Pb; Anot: 2H2O \( \to\) O2 + 4H+ + 4e
-
B.
Catot: Mg2+ + 2e \( \to\) Mg; Anot: Pb \( \to\) Pb2+ + e
-
C.
Catot: 2H2O + 2e \( \to\) H2 + 2OH-; Anot: Pb \( \to\) Pb2+ + e
-
D.
Catot: Pb2+ + 2e \( \to\) Pb; Anot: Pb \( \to\) Pb2+ + e
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện ly nóng chảy hoặc dung dịch chất điện ly nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
* Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
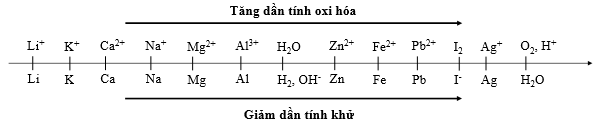
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Mg(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
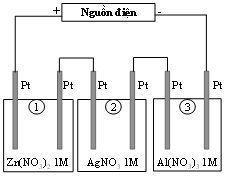
Sau một thời gian, sinh viên quan sát thấy có 3,24 gam kim loại bạc bám lên điệc cực của bình 2. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Zn và Al lần lượt là 108; 65 và 27 đvC.
Từ thí nghiệm 2, hãy tính:
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
-
A.
Pb → Pb2++ 2e.
-
B.
Mg → Mg2+ + 2e.
-
C.
2H2O → O2+ 4H+ + 4e.
-
D.
4NO3- → 2N2O5 + O2 + 4e.
Số gam kim loại Zn bám lên điện cực trong bình 1 là:
-
A.
0 gam
-
B.
3,9 gam
-
C.
0,975 gam
-
D.
1,95 gam
Số gam kim loại Al bám lên điện cực trong bình 3 là:
-
A.
0 gam
-
B.
1,62 gam
-
C.
0,405 gam
-
D.
0,81 gam
Điện phân 400 ml (không đổi) dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng 1,93A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn dưới đây.
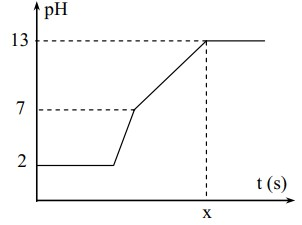
Giá trị của t trên đồ thị là
-
A.
3600
-
B.
3000
-
C.
1800
-
D.
1200
Tiến hành điện phân 100 gam dung dịch chứa 0,2 mol FeCl3; 0,1 mol CuCl2 và 0,16 mol HCl (với 2 điện cực trơ) đến khi có khi bắt đầu thoát ra ở cả hai điện cực thì dừng điện phân. Đem phần dung dịch cho tác dụng hết với 150 gam dung dịch chứa AgNO3, kết thúc phản ứng thu được 90,08 gam kết tủa và dung dịch Y chứa một muối duy nhất có nồng độ a%. Giá trị của a gần nhất với giá trị nào sau đây?
-
A.
34,5.
-
B.
33,5.
-
C.
30,5.
-
D.
35,5.
Hòa tan hoàn toàn m gam hỗn hợp CuSO4 và NaCl vào nước thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được trên cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (đồ thị gấp khúc tại các điểm M, N). Giả sử hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của m là

-
A.
14,48.
-
B.
15,76.
-
C.
13,42.
-
D.
11,08.
Tiến hành điện phân dung dịch chứa a mol KCl và b mol CuSO4 với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 7,5A, trong thời gian t = 4632s, thu được dung dịch X, đồng thời anot thoát ra 0,12 mol hỗn hợp khí. Nếu thời gian điện phân là 1,5t (s) thì tổng số mol khí thoát ra ở 2 điện cực là 0,215 mol. Giả sử trong quá trình điện phân nước bay hơi không đáng kể, hiệu suất điện phân đạt 100%, các khí sinh ra không tan trong nước, bỏ qua sự thủy phân của muối. Cho các phát biểu liên quan đến bài toán:
(a) Tổng khối lượng 2 muối trước điện phân là 35,48g
(b) Nếu thời gian điện phân là 1,25t (s) thì nước đã điện phân ở 2 điện cực
(c) Giá trị của a, b lần lượt là 0,12 và 0,25
(d) Dung dịch X chỉ có 2 chất tan
(e) Đến thời điểm 1,5t (s), số mol H+ sinh ra ở anot là 0,32 mol
Số phát biểu sai là:
-
A.
4
-
B.
1
-
C.
2
-
D.
3
Lời giải và đáp án
Cho m gam tinh thể CuSO4.5H2O vào dung dịch KCl thu được dung dịch X. Tiến hành điện phân dung dịch X với điện cực trơ, màng ngăn xốp và cường độ dòng điện không đổi, ở thời gian t giây thu được dung dịch Y đồng thời ở anot thu được 0,15 mol hỗn hợp khí. Nếu thời gian điện phân là 2t giây, tổng số mol khí thoát ra ở cả hai điện cực là 0,393 mol. Nhúng thanh Mg vào dung dịch Y, kết thúc phản ứng thấy khối lượng thanh không đổi so với trước phản ứng. Giá trị của m là
-
A.
70,5.
-
B.
71,0.
-
C.
73,0.
-
D.
73,5.
Đáp án : A
Trong t giây đầu tiên, tại anot thu được Cl2 (a mol) và O2 (b mol)
Từ tổng số mol khí => PT (1)
+) Tính số mol electron trao đổi trong t (s) theo a và b => số mol e trao đổi trong 2t (s)
+) Đặt \({{n}_{CuS{{O}_{4}}}}=x\) => trong t (s) tính nCuSO4 bị đp => nCuSO4 dư
+) Khi nhúng Mg vào Y, vì khối lượng thanh không đổi nên: mMg pứ = mCu bị Mg đẩy ra => PT (2)
+) Tính số mol H2 thu được sau 2t (s)
Khí trong 2t giây = khí trong t giây đầu (0,15 mol) + H2 + O2
=> tổng số mol khí = PT (3)
Giải hệ (1), (2), (3) => a; b ; x => \({{m}_{CuS{{O}_{4}}.5{{H}_{2}}O}}\)
Trong t giây đầu tiên, tại anot thu được Cl2 (a mol) và O2 (b mol)
=> a + b = 0,15 (1)
=> Số mol electron trao đổi trong t giây = 2a + 4b
Ban đầu đặt \({{n}_{CuS{{O}_{4}}}}=x\) => trong t giây thì nCuSO4 bị đp = a + 2b => nCuSO4 dư = x – a – 2b
\({{n}_{{{O}_{2}}}}=b=>{{n}_{{{H}^{+}}}}=4b\)
Khi nhúng Mg vào Y, vì khối lượng thanh không đổi nên: mMg pứ = mCu bị Mg đẩy ra
=> 24.(x – a – 2b + 2b) = 64.(x – a – 2b) (2)
Sau 2t giây thì ne = 4a + 8b => nH2 = 2a + 4b – x
Khí trong 2t giây = khí trong t giây đầu (0,15 mol) + H2 + O2
=> 0,15 + (2a + 4b – x) + (a/2 + b) = 0,393 (3)
Giải hệ (1), (2), (3) => a = 0,09; b = 0,06; x = 0,282
=> \({{m}_{CuS{{O}_{4}}.5{{H}_{2}}O}}=70,5\)
Điện phân dung dịch chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1: 3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện 2,68A. Sau thời gian điện phân t (giờ), thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Dung dịch Y phản ứng vừa hết với 2,55 gam Al2O3. Giá trị của t gần nhất với giá trị nào sau đây?
-
A.
4.
-
B.
5
-
C.
6.
-
D.
3,5.
Đáp án : D
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
+) Xét các chất có trong dd Y
+) \({{n}_{O{{H}^{-}}}}=2{{n}_{A{{l}_{2}}{{O}_{3}}}}\)
+) Từ số mol OH- sinh ra => tính số mol Cl- và số mol Cu2+ phản ứng
+) m giảm = mkhí sinh ra => so sáng với 10,375
=> H2O bị điện phân => tính số mol H2 và O2 sinh ra
+) Tính số mol các khí thoát ra ở anot => số mol e trao đổi
+) \(t=\frac{{{n}_{e}}.F}{I}\)
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước => dung dịch Y chứa OH-
Vì dung dịch Y chứa 2 chất tan => Y gồm NaOH và Na2SO4 => Cl- bị điện phân hết
\(A{{l}_{2}}{{O}_{3}}+2O{{H}^{-}}~\to \text{ }2Al{{O}_{2}}^{-}+{{H}_{2}}O\)
=> \({{n}_{O{{H}^{-}}}}=2{{n}_{A{{l}_{2}}{{O}_{3}}}}=0,05\text{ }mol\)
Quá trình điện phân:
Cu2+ + 2Cl- → Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
0,05 ← 0,025 ← 0,025 ← 0,05
m giảm= 64a + 71a + 71.0,5a + 2.0,5a = 8,575 gam < 10,375
=> H2O bị điện phân: mH2O = 10,375 - 8,575 = 1,8 gam
2H2O → 2H2 + O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2 và 0,05 mol O2
=> \({{n}_{e}}=0,075.2+0,05.4=0,35\text{ }mol\Rightarrow t=\frac{{{n}_{e}}.F}{I}=\frac{0,35.96500}{2,68}=12602,6\text{ (s)}=3,5\,(h)\)
Tiến hành điện phân dung dịch chứa 43,24 gam hỗn hợp gồm MSO4 và NaCl bằng điện cực trơ màng ngăn xốp với cường độ dòng điện không đổi. Sau thời gian t giây thì nước bắt đầu điện phân ở cả 2 điện cực, thấy khối lượng catot tăng so với ban đầu, đồng thời anot thoát ra một khí duy nhất có thể tích là 4,48 lít (đktc). Nếu thời gian điện phân là 2t giây thì khối lượng dung dịch giảm 25,496 gam. Kim loại M là :
-
A.
Ni
-
B.
Cu
-
C.
Fe
-
D.
Zn
Đáp án : A
Gọi số mol MSO4 và NaCl trong hỗn hợp ban đầu lần lượt là x và y mol
=> khối lượng hỗn hợp = PT (1)
Vì điện phân chỉ ngừng khi nước bắt đầu điện phân ở cả 2 điện cực, mà ở anot chỉ có Cl2
=> nước chưa bị điện phân ở anot
+) từ số mol Cl2 thu được => y (2)
+) Tính số mol e trao đổi ở 2t (s)
=> mdd giảm = PT (3)
Từ (1),(2),(3) => x; y và M
Gọi số mol MSO4 và NaCl trong hỗn hợp ban đầu lần lượt là x và y mol
Khi điện phân t (s)
43,24 = (M + 96).x + 58,5.y (1)
Catot (-) : M2+ + 2e → M
Mol x → 2x
2H2O + 2e → H2 + 2OH-
Mol (0,4 – 2x)
Anot (+) : 2Cl- → Cl2 + 2e
ne = 0,4 mol
=> nCl2 = 0,2 mol ; nNaCl = 0,4 mol = y
=> (M + 96)x = 19,84 (2)
(Vì điện phân chỉ ngừng khi nước bắt đầu điện phân ở cả 2 điện cực, mà ở Anot chỉ có Cl2
=> nước chưa bị điện phân ở anot)
Với 2t (s) => ne = 0,8 mol
Anot : 2H2O + 2e → O2 + 4H+ + 4e
=> mdd giảm = M.x + 2.(0,2 – x + 0,2) + 0,2.71 + 0,1.32 = 25,496 (3)
Từ (2),(3) => x = 0,128 ; M = 59 (Ni)
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1 : 3) với cường độ dòng điện 1,34A. Sau thời gian t giờ, thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Cho bột Al dư vào Y, thu được 1,68 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước. Giá trị của t là
-
A.
7.
-
B.
6.
-
C.
5.
-
D.
4.
Đáp án : A
+ Bảo toàn electron
+ Viết các quá trình điện phân
+ m giảm = m↓ + m↑
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al + OH- → AlO2- + 1,5H2
\(=>{{n}_{O{{H}^{-}}}}=\frac{{{n}_{{{H}_{2}}}}}{1,5}=0,05\text{ }mol\)
Quá trình điện phân:
Cu2+ + 2Cl- → Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm= 64a + 71a + 71.0,5a + 2.0,5a = 8,575 gam < 10,375
=> H2O bị điện phân: mH2O = 10,375 - 8,575 = 1,8 gam
H2O → H2 + 0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne = 0,075.2 + 0,05.4 = 0,35 mol
\(=>t=\frac{{{n}_{e}}.96500}{I}=\frac{0,35.96500}{1,34}=25205,2\text{ }(s)=7\,(h)\)
Điện phân dung dịch muối MSO4 (M là kim loại) với điện cực trơ cường độ dòng điện không đổi. Sau thời gian t giây thu được a mol khí ở anot. Nếu thời gian điện phân là 2t giây thì tống số mol khí thu được ở cả hai điện cực là 2,5a mol. Giả sử hiệu suất điện phân là 100%. Khí sinh ra không tan trong nước. Phát biều nào sau đây sai?
-
A.
Tại thời điểm t giây, ion M2+chưa bị điện phân hết
-
B.
Khi thu được 1,8a mol khí ở anot thì vẫn chưa xuất hiện bọt khí ở catot
-
C.
Dung dịch sau 2t giây điện phân có pH <7
-
D.
Tại thời điểm 2t giây, có bọt khí ở catot
Đáp án : B
+) tại thời điểm t (s) có a mol khí ở anot => tính số mol e trao đổi
+) tại thời điểm 2t (s), số mol e trao đổi gấp đôi trong t (s)
=> tính số mol khí thoát ra ở anot => số mol khí thoát ra ở catot và số mol M2+ phản ứng
+) Xét các đáp án
+) t giây
Catot: M2+ + 2e → M
2a ← 4a
Anot: H2O - 2e → 0,5O2 + 2H+
4a ← a
+) 2t giây
Điện phân trong thời gian 2t (s) thì số mol e trao đổi gấp đôi trong t (s)
=> ne trao đổi 2t = 2.4a = 8a (mol)
Anot: 2H2O - 4e → O2 + 4H+
8a → 2a → 8a
Vì tổng số mol khí thu được ở 2 điện cực là 2,5a mol => nH2 sinh ra ở catot = 2,5a – 2a = 0,5a (mol)
Catot:
M2+ + 2e → M
3,5a ← 7a
2H2O + 2e → H2 + 2OH-
a ← 0,5a → a
Vì tại thời điểm 2t (s) số mol M2+ bị điện phân là 3,5a => ở t (s) M2+ chưa bị điện phân hết => A đúng
+) Xét tại thời điểm thu được 1,8a mol khí ở anot:
Anot: H2O - 2e → 0,5O2 + 2H+
7,2a ← 1,8a
Catot:
M2+ + 2e → M
3,5a → 7a
2H2O + 2e → H2 + 2OH-
0,2a → 0,1a
=> tại thời điểm này thu được 0,1a mol khí H2 ở catot => B sai
+) Sau 2t (s) thu được ${{n}_{{{H}^{+}}}}=8\text{a}\,>{{n}_{O{{H}^{-}}}}=a$ => dung dịch thu được có pH < 7
+) D đúng, tại thời điểm 2t (s) ở catot thoát ra 0,5a mol khí H2
Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau phản ứng xảy ra hoàn toàn thu được 0,336 gam hỗn hợp kim loại; 0,112 lít hỗn hợp khí Z (đktc) gồm NO và N2O có tỉ khối đối với H2 là 19,2 và dung dịch Y chứa 3,04 gam muối. Cho toàn bộ hỗn hợp bột kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lit khí H2 (đktc). Giá trị của t là :
-
A.
2267,75
-
B.
2895,10
-
C.
2316,00
-
D.
2219,40
Đáp án : C
- Bảo toàn e
- Định luật Faraday : ne.F = It
+) Mg + X thu được hỗn hợp kim loại => Ag+ chưa điện phân hết
+) Hỗn hợp kim loại + HCl => nMg = nH2 => nAg
+) Tính số mol NO và N2O
Gọi \({{n}_{N{{H}_{4}}N{{O}_{3}}}}=x\text{ }mol\)
Bảo toàn e : \({{n}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}={{n}_{Mg+HN{{O}_{3}}}}+{{n}_{Mg+A{{g}^{+}}}}~=\frac{1}{2}.\left( 3{{n}_{NO}}+8{{n}_{{{N}_{2}}O}}+8{{n}_{N{{H}_{4}}N{{O}_{3}}}} \right)+\frac{1}{2}.{{n}_{Ag}}\)
=> tính số mol muối Mg(NO3)2
+) Từ mmuối \(={{m}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}+{{m}_{N{{H}_{4}}N{{O}_{3}}}}\Rightarrow x\)
+) \({{n}_{{{H}^{+}}(X)}}=4{{n}_{NO}}+10{{n}_{{{N}_{2}}O}}+10{{n}_{N{{H}_{4}}N{{O}_{3}}}}={{n}_{e}}\)
+) Định luật Faraday : ne.F = It => t
Khi điện phân AgNO3 :
Catot : Ag+ + 1e → Ag
Anot : 2H2O → 4H+ + 4e + O2
Mg + X thu được hỗn hợp kim loại => Ag+ chưa điện phân hết
- Hỗn hợp kim loại + HCl => nMg = nH2 = 0,005 mol => nAg = 0,002 mol
Hỗn hợp khí là sản phẩm khử của Mg với H+ và NO3- (Mg dư)
\({{n}_{NO}}+{{n}_{{{N}_{2}}O}}\) = 0,005 mol
\({{m}_{NO}}+{{m}_{{{N}_{2}}O}}~\)= 2.19,2.0,005 = 0,192 gam
=> nNO = 0,002 và \({{n}_{{{N}_{2}}O}}\)= 0,003 mol
Gọi \({{n}_{N{{H}_{4}}N{{O}_{3}}}}=x\text{ }mol\)
Bảo toàn e : \({{n}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}={{n}_{Mg+HN{{O}_{3}}}}+{{n}_{Mg+A{{g}^{+}}}}~=\frac{1}{2}.\left( 3{{n}_{NO}}+8{{n}_{{{N}_{2}}O}}+8{{n}_{N{{H}_{4}}N{{O}_{3}}}} \right)+\frac{1}{2}.{{n}_{Ag}}\)
\(=\frac{1}{2}\left( 3.0,002+8.0,003+8x \right)+\frac{1}{2}.0,002=0,016+4x\)
=> mmuối \(={{m}_{Mg{{\left( N{{O}_{3}} \right)}_{2}}}}+{{m}_{N{{H}_{4}}N{{O}_{3}}}}=148.\left( 0,016+4x \right)+80x=3,04\,gam\)
=> x = 0,001 mol
=> \({{n}_{{{H}^{+}}(X)}}=4{{n}_{NO}}+10{{n}_{{{N}_{2}}O}}+10{{n}_{N{{H}_{4}}N{{O}_{3}}}}=0,048\text{ }mol={{n}_{e}}\)
Định luật Faraday : ne.F = It => t = 2316 (s)
Cho hai bình điện phân, bình (1) đựng 20 ml dung dịch NaOH 1,73M; bình (2) đựng dung dịch gồm 0,225 mol Cu(NO3)2 và 0,2 mol HCl. Mắc nối tiếp bình (1) và bình (2). Điện phân các dung dịch bằng dòng điện một chiều với cường độ dòng điện không đổi một thời gian. Khi dừng điện phân, tháo ngay catot ở các bình. Sau phản ứng thấy nồng độ NaOH ở bình (1) là 2M, Cho tiếp 14 gam bột Fe vào bình (2) đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn không tan. Biết NO là sản phẩm khử duy nhất N+5, khối lượng riêng của nước là 1 g/ml. Giá trị m là:
-
A.
9,8
-
B.
10,4
-
C.
8,3
-
D.
9,4
Đáp án : C
+) Sau khi x mol H2O bị điện phân thì thể tích dung dịch còn lại là 20-18x (ml)
+) Từ nồng độ của NaOH => tính x
=> ne trao đổi
Bình 2:
+) từ số mol e trao đổi => tính Cu2+ còn dư và số mol H+ tạo thành
Khi cho 0,25 mol Fe vào xảy ra 2 phản ứng:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Fe + Cu2+ → Fe2+ + Cu
+) tính số mol các chất rắn thu được theo 2 PT trên
+ Bình 1: nNaOH = 0,0346 mol
Sau khi x mol H2O bị điện phân thì thể tích dung dịch còn lại là 20-18x (ml)
=> \({{C}_{M}}=\frac{0,0346}{\frac{20-18x}{1000}}=2\) => x = 0,15
=> ne = 2x = 0,3
Bình 2:
Tại catot:
Cu2+ + 2e → Cu
0,15.....0,3
Cu2+ dư 0,225 - 0,15 = 0,075 mol
Tại anot:
2Cl- - 2e → Cl2
0,2→0,2
2H2O – 4e → O2 + 4H+
0,1 → 0,1
Dung dịch trong bình 2 sau điện phân gồm: Cu2+ (0,075 mol); H+: (0,2 + 0,1 = 0,3 mol)
Khi cho 0,25 mol Fe vào:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Bđ: 0,25 0,3 0,45
Pư: 0,1125 ← 0,3 → 0,075
Sau: 0,1375
Fe + Cu2+ → Fe2+ + Cu
Bđ: 0,1375 0,075
Pư: 0,075 ← 0,075 → 0,075
Sau:0,0625 0,075
=> m chất rắn = 0,0625.56 + 0,075.64 = 8,3 gam
Điện phân dung dịch AgNO3 với điện cực trơ, sau một thời gian thu được dung dịch X chứa 2 chất tan có cùng nồng độ (mol/lít), và thấy khối lượng dung dịch giảm đi 9,28 gam so với ban đầu. Cho tiếp 2,8 gam bột Fe vào dung dịch X, thu được dung dịch Y và chất rắn Z và khí NO ( sản phẩm khử duy nhất của N5+). Biết các phản ứng xảy ra hoàn toàn. Tổng khối lượng muối trong dung dịch Y là:
-
A.
11,48.
-
B.
15,08.
-
C.
10,24.
-
D.
13,64
Đáp án : A
B1: Viết phương trình phản ứng điện phân: : 4AgNO3 + 2H2O → 4Ag ↓ + O2 ↑ + 4HNO3
+ mdd giảm = m↓ + m↑ => tính được nAgNO3 bị điện phân => tính được nAgNO3 dư = nHNO3
B2: Viết thứ tự xảy ra các PTHH khi cho Fe vào dd X
Fe + 4H+ + NO3- → Fe3+ + NO + 2H2O
Fe + 2Ag+ → Fe2+ + 2Ag↓
Ag+ + Fe2+ → Fe3+ + Ag↓
+ Bảo toàn nguyên tố Fe, N
PTHH: 4AgNO3 + 2H2O → 4Ag ↓ + O2 ↑ + 4HNO3
x → x → 0,25x → x
Gọi nAgNO3 bị điện phân là x (mol)
Ta có: mdd giảm = mAg + mO2
=> 108x + 0,25x. 32 = 9,28
=> x = 0,08 (mol)
Theo đề bài dd X là AgNO3 và HNO3 có nồng độ mol/l bằng nhau => nAgNO3 dư = nHNO3 = 0,08 (mol)
Fe + 4H+ + NO3- → Fe3+ + NO + 2H2O (1)
PƯ 0,02 ←0,08→0,02→ 0,02
Dư 0,03 0,14
Fe + 2Ag+ → Fe2+ + 2Ag↓ (2)
Pư 0,03 → 0,06 → 0,03
Dư 0,02
Ag+ + Fe2+ → Fe3+ + Ag↓ (3)
Pư 0,02 → 0,02→ 0,02
Sau phản ứng (1), (2) (3) => nFe2+ = nFe2+ (2) – nFe2+ (3) = 0,03- 0,02 = 0,01 (mol)
nFe3+ = nFe3+ (1) + nFe3+ (3) = 0,02 + 0,02 = 0,04 (mol)
Vậy dd Y gồm : Fe(NO3)2: 0,01 mol; Fe(NO3)3: 0,04 (mol)
=> m= 0,01. 180 + 0,04. 242 = 11,48 (g)
Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch chứa hỗn hợp CuSO4 và NaCl (tỉ lệ 1 : 1) bằng dòng điện một chiều có cường độ ổn định. Sau t (h), thu được dung dịch X và sau 2t (h) thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư, thu được a mol khí H2. Dung dịch Y tác dụng với bột Al dư thu được 4a mol khí H2. Phát biểu nào sau đây không đúng?
-
A.
Tại thời điểm 2t (h), tổng số mol khí thoát ra ở hai điện cực là 9a mol.
-
B.
Khi thời gian là 1,75t (h), tại catot đã có khí thoát ra.
-
C.
Tại thời điểm 1,5t (h), Cu2+ chưa điện phân hết.
-
D.
Nước bắt đầu điện phân tại anot ở thời điểm 0,75t (h)
Đáp án : D
+) Giả sử: nCuSO4 = nNaCl = 2 mol
CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4 (1)
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4 (2)
+) Sau t giờ thu được X có hòa tan Al nên (1) phản ứng hết, (2) đang xảy ra
+) ${{n}_{{{H}_{2}}S{{O}_{4}}}}={{n}_{{{H}_{2}}}}$
+) tính số mol e trao đổi trong t giờ theo a
+) Dung dịch Y tác dụng với Al thu được 4a mol khí H2 => ${{n}_{{{H}_{2}}S{{O}_{4}}}}={{n}_{{{H}_{2}}}}=4\text{a}$
+) Tính số mol CuSO4 phản ứng trong 2t (h) theo a
- Giả sử catot chưa sinh khí H2:
ne trong 2t giờ = 2.ne trong t giờ => a, so sánh số mol H2SO4 với số mol CuSO4 => loại TH này
Vậy sau 2t giờ, catot đã sinh H2 (u mol), CuSO4 đã hết từ trước đó
=> \({{n}_{CuS{{O}_{4}}}}\)điện phân (1) + (2) = \({{n}_{CuS{{O}_{4}}}}\)bđầu => \({{n}_{CuS{{O}_{4}}}}\) (2) => a
Bảo toàn electron tại catot trong 2t giờ
\(2.{{n}_{Cu}}+2.{{n}_{{{H}_{2}}}}\) = 2.ne trong t giờ => u
+) Xét các đáp án
Vì bài toán không cho số mol cụ thể của mỗi chất nên ta giả sử: nCuSO4 = nNaCl = 2 mol
CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4 (1)
Vì nCuSO4 = nNaCl = 2 mol => sau phản ứng (1) CuSO4 còn dư, NaCl hết
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4 (2)
Sau t giờ thu được X có hòa tan Al nên (1) phản ứng hết, (2) đang xảy ra; Al phản ứng với H2SO4 sinh ra khí H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
$\Rightarrow {{n}_{{{H}_{2}}S{{O}_{4}}}}={{n}_{{{H}_{2}}}}=a\,(mol)$
Từ (1) => \({{n}_{CuS{{O}_{4}}\,(1)}}=1\text{ }mol\)
Từ (2) => \({{n}_{CuS{{O}_{4}}\text{ }(2)}}=a\)
=> ne trong t giờ = 2 + 2a
Sau 2t giờ:
Dung dịch Y tác dụng với Al thu được 4a mol khí H2 => ${{n}_{{{H}_{2}}S{{O}_{4}}}}={{n}_{{{H}_{2}}}}=4\text{a}$
Từ (2) => \({{n}_{CuS{{O}_{4}}~\left( 2 \right)}}={{n}_{{{H}_{2}}S{{O}_{4}}}}=4a\)
=> \({{n}_{CuS{{O}_{4}}}}\) pư tổng = 1 + 4a
Nếu sau 2t giờ, catot chưa sinh khí H2 thì:
ne trong 2t giờ = 2.ne trong t giờ => 2.(1 + 4a) = 2.(2 + 2a) => a = 0,5
=> \({{n}_{{{H}_{2}}S{{O}_{4}}}}=2\) (vô lí vì \({{n}_{{{H}_{2}}S{{O}_{4}}}}<{{n}_{CuS{{O}_{4}}}}<2\))
Vậy sau 2t giờ, catot đã sinh H2 (u mol), CuSO4 đã hết từ trước đó
=> \({{n}_{CuS{{O}_{4}}}}\)điện phân (1) + (2) = \({{n}_{CuS{{O}_{4}}}}\)bđầu = 2 mol => \({{n}_{CuS{{O}_{4}}}}\) (2) = 2 – 1 = 1 mol
=> 4a = 1 => a = 0,25
Bảo toàn electron tại catot trong 2t giờ
\(2.{{n}_{Cu}}+2.{{n}_{{{H}_{2}}}}\) = 2.ne trong t giờ => 2.2 + 2.u = 2.(2 + 2a) => u = 0,5
Tại anot: \({{n}_{C{{l}_{2}}}}\) = 1 và \({{n}_{{{O}_{2}}}}\) = 0,75 (bảo toàn electron tính O2)
=> nkhí tổng = 2,25 = 9a => A đúng
Sau 1,75t giờ: \({{n}_{e}}=1,75.\left( 2+2a \right)=4,375>2.{{n}_{C{{u}^{2+}}}}=4\) nên catot đã có khí thoát ra => B đúng
Sau 1,5t giờ thì \({{n}_{e}}=1,5.\left( 2+2a \right)=3,75<2.{{n}_{C{{u}^{2+}}}}=4\) nên Cu2+ chưa hết => C đúng
Sau 0,75t giờ thì \({{n}_{e}}=0,75.\left( 2+2a \right)=1,875<{{n}_{C{{l}^{-}}}}=2\) nên Cl- chưa hết, H2O chưa bị điện phân => D sai
Dung dịch X chứa m gam chất tan gồm Cu(NO3)2 (có mCu(NO3)2 > 5 gam) và NaCl. Điện phân dung dịch X với điện cực trơ, màng ngăn xốp và cường độ dòng điện không đổi. Sau thời gian t giây thì thu được dung dịch Y chứa (m – 18,79) gam chất tan và có khí thoát ra ở catot. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Z chứa z gam chất tan và hỗn hợp khí T chứa 3 khí và có tỉ khối hơi so với H2 là 16. Cho Z vào dung dịch chứa 0,1 mol FeCl2 và 0,2 mol HCl thì thu được dung dịch chứa (z + 16,46) gam chất tan và có khí thoát ra. Tổng giá trị m + z là
-
A.
73,42.
-
B.
72,76.
-
C.
74,56.
-
D.
76,24.
Đáp án : B
Đặt a, b là số mol Cu(NO3)2 và NaCl trong X
Trong t giây tại catot thu được: nCu = a mol và nH2 = x mol
=> ne => nCl2
∆mgiảm = \({{m}_{{{H}_{2}}O}}-{{m}_{Cu}}-{{m}_{{{H}_{2}}}}-{{m}_{C{{l}_{2}}}}=-18,79\) => PT (1) ẩn a và x
Trong 2t giây thì ne = 2.ne t giây
+) Tính số mol Cu và H2 tại catot
+) Tính số mol Cl2 và O2 tại anot
+) Từ Mkhí = 32 => PT (2)
+) dung dịch Z chứa: Na+ (b mol), NO3- (2a mol) => OH- (b – 2a) mol
=> mchất tan tính theo a và b
Thêm vào Z gồm Fe2+ (0,1 mol), H+ (0,2 mol) và Cl- (0,4 mol)
Sau trung hòa thì: nH+ dư = 0,2 + 2a – b
+) Dựa vào \({{m}_{Cu{{\left( N{{O}_{3}} \right)}_{2}}}}>5\text{ }gam\)và \({{n}_{F{{e}^{2+}}}}=0,1\), biện luận NO3- chắc chắn dư
TH1: Nếu H+ hết
+) Tính số mol ion NO3- dư trong dd
+) mchất tan = ${{m}_{N{{a}^{+}}}}+{{m}_{NO_{3}^{-}}}+{{m}_{F{{\text{e}}^{3+}}}}+{{m}_{C{{l}^{-}}}}$ => Pt (3)
Giải hệ (1), (2), (3) ta có x; a; b
TH2: Nếu H+ dư
+) Tính số mol ion NO3- và H+ còn dư trong dd
mchất tan = ${{m}_{N{{a}^{+}}}}+{{m}_{NO_{3}^{-}}}+{{m}_{F{{\text{e}}^{3+}}}}+{{m}_{C{{l}^{-}}}}+{{m}_{{{H}^{+}}}}$ => Pt (4)
Giải hệ (1), (2) và (4) và kết luận
Đặt a, b là số mol Cu(NO3)2 và NaCl trong X
Trong t giây tại catot thu được: nCu = a mol và nH2 = x mol
=> ne = 2a + 2x => nCl2 = a + x
∆mgiảm = \({{m}_{{{H}_{2}}O}}-{{m}_{Cu}}-{{m}_{{{H}_{2}}}}-{{m}_{C{{l}_{2}}}}=-18,79\)
=> 18.2x – 64a – 2x – 71.(a + x) = -18,79
=> 37x + 135a = 18,79 (1)
Trong 2t giây thì ne = 4a + 4x
Vậy trong 2t giây:
Tại catot: nCu = a và nH2 = a + 2x
Tại anot: \({{n}_{C{{l}_{2}}}}=\frac{b}{2}\) và \({{n}_{{{O}_{2}}}}=a+x-\frac{b}{4}\)
Mkhí = 32, cũng là M của O2 nên H2 và Cl2 cũng có M = 32
=> \(2.\left( a+2x \right)\text{+}71.\frac{b}{2}=32.\left( a+2x+\frac{b}{2} \right)\)
=> 60x + 30a – 19,5b = 0 (2)
Lúc này dung dịch Z chứa: Na+ (b mol), NO3- (2a mol) => OH- (b – 2a) mol
=> mchất tan = z = 90a + 40b
Thêm vào Z gồm Fe2+ (0,1 mol), H+ (0,2 mol) và Cl- (0,4 mol)
Sau trung hòa thì: nH+ dư = 0,2 + 2a – b
Do \({{m}_{Cu{{\left( N{{O}_{3}} \right)}_{2}}}}>5\text{ }gam\text{ }n\hat{e}n\text{ }{{n}_{NO_{3}^{-}}}=2a>0,053\) trong khi \({{n}_{F{{e}^{2+}}}}=0,1\) nên NO3- chắc chắn dư
TH1: Nếu H+ hết
H+ + OH- → H2O
(b-2a) ← (b-2a)
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
(0,2-b+2a) →\(\frac{0,2+2ab}{4}\)
=> \({{n}_{NO_{3}^{-}(trong\,dd)}}=2a-\frac{0,2+2ab}{4}=1,5a+0,25b-0,05\)
=> mchất tan = ${{m}_{N{{a}^{+}}}}+{{m}_{NO_{3}^{-}}}+{{m}_{F{{\text{e}}^{3+}}}}+{{m}_{C{{l}^{-}}}}$
=> 23b + 62.(1,5a + 0,25b – 0,05) + 0,1.56 + 0,4.35,5 = 90a + 40b + 16,46 (3)
Giải hệ (1), (2), (3) ta có x = 0,07; a = 0,12; b = 0,4
Vậy m = 45,96 gam
Chất tan trong Z = 26,8
=> m + z = 72,76
TH2: Nếu H+ dư => \({{n}_{NO}}=\frac{0,1}{3}\)
H+ + OH- → H2O
(b-2a) ← (b-2a)
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,1 → $\frac{0,4}{3}$ → \(\frac{0,1}{3}\)
=> ${{n}_{NO_{3}^{-}(trong\,dd)}}=2\text{a}-\frac{0,1}{3}$
${{n}_{{{H}^{+}}du}}=0,2-\frac{0,4}{3}-(b-2\text{a})=\frac{0,2}{3}+2\text{a}-b$
mchất tan = ${{m}_{N{{a}^{+}}}}+{{m}_{NO_{3}^{-}}}+{{m}_{F{{\text{e}}^{3+}}}}+{{m}_{C{{l}^{-}}}}+{{m}_{{{H}^{+}}}}$
=> 23b + 62.(2a – 0,1/3) + 0,1.56 + 0,4.35,5 + 0,2/3 + 2a - b = 90a + 40b + 16,46 (4)
Giải hệ (1), (2) và (4) => nghiệm âm, loại TH này
Hòa tan hoàn toàn m gam hỗn hợp Cu(NO3)2 và KCl vào H2O thu được dung dịch X. Điện phân dung dịch X (với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giờ thu được 1,12 lít (đktc) khí ở anot. Nếu điện phân trong thời gian 3,5t giờ thì thu được 2,8 lít khí (đktc) khí ở anot và thu được dung dịch Y. Cho 20 gam bột Fe vào Y, sau khi các phản ứng xảy ra hoàn toàn thu được khí NO (sản phẩm khử duy nhất của N+5) và 16,4 gam hỗn hợp kim loại. Biết hiệu suất điện phân là 100%, các khí không tan trong dung dịch. Giá trị của m là
-
A.
48,775
-
B.
58,175
-
C.
31,675
-
D.
69,350
Đáp án : B
Vì nkhí(1) . 3,5 ≠ nkhi(2) nên trường hợp 1 chỉ có khí là Cl2 còn trường hợp 2 tạo ra cả O2
Tại A : 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
Tại K : Cu+2 +2e → Cu
→ số mol Cl2 và O2 theo số mol e
3Fe + 8H+ + 2NO3- → 3Fe2+ + 4H2O + 2NO
Nếu dung dịch Y không có Cu2+ thì mkm loại giảm = ?
Nếu lượng giảm khác 3,6 thì dung dịch Y có Cu2+ : Fe + Cu2+ → Fe2+ +Cu
Bảo toàn Cu
Khi điện phân 3,5t giờ thì nkhí = 0,125 mol
Vì nkhí(1) . 3,5 ≠ nkhi(2) nên trường hợp 1 chỉ có khí là Cl2 còn trường hợp 2 tạo ra cả O2
Tại A : 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
Tại K : Cu+2 +2e → Cu
Xét trong trường hợp điện phân 3,5t giờ thì nCl2 = a mol và nO2 = b mol→ a + b = 0,125 mol
Trong t giờ ne = 2nCl2 = 2.0,05 =0,1 mol → trong 3,5 t giờ thì ne = 0,35 mol e = 2a + 4b
Giải được a = 0,075 mol; b = 0,05 mol
Bảo toàn Cl có nKCl = 2nCl2 = 0,15 mol
3Fe + 8H+ + 2NO3- → 3Fe2+ + 4H2O + 2NO
0,075 ← 0,2 mol
mkm loại giảm = 20 – 16,4 = 3,6 g
Nếu dung dịch Y không có Cu2+ thì mkm loại giảm = 56.0,075 = 4,2 g ≠ 3,6g nên dung dịch chứa Cu2+ dư
Fe + Cu2+ → Fe2+ +Cu
x mol x mol
→ mkm loại giảm = 20 – 16,4 = 3,6 g = 56(0,075+x) – 64x → x = 0,075 mol
Vì Y có dư Cu2+ nên phản ứng điện phân tại K chỉ có Cu → nCu = ne : 2 = 0,35 : 2 =0,175 mol
Bảo toàn Cu có nCu(NO3)2 = nCu + nCu(Y) = 0,175 + 0,075 = 0,25 mol
→ m = mKCl + mCu(NO3)2 = 0,15.74,5 + 0,25.188 = 58,175 g
Điện phân V lit dung dịch X (điện cực trơ, màng ngăn xốp , cường độ dòng điện không đổi) chứa đồng thời R(NO3)2 0,45M (R là kim loại có hóa trị không đổi) và NaCl 0,4M trong thời gian t(giây) thu được 5,376 lit hỗn hợp khí ở anot (dktc). Nếu thời gian điện phân là 2t (giây) thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 320 ml dung dịch chứa KOH 0,75M và NaOH 0,5M, không sinh ra kết tủa . Biết hiệu suất điện phân 100%. Các khí sinh ra không tan trong dung dịch. Giá trị của V là :
-
A.
0,60
-
B.
0,80
-
C.
0,40
-
D.
1,60
Đáp án : B
- Biện luận 2 trường hợp : +) R2+ chưa bị điện phân hoàn toàn
+) R2+ đã bị điện phân hết, H2O đã bị điện phân ở catot
(Bảo toàn electron : ne trao đổi)
Do Y có phản ứng với kiềm nên Y là không phải là K-Na-Ca-Ba => R2+ có thể bị điện phân
- Các quá trình có thể xảy ra ở các điện cực :
+) Anot : 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
+) Catot : R2+ + 2e → R
2H2O + 2e → 2OH- + H2
- nR(NO3)2 = 0,45V và nNaCl = 0,4V mol ; nkhí (Anot) = 5,376 : 22,4 = 0,24 mol
- Phản ứng điện phân tổng quát chung : R(NO3)2 + 2NaCl → R + Cl2 + 2NaNO3 (1)
=> nCl2 = ½ nNaCl = 0,2V => nO2 = 0,24 – 0,2V
- Trong t giây : ne tđ = 2nCl2 + 4nO2 = 0,96 – 0,4V
=> Trong t giây tiếp theo anot sinh ra nO2 = 0,25ne = 0,24 – 0,1V
=> nO2 tổng = (0,24 – 0,2V) + (0,24 – 0,1V) = 0,48 – 0,3V
- Có : nOH = nKOH + nNaOH = 0,32.0,75 + 0,32.0,5 = 0,4 mol
=> Ta xét 2 trường hợp
+) TH1 : Trong 2t giây R2+ vẫn chưa bị điện phân hết => chưa điện phân nước ở catot
=> 2nR2+ < ne tđ
=> 0,45V.2 < (0,96 – 0,4V).2
=> V < 1,129
- nR2+ dư = 0,96 – 0,4V – 0,45V = 0,96 – 0,85V
Lúc này nH+ = 4nO2 tổng = 4.(0,48 – 0,3V)
Thêm kiềm vào không có kết tủa chứng tỏ R(OH)2 lưỡng tính đã tan trở lại
R2+ + 2OH- → R(OH)2
R(OH)2 + 2OH- → RO22- + 2H2O
=> nOH = nH+ + 4nR2+ dư => 0,4 = 4.(0,48 – 0,3V) + 4.(0,96 – 0,85V)
=> V = 1,165 (Loại)
+) TH2 : Trong 2t giây R2+ đã bị điện phân hết, H2O đã bị điện phân ở catot :
Sau (1) còn : nR2+ = 0,45V – 0,2V = 0,25V
=> Khi điện phân hết R2+ thì nH+ = 0,25V.2 = 0,5V
=> nH+ = nOH- = 0,4 = 0,5V => V = 0,8 lit
Điện phân dung dịch X chứa KCl và CuSO4 bằng dòng điện một chiều có cường độ 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị bên.

Phát biểu nào sau đây đúng?
-
A.
Tỉ lệ mol CuSO4 : KCl trong X là 2 : 5.
-
B.
Dung dịch sau điện phân có pH > 7.
-
C.
Tại thời điểm 2x (giây), tổng thể tích khí thoát ra ở hai cực là 2,8 lít (đktc).
-
D.
Tại thời điểm z (giây), khối lượng dung dịch giảm là 10,38 gam.
Đáp án : B
Ta thấy đoạn đồ thị thứ 2 dốc hơn đoạn 1 nên suy ra Cu2+ điện phân hết trước Cl- (đoạn 1 khí là Cl2; đoạn 2 khí là Cl2 và H2; đoạn 3 khí là H2 và O2)
Viết các phản ứng điện phân ở các điện cực từ đó xác định được số mol của các chất ban đầu.
Ta thấy đoạn đồ thị thứ 2 dốc hơn đoạn 1 nên suy ra Cu2+ điện phân hết trước Cl- (đoạn 1 khí là Cl2; đoạn 2 khí là Cl2 và H2; đoạn 3 khí là H2 và O2)
+ Tại x giây: n khí = 0,896 : 22,4 = 0,04 mol

=> nCuSO4 bđ = 0,04 mol
+ Tại y giây: n khí = 3,584 : 22,4 = 0,16 mol

=> n khí = nH2 + nCl2 => x + x + 0,04 = 0,16 => x = 0,06 mol
=> nCl- = 2x + 0,08 = 0,2 mol
=> nKCl bđ = 0,2 mol
Xét các phương án:
+ A sai vì nCuSO4 : nKCl = 0,04 : 0,2 = 1 : 5
+ B đúng vì Cu2+ điện phân hết trước Cl-:
CuSO4 + 2KCl → Cu + Cl2 + K2SO4
2KCl + 2H2O → 2KOH + Cl2 + H2
+ C sai vì:
Tại 2x giây, ne(2x giây) = 2.ne(x giây) = 0,16 mol
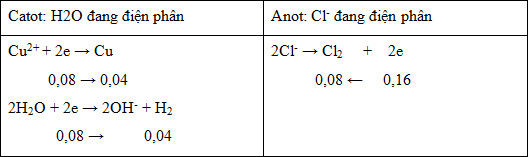
=> V khí = (0,04+0,08).22,4 = 2,688 lít
+ D sai vì:
Tại z giây:
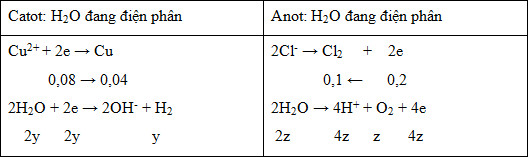
BTe: 0,08 + 2y = 0,2 + 4z
n khí = y + 0,1 + z = 4,928/22,4
Giải hệ thu được y = 0,1 và z = 0,02
=> m dd giảm = mCu + mH2 + mCl2 + mO2 = 0,04.64 + 0,1.2 + 0,1.71 + 0,02.32 = 10,5 gam
Cho hỗn hợp X gồm CuCl2 và FeCl3. Điện phân dung dịch chứa m gam hỗn hợp X với điện cực trơ, cường độ dòng điện 2,68A, trong thời gian là 4 giờ. Sau khi kết thúc điện phân thu được dung dịch Y có khối lượng giảm 20,6 gam so với trước khi điện phân. Toàn bộ dung dịch Y tác dụng với lượng dư dung dịch AgNO3 thu được 136,4 gam kết tủa. Mặt khác cho 14,88 gam bột Mg vào dung dịch chứa m gam hỗn hợp X ban đầu. Kết thúc phản ứng thu được m' gam kim loại. Giá trị của m' là
-
A.
26,88 gam.
-
B.
35,68 gam.
-
C.
19,2 gam.
-
D.
24,48 gam.
Đáp án : B
ne = 0,4 mol => nCl- pư = 0,4 mol => nCl2 = 0,2 mol
=> mCu = 20,6 - 0,2.71 = 6,4 gam => nCu = 0,1 mol
=> mFe3+ = 0,4 - 0,1.2 = 0,2 mol => nAg = 0,2 mol
=> nAgCl = (136,4 - 0,2.108)/143,5 = 0,8 mol
BTNT "Cl" => X chứa CuCl2 (0,8 mol) < 2nMg => Mg dư
=> a = 14,88 + 0,3.64 + 0,2.56 - 0,4.24 = 35,68 gam
n e = It/F = 2,68.4.3600/96500 = 0,4 mol
Thứ tự điện phân:
(1) FeCl3 → FeCl2 + 0,5 Cl2
(2) CuCl2 → Cu + Cl2
(3) FeCl2 → Fe + Cl2
Do dung dịch Y tác dụng với AgNO3 thu được kết tủa nên suy ra dung dịch Y chứa Fe2+ và Cl-.
Đặt số mol ban đầu của CuCl2 và FeCl3 lần lượt là x và y (mol)
TH1: Chỉ xảy ra (1)

m dd giảm = mCl2 = 0,2.71 = 14,2 gam ≠ 20,6 gam (loại)
TH2: Xảy ra (1) và (2)
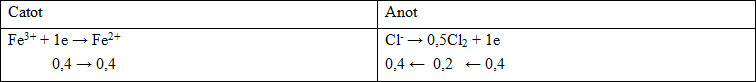
m dd giảm = mCu + mCl2 => 64(0,2-0,5y) + 0,2.71 = 136,4 => y = 3,41875 > 0,4 (loại)
TH3: Xảy ra (1) (2) (3)

+ m dd giảm = mCu + mFe + mCl2 => 64x + 56(0,2-0,5y-x) + 0,2.71 = 20,6 (1)
+ nCl- dư = 2x + 3y - 0,4 (mol); nFe2+ dư = y - (0,2-0,5y-x) = x + 1,5y - 0,2 (mol)
=> mAgCl = nCl- = 2x + 3y - 0,4 (mol); nAg = nFe2+ = x + 1,5y - 0,2 (mol)
=> m kết tủa = 143,5(2x + 3y - 0,4) + 108(x + 1,5y - 0,2) = 136,4 (2)
Giải (1) và (2) được x = 1992/9875 và y = 2262/9875 (loại vì khi đó nFe < 0)
Vậy không có trường hợp nào thỏa mãn.
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện ly nóng chảy hoặc dung dịch chất điện ly nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
* Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:

Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Mg(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Bán phản ứng nào xảy ra ở anot?
-
A.
Pb \( \to\) Pb2+ + 2e
-
B.
Mg \( \to\) Mg2+ + 2e
-
C.
2H2O \( \to\) O2 + 4H+ + 4e
-
D.
\(4NO_3^ - \to 2{N_2}{O_5} + {O_2} + 4{\text{e}}\)
Đáp án: C
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Bán phản ứng xảy ra ở anot là 2H2O \( \to\) O2 + 4H+ + 4e
Bán phản ứng nào xảy ra ở catot?
-
A.
Pb2+ + 2e \( \to\) Pb
-
B.
Mg2+ + 2e \( \to\) Mg
-
C.
O2 + 4H+ + 4e \( \to\) 2H2O
-
D.
H2O + 2e \( \to\) H2 + 2OH-
Đáp án: A
Catot của thiết bị là nơi xảy ra bán phản ứng khử
Bán phản ứng xảy ra ở catot là Pb2+ + 2e \( \to\) Pb
Giá trị pH của dung dịch thay đổi như thế nào?
-
A.
pH tăng do OH- sinh ra ở catot
-
B.
pH giảm do H+ sinh ra ở anot
-
C.
pH không đổi do không có H+ và OH- sinh ra
-
D.
pH không đổi do lượng H+ sinh ra ở anot bằng với lượng OH- sinh ra ở catot
Đáp án: B
Viết các quá trình điện phân ở hai cực của thiết bị
Đánh giá giá trị pH của dung dịch
+ Tại catot:
Pb \( \to\) Pb2+ + 2e
Mg \( \to\) Mg2+ + 2e
+ Tại anot:
2H2O \( \to\) O2 + 4H+ + 4e
Do H+ sinh ra ở anot nên pH của dung dịch giảm dần
Nếu người sinh viên đổi 2 điện cực than chì bằng 2 điện cực kim loại Pb, phản ứng nào xảy ra ở catot và anot?
-
A.
Catot: Pb2+ + 2e \( \to\) Pb; Anot: 2H2O \( \to\) O2 + 4H+ + 4e
-
B.
Catot: Mg2+ + 2e \( \to\) Mg; Anot: Pb \( \to\) Pb2+ + e
-
C.
Catot: 2H2O + 2e \( \to\) H2 + 2OH-; Anot: Pb \( \to\) Pb2+ + e
-
D.
Catot: Pb2+ + 2e \( \to\) Pb; Anot: Pb \( \to\) Pb2+ + e
Đáp án: D
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Catot của thiết bị là nơi xảy ra bán phản ứng khử
Tại catot xảy ra bán phản ứng: Pb2+ + 2e \( \to\) Pb
Tại anot xảy ra bán phản ứng: Pb \( \to\) Pb2+ + e
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện ly nóng chảy hoặc dung dịch chất điện ly nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
* Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:

Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Mg(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.

Sau một thời gian, sinh viên quan sát thấy có 3,24 gam kim loại bạc bám lên điệc cực của bình 2. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Zn và Al lần lượt là 108; 65 và 27 đvC.
Từ thí nghiệm 2, hãy tính:
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
-
A.
Pb → Pb2++ 2e.
-
B.
Mg → Mg2+ + 2e.
-
C.
2H2O → O2+ 4H+ + 4e.
-
D.
4NO3- → 2N2O5 + O2 + 4e.
Đáp án: C
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Bán phản ứng xảy ra ở anot là: 2H2O → O2 + 4H+ + 4e.
Số gam kim loại Zn bám lên điện cực trong bình 1 là:
-
A.
0 gam
-
B.
3,9 gam
-
C.
0,975 gam
-
D.
1,95 gam
Đáp án: A
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu bằng cách điện phân dung dịch muối của chúng.
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
\( \to\) Zn2+ và Al3+ không bị điện phân.
Số gam kim loại Al bám lên điện cực trong bình 3 là:
-
A.
0 gam
-
B.
1,62 gam
-
C.
0,405 gam
-
D.
0,81 gam
Đáp án: A
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu bằng cách điện phân dung dịch muối của chúng.
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
\( \to\) Zn2+ và Al3+ không bị điện phân.
Điện phân 400 ml (không đổi) dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng 1,93A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn dưới đây.

Giá trị của t trên đồ thị là
-
A.
3600
-
B.
3000
-
C.
1800
-
D.
1200
Đáp án : B
- Biện luận thành phần dung dịch và khí thoát ra trong mỗi giai đoạn
- Áp dụng định luật bảo toàn e => e trao đổi => t
Ta có: nCuCl2 = 0,4.0,02 = 0,008 (mol)
Ban đầu: pH = 2 → [H+] = 10-2 (M) = 0,01 M → nHCl = 0,01.0,4 = 0,004 mol
*Đoạn 1: pH không thay đổi trong khoảng thời gian catot khử Cu2+ và anot oxi hóa ion Cl-.
Catot: Cu2+ + 2e → Cu
=> ne đoạn 1 = 2.nCu2+ = 2.0,008 = 0,016 (mol)
*Đoạn 2: pH tăng nhanh chóng do H+ bị khử cho tới khi hết tại catot:
Catot: 2H+ + 2e → H2
=> ne đoạn 2 = nH+ = 0,004 mol
*Đoạn 3: pH tiếp tục tăng, dung dịch chuyển sang môi trường kiềm do H2O bị khử tại catot tạo OH-.
Ta có: pH = 13 → [H+] = 10-13M → [OH-] = 0,1 M → nOH- = 0,4.0,1 = 0,04 mol
Catot: 2H2O + 2e → 2OH- + H2
Ta có: ne đoạn3 = nOH- = 0,04 mol
Vậy số mol electron trao đổi trong cả 3 giai đoạn bằng
ne trao đổi = ne đoạn1 + ne đoạn2 + ne đoạn3 = 0,016 + 0,004 + 0,04 = 0,06 (mol)
Mặt khác ta có: ne trao đổi = It/F → t = 0,06.96500/1,93 = 3000 (s)
Tiến hành điện phân 100 gam dung dịch chứa 0,2 mol FeCl3; 0,1 mol CuCl2 và 0,16 mol HCl (với 2 điện cực trơ) đến khi có khi bắt đầu thoát ra ở cả hai điện cực thì dừng điện phân. Đem phần dung dịch cho tác dụng hết với 150 gam dung dịch chứa AgNO3, kết thúc phản ứng thu được 90,08 gam kết tủa và dung dịch Y chứa một muối duy nhất có nồng độ a%. Giá trị của a gần nhất với giá trị nào sau đây?
-
A.
34,5.
-
B.
33,5.
-
C.
30,5.
-
D.
35,5.
Đáp án : B
- Xét thành phần các chất sau mỗi quá trình điện phân, tác dụng với AgNO3 và cuối cùng là toàn bộ quá trình phản ứng
- Áp dụng định luật bảo toàn khối lượng, bảo toàn e để giải bài toán.
- Xét phản ứng điện phân:
Bên Catot, thứ tự điện phân là: Fe3+; Cu2+, H+, Fe2+, H2O
Bên Anot, thứ tự điện phân là: Cl-, H2O
Nhưng vì chỉ điện phân đến khi 2 bên đều bắt đầu thoát khí nên
+ ở catot, chỉ có Fe3+: Cu2+ bị điện phân
Fe3+ +1e → Fe2+ Cu2+ +2e → Cu
+ ở anot, chỉ có Cl- bị điện phân
2Cl- → Cl2 + 2e
Suy ra, dd A còn lại sau khi điện phân là: FeCl2 và HCl
nFeCl2 = nFeCl3 = 0,2 (mol) ; nHCl = 0,16 (mol)
mddA = 100 – mCuCl2 = 100 – 0,1.135 = 86,5 (g)
- Xét phản ứng của dd A với dd AgNO3
+ Phản ứng tạo kết tủa chắc chắn có Ag và AgCl
nAgCl↓ = nHCl + 2nFeCl2 = 0,16 + 2.0,2 = 0,56 (mol)
\( \to {n_{Ag}} = \frac{{90,08 - 0,56.143,5}}{{108}} = 0,09\,(mol)\)
BTNT “Ag”: nAgNO3 = nAgCl↓ + nAg↓ = 0,56 + 0,09 = 0,65 (mol)
+ Phản ứng tạo 1 muối duy nhất nên muối đó chỉ có thể là Fe(NO3)3
nFe(NO3)3 = nFeCl2 = 0,2 (mol)
+ Phản ứng chắc chắn tạo hỗn hợp khí dạng NxOy, tạm gọi là khí X
Ta có: \({n_{{H_2}O}} = \frac{1}{2}{n_{HCl}} = 0,08\,(mol)\)
+ Bảo toàn khối lượng ta có: mFeCl2, HCl + mAgNO3 = m↓ + mFe(NO3)3 + mX + mH2O
→ 0,2.127 + 0,16.36,5 + 0,65.170 = 90,08 + 0,2.242 + mX + 0,08.18
→ mX = 1,82 (g)
+ Xét toàn bộ quá trình phản ứng:
Dd sau cùng là Fe(NO3)3
mdd Fe(NO3)3 = mddA + mdd AgNO3 - m↓ - mX↑
= 86,5 + 150 – 90,08 – 1,82
= 144,6 (g)
\(a\% = \frac{{{m_{Fe{{(N{O_3})}_3}}}}}{{{m_{d{d_{Fe{{(N{O_3})}_3}}}}}\,}}.100\% = \frac{{0,2.242}}{{144,6}}.100\% = 33,47\% \) gần nhất với 33,5%
Hòa tan hoàn toàn m gam hỗn hợp CuSO4 và NaCl vào nước thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được trên cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (đồ thị gấp khúc tại các điểm M, N). Giả sử hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của m là

-
A.
14,48.
-
B.
15,76.
-
C.
13,42.
-
D.
11,08.
Đáp án : B
Chia đồ thị ra 3 giai đoạn
Đoạn 1: chỉ có Cl2 thoát ra ở anot
Đoạn 2: Có Cl2 và H2 bên catot thoát ra
Đoạn 3: Có H2 và O2 bên anot thoát ra
Lập phương trình với số mol khí thoát ra và số mol e trao đổi sẽ tìm ra được số mol mỗi khí Cl2, H2, O2
Từ đó suy ngược lại tìm được m =?
Đoạn 1: nCl2 = 0,04 mol
→Trong a giây mỗi điện cực đã trao đổi 0,04.2 = 0,08 mol electron.
Đoạn 2: Có độ dốc lớn hơn đoạn 1 nên tốc độ thoát khí nhanh hơn → thoát Cl2 và H2
Bảo toàn electron → nCl2 = nH2 = u
Đoạn 3: Thoát H2 và O2. Đặt nO2 = v → nH2 = 2v
Ta có hệ:
\(\left\{ \matrix{
\sum {{n_{khi}} = {n_{C{l_2}}} + {n_{{H_2}}} + {n_{{O_2}}}} \hfill \cr
\sum {n{\,_{e\,\,anot}} = 2{n_{C{l_2}}} + 4{n_{{O_2}}} = } \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{
0,04 + 2u + 3v = 0,21 \hfill \cr
2(u + 0,04) + 4v = 3,5.0,08 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
u = 0,04 \hfill \cr
v = 0,03 \hfill \cr} \right.\)
nCuSO4 = nCu = nCl2 đoạn 1 = 0,04 (mol)
nNaCl = 2nCl2 tổng = 2(0,04 + 0,04) = 0,16(mol)
→ m = 0,04.160 + 0,16.58,5 = 15,76 (g)
Tiến hành điện phân dung dịch chứa a mol KCl và b mol CuSO4 với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 7,5A, trong thời gian t = 4632s, thu được dung dịch X, đồng thời anot thoát ra 0,12 mol hỗn hợp khí. Nếu thời gian điện phân là 1,5t (s) thì tổng số mol khí thoát ra ở 2 điện cực là 0,215 mol. Giả sử trong quá trình điện phân nước bay hơi không đáng kể, hiệu suất điện phân đạt 100%, các khí sinh ra không tan trong nước, bỏ qua sự thủy phân của muối. Cho các phát biểu liên quan đến bài toán:
(a) Tổng khối lượng 2 muối trước điện phân là 35,48g
(b) Nếu thời gian điện phân là 1,25t (s) thì nước đã điện phân ở 2 điện cực
(c) Giá trị của a, b lần lượt là 0,12 và 0,25
(d) Dung dịch X chỉ có 2 chất tan
(e) Đến thời điểm 1,5t (s), số mol H+ sinh ra ở anot là 0,32 mol
Số phát biểu sai là:
-
A.
4
-
B.
1
-
C.
2
-
D.
3
Đáp án : A
Áp dụng công thức tính số mol trong bài toán điện phân: ne = It/nF
Dựa vào số mol e trao đổi và số mol khí => chất nào bị điện phân
=> số mol các chất ban đầu.
Khi t = 4632s => ne = It/F = 0,36 mol
Các phản ứng có thể xảy ra ở 2 điện cực:
Tại Catot: Cu2+ + 2e → Cu
2H2O + 2e → 2OH- + H2
Tại anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
=> ne = 2nCl2 + 4nO2 = 2.0,5a + 4x
Và: nkhí = nCl2 + nO2 = 0,5a + x = 0,12
=> a = 0,12 mol ; x= 0,06 mol
- Khi t = 6948s => ne = 0,54 mol
Tại anot thoát thêm Oxi: nO2 thêm = (0,54 – 0,36): 4 = 0,045 mol
=> nkhí ở anot = 0,12 + 0,045 = 0,165 mol => H2O bị điện phân ở Catot => nH2 = 0,215 – 0,165 = 0,05 mol
Bảo toàn e cho catot: 2nCu + 2nH2 = ne => 2b + 0,05.2 = 0,54
=> b = 0,22 mol
Các phát biểu:
(a) Tổng khối lượng 2 muối trước điện phân là 35,48g
=> Sai. mmuối = 0,12.74,5 + 0,22.160 = 44,14g
(b) Nếu thời gian điện phân là 1,25t (s) thì nước đã điện phân ở 2 điện cực
=> Đúng. Nếu thời gian là 1,25t => ne = 1,25.0,36 = 0,45 mol > 2nCu = 0,44 mol => nước bị điện phân ở cả catot
(c) Giá trị của a,b lần lượt là 0,12 và 0,25
=> Sai. b = 0,22 mol
(d) Dung dịch X chỉ có 2 chất tan
=> Sai. X gồm 3 chất tan: K2SO4, H2SO4, CuSO4.
(e) Đến thời điểm 1,5t (s), số mol H+ sinh ra ở anot là 0,32 mol
=> Sai. nH+ = 4nO2 = 4.(0,06 + 0,045) = 0,42 mol
Vậy có 4 phát biểu sai
Luyện tập và củng cố kiến thức Tổng hợp bài tập kim loại tác dụng với dung dịch muối hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 5 Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nhiệt luyện Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện phân hỗn hợp muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập sự điện phân 1 muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Sự điện phân Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Kim loại tác dụng với dung dịch muối (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Kim loại tác dụng với dung dịch muối (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Điều chế kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 20. Ăn mòn kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Dãy điện hóa kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit không có tính oxi hóa Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Lý thuyết chung về kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận