Trắc nghiệm Bài 22. Kim loại tác dụng với dung dịch muối (phần 1) - Hóa 12
Đề bài
Khi cho mẫu Zn vào bình đựng dung dịch X, thì thấy khối lượng chất rắn trong bình tăng lên. Dung dịch X là:
-
A.
Cu(NO3)2.
-
B.
AgNO3.
-
C.
Ba(NO3)2.
-
D.
Fe(NO3)3.
Ngâm một thanh kẽm trong 100 ml dung dịch AgNO3 0,2M. Giả sử kim loại sinh ra bám hết vào thanh kẽm. Sau khi phản ứng hoàn toàn khối lượng thanh kẽm tăng bao nhiêu gam ?
-
A.
2,16 gam.
-
B.
1,51 gam.
-
C.
0,65 gam.
-
D.
0,86 gam
Nhúng thanh Fe vào dung dịch CuSO4. Sau một thời gian, khối lượng thanh sắt tăng 0,8 gam so với khối lượng ban đầu. Khối lượng Fe đã phản ứng là:
-
A.
6,4 gam
-
B.
8,4 gam.
-
C.
11,2 gam.
-
D.
5,6 gam.
Ngâm một thanh kẽm trong 200 ml dung dịch FeSO4 xM. Sau khi phản ứng kết thúc lấy thanh kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng thanh kẽm giảm 1,8 gam. Giá trị của x là
-
A.
1,000.
-
B.
0,001.
-
C.
0,040.
-
D.
0,200.
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
-
A.
3,84.
-
B.
2,32.
-
C.
1,68.
-
D.
0,64.
Nhúng thanh kim loại M vào 100 ml dung dịch CuCl2 0,2M. Sau khi phản ứng hoàn toàn khối lượng thanh kim loại tăng 0,92 gam. Kim loại M là
-
A.
Al.
-
B.
Mg.
-
C.
Zn.
-
D.
Cr.
Cho m gam bột Zn vào 100 ml dung dịch Fe2(SO4)3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 2,13 gam so với khối lượng dung dịch ban đầu. Giá trị của m là:
-
A.
3,25.
-
B.
8,45.
-
C.
4,53.
-
D.
6,5.
Cho 4,8 gam Mg vào dung dịch chứa 0,2 mol FeCl3, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X, cô cạn dung dịch X được m gam muối khan. Giá trị của m là
-
A.
25,4.
-
B.
34,9.
-
C.
44,4.
-
D.
31,7.
Cho 8,40 gam sắt vào 300 ml dung dịch AgNO3 1,3 M. Lắc kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
-
A.
16,20.
-
B.
42,12.
-
C.
32,40
-
D.
48,60
Cho m gam Zn vào dung dịch chứa 0,15 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,92 gam chất rắn. Giá trị của m là:
-
A.
9,425.
-
B.
4,875.
-
C.
4,550.
-
D.
14,625.
Ngâm bột sắt vào dung dịch gồm Cu(NO3)2 và AgNO3. Kết thúc phản ứng thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Kết luận nào sau đây đúng ?
-
A.
X gồm Fe(NO3)2, Cu(NO3)2.
-
B.
X gồm Fe(NO3)2, Fe(NO3)3.
-
C.
Y gồm Fe, Cu
-
D.
Y gồm Fe, Ag.
Cho x mol Mg vào dung dịch chứa y mol Cu(NO3)2 và z mol AgNO3, sau khi kết thúc phản ứng thu được dung dịch 2 muối. Mối quan hệ giữa x, y, z là
-
A.
z < x < 0,5z + y.
-
B.
z < x < y + z.
-
C.
0,5z < x < 0,5z + y.
-
D.
x < 0,5z + y.
Cho 0,81 gam Al tác dụng với 500 ml dung dịch X chứa Fe(NO3)2 0,1M và Cu(NO3)2 0,09M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
-
A.
2,88.
-
B.
2,68.
-
C.
2,52.
-
D.
5,68.
Cho 1,44 gam Mg tác dụng với 500 ml dung dịch X chứa Zn(NO3)2 0,1M và Cu(NO3)2 0,02M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
-
A.
3,89.
-
B.
3,84.
-
C.
5,64
-
D.
5,68.
Cho 0,675 gam Al tác dụng với 150 ml dung dịch X chứa Fe(NO3)3 0,5M và Cu(NO3)2 0,5M. Kết luận nào sau đây sai:
-
A.
Sau phản ứng không thu được kim loại.
-
B.
Dung dịch sau phản ứng chứa 3 muối.
-
C.
Al đã phản ứng hết.
-
D.
Chất rắn sau phản ứng là Cu.
Cho 2,025 gam Al tác dụng với 150 ml dung dịch X chứa Fe(NO3)3 0,5M và Cu(NO3)2 0,2M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
-
A.
4,44.
-
B.
1,92.
-
C.
6,12.
-
D.
2,52.
Cho 0,56 gam bột sắt vào 100 ml dung dịch gồm AgNO3 0,3M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
-
A.
2,16.
-
B.
3,24.
-
C.
1,08.
-
D.
1,62.
Cho 4,48 gam bột sắt vào 200 ml dung dịch gồm AgNO3 0,3M và Cu(NO3)2 0,5M; khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
-
A.
6,48.
-
B.
3,2.
-
C.
9,68.
-
D.
12,24.
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 5,12 gam chất rắn. Giá trị của a là
-
A.
1,92
-
B.
1,29
-
C.
2,19
-
D.
4,55
Cho a gam Mg vào 100 ml dung dịch Al(NO3)3 2M và Cu(NO3)2 3M thu được 21,36 gam chất rắn. Giá trị của a là
-
A.
10,08.
-
B.
7,2.
-
C.
10,8.
-
D.
18,0
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 25,8 gam chất rắn. Giá trị của a là
-
A.
14,4.
-
B.
15,6.
-
C.
14,7.
-
D.
18,3.
Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 4 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
-
A.
5,4.
-
B.
8,3.
-
C.
10,8.
-
D.
2,7.
Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 8,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
-
A.
6,4.
-
B.
17,2.
-
C.
10,8.
-
D.
5,6.
Lời giải và đáp án
Khi cho mẫu Zn vào bình đựng dung dịch X, thì thấy khối lượng chất rắn trong bình tăng lên. Dung dịch X là:
-
A.
Cu(NO3)2.
-
B.
AgNO3.
-
C.
Ba(NO3)2.
-
D.
Fe(NO3)3.
Đáp án : B
Khối lượng chất rắn tăng lên => khối lượng kim loại tạo ra lớn hơn Zn
Khối lượng chất rắn tăng lên => khối lượng kim loại tạo ra lớn hơn Zn => loại A và D vì Mkim loại < MZn
Loại C vì Zn không đẩy được Ba2+
Ngâm một thanh kẽm trong 100 ml dung dịch AgNO3 0,2M. Giả sử kim loại sinh ra bám hết vào thanh kẽm. Sau khi phản ứng hoàn toàn khối lượng thanh kẽm tăng bao nhiêu gam ?
-
A.
2,16 gam.
-
B.
1,51 gam.
-
C.
0,65 gam.
-
D.
0,86 gam
Đáp án : B
Độ tăng khối lượng = ${{\text{m}}_{\text{B}\downarrow }}$- ${{\text{m}}_{\text{A tan}}}$
nAgNO3 = 0,1.0,2 = 0,02 mol
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
0,01 ← 0,02 → 0,02
=> Độ tăng khối lượng = ${{\text{m}}_{\text{B}\downarrow }}$- ${{\text{m}}_{\text{A tan}}}$= 0,02.108 – 0,01.65 = 1,51 gam
Nhúng thanh Fe vào dung dịch CuSO4. Sau một thời gian, khối lượng thanh sắt tăng 0,8 gam so với khối lượng ban đầu. Khối lượng Fe đã phản ứng là:
-
A.
6,4 gam
-
B.
8,4 gam.
-
C.
11,2 gam.
-
D.
5,6 gam.
Đáp án : D
tăng giảm khối lượng
Fe + Cu2+ → Cu + Fe2+
1 1 => m tăng = 8
a a => m tăng = 0,8
Fe + Cu2+ → Cu + Fe2+
1 1 => m tăng = 8
a a => m tăng = 0,8
=> a = 0,1 => mFe = 5,6 gam
Ngâm một thanh kẽm trong 200 ml dung dịch FeSO4 xM. Sau khi phản ứng kết thúc lấy thanh kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng thanh kẽm giảm 1,8 gam. Giá trị của x là
-
A.
1,000.
-
B.
0,001.
-
C.
0,040.
-
D.
0,200.
Đáp án : A
sử dụng tăng giảm khối lượng
Zn + Fe2+ → Zn2+ + Fe
1 1 1 => mgiảm = 9 gam
0,2x ← 0,2x → 0,2x => mgiảm = 1,8 gam
Zn + Fe2+ → Zn2+ + Fe
1 1 1 => mgiảm = 9 gam
0,2x ← 0,2x → 0,2x => mgiảm = 1,8 gam
=> 0,2x.9 = 1,8 => x = 1
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
-
A.
3,84.
-
B.
2,32.
-
C.
1,68.
-
D.
0,64.
Đáp án : B
sử dụng tăng giảm khối lượng
Fe + CuSO4 → FeSO4 + Cu
0,01 ← 0,01 → 0,01
=> độ tăng khối lượng = mCu – mFe = 0,01.(64 – 56) = 0,08 gam
=> mchất rắn Y = 2,24 + mtăng = 2,24 + 0,08 = 2,32 gam
nFe = 0,04 mol; nCuSO4 = 0,01 mol
Fe + CuSO4 → FeSO4 + Cu
0,01 ← 0,01 → 0,01
=> độ tăng khối lượng = mCu – mFe = 0,01.(64 – 56) = 0,08 gam
=> mchất rắn Y = 2,24 + mtăng = 2,24 + 0,08 = 2,32 gam
Nhúng thanh kim loại M vào 100 ml dung dịch CuCl2 0,2M. Sau khi phản ứng hoàn toàn khối lượng thanh kim loại tăng 0,92 gam. Kim loại M là
-
A.
Al.
-
B.
Mg.
-
C.
Zn.
-
D.
Cr.
Đáp án : A
2M + nCuCl2 → 2MCln + nCu
1 → n → 0,5n => khối lượng tăng: 0,5n.64 – M (gam)
$\frac{0,04}{n}$ ← 0,02 → 0,02 => khối lượng tăng: 0,92 gam
=> $\frac{0,04}{n}.(32n-M)=0,92$
nCuCl2 = 0,02 mol
2M + nCuCl2 → 2MCln + nCu
1 → n → 0,5n => khối lượng tăng: 0,5n.64 – M (gam)
$\frac{0,04}{n}$ ← 0,02 → 0,02 => khối lượng tăng: 0,92 gam
=> $\frac{0,04}{n}.(32n-M)=0,92$=> M = 9n => M là Al
Cho m gam bột Zn vào 100 ml dung dịch Fe2(SO4)3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 2,13 gam so với khối lượng dung dịch ban đầu. Giá trị của m là:
-
A.
3,25.
-
B.
8,45.
-
C.
4,53.
-
D.
6,5.
Đáp án : A
Zn + 2Fe3+ → Zn2+ + 2Fe2+ (1)
Zn + Fe2+ → Zn2+ + Fe (2)
Theo (1): ${{n}_{Zn}}=\frac{1}{2}{{n}_{F{{e}^{3+}}}}$ = 0,03 mol
Đặt nFe sinh ra = x mol => nZn (2) = x mol
+) mdung dịch tăng = mZn – mFe
+) mZn = mZn (1) + mZn (2)
${{n}_{F{{e}_{2}}{{\left( S{{O}_{4}} \right)}_{3}}}}=\text{ }0,03\text{ }mol\,\,\to \,\,{{n}_{F{{e}^{3+}}}}=0,06\,\,mol$
Zn + 2Fe3+ → Zn2+ + 2Fe2+ (1)
Zn + Fe2+ → Zn2+ + Fe (2)
Theo (1): ${{n}_{Zn}}=\frac{1}{2}{{n}_{F{{e}^{3+}}}}$ = 0,03 mol
Đặt nFe sinh ra = x mol => nZn (2) = x mol
mdung dịch tăng = mZn – mFe = 2,13
=> 0,03.65 + 65x – 56x = 2,13 => x = 0,02
=> mZn = mZn (1) + mZn (2) = 65.(0,03 + 0,02) = 3,25 gam
+ tính nhầm số mol Zn, lấy nZn = x = 0,1 => chọn nhầm D
+ chỉ viết 1 phản ứng Zn + Fe3+ → Zn2+ + Fe => tính toán sai
Cho 4,8 gam Mg vào dung dịch chứa 0,2 mol FeCl3, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X, cô cạn dung dịch X được m gam muối khan. Giá trị của m là
-
A.
25,4.
-
B.
34,9.
-
C.
44,4.
-
D.
31,7.
Đáp án : D
+) ne Fe3+ nhận tạo Fe2+ = 0,2 < ne Mg cho tối đa = 0,2.2 = 0,4 < ne Fe3+ nhận tạo Fe = 0,2.3 = 0,6
=> Mg phản ứng hết, FeCl3 phản ứng tạo thành Fe và FeCl2
=> nMgCl2 = nMg
Bảo toàn nguyên tố Cl: nFeCl2 = (3nFeCl3 - 2nMgCl2) / 2
+) mmuối = mMgCl2 + mFeCl2
nMg = 0,2 mol;
Ta thấy : ne Fe3+ nhận tạo Fe2+ = 0,2 < ne Mg cho tối đa = 0,2.2 = 0,4 < ne Fe3+ nhận tạo Fe = 0,2.3 = 0,6
=> Mg phản ứng hết, FeCl3 phản ứng tạo thành Fe và FeCl2
=> nMgCl2 = nMg = 0,2 mol
Bảo toàn nguyên tố Cl: nFeCl2 = (3nFeCl3 - 2nMgCl2) / 2 = 0,1 mol
=> mmuối = mMgCl2 + mFeCl2 = 31,7
Cách 2: Ta có nCl = 0,2.3 = 0,6 mol
Cl kết hợp với Mg trước để tạo thành muối MgCl2, sau đó nếu còn Cl sẽ kết hợp với Fe tạo FeCl2
=> nMgCl2 = nMg = 0,2 mol và tiêu tốn 1 lượng Cl = 0,2.2 = 0,4 mol
=> 0,2 mol Cl còn lại sẽ kết hợp với Fe tạo FeCl2 => nFeCl2 = 0,2 / 2 = 0,1 mol
+ chỉ viết 1 phản ứng Mg + Fe3+ → Mg2+ + Fe => tính toán sai
Cho 8,40 gam sắt vào 300 ml dung dịch AgNO3 1,3 M. Lắc kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
-
A.
16,20.
-
B.
42,12.
-
C.
32,40
-
D.
48,60
Đáp án : B
Ta thấy ne Fe cho tạo thành Fe2+ < ne Ag+ nhận < ne Fe cho tạo thành Fe3+
=> phản ứng tạo 2 muối Fe(NO3)2 và Fe(NO3)3
=> Ag+ phản ứng tạo hết thành Ag
=> nAg = nAgNO3
nFe = 0,15 mol; nAgNO3 = 0,39 mol
Ta thấy ne Fe cho tạo thành Fe2+ = 0,15.2 = 0,3 mol < ne Ag+ nhận = 0,39 < ne Fe cho tạo thành Fe3+ = 0,15.3 = 0,45
=> phản ứng tạo 2 muối Fe(NO3)2 và Fe(NO3)3
=> Ag+ phản ứng tạo hết thành Ag
=> nAg = nAgNO3 = 0,39 mol => m = 42,12 gam
+ chỉ tính theo pt : Fe + 2Ag+ → Fe2+ + 2Ag và tính nAg theo Fe => chọn nhầm C
+ tính nAg+ cho bằng số mol e cho của Fe tạo hết thành Fe3+ => chọn nhầm D
+ cho nAg = nFe = 0,15 => chọn nhầm A
Cho m gam Zn vào dung dịch chứa 0,15 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,92 gam chất rắn. Giá trị của m là:
-
A.
9,425.
-
B.
4,875.
-
C.
4,550.
-
D.
14,625.
Đáp án : A
+) mFe tối đa sinh ra = 0,15 . 56 = 8,4 gam > 3,92 gam => chất rắn chỉ có Fe, còn Zn đã phản ứng hết
+) FeCl3 phản ứng với Zn tạo thành Fe (0,07 mol) và FeCl2 (0,15 – 0,07 = 0,08 mol)
+) Bảo toàn e: 2nZn = 3nFe + nFeCl2
nFeCl3 = 0,15mol => mFe tối đa sinh ra = 0,15 . 56 = 8,4 gam > 3,92 gam
=> chất rắn chỉ có Fe, còn Zn đã phản ứng hết
nFe = 3,92 / 56 = 0,07 mol
FeCl3 phản ứng với Zn tạo thành Fe (0,07 mol) và FeCl2 (0,15 – 0,07 = 0,08 mol)
Bảo toàn e: 2nZn = 3nFe + nFeCl2 => nZn = 0,145 mol
=> m = 9,425 gam
+ tính số mol Zn theo số mol e Fe3+ nhận tối đa => chọn nhầm D
+ tính số mol Zn = số mol Fe sinh ra = 0,07 mol => chọn nhầm C
Ngâm bột sắt vào dung dịch gồm Cu(NO3)2 và AgNO3. Kết thúc phản ứng thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Kết luận nào sau đây đúng ?
-
A.
X gồm Fe(NO3)2, Cu(NO3)2.
-
B.
X gồm Fe(NO3)2, Fe(NO3)3.
-
C.
Y gồm Fe, Cu
-
D.
Y gồm Fe, Ag.
Đáp án : A
xem lại lí thuyết kim loại tác dụng với dung dịch muối và dãy điện hóa
Dãy điện hóa : Fe2+/Fe Cu2+/Cu Ag+/Ag
→ dung dịch X gồm 2 muối có tính oxi hóa yếu hơn là Fe2+ và Cu2+
Chất rắn Y gồm 2 kim loại có tính khử yếu hơn là Ag và Cu
Cho x mol Mg vào dung dịch chứa y mol Cu(NO3)2 và z mol AgNO3, sau khi kết thúc phản ứng thu được dung dịch 2 muối. Mối quan hệ giữa x, y, z là
-
A.
z < x < 0,5z + y.
-
B.
z < x < y + z.
-
C.
0,5z < x < 0,5z + y.
-
D.
x < 0,5z + y.
Đáp án : C
Mg + 2Ag+ → Mg2+ + 2Ag (1)
Mg + Cu2+ → Mg2+ + Cu (2)
=> dung dịch sau phản ứng thu được 2 muối là Mg2+ và Cu2+
TH1: Cu2+ chưa phản ứng => Ag+ ở phản ứng (1) thiếu hoặc vừa đủ
TH2: Cu2+ phản ứng 1 phần => Ag+ ở (1) đã phản ứng hết và Mg hết
Mg + 2Ag+ → Mg2+ + 2Ag (1)
Mg + Cu2+ → Mg2+ + Cu (2)
=> dung dịch sau phản ứng thu được 2 muối là Mg2+ và Cu2+
Xảy ra 2 trường hợp:
TH1: Cu2+ chưa phản ứng => Ag+ ở phản ứng (1) thiếu hoặc vừa đủ
=> ne cho = ne nhận = nAg+ = z mol
Mg có thể dư hoặc vừa đủ \({{n}_{Mg}}\ge \dfrac{{{n}_{e\text{ }cho}}}{2}=>\text{ }x\ge 0,5z\)
TH2: Cu2+ phản ứng 1 phần => Ag+ ở (1) đã phản ứng hết và Mg hết
=> ne cho = 2nMg = 2x
ne nhận = nAg+ + nCu2+ phản ứng < 2y + z
=> 2x < 2y + z => x < y + 0,5z
+ Chọn nhầm A vì quên trường hợp dấu “ = ” xảy ra vẫn thỏa mãn
Cho 0,81 gam Al tác dụng với 500 ml dung dịch X chứa Fe(NO3)2 0,1M và Cu(NO3)2 0,09M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
-
A.
2,88.
-
B.
2,68.
-
C.
2,52.
-
D.
5,68.
Đáp án : A
Nhận thấy : ne Al cho tối đa = 0,03.3 = 0,09 mol = nCu2+ nhận e
=> Al phản ứng vừa đủ với Cu(NO3)2; còn Fe(NO3)2 chưa phản ứng
+) nCu = nCu(NO3)2
nAl = 0,03 mol; nFe(NO3)2 = 0,05 mol; nCu(NO3)2 = 0,045 mol
Nhận thấy : ne Al cho tối đa = 0,03.3 = 0,09 mol = nCu2+ nhận e
=> Al phản ứng vừa đủ với Cu(NO3)2; còn Fe(NO3)2 chưa phản ứng
=> chất rắn thu được chỉ là Cu
nCu = nCu(NO3)2 = 0,045 mol => m = 2,88 gam
+ quên thứ tự của dãy điện hóa => cho Fe phản ứng trước => chọn nhầm C
+ tính cả chất rắn gồm Fe và Cu => chọn nhầm D
Cho 1,44 gam Mg tác dụng với 500 ml dung dịch X chứa Zn(NO3)2 0,1M và Cu(NO3)2 0,02M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
-
A.
3,89.
-
B.
3,84.
-
C.
5,64
-
D.
5,68.
Đáp án : A
ne Mg cho tối đa = 0,06.2 = 0,12 mol
ne Cu2+ nhận = 0,01.2 = 0,02 mol; ne Zn2+ nhận = 0,1 mol => ne nhận tối đa = 0,02 + 0,1 = 0,12 mol
Ta thấy ne cho tối đa = ne nhận tối đa = 0,12 mol => Mg phản ứng vừa đủ với Cu2+ và Zn2+
nMg = 0,06 mol; nZn(NO3)2 = 0,05 mol; nCu(NO3)2 = 0,01
ne Mg cho tối đa = 0,06.2 = 0,12 mol
ne Cu2+ nhận = 0,01.2 = 0,02 mol; ne Zn2+ nhận = 0,1 mol => ne nhận tối đa = 0,02 + 0,1 = 0,12 mol
Ta thấy ne cho tối đa = ne nhận tối đa = 0,12 mol => Mg phản ứng vừa đủ với Cu2+ và Zn2+
=> chất rắn thu được gồm Cu (0,01 mol) và Zn (0,05 mol)
=> m = 3,89 gam
+ tính số mol Cu = số mol Mg = 0,06 => chọn nhầm B
Cho 0,675 gam Al tác dụng với 150 ml dung dịch X chứa Fe(NO3)3 0,5M và Cu(NO3)2 0,5M. Kết luận nào sau đây sai:
-
A.
Sau phản ứng không thu được kim loại.
-
B.
Dung dịch sau phản ứng chứa 3 muối.
-
C.
Al đã phản ứng hết.
-
D.
Chất rắn sau phản ứng là Cu.
Đáp án : D
Phương pháp
+) Thứ tự dãy điện hóa: $\frac{A{{l}^{3+}}}{Al}\,\,\,\,\frac{F{{e}^{2+}}}{Fe}\,\,\,\,\frac{C{{u}^{2+}}}{Cu}\,\,\,\frac{F{{e}^{3+}}}{F{{e}^{2+}}}$
Ta thấy: ne Al cho tối đa = 0,025.3 = 0,075 = ne Fe3+ nhận tạo Fe2+
=> Al phản ứng vừa đủ với Fe3+ tạo thành Al3+ và Fe2+
nAl = 0,025 mol; nFe(NO3)3 = 0,075 mol; nCu(NO3)2 = 0,075 mol
Thứ tự dãy điện hóa: $\frac{A{{l}^{3+}}}{Al}\,\,\,\,\frac{F{{e}^{2+}}}{Fe}\,\,\,\,\frac{C{{u}^{2+}}}{Cu}\,\,\,\frac{F{{e}^{3+}}}{F{{e}^{2+}}}$
Ta thấy: ne Al cho tối đa = 0,025.3 = 0,075 = ne Fe3+ nhận tạo Fe2+
=> Al phản ứng vừa đủ với Fe3+ tạo thành Al3+ và Fe2+
=> Sau phản ứng không thu được chất rắn
Cho 2,025 gam Al tác dụng với 150 ml dung dịch X chứa Fe(NO3)3 0,5M và Cu(NO3)2 0,2M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
-
A.
4,44.
-
B.
1,92.
-
C.
6,12.
-
D.
2,52.
Đáp án : A
Xét: ne Al cho tối đa = 0,075.3 = 0,225 mol
ne Fe3+ nhận tạo Fe2+ = 0,075.1 = 0,075 mol
= 0,03.2 = 0,06 mol
ne Fe2+ nhận tạo Fe = 0,075.2 = 0,15 mol
=> Cu(NO3)2 phản ứng hết; Fe(NO3)3 phản ứng tạo thành Fe và Fe(NO3)2
=> ne nhận tạo Fe = ne Al cho tối đa - ne Fe3+ nhận tạo Fe2+ - ne Cu2+ nhận tạo Cu
nAl = 0,075 mol; nFe(NO3)3 = 0,075 mol; nCu(NO3)2 = 0,03 mol
Xét: ne Al cho tối đa = 0,075.3 = 0,225 mol
ne Fe3+ nhận tạo Fe2+ = 0,075.1 = 0,075 mol
ne Cu2+ nhận tạo Cu = 0,03.2 = 0,06 mol
ne Fe2+ nhận tạo Fe = 0,075.2 = 0,15 mol
Ta thấy :
ne Fe3+ nhận tạo Fe2+ + ne Cu2+ nhận tạo Cu < ne Al cho tối đa < ne Fe3+ nhận tạo Fe2+ + ne Cu2+ nhận tạo Cu + ne Fe2+ nhận tạo Fe
được biểu diễn theo sơ đồ sau:
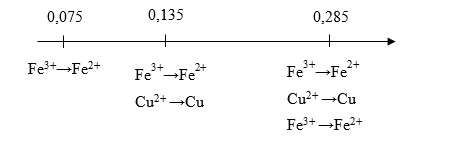
=> Cu(NO3)2 phản ứng hết; Fe(NO3)3 phản ứng tạo thành Fe và Fe(NO3)2
=> ne nhận tạo Fe = 0,225 – 0,075 – 0,06 = 0,09 mol => nFe = 0,09 / 2 = 0,045 mol
=> m = 0,03.64 + 0,045.56 = 4,44 gam
+ Chọn nhầm B vì tính mỗi khối lượng của Cu
+ chọn nhầm C vì tính cả khối lượng của Cu và Fe phản ứng tối đa
+ chọn nhầm D vì tính mỗi khối lượng của Fe
Cho 0,56 gam bột sắt vào 100 ml dung dịch gồm AgNO3 0,3M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
-
A.
2,16.
-
B.
3,24.
-
C.
1,08.
-
D.
1,62.
Đáp án : B
+) ne Fe cho tối đa = 0,01.3 = 0,03 mol = ne Ag+ nhận tối đa
=> Fe phản ứng hết với Ag, tạo thành Fe3+ và Ag
+) nAg = nAgNO3
nFe = 0,01 mol; nAgNO3 = 0,03 mol; nCu(NO3)2 = 0,05 mol
Ta thấy : ne Fe cho tối đa = 0,01.3 = 0,03 mol = ne Ag+ nhận tối đa
=> Fe phản ứng hết với Ag, tạo thành Fe3+ và Ag
=> nAg = nAgNO3 = 0,03 mol => m = 0,03.108 = 3,24 gam
+ chọn nhầm A vì quên phản ứng Ag+ + Fe2+ → Ag + Fe3+
Cho 4,48 gam bột sắt vào 200 ml dung dịch gồm AgNO3 0,3M và Cu(NO3)2 0,5M; khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
-
A.
6,48.
-
B.
3,2.
-
C.
9,68.
-
D.
12,24.
Đáp án : C
Nhận xét: 3nFe > nAg => không xảy ra phản ứng Ag+ + Fe2+ → Ag + Fe3+ => Fe tạo muối Fe2+
ne Fe cho tối đa = 0,08.2 = 0,16 mol
ne Ag+ nhận tối đa = 0,06 mol
ne Cu2+ nhận tối đa = 0,1.2 = 0,2 mol
Ta thấy : 0,06 < ne Fe cho tối đa < 0,06 + 0,2
=> Ag+ phản ứng hết, Cu2+ phản ứng 1 phần
+) ne Cu2+ nhận tạo Cu = 0,16 – 0,06 = 0,1 mol
+) m = mAg + mCu
nFe = 0,08 mol; nAgNO3 = 0,06 mol; nCu(NO3)2 = 0,1 mol
Nhận xét: 2nFe > nAg => không xảy ra phản ứng Ag+ + Fe2+ → Ag + Fe3+ => Fe tạo muối Fe2+
ne Fe cho tối đa = 0,08.2 = 0,16 mol
ne Ag+ nhận tối đa = 0,06 mol
ne Cu2+ nhận tối đa = 0,1.2 = 0,2 mol
Ta thấy : 0,06 < ne Fe cho tối đa < 0,06 + 0,2
=> Ag+ phản ứng hết, Cu2+ phản ứng 1 phần
=> ne Cu2+ nhận tạo Cu = 0,16 – 0,06 = 0,1 mol => nCu = 0,05 mol
=> m = mAg + mCu = 0,06.108 + 0,05.64 = 9,68 gam
+ không xét 2nFe > nAg => tính e Fe cho tối đa = 0,08.3 = 0,24 mol => chọn nhầm D
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 5,12 gam chất rắn. Giá trị của a là
-
A.
1,92
-
B.
1,29
-
C.
2,19
-
D.
4,55
Đáp án : A
+) Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam > 5,12 gam
=> Mg phản ứng hết với Cu2+ (Cu2+ còn dư và Mg chưa phản ứng với Al3+)
+) nMg = nCu
nAl2(SO4)3 = 0,1 mol; nCuSO4 = 0,3 mol → nAl3+ = 0,2 mol; nCu2+ = 0,3 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam > 5,12 gam
=> Mg phản ứng hết với Cu2+ (Cu2+ còn dư và chưa phản ứng với Al3+)
=> nMg = nCu = 5,12 / 64 = 0,08 mol => m = 1,92 gam
+ nhầm thứ tự phản ứng (Al3+ phản ứng trước) => chọn nhầm D
Cho a gam Mg vào 100 ml dung dịch Al(NO3)3 2M và Cu(NO3)2 3M thu được 21,36 gam chất rắn. Giá trị của a là
-
A.
10,08.
-
B.
7,2.
-
C.
10,8.
-
D.
18,0
Đáp án : A
+) Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam < 21,36 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,3.64 + 0,2.27 = 24,6 > 21,36
=> Cu2+ phản ứng hết, Al3+ phản ứng 1 phần; chất rắn sau phản ứng gồm Cu (0,3 mol) và Al
+) mAl sinh ra = 21,36 – 0,3.64 = 2,16 gam
+) Bảo toàn e: 2nMg = 2nCu + 3nAl
nAl(NO3)3 = 0,2 mol; nCu(NO3)2 = 0,3 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam < 21,36 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,3.64 + 0,2.27 = 24,6 > 21,36
=> Cu2+ phản ứng hết, Al3+ phản ứng 1 phần; chất rắn sau phản ứng gồm Cu (0,3 mol) và Al
mAl sinh ra = 21,36 – 0,3.64 = 2,16 gam => nAl = 0,08 mol
Bảo toàn e: 2nMg = 2nCu + 3nAl => nMg = (2.0,3 + 3.0,08) / 2 = 0,42 mol
=> m = 0,42.24 = 10,08 gam
+ tính số mol Mg theo Cu (0,3 mol) => chọn nhầm B
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 25,8 gam chất rắn. Giá trị của a là
-
A.
14,4.
-
B.
15,6.
-
C.
14,7.
-
D.
18,3.
Đáp án : B
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam < 25,8 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,3.64 + 0,2.27 = 24,6 < 25,8 gam
=> cả Cu2+ và Al3+ phản ứng hết, Mg dư => chất rắn sau phản ứng gồm Cu (0,3 mol), Al (0,2 mol) và Mg
+) mMg dư = mchất rắn – mAl - mCu
Bảo toàn e: 2nMg phản ứng = 3nAl + 2nCu
+) m = mMg dư + mMg phản ứng
nAl2(SO4)3 = 0,1 mol; nCuSO4 = 0,3 mol => nAl3+ = 0,2 mol; nCu2+ = 0,3 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam < 25,8 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,3.64 + 0,2.27 = 24,6 < 25,8 gam
=> cả Cu2+ và Al3+ phản ứng hết, Mg dư => chất rắn sau phản ứng gồm Cu (0,3 mol), Al (0,2 mol) và Mg
=> mMg dư = 25,8 – 24,6 = 1,2 gam
Bảo toàn e: 2nMg phản ứng = 3nAl + 2nCu => nMg phản ứng = (3.0,2 + 0,3.2) / 2 = 0,6 mol
=> m = 0,6.24 + 1,2 = 15,6
+ quên tính khối lượng Mg dư => chọn nhầm A
Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 4 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
-
A.
5,4.
-
B.
8,3.
-
C.
10,8.
-
D.
2,7.
Đáp án : A
+) Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1 => mtăng = 0,1.108 – 0,05.56 = 8 > 4
=> Ag+ chưa phản ứng hết; Cu2+ chưa phản ứng
+) mtăng = 108x – 0,5x.56 = 4
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1 => mtăng = 0,1.108 – 0,05.56 = 8 > 4
=> Ag+ chưa phản ứng hết; Cu2+ chưa phản ứng
Gọi nAg+ phản ứng = x mol
mtăng = 108x – 0,5x.56 = 4 => x = 0,05 mol
=> khối lượng kim loại bám là mAg = 108.0,05 = 5,4 gam
+ tính khối lượng Ag theo AgNO3 ban đầu => chọn nhầm C
+ nhầm lẫn khối lượng tăng và khối lượng kim loại bám vào
Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 8,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
-
A.
6,4.
-
B.
17,2.
-
C.
10,8.
-
D.
5,6.
Đáp án : B
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
=> mtăng = 0,1.108 – 0,05.56 = 8 < 8,8 => Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
=> mtăng = 64x – 56x = 8x
+) tổng khối lượng tăng ở 2 phản ứng là: mtăng = 8 + 8x = 8,8 => x = 0,1 mol
+) mkim loại bám vào = mAg + mCu
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1 => mtăng = 0,1.108 – 0,05.56 = 8 < 8,8
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
x → x → x => mtăng = 64x – 56x = 8x
=> tổng khối lượng tăng ở 2 phản ứng là: mtăng = 8 + 8x = 8,8 => x = 0,1 mol
=> mkim loại bám vào = mAg + mCu = 17,2 gam
+ không tính khối lượng Cu bám vào => chọn nhầm C
+ không tính khối lượng Ag bám vào => chọn nhầm A
Luyện tập và củng cố kiến thức Bài 22. Kim loại tác dụng với dung dịch muối (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Sự điện phân Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập sự điện phân 1 muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện phân hỗn hợp muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nhiệt luyện Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện phân hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập kim loại tác dụng với dung dịch muối hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 5 Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Điều chế kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 20. Ăn mòn kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Dãy điện hóa kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit không có tính oxi hóa Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Lý thuyết chung về kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận