Trắc nghiệm Bài 31. Sắt - Hóa 12
Đề bài
Nguyên tử của nguyên tố sắt có
-
A.
2 electron hóa trị.
-
B.
6 electron d.
-
C.
56 hạt mang điện.
-
D.
8 electron lớp ngoài cùng.
Cho Fe (Z = 26). Cấu hình electron đúng của ion Fe2+ là
-
A.
[18Ar]3d84s2.
-
B.
[18Ar]3d54s1
-
C.
[18Ar]3d6.
-
D.
[18Ar]3d44s2.
Tính chất vật lí nào sau đây của sắt khác với các đơn chất kim loại khác ?
-
A.
Tính dẻo, dễ rèn.
-
B.
Dẫn điện và dẫn nhiệt.
-
C.
Là kim loại nặng.
-
D.
Có tính nhiễm từ.
Phương trình hóa học nào sau đây viết không đúng ?
-
A.
Fe + S $\xrightarrow{{{t}^{o}}}$ FeS.
-
B.
4Fe + 3O2 (kk) $\xrightarrow{{{t}^{o}}}$ 2Fe2O3.
-
C.
2Fe + 3Cl2 $\xrightarrow{{{t}^{o}}}$ 2FeCl3
-
D.
Fe + 2FeCl3 → 3FeCl2.
Quặng sắt manhetit có thành phần chính là
-
A.
Fe2O3.
-
B.
FeCO3.
-
C.
Fe3O4.
-
D.
FeS2.
Dãy bao gồm các ion sắp xếp theo chiều giảm dần tính oxi hóa là
-
A.
Ag+, Cu2+, Fe3+, Fe2+.
-
B.
Fe3+, Cu2+, Ag+, Fe2+.
-
C.
Ag+, Fe3+, Cu2+, Fe2+.
-
D.
Fe3+, Ag+, Cu2+, Fe2+.
Có thể đựng axit nào sau đây trong bình sắt ?
-
A.
HCl loãng.
-
B.
H2SO4 loãng.
-
C.
HNO3 đặc nguội.
-
D.
HNO3 đặc nóng.
Đốt một lượng dư sắt trong khí clo thu được hỗn hợp gồm 2 chất rắn. Thành phần chất rắn đó gồm
-
A.
FeCl2 và FeCl3.
-
B.
FeCl3 và Fe.
-
C.
FeCl2 và Fe.
-
D.
đáp án khác.
Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch
-
A.
FeCl3.
-
B.
CuSO4.
-
C.
AgNO3.
-
D.
MgCl2.
Kim loại sắt tác dụng với dung dịch nào sau đây tạo muối sắt (II)
-
A.
HNO3 đặc, nóng, dư.
-
B.
CuSO4.
-
C.
H2SO4 đặc, nóng, dư
-
D.
MgSO4.
Để bảo quản dung dịch FeSO4 trong phòng thí nghiệm, người ta cần thêm vào bình chất nào dưới đây
-
A.
Một đinh Fe sạch.
-
B.
Dung dịch H2SO4 loãng.
-
C.
Một dây Cu sạch.
-
D.
Dung dịch H2SO4 đặc.
Cho từ từ đến dư kim loại Na vào dung dịch có chứa muối FeCl3. Số phản ứng xảy ra là:
-
A.
4
-
B.
2
-
C.
3
-
D.
5
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do
-
A.
nhôm có tính khử mạnh hơn sắt.
-
B.
trên bề mặt nhôm có lớp Al2O3 bền vững bảo vệ
-
C.
nhôm có tính khử yếu hơn sắt.
-
D.
trên bề mặt nhôm có lợp Al(OH)3 bảo vệ.
Trường hợp không xảy ra phản ứng hoá học là:
-
A.
Fe + dung dịch FeCl3.
-
B.
Fe + dung dịch HCl.
-
C.
Cu + dung dịch FeCl3.
-
D.
Cu + dung dịch FeCl2.
Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe (dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
-
A.
Fe(NO3)3.
-
B.
Fe(NO3)2.
-
C.
Fe(NO3)2, Cu(NO3)2
-
D.
Fe(NO3)3, Fe(NO3)2.
Cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thu được khí NO là sản phẩm khử duy nhất, dung dịch Y và còn lại chất rắn chưa tan Z. Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra. Thành phần chất tan trong dung dịch Y là:
-
A.
Fe(NO3)3 và Cu(NO3)2.
-
B.
Fe(NO3)2 và Cu(NO3)2.
-
C.
Fe(NO3)2.
-
D.
Fe(NO3)3 và Fe(NO3)2.
Cho kim loại M tác dụng với Cl2 thu được muối X. Cho kim loại M tác dụng với HCl thu được muối Y. Nếu cho M tác dụng với muối X thu được muối Y. M là
-
A.
Mg.
-
B.
Zn.
-
C.
Fe.
-
D.
Al.
Có 4 dung dịch đựng riêng biệt: (a) HCl; (b) CuCl2; (c) FeCl2; (d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất. Số trường hợp xảy ra ăn mòn điện hóa là
-
A.
0
-
B.
1
-
C.
3
-
D.
2
Để điều chế Fe trong công nghiệp, người ta có thể dùng phương pháp nào sau đây:
-
A.
Mg + FeCl2 →
-
B.
Fe2O3 + Al $\xrightarrow{{{t}^{o}}}$
-
C.
Điện phân dung dịch FeCl2
-
D.
Fe2O3 + CO →
Trong các kim loại quặng sắt, quặng có hàm lượng sắt cao nhất là:
-
A.
Hematit nâu.
-
B.
Manhetit.
-
C.
Xiđerit.
-
D.
Hematit đỏ
Phản ứng của Fe với O2 như hình vẽ
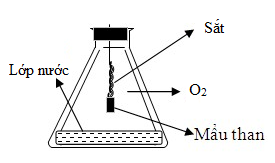
Cho các phát biểu sau đây:
(a) Vai trò của mẩu than để làm mồi cung cấp nhiệt cho phản ứng.
(b) Phản ứng tỏa nhiều nhiệt làm đầu dây sắt nóng chảy có thể thành cục tròn.
(c) Vai trò của lớp nước ở đáy bình là để tránh vỡ bình.
(d) Phản ứng cháy sáng, có các tia lửa bắn ra từ dây sắt.
Số phát biểu sai là
-
A.
2.
-
B.
0.
-
C.
1.
-
D.
3.
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố Fe(Z = 26) thuộc chu kì nào?
-
A.
5
-
B.
2
-
C.
3
-
D.
4
Những nhận định sau về kim loại sắt:
(1) Kim loại sắt có tính khử trung bình.
(2) Ion Fe2+ bền hơn Fe3+.
(3) Fe bị thụ động trong H2SO4 đặc nguội.
(4) Quặng manhetit là quặng có hàm lượng sắt cao nhất.
(5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính.
(6) Kim loại sắt có thể khử được ion Fe3+.
Số nhận định đúng là
-
A.
3
-
B.
4
-
C.
5
-
D.
6
Ở nhiệt độ thường, kim loại Fe phản ứng được với dung dịch nào sau đây?
-
A.
NaNO3.
-
B.
CaCl2.
-
C.
CuSO4.
-
D.
KCl.
Kim loại sắt phản ứng với lượng dư dung dịch chất nào sau đây tạo ra muối sắt(II)?
-
A.
H2SO4 đặc, nóng.
-
B.
HNO3 loãng.
-
C.
H2SO4 loãng.
-
D.
HNO3 đặc nóng.
Lời giải và đáp án
Nguyên tử của nguyên tố sắt có
-
A.
2 electron hóa trị.
-
B.
6 electron d.
-
C.
56 hạt mang điện.
-
D.
8 electron lớp ngoài cùng.
Đáp án : B
- Cấu hình electron: 1s22s22p63s23p63d64s2
=> sắt có 6 electron d
Cho Fe (Z = 26). Cấu hình electron đúng của ion Fe2+ là
-
A.
[18Ar]3d84s2.
-
B.
[18Ar]3d54s1
-
C.
[18Ar]3d6.
-
D.
[18Ar]3d44s2.
Đáp án : C
- Cấu hình electron: 1s22s22p63s23p63d64s2
=> cấu hình e của ion Fe2+ là [18Ar]3d6
Tính chất vật lí nào sau đây của sắt khác với các đơn chất kim loại khác ?
-
A.
Tính dẻo, dễ rèn.
-
B.
Dẫn điện và dẫn nhiệt.
-
C.
Là kim loại nặng.
-
D.
Có tính nhiễm từ.
Đáp án : D
Tính chất khác là sắt có tính nhiễm từ
Phương trình hóa học nào sau đây viết không đúng ?
-
A.
Fe + S $\xrightarrow{{{t}^{o}}}$ FeS.
-
B.
4Fe + 3O2 (kk) $\xrightarrow{{{t}^{o}}}$ 2Fe2O3.
-
C.
2Fe + 3Cl2 $\xrightarrow{{{t}^{o}}}$ 2FeCl3
-
D.
Fe + 2FeCl3 → 3FeCl2.
Đáp án : B
Phương trình hóa học viết không đúng là : 4Fe + 3O2(kk) $\xrightarrow{{{t}^{o}}}$ 2Fe2O3
Vì Fe cháy trong oxi không khí sinh ra oxit sắt từ Fe3O4
Quặng sắt manhetit có thành phần chính là
-
A.
Fe2O3.
-
B.
FeCO3.
-
C.
Fe3O4.
-
D.
FeS2.
Đáp án : C
Quặng sắt manhetit có thành phần chính là Fe3O4
Dãy bao gồm các ion sắp xếp theo chiều giảm dần tính oxi hóa là
-
A.
Ag+, Cu2+, Fe3+, Fe2+.
-
B.
Fe3+, Cu2+, Ag+, Fe2+.
-
C.
Ag+, Fe3+, Cu2+, Fe2+.
-
D.
Fe3+, Ag+, Cu2+, Fe2+.
Đáp án : C
xem lại lí thuyết dãy điện hóa
Dãy các ion sắp xếp theo chiều giảm dần tính oxi hóa là Ag+, Fe3+, Cu2+, Fe2+.
Có thể đựng axit nào sau đây trong bình sắt ?
-
A.
HCl loãng.
-
B.
H2SO4 loãng.
-
C.
HNO3 đặc nguội.
-
D.
HNO3 đặc nóng.
Đáp án : C
Bình sắt có thể đựng được axit HNO3 đặc nguội vì sắt bị thụ động trong HNO3 đặc nguội
Đốt một lượng dư sắt trong khí clo thu được hỗn hợp gồm 2 chất rắn. Thành phần chất rắn đó gồm
-
A.
FeCl2 và FeCl3.
-
B.
FeCl3 và Fe.
-
C.
FeCl2 và Fe.
-
D.
đáp án khác.
Đáp án : B
Fe dư => chất rắn sau phản ứng chứa Fe dư và muối Fe(III)
Dễ nhầm sang trường hợp tạo muối Fe(II) và sắt dư: Fe+ Fe(III) → Fe(II)
Tuy nhiên phản ứng này chỉ xảy ra trong dung dịch nên => Fe dư thì sản phẩm là muối Fe(III) và Fe dư
Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch
-
A.
FeCl3.
-
B.
CuSO4.
-
C.
AgNO3.
-
D.
MgCl2.
Đáp án : D
Kim loại Fe không đẩy được Mg ra khỏi muối MgCl2
Kim loại sắt tác dụng với dung dịch nào sau đây tạo muối sắt (II)
-
A.
HNO3 đặc, nóng, dư.
-
B.
CuSO4.
-
C.
H2SO4 đặc, nóng, dư
-
D.
MgSO4.
Đáp án : B
Fe tác dụng với HNO3 và H2SO4 đặc nóng dư đều thu được muối sắt (III)
Fe + CuSO4 → FeSO4 + Cu
Để bảo quản dung dịch FeSO4 trong phòng thí nghiệm, người ta cần thêm vào bình chất nào dưới đây
-
A.
Một đinh Fe sạch.
-
B.
Dung dịch H2SO4 loãng.
-
C.
Một dây Cu sạch.
-
D.
Dung dịch H2SO4 đặc.
Đáp án : A
Người ta dùng đinh Fe sạch để sắt khử muối sắt(III) thành muối sắt(II): Fe + Fe2(SO4)3 → 3FeSO4
Cho từ từ đến dư kim loại Na vào dung dịch có chứa muối FeCl3. Số phản ứng xảy ra là:
-
A.
4
-
B.
2
-
C.
3
-
D.
5
Đáp án : B
xem lại lí thuyết về sắt
2Na + 2H2O → 2Na+ + 2OH- + H2
Fe3+ + 3OH- → Fe(OH)3
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do
-
A.
nhôm có tính khử mạnh hơn sắt.
-
B.
trên bề mặt nhôm có lớp Al2O3 bền vững bảo vệ
-
C.
nhôm có tính khử yếu hơn sắt.
-
D.
trên bề mặt nhôm có lợp Al(OH)3 bảo vệ.
Đáp án : B
xem lại lí thuyết về sắt
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do trên bề mặt nhôm có lớp Al2O3 bền vững bảo vệ
Trường hợp không xảy ra phản ứng hoá học là:
-
A.
Fe + dung dịch FeCl3.
-
B.
Fe + dung dịch HCl.
-
C.
Cu + dung dịch FeCl3.
-
D.
Cu + dung dịch FeCl2.
Đáp án : D
Trường hợp không xảy ra phản ứng hoá học là Cu + dung dịch FeCl2.
Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe (dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
-
A.
Fe(NO3)3.
-
B.
Fe(NO3)2.
-
C.
Fe(NO3)2, Cu(NO3)2
-
D.
Fe(NO3)3, Fe(NO3)2.
Đáp án : B
- Các phản ứng xảy ra:
Cu(dư) + AgNO3 → Cu(NO3)2 + Ag
Cu(NO3)2 + Fe(dư) → Fe(NO3)2 + Cu
Vậy dung dịch Y chứa Fe(NO3)2.
Cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thu được khí NO là sản phẩm khử duy nhất, dung dịch Y và còn lại chất rắn chưa tan Z. Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra. Thành phần chất tan trong dung dịch Y là:
-
A.
Fe(NO3)3 và Cu(NO3)2.
-
B.
Fe(NO3)2 và Cu(NO3)2.
-
C.
Fe(NO3)2.
-
D.
Fe(NO3)3 và Fe(NO3)2.
Đáp án : C
- Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra Þ trong Z có chứa Fe.
- Vì lượng Fe còn dư sau phản ứng nên khi cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thì dung dịch Y thu được chỉ có chứa Fe(NO3)2.
Cho kim loại M tác dụng với Cl2 thu được muối X. Cho kim loại M tác dụng với HCl thu được muối Y. Nếu cho M tác dụng với muối X thu được muối Y. M là
-
A.
Mg.
-
B.
Zn.
-
C.
Fe.
-
D.
Al.
Đáp án : C
M tác dụng với Cl2 và với HCl cho 2 muối khác nhau => kim loại M có nhiều hóa trị
Có 4 dung dịch đựng riêng biệt: (a) HCl; (b) CuCl2; (c) FeCl2; (d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất. Số trường hợp xảy ra ăn mòn điện hóa là
-
A.
0
-
B.
1
-
C.
3
-
D.
2
Đáp án : D
xem lại lí thuyết về sắt
Để xảy ra quá trình ăn mòn điện hóa cần thỏa mãn 3 điều kiện:
+ Có 2 điện cực khác bản
+ 2 điện cực tiếp xúc trực tiếp hoặc gián tiếp với nhau
+ 2 điện cực được nhúng trong cùng 1 dung dịch chất điện li
Có 2 trường hợp thỏa mãn: Fe nhúng vào dung dịch CuCl2 và Fe nhúng vào dung dịch CuCl2 + HCl
Để điều chế Fe trong công nghiệp, người ta có thể dùng phương pháp nào sau đây:
-
A.
Mg + FeCl2 →
-
B.
Fe2O3 + Al $\xrightarrow{{{t}^{o}}}$
-
C.
Điện phân dung dịch FeCl2
-
D.
Fe2O3 + CO →
Đáp án : D
xem lại lí thuyết về sắt
điều chế Fe trong công nghiệp, người ta có thể dùng phương pháp khử Fe2O3 bằng khí CO
A và B sai vì kim loại Mg và Al giá thành cao hơn Fe
C sai vì đphương pháp điện phân dung dịch tốn nhiều chi phí
Trong các kim loại quặng sắt, quặng có hàm lượng sắt cao nhất là:
-
A.
Hematit nâu.
-
B.
Manhetit.
-
C.
Xiđerit.
-
D.
Hematit đỏ
Đáp án : B
Hematit nâu Fe2O3.nH2O
Manhetit Fe3O4
Xiđerit FeCO3
Hematit đỏ Fe2O3
Ta tính %Fe trong các quặng trên, quặng có %Fe lớn nhất là manhetit
Phản ứng của Fe với O2 như hình vẽ

Cho các phát biểu sau đây:
(a) Vai trò của mẩu than để làm mồi cung cấp nhiệt cho phản ứng.
(b) Phản ứng tỏa nhiều nhiệt làm đầu dây sắt nóng chảy có thể thành cục tròn.
(c) Vai trò của lớp nước ở đáy bình là để tránh vỡ bình.
(d) Phản ứng cháy sáng, có các tia lửa bắn ra từ dây sắt.
Số phát biểu sai là
-
A.
2.
-
B.
0.
-
C.
1.
-
D.
3.
Đáp án : B
Dựa vào kiến thức phản ứng đốt cháy của Fe với O2
Tất cả các đáp án đều đúng → có 0 phát biểu sai
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố Fe(Z = 26) thuộc chu kì nào?
-
A.
5
-
B.
2
-
C.
3
-
D.
4
Đáp án : D
Viết cấu hình e của Fe sau đó có bao nhiêu lớp e thì Fe thuộc chu kì đó
Fe (Z = 26) có cấu hình: [Ar]3d64s2
→ Có 4 lớp => thuộc chu kì 4 trong bảng hệ thống tuần hoàn.
Những nhận định sau về kim loại sắt:
(1) Kim loại sắt có tính khử trung bình.
(2) Ion Fe2+ bền hơn Fe3+.
(3) Fe bị thụ động trong H2SO4 đặc nguội.
(4) Quặng manhetit là quặng có hàm lượng sắt cao nhất.
(5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính.
(6) Kim loại sắt có thể khử được ion Fe3+.
Số nhận định đúng là
-
A.
3
-
B.
4
-
C.
5
-
D.
6
Đáp án : B
(1) đúng
(2) sai, Fe2+ trong không khí dễ bị oxi hóa thành Fe3+
(3) đúng
(4) đúng, quặng manhetit (Fe3O4) là quặng có hàm lượng Fe cao nhất.
(5) sai, vì từ trường Trái Đất sinh ra do sự chuyển động của các chất lỏng dẫn điện
(6) đúng, Fe + 2Fe3+ → 3Fe2+
Vậy có 4 phát biểu đúng
Ở nhiệt độ thường, kim loại Fe phản ứng được với dung dịch nào sau đây?
-
A.
NaNO3.
-
B.
CaCl2.
-
C.
CuSO4.
-
D.
KCl.
Đáp án : C
Dựa vào quy tắc alpha trong dãy điện hóa
Fe + CuSO4 → FeSO4 + Cu
Kim loại sắt phản ứng với lượng dư dung dịch chất nào sau đây tạo ra muối sắt(II)?
-
A.
H2SO4 đặc, nóng.
-
B.
HNO3 loãng.
-
C.
H2SO4 loãng.
-
D.
HNO3 đặc nóng.
Đáp án : C
Xem lại TCHH của sắt
- Tác dụng với HNO3 dư (loãng hay đặc nóng) đều cho muối Fe3+
- Tác dụng với H2SO4 đặc nóng cho Fe3+; tác dụng với H2SO4 loãng cho Fe2+
Fe + H2SO4 loãng → FeSO4 + H2
Luyện tập và củng cố kiến thức Bài 32. Hợp chất của sắt Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 33. Hợp kim của sắt Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 33. Quy đổi sắt Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 34. Crom và hợp chất của crom Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 34. Crom và hợp chất của crom (tiếp) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 35. Đồng và hợp chất của đồng Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 36. Sơ lược về một số kim loại khác Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập Crom - Sắt - Đồng hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 7t Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận