Trắc nghiệm Tổng hợp bài tập Crom - Sắt - Đồng hay và khó - Hóa 12
Đề bài
Hòa tan hoàn toàn 17,04 gam hỗn hợp gồm Fe, FeO, Fe3O4 và Fe2O3 trong 660 mol dd HCl 1M dư thu được dd A và 1,68 lít H2 đktc. Cho AgNO3 dư vào A thấy thoát ra 0,336 lít khí NO (sản phẩm khử duy nhất) và tạo thành m gam kết tủa. Giá tri của m là
-
A.
102,81
-
B.
94,02
-
C.
99,06
-
D.
94,71
Hỗn hợp X gồm Fe2O3, FeO và Cu (trong đó nguyên tố oxi chiếm 16% theo khối lượng). Cho m gam X tác dụng với 500 ml dung dịch HCl 2M (dư), thu được dung dịch Y và còn lại 0,27m gam chất rắn không tan. Cho dung dịch AgNO3 dư vào Y, thu được khí NO (sản phẩm khử duy nhất của N+5) và 165,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
-
A.
40.
-
B.
48
-
C.
32.
-
D.
28.
Nung m gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3, FeCO3 trong bình kín (không có không khí). Sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn Y và khí Z có tỉ khối so với H2 là 22,5 (giả sử khí NO2 sinh ra không tham gia vào phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch gồm 0,01 mol KNO3 và 0,15 mol H2SO4 loãng thu được dung dịch chỉ chứa 21,23 gam muối trung hòa của kim loại và hỗn hợp hai khí có tỉ khối so với H2 là 8 (trong đó có 1 khí hóa nâu ngoài không khí). Giá trị m là
-
A.
11,32
-
B.
13,92
-
C.
19,16
-
D.
13,76
Cho m gam hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO4 1M. Sau phản ứng thu được dung dịch Y chứa 59,04g muối trung hòa và 896 ml NO (sản phẩm khử duy nhất của N+5, ở dktc). Y phản ứng vừa đủ với 0,44 mol NaOH. Biết các phản ứng xảy ra hoàn toàn. Phầm trăm khối lượng của Fe(NO3)2 trong X có giá trị gần nhất với giá trị nào sau đây?
-
A.
73
-
B.
18
-
C.
63
-
D.
20
Hỗn hợp X1 gồm Fe, FeCO3 và kim loại M (có hóa trị không đổi). Cho 14,1 gam X1 tác dụng với 500 ml dung dịch HNO3 xM, thu được dung dịch X2 và 4,48 lít hỗn hợp Y1 (có tỉ khối so với hiđro là 16,75) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO3 dư có trong dung dịch X2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X3. Chia X3 làm hai phần bằng nhau:
- Phần 1: đem cô cạn thì thu được 38,3 gam hỗn hợp muối khan.
- Phần 2: Cho tác dụng với dung dịch NaOH dư thì thu được 8,025 gam kết tủa của 1 chất.
Biết các phản ứng đều xảy ra hoàn toàn, các chất khí đều đo ở đktc, quá trình cô cạn không xảy ra phản ứng hóa học. Giá trị của x gần với giá trị nào sau đây?
-
A.
2,26
-
B.
2,42
-
C.
2,31
-
D.
1,98
Cho 23 gam hỗn hợp X gồm Cu, Fe, Cu2S, CuS, FeS2 và FeS tác dụng hết với dung dịch HNO3(đặc nóng, dư) thu được V lít (ở đktc) khí NO2 duy nhất và dung dịch Y. Nếu cho toàn bộ Y vào một lượng dư dung dịch BaCl2, thu được 58,25 gam kết tủa. Mặt khác, khi cho toàn bộ Y tác dụng với dung dịch NaOH dư thu được 25,625 gam chất kết tủa. Giá trị của V là
-
A.
16,8.
-
B.
38,08
-
C.
24,64.
-
D.
47,6.
Cho 7,488 gam hỗn hợp rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,3 mol HCl và 0,024 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,032 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,009 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 44,022 gam kết tủa. Phần trăm khối lượng Fe trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
-
A.
46,6%.
-
B.
37,8%.
-
C.
35,8%.
-
D.
49,6%.
Cho 46,8 gam hỗn hợp CuO và Fe3O4 (tỉ lệ mol 1: 1) tan hết trong dung dịch H2SO4 (loãng, vừa đủ) thu được dung dịch (A).Cho m gam Mg vào dung dịch (A), sau khi phản ứng kết thúc thu được dung dịch B. Thêm dung dịch KOH dư vào (B) được kết tủa (D). Nung (D) trong không khí đến khối lượng không đổi được 45,0 gam chất rắn (E). giá trị gần nhất của m là
-
A.
6,6 gam
-
B.
13,2 gam
-
C.
11,0 gam
-
D.
8,8 gam
Hòa tan 1,12 gam Fe bằng 300ml dung dịch HCl 0,2M, thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào dung dịch X, thu được khí NO ( sản phẩm khử duy nhất của N+5) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
-
A.
7,36.
-
B.
8,61
-
C.
9,15.
-
D.
10,23.
Hỗn hợp X gồm FeO, Fe3O4 và Cu (trong đó số mol FeO bằng 1/4 số mol hỗn hợp X). Hòa tan hoàn toàn 27,36 gam X trong dung dịch chứa NaNO3 và HCl, thu được 0,896 lít khí NO (sản phẩm khử duy nhất của NO3-, ở đktc) và dung dịch Y chỉ chứa muối clorua có khối lượng 58,16 gam. Cho Y tác dụng với AgNO3 dư thu được m gam kết tủa. Giá trị của m là :
-
A.
100,45.
-
B.
110,17.
-
C.
106,93.
-
D.
155,72.
Hòa tan hoàn toàn 3,92 gam bột Fe vào 44,1 gam dung dịch HNO3 50% thu được dung dịch X(không có ion NH4+, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi của nước). Cho X phản ứng với 200ml dung dịch chứa đồng thời KOH 0,5M và NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y thu được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 20,56 gam hỗn hợp chất rắn khan. Nồng độ phần trăm của Fe(NO3)2 trong dung dịch X là
-
A.
37,18%.
-
B.
37,52%.
-
C.
38,71%.
-
D.
35,27%.
Nung m gam hỗn hợp X gồm Fe, Cu, Fe(NO3)2, Cu(NO3)2 và FeCO3 trong bình chân không, thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 22,8 (giả sử khí NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch chứa đồng thời 0,08 mol KNO3 và 0,68 mol \(H_2SO_4\) (loãng), thu được dung dịch chỉ chứa 98,36 gam muối trung hòa của các kim loại và hỗn hợp khí T gồm NO và H2. Tỉ khối của T so với H2 là 12,2. Biết các phản ứng xảy ra hoàn toàn. giá trị của m gần nhất với giá trị nào sau đây?
-
A.
60,72.
-
B.
60,74.
-
C.
60,73.
-
D.
60,75
Lời giải và đáp án
Hòa tan hoàn toàn 17,04 gam hỗn hợp gồm Fe, FeO, Fe3O4 và Fe2O3 trong 660 mol dd HCl 1M dư thu được dd A và 1,68 lít H2 đktc. Cho AgNO3 dư vào A thấy thoát ra 0,336 lít khí NO (sản phẩm khử duy nhất) và tạo thành m gam kết tủa. Giá tri của m là
-
A.
102,81
-
B.
94,02
-
C.
99,06
-
D.
94,71
Đáp án : A
Quy đổi hỗn hợp thành Fe và O
Bảo toàn số mol H+ có nHCl = 2nH2 +2nO + nH+(A) → nO
→ x
Khi cho AgNO3 vào dd A thì tạo ↓ AgCl và Ag
Bảo toàn số mol Cl thì AgCl : 0,66 mol
Bảo toàn e cho toàn bộ quá trình → nAg
→ m
Quy đổi hỗn hợp thành Fe và O với số mol là x và y → 56x + 16y = 17,04 g
nNO = 0,015 mol → nH+(A)=0,06 mol
Bảo toàn số mol H+ có :
\({{n}_{HCl}}~=2{{n}_{{{H}_{2}}}}+2{{n}_{O}}~+{{n}_{{{H}^{+}}(A)}}~\)→\({{n}_{O}}=y=\frac{0,66-0,06-2.0,075}{2}=0,225\text{ }mol\)→ x = 0,24 mol
Khi cho AgNO3 vào dd A thì tạo ↓ AgCl và Ag
Bảo toàn số mol Cl thì AgCl : 0,66 mol
Bảo toàn e cho toàn bộ quá trình thì 3x =2.0,075 + 2.0,225 +3.0,015+ nAg
→ nAg = 0,075 mol
→ m = 0,075.108 + 0,66 .143,5 = 102,81 gam
Hỗn hợp X gồm Fe2O3, FeO và Cu (trong đó nguyên tố oxi chiếm 16% theo khối lượng). Cho m gam X tác dụng với 500 ml dung dịch HCl 2M (dư), thu được dung dịch Y và còn lại 0,27m gam chất rắn không tan. Cho dung dịch AgNO3 dư vào Y, thu được khí NO (sản phẩm khử duy nhất của N+5) và 165,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
-
A.
40.
-
B.
48
-
C.
32.
-
D.
28.
Đáp án : A
Xét hỗn hợp kết tủa: \({{n}_{AgCl}}={{n}_{HCl}}\Rightarrow {{n}_{AgCl}}=\frac{{{m}_{\downarrow }}-143,5.{{n}_{AgCl}}}{108}\)
Lập hệ PT:
+ $160.{{n}_{F{{\text{e}}_{2}}{{O}_{3}}}}+72.{{n}_{F\text{e}O}}+64.{{n}_{Cu\,pu}}=m-{{m}_{Cu\,du}}$
+) $\frac{{{m}_{O}}}{{{m}_{X}}}=0,16$
+ Bảo toàn electron: nFeO + 2.nCu pứ = 3.nNO + nAg
+) nHCl = 6.nFe2O3 + 2.nFeO + 4.nNO
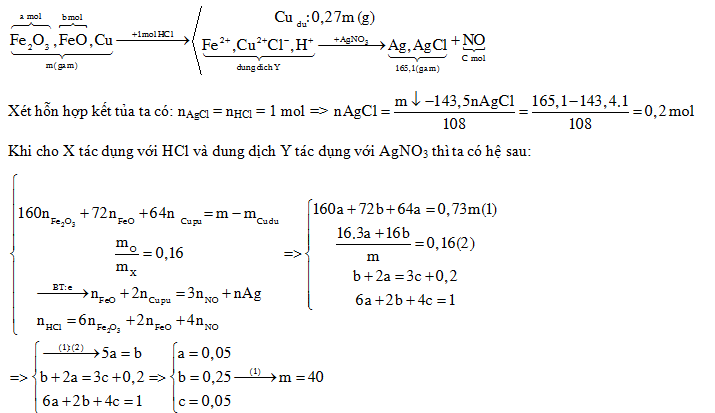
Nung m gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3, FeCO3 trong bình kín (không có không khí). Sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn Y và khí Z có tỉ khối so với H2 là 22,5 (giả sử khí NO2 sinh ra không tham gia vào phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch gồm 0,01 mol KNO3 và 0,15 mol H2SO4 loãng thu được dung dịch chỉ chứa 21,23 gam muối trung hòa của kim loại và hỗn hợp hai khí có tỉ khối so với H2 là 8 (trong đó có 1 khí hóa nâu ngoài không khí). Giá trị m là
-
A.
11,32
-
B.
13,92
-
C.
19,16
-
D.
13,76
Đáp án : D
+) Mhh khí = 2.8 = 16 => nH2 = nNO
Trong muối có: Fe x mol, K+ 0,01 mol, SO42- 0,15 mol
mmuối = 21,23 => x => mFe
+) Khí Z gồm NO2 và CO2 có M = 45 => nNO2 = nCO2 = a
=> trong X có: Fe 0,115 mol, NO3- a mol, CO32- a mol
+) Bảo toàn mol O trong CO3 và NO3 => số mol O
=> các chất trong Y
NO3- + 3e + 4 H+ → NO + 2H2O
2 H+ + 2e → H2
2 H+ + O → H2O
+) Tính nH+ phản ứng => a
+) \({{m}_{X~}}={{m}_{Fe}}~+{{m}_{NO_{3}^{-}}}~+{{m}_{CO_{3}^{2-}}}~\)
Hỗn hợp khí có M = 2.8 = 16 => có H2 và NO => nH2 = nNO, vì có H2
=> 0,01 mol KNO3 hết cho 0,01 mol NO => nH2 = 0,01
Trong muối có: Fe x mol, K+ 0,01 mol, SO42- 0,15 mol
mmuối = 56x + 39.0,01 + 96.0,15 = 21,23 => x = 0,115 => mFe = 6,44
=> Khí Z gồm NO2 và CO2 có M = 45 => nNO2 = nCO2 = a
=> trong X có: Fe 0,115 mol, NO3- a mol, CO32- a mol => nO = 6a mol (bảo toàn mol O trong CO3 và NO3)
=> trong Y có 0,115 mol Fe và 2a mol O (giảm 4a do tạo khí NO2 và CO2)
NO3- + 3e + 4 H+ → NO + 2 H2O
0,01 0,04 0,01
2 H+ + 2e → H2
0,02 0,01
2 H+ + O → H2O
4a 2a
nH+ = 0,04 + 0,02 + 4a = 2.0,15 => a = 0,06
mX = mFe + mNO3 + mCO3 = 6,44 + 62.0,06 + 60.0,06 = 13,76
Cho m gam hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO4 1M. Sau phản ứng thu được dung dịch Y chứa 59,04g muối trung hòa và 896 ml NO (sản phẩm khử duy nhất của N+5, ở dktc). Y phản ứng vừa đủ với 0,44 mol NaOH. Biết các phản ứng xảy ra hoàn toàn. Phầm trăm khối lượng của Fe(NO3)2 trong X có giá trị gần nhất với giá trị nào sau đây?
-
A.
73
-
B.
18
-
C.
63
-
D.
20
Đáp án : A
- Bảo toàn nguyên tố
- Bảo toàn điện tích
Gọi số mol Fe, Fe3O4, Fe(NO3)2 lần lượt là a, b, c
2H+ + O → H2O
4H+ + NO3- + 3e → NO + 2H2O
=> b
Trong Y : Bảo toàn nguyên tố : nNO3 = 2c – nNO3 pứ
+) \({{n}_{{{K}^{+}}}}={{n}_{SO_{4}^{2-}}}~\)
Gọi x, y lần lượt là số mol Fe2+ và Fe3+ trong Y
Bảo toàn điện tích : \(2{{n}_{F{{e}^{2+}}}}~+3{{n}_{F{{e}^{3+}}}}~+{{n}_{{{K}^{+}}~}}={{n}_{NO_{3}^{-}}}~+2{{n}_{SO_{4}^{2-}}}\) => PT (1)
+) \({{n}_{NaOH}}=2{{n}_{F{{e}^{2+}}}}+3{{n}_{F{{e}^{3+}}}}\) => PT (2)
Từ (1) và (2) => c
+) \({{m}_{Y}}~={{m}_{NO_{3}^{-}}}~+\text{ }{{m}_{{{K}^{+}}}}+{{m}_{F{{e}^{2+}}}}+{{m}_{F{{e}^{3+}}}}+{{m}_{SO_{4}^{2-}}}\) => PT (3)
=> x và y
Bảo toàn Fe => a
+) \({{m}_{X}}~={{m}_{Fe}}~+{{m}_{F{{e}_{3}}{{O}_{4}}}}~+{{m}_{Fe{{\left( N{{O}_{3}} \right)}_{2}}}}\)
nNO = 0,04 mol
Gọi số mol Fe, Fe3O4, Fe(NO3)2 lần lượt là a, b, c
Vì sau phản ứng chỉ chứa muối trung hòa nên H+ (HSO4-) hết theo các quá trình sau :
2H+ + O → H2O
4H+ + NO3- + 3e → NO + 2H2O
=> 8b + 0,16 = nH+ = 0,32 mol => b = 0,02 mol
Trong Y : Bảo toàn nguyên tố : nNO3 = 2c – nNO3 pứ = 2c – 0,04
\({{n}_{{{K}^{+}}}}={{n}_{SO_{4}^{2-}}}~\)= 0,32 mol
Gọi x, y lần lượt là số mol Fe2+ và Fe3+ trong Y
Bảo toàn điện tích : \(2{{n}_{F{{e}^{2+}}}}~+3{{n}_{F{{e}^{3+}}}}~+{{n}_{{{K}^{+}}~}}={{n}_{NO_{3}^{-}}}~+2{{n}_{SO_{4}^{2-}}}\)
=> 2x + 3y + 0,32 = 2c – 0,04 + 0,32.2
=> 2x + 3y = 2c + 0,28 (1)
Có : \({{n}_{NaOH}}=2{{n}_{F{{e}^{2+}}}}+3{{n}_{F{{e}^{3+}}}}\) => 0,44 = 2x + 3y (2)
Từ (1) và (2) => c = 0,08 mol
\({{m}_{Y}}~={{m}_{NO_{3}^{-}}}~+\text{ }{{m}_{{{K}^{+}}}}+{{m}_{F{{e}^{2+}}}}+{{m}_{F{{e}^{3+}}}}+{{m}_{SO_{4}^{2-}}}\)
=> 59,04 = 62.(2c - 0,04) + 0,32.39 + 0,32.96 + 56x + 56y
=> x + y = 0,15 mol (3)
Bảo toàn Fe : a + 3b + c = 0,15
=> a = 0,01
=> \({{m}_{X}}~={{m}_{Fe}}~+{{m}_{F{{e}_{3}}{{O}_{4}}}}~+{{m}_{Fe{{\left( N{{O}_{3}} \right)}_{2}}}}=19,6\,(gam)\)
=> \(\%{{m}_{Fe{{\left( N{{O}_{3}} \right)}_{2}}}}~=73,47\%\)
Hỗn hợp X1 gồm Fe, FeCO3 và kim loại M (có hóa trị không đổi). Cho 14,1 gam X1 tác dụng với 500 ml dung dịch HNO3 xM, thu được dung dịch X2 và 4,48 lít hỗn hợp Y1 (có tỉ khối so với hiđro là 16,75) gồm hai chất khí không màu trong đó có một khí hóa nâu ngoài không khí. Để trung hòa HNO3 dư có trong dung dịch X2 cần vừa đủ 200 ml dung dịch NaOH 1M và thu được dung dịch X3. Chia X3 làm hai phần bằng nhau:
- Phần 1: đem cô cạn thì thu được 38,3 gam hỗn hợp muối khan.
- Phần 2: Cho tác dụng với dung dịch NaOH dư thì thu được 8,025 gam kết tủa của 1 chất.
Biết các phản ứng đều xảy ra hoàn toàn, các chất khí đều đo ở đktc, quá trình cô cạn không xảy ra phản ứng hóa học. Giá trị của x gần với giá trị nào sau đây?
-
A.
2,26
-
B.
2,42
-
C.
2,31
-
D.
1,98
Đáp án : C
+) Xác định 2 khí trong Y1 và số mol mỗi khí
+) ${{n}_{FeC{{O}_{3}}}}={{n}_{C{{O}_{2}}}}$
Đặt nM = a mol, nên nFe = b mol
+) Từ khối lượng hh X1 => PT (1)
+) Xác định các chất có trong dung dịch X2
+ Phản ứng trung hòa:
HNO3 + NaOH → NaNO3 + H2O
=> nNaOH = n HNO3 dư
+) Xác định các chất có trong dung dịch X3
* Cô cạn ½ dung dịch X3, từ tổng khối lượng chất rắn thu được => PT (2)
* Cho dung dịch NaOH dư và ½ dung dịch X3 thu được kết tủa của một chất đó là Fe(OH)3
+) Từ 8,025 gam kết tủa của 1 chất => b = PT (3)
Theo bảo toàn electron => PT (4)
Từ (1), (2), (3), (4) => các giá trị an; c; M
+) nHNO3 phản ứng = nN(sp) => nHNO3 ban đầu => x
Hỗn hợp gồm kim loại M, Fe, FeCO3 tác dụng với dung dịch HNO3 thu được 2 khí không màu trong đó có 1 khí hóa nâu ngoài không khí nên 2 khí là NO và CO2
Tính được nCO2 = 0,05 mol; nNO = 0,15 mol $\Rightarrow {{n}_{FeC{{O}_{3}}}}={{n}_{C{{O}_{2}}}}=0,05\text{ }mol$
Đặt nM = a mol và nFe = b mol
Ta có: aM + 56b + 116.0,05 = 14,1
Nên aM + 56b = 8,3 (1)
- Dung dịch X2 có: $\left\{ {\begin{array}{*{20}{l}}{M{{\left( {N{O_3}} \right)}_n}(amol)}\\{Fe{{\left( {N{O_3}} \right)}_3}:\left( {b + 0,05} \right)mol}\\{HN{O_3}\;du}\\{N{H_4}N{O_3}:cmol}\end{array}} \right.$
+ Phản ứng trung hòa:
HNO3 + NaOH → NaNO3 + H2O
nNaOH = n HNO3 dư = 0,2.1 = 0,2 mol
- Dung dịch X3 có: $\left\{ {\begin{array}{*{20}{l}}{M{{\left( {N{O_3}} \right)}_n}:amol}\\{Fe{{\left( {N{O_3}} \right)}_3}:\left( {b + 0,05} \right)mol}\\{NaN{O_3}:0,2mol}\\{N{H_4}N{O_3}:cmol}\end{array}} \right.$
* Cô cạn ½ dung dịch X3, tổng khối lượng chất rắn thu được là:
(M + 62n).a + 242.(b + 0,05) + 80.c + 85.0,2 = 38,3.2 = 76,6
aM + 62an + 242b + 80c = 47,5 (2)
* Cho dung dịch NaOH dư và ½ dung dịch X3 thu được kết tủa của một chất đó là Fe(OH)3
Fe(NO3)3 + 3NaOH → 3NaNO3 + Fe(OH)3
Ta có: 107.(b + 0,05) = 16,05 => b = 0,1 (3)
Theo bảo toàn electron, ta có: an + 0,3 + 0,05 = 0,45 + 8c => an = 0,1 + 8c (4)
Từ (1), (2), (3), (4) => an = 0,3; c = 0,025; M = 9n
=> n = 3; M = 27 => kim loại Al là nghiệm thỏa mãn
nHNO3 phản ứng = nN(sp) = 0,1.3 + 0,15.3 + 0,025.2 + 0,15 = 0,95 mol
nHNO3 ban đầu = 0,95 + 0,2 = 1,15 mol
=> x = CM (HNO3) = 2,3M
Cho 23 gam hỗn hợp X gồm Cu, Fe, Cu2S, CuS, FeS2 và FeS tác dụng hết với dung dịch HNO3(đặc nóng, dư) thu được V lít (ở đktc) khí NO2 duy nhất và dung dịch Y. Nếu cho toàn bộ Y vào một lượng dư dung dịch BaCl2, thu được 58,25 gam kết tủa. Mặt khác, khi cho toàn bộ Y tác dụng với dung dịch NaOH dư thu được 25,625 gam chất kết tủa. Giá trị của V là
-
A.
16,8.
-
B.
38,08
-
C.
24,64.
-
D.
47,6.
Đáp án : D
Quy đổi hỗn hợp về Cu, Fe, S
Bảo toàn khối lượng
Bảo toàn electron
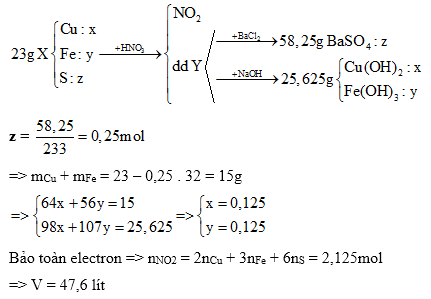
Cho 7,488 gam hỗn hợp rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,3 mol HCl và 0,024 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,032 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,009 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 44,022 gam kết tủa. Phần trăm khối lượng Fe trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
-
A.
46,6%.
-
B.
37,8%.
-
C.
35,8%.
-
D.
49,6%.
Đáp án : B
Bảo toàn electron
Bảo toàn điện tích
Bảo toàn nguyên tố Fe, H, O
+) Phần kết tủa có AgCl => nAg
+) Bảo toàn electron: \({{n}_{F{{e}^{2+}}}}~={{n}_{Ag}}~+3{{n}_{NO}}\)
+) nH+ dư = 4.nNO
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = PT (1)
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
+) Bảo toàn điện tích => \({{n}_{F{{e}^{3+}}}}\)
+) Bảo toàn Fe => PT (2)
Bảo toàn H => nH2O
Bảo toàn O: \(4{{n}_{F{{e}_{3}}{{O}_{4}}}}~+6{{n}_{Fe{{\left( N{{O}_{3}} \right)}_{2}}~}}+3{{n}_{HN{{O}_{3}}}}~={{n}_{Z}}+{{n}_{{{H}_{2}}O}}\) => PT (3)
Giải hệ (1),(2),(3) => a; b; c
Phần kết tủa có nAgCl = 0,3 => nAg = 0,009
Bảo toàn electron: \({{n}_{F{{e}^{2+}}}}~={{n}_{Ag}}~+3{{n}_{NO}}~=0,036\)
nNO = 0,009 => nH+ dư = 4.nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1)
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036 mol), H+ (0,036 mol), Cl- (0,3 mol)
Bảo toàn điện tích => \({{n}_{F{{e}^{3+}}}}~=0,064\)
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O: \(4{{n}_{F{{e}_{3}}{{O}_{4}}}}~+6{{n}_{Fe{{\left( N{{O}_{3}} \right)}_{2}}~}}+3{{n}_{HN{{O}_{3}}}}~={{n}_{Z}}+{{n}_{{{H}_{2}}O}}\)
=> 4b + 6c + 0,024.3 = 0,032 + 0,144 (3)
Giải hệ (1),(2),(3) => a = 0,05 mol; b = 0,014 mol; c = 0,008 mol
=> %mFe = 37,4% gần nhất với giá trị 37,8%
Cho 46,8 gam hỗn hợp CuO và Fe3O4 (tỉ lệ mol 1: 1) tan hết trong dung dịch H2SO4 (loãng, vừa đủ) thu được dung dịch (A).Cho m gam Mg vào dung dịch (A), sau khi phản ứng kết thúc thu được dung dịch B. Thêm dung dịch KOH dư vào (B) được kết tủa (D). Nung (D) trong không khí đến khối lượng không đổi được 45,0 gam chất rắn (E). giá trị gần nhất của m là
-
A.
6,6 gam
-
B.
13,2 gam
-
C.
11,0 gam
-
D.
8,8 gam
Đáp án : D
+) Tính số mol CuO và Fe3O4
+) Bảo toàn nguyên tố => các ion chứa trong dd A
+) Từ khối lượng chất rắn E là 45 gam => biện luận các chất có trong E và các phản ứng xảy ra
=> mE = mMgO + mFe2O3 => x
=> số mol Mg
Gọi nCuO = nFe3O4 = x (mol)
=> 80x + 232x = 46,8
=> x = 0,15 (mol)
=> nCuO = nFe3O4 = 0,15 (mol)
Bảo toàn nguyên tố => Dung dịch A chứa: 0,3 mol Fe3+; 0,15 mol Fe2+; 0,15 mol Cu2+; 0,75 mol SO42-
Nhận xét: Nếu hỗn hợp (CuO, Fe3O4) => (CuO, Fe2O3) thì khối lượng tăng lên, nhưng theo bài thì 45 < 46,8. Vậy phải có một phần kim loại Mg đã bị đẩy ra
Mg + 2Fe3+ → Mg2+ + 2Fe2+
0,15 ←0,3 → 0,15 → 0,3
Mg + Cu2+ → Mg2+ + Cu
Nếu toàn bộ Cu2+ đã bị đẩy ra thì B chứa Mg2+ (0,3); Fe2+ (0,45)
=> mE = mMgO + mFe2O3 = 48 > 45 gam
Nếu Cu2+ chưa hết thì m rắn > 48 gam (do CuO thế chỗ MgO thì khối lượng càng tăng). Vậy phải có 1 phần Fe bị đẩy ra.
Mg + Fe2+ → Mg2+ + Fe
x → x → x → x
=> \({{m}_{E}}~=40.\left( 0,3+x \right)+160.\frac{0,45-x}{2}=45\)
=> x = 0,075
=> nMg = 0,3 + x = 0,375
=> m = 9 gam (gần nhất với 8,8 gam)
Hòa tan 1,12 gam Fe bằng 300ml dung dịch HCl 0,2M, thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào dung dịch X, thu được khí NO ( sản phẩm khử duy nhất của N+5) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
-
A.
7,36.
-
B.
8,61
-
C.
9,15.
-
D.
10,23.
Đáp án : C
Viết các phương trình ion rút gọn xảy ra, tính toán lần lượt theo phương trình:
Ag+ + Cl - → AgCl↓
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
Fe2+ + Ag+ → Ag + Fe3+
=> m↓ = mAgCl + mAg =?
nFe = 1,12: 56 = 0,02 (mol); nHCl = 0,06 (mol)
Fe + 2HCl → FeCl2 + H2↑
0,02 → 0,04 → 0,02
Vậy dd X gồm FeCl2: 0,02 mol và HCl dư : 0,02 mol
Khi cho dd X + AgNO3 dư có phản ứng xảy ra:
Ag+ + Cl- → AgCl↓
0,06← 0,06 → 0,06 (mol)
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
0,015 ← 0,02
Fe2+ + Ag+ → Ag + Fe3+
(0,02-0,015) → 0,005 (mol)
=> m↓ = mAgCl + mAg = 0,06.143,5 + 0,005.108 = 9,15 (g)
Hỗn hợp X gồm FeO, Fe3O4 và Cu (trong đó số mol FeO bằng 1/4 số mol hỗn hợp X). Hòa tan hoàn toàn 27,36 gam X trong dung dịch chứa NaNO3 và HCl, thu được 0,896 lít khí NO (sản phẩm khử duy nhất của NO3-, ở đktc) và dung dịch Y chỉ chứa muối clorua có khối lượng 58,16 gam. Cho Y tác dụng với AgNO3 dư thu được m gam kết tủa. Giá trị của m là :
-
A.
100,45.
-
B.
110,17.
-
C.
106,93.
-
D.
155,72.
Đáp án : D
+) BTNT N: nNaNO3 = nNO
+) Gọi số mol FeO, Fe3O4, Cu lần lượt là x, y, z => Pt (1) số mol của FeO
+) PT (2) khối lượng của hỗn hợp X
+) BTNT O => tính số mol H2O theo x, y
+) BTNT H: nHCl = 2.nH2O
+) BTKL => PT (3)
=> x, y, z
Gọi ${{n}_{F{{\text{e}}^{2+}}}}=a;\,\,{{n}_{F{{\text{e}}^{3+}}}}=b$, dựa vào bảo toàn nguyên tố Fe và bảo toàn e => lập hệ PT a, b
=> a, b
+) nAgCl = nHCl và nAg = nFe2+ => khối lượng kết tủa

Hòa tan hoàn toàn 3,92 gam bột Fe vào 44,1 gam dung dịch HNO3 50% thu được dung dịch X(không có ion NH4+, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi của nước). Cho X phản ứng với 200ml dung dịch chứa đồng thời KOH 0,5M và NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y thu được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 20,56 gam hỗn hợp chất rắn khan. Nồng độ phần trăm của Fe(NO3)2 trong dung dịch X là
-
A.
37,18%.
-
B.
37,52%.
-
C.
38,71%.
-
D.
35,27%.
Đáp án : C
Bảo toàn điện tích với các chất trong dd Z
Bảo toàn nguyên tố N
Bảo toàn khối lượng có mFe + mDD HNO3 = mX + mkhí
0,07 mol Fe + 0,35 mol HNO3 → DD X
X + 0,1 mol KOH + 0,2 mol NaOH → muối Z
Muối Z có K+ : 0,1 mol; Na+ : 0,2 mol; NO3- : x mol và OH- : y mol
Bảo toàn điện tích có x + y = 0,3 mol
Khi nhiệt phân Z thì NO3- → NO2- →mmuối = 39.0,1 + 23.0,2 + 46x + 17y = 20,56
→ x = 0,24 mol và y = 0,06 mol
→ dung dịch X cũng có 0,24 mol NO3- > 3nFe = 0,21 mol → dung dịch X chứa HNO3 và 0,07 mol Fe(NO3)3
Bảo toàn N có nHNO3(X) = 0,24 – 0,07.3 =0,03 mol
Đặt sản phẩm khử của phản ứng là N+n thì ta có
N+5 + (5-n) e → N+n
Fe → Fe+3 + 3e
Ta có \({n_{{N^{ + n}}}} = {n_{HN{O_3}(bd)}} - {n_{N{O_3}(X)}} = 0,35 - 0,24 = 0,11\)
→ 0,11(5-n) = 3.0,07 =0,21 → n = 3,09 thì khí thoát ra có dạng N2On :0,055 mol
Bảo toàn khối lượng có mFe + mDD HNO3 = mX + mkhí → 3,92 + 44,1 = mx + 0,055.(14.2 + 16x)
→ mX = 43,76 gam
→ nồng độ % của Fe(NO3)3 trong X là C%[Fe(NO3)3] = 0,07.242 : 43,76. 100% = 38,7%
Nung m gam hỗn hợp X gồm Fe, Cu, Fe(NO3)2, Cu(NO3)2 và FeCO3 trong bình chân không, thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 22,8 (giả sử khí NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch chứa đồng thời 0,08 mol KNO3 và 0,68 mol \(H_2SO_4\) (loãng), thu được dung dịch chỉ chứa 98,36 gam muối trung hòa của các kim loại và hỗn hợp khí T gồm NO và H2. Tỉ khối của T so với H2 là 12,2. Biết các phản ứng xảy ra hoàn toàn. giá trị của m gần nhất với giá trị nào sau đây?
-
A.
60,72.
-
B.
60,74.
-
C.
60,73.
-
D.
60,75
Đáp án : D
Quy đổi hỗn hợp X thành Fe, Cu, NO3 và CO3
Đặt số mol của NO3 là x và của CO3 là y
→nNO2 =x và nCO2 = y mol
Bảo toàn nguyên tố H có 2nO + 2nH2 + 4nNO = 2nH2SO4 => nO =?
mCu + mFe + mK + mSO4 = mmuối → mCu + mFe = ?
Từ đó tìm được x, y
→ hỗn hợp ban đầu có m = mCu + mFe + mNO3 + mCO3 =?
Quy đổi hỗn hợp X thành Fe, Cu, NO3 và CO3
Đặt số mol của NO3 là x và của CO3 là y
Đốt chaý X thì NO3 → NO2 + O
CO3 → CO2 + O
→nNO2 =x và nCO2 = y mol
Khí Z có NO2 và CO2, không có O vì O sinh ra phản ứng trở lại với các kim loại Cu, Fe
Y có Cu : z mol , Fe : t mol và O
Ta có nO(Y) = x + y(1)
Vì hỗn hợp khí Z có tỉ khổi so với H2 là 22,8 nên \(\dfrac{{46x + 44y}}{{x + y}} = 22,8.2 = 45,6 \to x = 4y\)(2)
Y + KNO3 + H2SO4 → khí NO và H2
→ NO3- phản ứng hết nên nNO =nNO3- = 0,08 mol ( = nKNO3)
Xét khí T có \(\begin{array}{l}{d_{T/{H_2}}} = \dfrac{{{M_T}}}{2} = \dfrac{{\dfrac{{2{n_{{H_2}}} + 30.0,08}}{{{n_{{H_2}}} + 0,08}}}}{2} = 12,2\\ \Rightarrow {n_{{H_2}}}=0,02\end{array}\)
PTHH 2H+ + O +2e → H2O
4H+ + 3e + NO3- → H2O + NO
2H+ +2e → H2
Bảo toàn nguyên tố H có 2nO + 2nH2 + 4nNO = 2nH2SO4 → 2nO + 2.0,02 + 4.0,08 = 2.0,68
→ nO = 0,5 mol(3)
Ta có mCu + mFe + mK + mSO4 = mmuối → mCu + mFe + 0,68.96 +0,08.39 = 98,36
→ mCu + mFe = 29,96
Từ (1) (2) và (3) tính được x = 0,4 mol và y = 0,1 mol
→ hỗn hợp ban đầu có m = mCu + mFe + mNO3 + mCO3 = 29,96 + 0,4.62 + 0,1.60= 60,76 g
Luyện tập và củng cố kiến thức Ôn tập chương 7t Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 36. Sơ lược về một số kim loại khác Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 35. Đồng và hợp chất của đồng Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 34. Crom và hợp chất của crom (tiếp) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 34. Crom và hợp chất của crom Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 33. Quy đổi sắt Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 33. Hợp kim của sắt Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 32. Hợp chất của sắt Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 31. Sắt Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận