Trắc nghiệm Bài 18. Dãy điện hóa kim loại - Hóa 12
Đề bài
Dãy nào dưới đây gồm các kim loại sắp xếp theo chiều tăng dần tính oxi hóa ?
-
A.
Na+ < Mn2+ < Al3+ < Fe3+ < Cu2+.
-
B.
Na+ < Al3+ < Mn2+ < Cu2+ < Fe3+.
-
C.
Na+ < Al3+ <Mn2+ < Fe3+ < Cu2+.
-
D.
Na+ < Al3+ < Fe3+ < Mn2+ < Cu2+.
Dãy các ion xếp theo chiều giảm dần tính oxi hóa là
-
A.
Ag+, Cu2+, Fe3+, Fe2+.
-
B.
Fe3+, Cu2+, Ag+, Fe2+.
-
C.
Ag+, Fe3+, Cu2+, Fe2+.
-
D.
Fe3+, Ag+, Cu2+, Fe2+.
Cho phản ứng hóa học : Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
-
A.
sự khử Fe2+ và sự oxi hóa Cu.
-
B.
sự khử Fe2+ và sự khử Cu2+
-
C.
sự oxi hóa Fe và sự oxi hóa Cu.
-
D.
sự oxi hóa Fe và sự khử Cu2+.
Trong quá trình hoạt động của pin điện hoá Cu-Ag nồng độ của các ion trong dung dịch biến đổi như thế nào ?
-
A.
Nồng độ ion Ag+ tăng dần và nồng độ Cu2+ tăng dần
-
B.
Nồng độ ion Ag+ giảm dần và nồng độ Cu2+ giảm dần
-
C.
Nồng độ ion Ag+ tăng dần và nồng độ Cu2+ giảm dần
-
D.
Nồng độ ion Ag+ giảm dần và nồng độ Cu2+ tăng dần
Trong pin điện hóa Cu-Ag tại điện cực đồng xảy ra quá trình:
-
A.
Oxi hóa H2O.
-
B.
Khử Cu2+
-
C.
Khử H2O
-
D.
Oxi hóa Cu
Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Ta thấy
-
A.
điện cực Cu xảy ra quá trình khử.
-
B.
điện cực Zn tăng còn khối lượng điện cực Cu giảm.
-
C.
điện cực Cu xảy ra sự oxi hoá.
-
D.
điện cực Zn xảy ra sự khử.
Trong cầu muối của pin điện hóa Zn-Cu có sự di chuyển của:
-
A.
các ion
-
B.
các electron
-
C.
các nguyên tử Zn
-
D.
các nguyên tử Cu
Cho suất điện động của các pin điện hóa: Eo(Fe-Cu) = 0,78V; Eo(Cu-Ag) = 0,46V. Suất điện động của pin Fe - Ag là:
-
A.
0,8V
-
B.
0,34V
-
C.
1,24V
-
D.
0,44V
Cho biết thế điện cực chuẩn của các cặp oxi hóa - khử Mg2+/Mg ; Zn2+/Zn ; Cu2+/Cu ; Ag+/Ag ; Hg2+/Hg lần lượt là –2,37 V; –0,76 V ; 0,34 V ; 0,8 V và 0,85 V. E0(pin) = 3,22 V là suất điện động chuẩn của pin nào trong số các pin sau ?
-
A.
Zn – Ag
-
B.
Mg – Zn
-
C.
Zn – Hg
-
D.
Mg – Hg
Cho thế điện cực của các cặp oxi hóa khử: ${{E}^{o}}_{Z{{n}^{2+}}/Zn}$ = -0,76V; ${{E}^{o}}_{F{{e}^{2+}}/Fe}$= -0,44V; ${{E}^{o}}_{P{{b}^{2+}}/Pb}$= -0,13V; ${{E}^{o}}_{A{{g}^{+}}/Ag}$ = 0,8V. Pin điện hóa nào sau đây có suất điện động tiêu chuẩn lớn nhất ?
-
A.
Zn – Fe.
-
B.
Zn – Pb.
-
C.
Pb – Ag.
-
D.
Fe – Ag.
Cho các phản ứng xảy ra sau đây :
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
(2) Mn + 2HCl → MnCl2 + H2↑
Dãy các ion được sắp xếp theo chiều tăng dần tính oxi hoá là
-
A.
Ag+, Mn2+, H+, Fe3+.
-
B.
Mn2+, H+, Ag+, Fe3+.
-
C.
Ag+, Fe3+, H+, Mn2+
-
D.
Mn2+, H+, Fe3+, Ag+.
Cho 2 phản ứng sau :
Cu + 2FeCl3 →CuCl2 + 2FeCl2 (1)
Fe + CuCl2 → FeCl2 + Cu (2)
Kết luận nào dưới đây là đúng ?
-
A.
Tính oxi hoá của Cu2+ > Fe3+ > Fe2+
-
B.
Tính oxi hoá của Fe3+ > Cu2+ > Fe2+.
-
C.
Tính khử của Cu > Fe2+ > Fe
-
D.
Tính khử của Fe2+ > Fe > Cu.
Phản ứng nào dưới đây không xảy ra :
-
A.
Ni + Fe2+ → Ni2+ + Fe.
-
B.
Mg + Cu2+ → Mg2+ + Cu.
-
C.
Pb + 2Ag+ → Pb2+ + 2Ag.
-
D.
Fe + Pb2+ → Fe2+ + Pb.
Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2, Al2(SO4)3. Kim loại khử được cả 4 dung dịch muối đã cho là
-
A.
Fe.
-
B.
Mg.
-
C.
Al.
-
D.
Cu.
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy điện hoá : Fe3+/Fe2+ đứng trước Ag+/Ag)
-
A.
Ag, Mg.
-
B.
Cu, Fe.
-
C.
Fe, Cu.
-
D.
Mg, Ag.
Mệnh đề không đúng là
-
A.
Fe khử được Cu2+ trong dung dịch.
-
B.
Fe3+ có tính oxi hóa mạnh hơn Cu2+.
-
C.
Fe2+ oxi hóa được Cu.
-
D.
Tính oxi hóa của các ion tăng theo thứ tự: Fe2+, H+, Cu2+, Ag+.
Cho dung dịch ZnSO4 có lẫn tạp chất là dung dịch CuSO4. Hóa chất có thể dùng để loại bỏ tạp chất là
-
A.
Cu dư, lọc.
-
B.
Zn dư, lọc.
-
C.
Fe dư, lọc.
-
D.
Al dư, lọc.
Một tấm vàng kim loại bị bám một lớp Fe ở bề mặt. Ta có thể rửa lớp Fe để loại tạp chất bằng dung dịch
-
A.
CuSO4 dư.
-
B.
FeSO4 dư.
-
C.
FeCl3.
-
D.
ZnSO4 dư.
Có dung dịch FeSO4 lẫn tạp chất là CuSO4. Để có thể thu được dung dịch chỉ chứa FeSO4 có thể dùng phương pháp hóa học đơn giản là
-
A.
Dùng Zn để khử ion Cu2+ trong dung dịch thành Cu không tan.
-
B.
Dùng Al để khử ion Cu2+ trong dung dịch thành Cu không tan.
-
C.
Dùng Mg để khử ion Cu2+ trong dung dịch thành Cu không tan.
-
D.
Dùng Fe để khử ion Cu2+ trong dung dịch thành Cu không tan.
Ngâm lá niken vào các dung dịch muối sau : MgSO4, NaCl, CuSO4, AlCl3, ZnCl2, Pb(NO3)2. Các dung dịch có xảy ra phản ứng là
-
A.
MgSO4, CuSO4.
-
B.
AlCl3, Pb(NO3)2.
-
C.
ZnCl2, Pb(NO3)2.
-
D.
CuSO4, Pb(NO3)2.
Cho Zn dư vào dung dịch AgNO3, Cu(NO3)2, Fe(NO3)3. Số phản ứng hoá học xảy ra là:
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Nhúng một lá sắt nhỏ vào dung dịch chứa một trong những hoá chất sau : FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, AgNO3, H2SO4 (đặc, nóng, dư), NaNO3. Số trường hợp phản ứng tạo ra muối Fe (II) là
-
A.
5.
-
B.
3.
-
C.
4.
-
D.
6.
Thực hiện các thí nghiệm sau :
(1) Cho lượng dư kim loại Fe vào dung dịch HNO3.
(2) Cho dung dịch Fe(NO3)2 vào dung dịch HCl.
(3) Cho lượng dư kim loại Fe vào dung dịch AgNO3.
(4) Cho lượng dư dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(5) Cho dung dịch (KMnO4, H2SO4) vào dung dịch FeSO4.
(6) Cho dung dịch (K2Cr2O7, H2SO4) vào dung dịch FeSO4.
Những thí nghiệm sau khi kết thúc thu được sản phẩm muối sắt (III) là
-
A.
2, 4, 5, 6.
-
B.
1, 2, 3, 4.
-
C.
1, 4, 5, 6.
-
D.
1, 3, 5, 6.
Cho các phát biểu sau :
(1) Các kim loại kiềm đều tan tốt trong nước.
(2) Các kim loại Mg, Fe, K và Al chỉ điều chế được bằng phương pháp điện phân nóng chảy.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Khi cho Al vào dung dịch FeCl3 dư thu được kim loại Fe.
Số phát biểu đúng là
-
A.
4.
-
B.
3.
-
C.
2.
-
D.
1.
Phản ứng giữa các cặp chất nào sau đây không tạo ra kim loại?
-
A.
Fe + CuSO4.
-
B.
AgNO3 + Fe(NO3)2
-
C.
Cu + AgNO3.
-
D.
Cu + FeCl3.
Phản ứng giữa hai chất nào sau đây có thể xảy ra trong dung dịch?
-
A.
Fe + ZnCl2.
-
B.
Mg + NaCl
-
C.
Fe + Cu(NO3)2.
-
D.
Al + MgSO4
Cho các kim loại: Au, Al, Cu, Ag, Zn. Số kim loại tác dụng được với dung dịch H2SO4 loãng là
-
A.
4
-
B.
3
-
C.
5
-
D.
2
Thực nghiệm cho thấy Cu tác dụng được với dung dịch FeCl3 theo phương trình hoá học: Cu + 2 FeCl3 → 2FeCl2 + CuCl2. Như vậy,
-
A.
ion Fe3+ có tính khử mạnh hơn ion Fe2+.
-
B.
ion Fe3+ có tính oxi hoá yếu hơn ion Cu2+.
-
C.
ion Fe2+ có tính oxi hoá mạnh hơn ion Fe3+.
-
D.
ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+.
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag)
-
A.
Fe, Cu.
-
B.
Ag, Mg.
-
C.
Mg, Ag.
-
D.
Cu, Fe.
Cho hỗn hợp Al, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 được dung dịch X và chất rắn Y gồm 3 kim loại. Chất rắn Y gồm
-
A.
Al, Fe, Cu.
-
B.
Fe, Cu, Ag.
-
C.
Al, Cu, Ag.
-
D.
Al, Fe, Ag.
Hỗn hợp X gồm 3 kim loại: Fe, Ag, Cu. Cho X vào dung dịch Y chỉ chứa 1 chất tan, khuấy kĩ cho đến khi phản ứng kết thúc thấy Fe và Cu tan hết và còn lại Ag không tan đúng bằng lượng Ag vốn có trong hỗn hợp X. Chất tan trong dung dịch Y là
-
A.
AgNO3.
-
B.
Cu(NO3)2.
-
C.
Fe2(SO4)3.
-
D.
FeSO4.
Cho Fe tác dụng với dung dịch AgNO3 dư thu được dung dịch X. Cho Cu dư vào dung dịch X thu được dung dịch Y. Dung dịch Y chứa
-
A.
Fe(NO3)2
-
B.
Fe(NO3)3
-
C.
Fe(NO3)2 và Cu(NO3)2
-
D.
Fe(NO3)3 và AgNO3
Dung dịch Fe2(SO4)3 tác dụng với lượng dư kim loại nào tạo dung dịch chứa hai muối?
-
A.
Fe
-
B.
Zn
-
C.
Cu
-
D.
Ag
Lời giải và đáp án
Dãy nào dưới đây gồm các kim loại sắp xếp theo chiều tăng dần tính oxi hóa ?
-
A.
Na+ < Mn2+ < Al3+ < Fe3+ < Cu2+.
-
B.
Na+ < Al3+ < Mn2+ < Cu2+ < Fe3+.
-
C.
Na+ < Al3+ <Mn2+ < Fe3+ < Cu2+.
-
D.
Na+ < Al3+ < Fe3+ < Mn2+ < Cu2+.
Đáp án : B
xem lại dãy điện hóa của kim loại
Theo dãy điện hóa, sắp xếp tính oxi hóa tăng dần : Na+ < Al3+ < Mn2+ < Cu2+ < Fe3+
Dãy các ion xếp theo chiều giảm dần tính oxi hóa là
-
A.
Ag+, Cu2+, Fe3+, Fe2+.
-
B.
Fe3+, Cu2+, Ag+, Fe2+.
-
C.
Ag+, Fe3+, Cu2+, Fe2+.
-
D.
Fe3+, Ag+, Cu2+, Fe2+.
Đáp án : C
xem lại dãy điện hóa của kim loại
Theo dãy điện hóa, dãy các ion xếp theo chiều giảm dần tính oxi hóa là Ag+, Fe3+, Cu2+, Fe2+
Cho phản ứng hóa học : Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
-
A.
sự khử Fe2+ và sự oxi hóa Cu.
-
B.
sự khử Fe2+ và sự khử Cu2+
-
C.
sự oxi hóa Fe và sự oxi hóa Cu.
-
D.
sự oxi hóa Fe và sự khử Cu2+.
Đáp án : D
xem lại khái niệm chất oxi hóa – khử
Quá trình nhường electron là sự oxi hóa, quá trình nhận electron là sự khử
Fe + CuSO4 → FeSO4 + Cu
$Fe\,\,\,\to \,\,\,F{{e}^{2+}}+2e$ (sự oxi hóa)
$C{{u}^{2+}}+2e\,\,\to \,\,Cu$ (sự khử)
Trong quá trình hoạt động của pin điện hoá Cu-Ag nồng độ của các ion trong dung dịch biến đổi như thế nào ?
-
A.
Nồng độ ion Ag+ tăng dần và nồng độ Cu2+ tăng dần
-
B.
Nồng độ ion Ag+ giảm dần và nồng độ Cu2+ giảm dần
-
C.
Nồng độ ion Ag+ tăng dần và nồng độ Cu2+ giảm dần
-
D.
Nồng độ ion Ag+ giảm dần và nồng độ Cu2+ tăng dần
Đáp án : D
Quá trình hoạt động của pin Cu-Ag :
Cu → Cu2+ + 2e => tăng nồng độ ion Cu2+
Ag+ + 1e → Ag => giảm nồng độ ion Ag+
Trong pin điện hóa Cu-Ag tại điện cực đồng xảy ra quá trình:
-
A.
Oxi hóa H2O.
-
B.
Khử Cu2+
-
C.
Khử H2O
-
D.
Oxi hóa Cu
Đáp án : D
xem lại lí thuyết dãy điện hóa của kim loại
Quá trình hoạt động của pin Cu-Ag :
Cu → Cu2+ + 2e (sự oxi hóa)
Ag+ + 1e → Ag (sự khử)
Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Ta thấy
-
A.
điện cực Cu xảy ra quá trình khử.
-
B.
điện cực Zn tăng còn khối lượng điện cực Cu giảm.
-
C.
điện cực Cu xảy ra sự oxi hoá.
-
D.
điện cực Zn xảy ra sự khử.
Đáp án : A
xem lại lí thuyết dãy điện hóa của kim loại
Trong pin điện hóa Zn-Cu xảy ra quá trình :
Zn → Zn2+ + 2e (sự oxi hóa, làm thanh Zn bị mòn đi)
Cu2+ + 2e → Cu (sự khử, làm thanh Cu dày lên)
Trong cầu muối của pin điện hóa Zn-Cu có sự di chuyển của:
-
A.
các ion
-
B.
các electron
-
C.
các nguyên tử Zn
-
D.
các nguyên tử Cu
Đáp án : A
Để duy trì được dòng điện trong quá trình hoạt động của pin điện hóa, người ta dùng cầu muối. Vai trò của cầu muối là trung hòa điện tích của 2 dung dịch: các ion dương Na+ hoặc K+ và Zn2+ di chuyển qua cầu muối đến cốc đựng dung dịch CuSO4. Ngược lại, các ion âm SO42- hoặc NO3- di chuyển qua cầu muối đến dung dịch ZnSO4 (xem lại lí thuyết dãy điện hóa kim loại)
Cho suất điện động của các pin điện hóa: Eo(Fe-Cu) = 0,78V; Eo(Cu-Ag) = 0,46V. Suất điện động của pin Fe - Ag là:
-
A.
0,8V
-
B.
0,34V
-
C.
1,24V
-
D.
0,44V
Đáp án : C
Công thức tính suất điện động của pin : Eopin = Eo(+) – Eo(-)
Công thức tính suất điện động của pin : Eopin = Eo(+) – Eo(-)
$\to {{E}^{o}}_{Fe-Cu}~={{E}^{o}}_{C{{u}^{2+}}/Cu}\,\,\text{ }-{{E}^{o}}_{F{{e}^{2+}}/Fe}~\text{ }\, và \,\,\,\, {{E}^{o}}_{Cu-Ag}~=\text{ }{{E}^{o}}_{A{{g}^{+}}/Ag}\,\,-{{E}^{o}}_{C{{u}^{2+}}/Cu}~\text{ }$
$\to {{E}^{o}}_{Fe-Ag}~=\text{ }{{E}^{o}}_{A{{g}^{+}}/Ag}\,\,-{{E}^{o}}_{F{{e}^{2+}}/Fe}~\text{ }$
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,=\text{ }{{E}^{o}}_{A{{g}^{+}}/Ag}\,\text{ }-{{E}^{o}}_{C{{u}^{2+}}/Cu}+{{E}^{o}}_{C{{u}^{2+}}/Cu}-{{E}^{o}}_{F{{e}^{2+}}/Fe}~\,\,$
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,={{E}^{o}}_{Cu-Ag}\,+{{E}^{o}}_{Fe-Cu}$
$\to {{E}^{o}}_{Fe-Ag}$= 0,46 + 0,78 = 1,24 V
Cho biết thế điện cực chuẩn của các cặp oxi hóa - khử Mg2+/Mg ; Zn2+/Zn ; Cu2+/Cu ; Ag+/Ag ; Hg2+/Hg lần lượt là –2,37 V; –0,76 V ; 0,34 V ; 0,8 V và 0,85 V. E0(pin) = 3,22 V là suất điện động chuẩn của pin nào trong số các pin sau ?
-
A.
Zn – Ag
-
B.
Mg – Zn
-
C.
Zn – Hg
-
D.
Mg – Hg
Đáp án : D
Công thức tính suất điện động của pin : Eopin = Eo(+) – Eo(-)
Ta có: ${{E}^{o}}_{Zn-Ag}~=\text{ }{{E}^{o}}_{A{{g}^{+}}/Ag}\text{ }-{{E}^{o}}_{Z{{n}^{2+}}/Zn}~\,\,=0,8\left( -0,76 \right)=1,56\text{ }V$
${{E}^{o}}_{Mg-Zn}~=\text{ }{{E}^{o}}_{Z{{n}^{2+}}/Zn}\text{ }-{{E}^{o}}_{M{{g}^{2+}}/Mg}~\,\,=-\text{ }0,76\left( -2,37 \right)=1,61\text{ }V$
${{E}^{o}}_{Zn-Hg}~=\text{ }{{E}^{o}}_{H{{g}^{2+}}/Hg}\text{ }-{{E}^{o}}_{Z{{n}^{2+}}/Zn}~\,\,=0,85\left( 0,76 \right)=1,61\text{ }V$
${{E}^{o}}_{Mg-Hg}~=\text{ }{{E}^{o}}_{H{{g}^{2+}}/Hg}\text{ }-{{E}^{o}}_{M{{g}^{2+}}/Mg}~\,\,=0,85\left( 2,37 \right)=3,22\text{ }V$
Cho thế điện cực của các cặp oxi hóa khử: ${{E}^{o}}_{Z{{n}^{2+}}/Zn}$ = -0,76V; ${{E}^{o}}_{F{{e}^{2+}}/Fe}$= -0,44V; ${{E}^{o}}_{P{{b}^{2+}}/Pb}$= -0,13V; ${{E}^{o}}_{A{{g}^{+}}/Ag}$ = 0,8V. Pin điện hóa nào sau đây có suất điện động tiêu chuẩn lớn nhất ?
-
A.
Zn – Fe.
-
B.
Zn – Pb.
-
C.
Pb – Ag.
-
D.
Fe – Ag.
Đáp án : D
Công thức tính suất điện động của pin : Eopin = Eo(+) – Eo(-)
Ta có: ${{E}^{o}}_{Zn-Fe}~=\text{ }{{E}^{o}}_{F{{e}^{2+}}/Fe}\text{ }-{{E}^{o}}_{Z{{n}^{2+}}/Zn}~\,\,=$ – 0,44 – (– 0,76) = 0,32 V
${{E}^{o}}_{Zn-Pb}~=\text{ }{{E}^{o}}_{P{{b}^{2+}}/Pb}\text{ }-{{E}^{o}}_{Z{{n}^{2+}}/Zn}~\,\,=$ – 0,13 – ( – 0,76) = 0,63 V
${{E}^{o}}_{Pb-Ag}~=\text{ }{{E}^{o}}_{A{{g}^{+}}/Ag}~\,-{{E}^{o}}_{P{{b}^{2+}}/Pb}\text{ }\,=$ 0,8 – 0,13 = 0,67 V
${{E}^{o}}_{Fe-Ag}~=\text{ }{{E}^{o}}_{A{{g}^{+}}/Ag}~-{{E}^{o}}_{F{{e}^{2+}}/Fe}\text{ }\,\,=$ 0,8 – (– 0,44 ) = 1,24 V
=> Pin Fe- Ag có suất điện động tiêu chuẩn lớn nhất
Cho các phản ứng xảy ra sau đây :
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
(2) Mn + 2HCl → MnCl2 + H2↑
Dãy các ion được sắp xếp theo chiều tăng dần tính oxi hoá là
-
A.
Ag+, Mn2+, H+, Fe3+.
-
B.
Mn2+, H+, Ag+, Fe3+.
-
C.
Ag+, Fe3+, H+, Mn2+
-
D.
Mn2+, H+, Fe3+, Ag+.
Đáp án : D
dựa vào phản ứng xác định ion nào có tính oxi hóa mạnh hơn rồi sắp xếp
KL mạnh + chất oxi hóa mạnh => KL yếu + chất oxi hóa yếu
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
→ tính oxi hóa của Fe3+ < Ag+
(2) Mn + 2HCl → MnCl2 + H2↑
→ tính oxi hóa của Mn2+ < H+
Cho 2 phản ứng sau :
Cu + 2FeCl3 →CuCl2 + 2FeCl2 (1)
Fe + CuCl2 → FeCl2 + Cu (2)
Kết luận nào dưới đây là đúng ?
-
A.
Tính oxi hoá của Cu2+ > Fe3+ > Fe2+
-
B.
Tính oxi hoá của Fe3+ > Cu2+ > Fe2+.
-
C.
Tính khử của Cu > Fe2+ > Fe
-
D.
Tính khử của Fe2+ > Fe > Cu.
Đáp án : B
dựa vào phản ứng xác định ion nào có tính oxi hóa mạnh hơn rồi sắp xếp
KL mạnh + chất oxi hóa mạnh => KL yếu + chất oxi hóa yếu
Fe + CuCl2 → FeCl2 + Cu → tính oxi hóa của ion Cu2+ > Fe2+
Cu + 2FeCl3 → CuCl2 + 2FeCl2 → tính oxi hóa của ion Fe3+ > Cu2+
→ Dãy sắp xếp tính oxi hóa giảm dần là Fe3+ > Cu2+ > Fe2+
Phản ứng nào dưới đây không xảy ra :
-
A.
Ni + Fe2+ → Ni2+ + Fe.
-
B.
Mg + Cu2+ → Mg2+ + Cu.
-
C.
Pb + 2Ag+ → Pb2+ + 2Ag.
-
D.
Fe + Pb2+ → Fe2+ + Pb.
Đáp án : A
Vì tính khử của kim loại Fe mạnh hơn Ni → ta có phương trình :
Fe + Ni2+ → Fe2+ + Ni
Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2, Al2(SO4)3. Kim loại khử được cả 4 dung dịch muối đã cho là
-
A.
Fe.
-
B.
Mg.
-
C.
Al.
-
D.
Cu.
Đáp án : B
Mg là kim loại mạnh hơn những kim loại trong muối → Mg khử được cả 4 dung dịch muối
Phương trình phản ứng
Mg + ZnSO4 → MgSO4 + Zn
Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
Mg + CuCl2 → MgCl2 + Cu
3Mg + Al2(SO4)3 → 3MgSO4 + 2Al
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy điện hoá : Fe3+/Fe2+ đứng trước Ag+/Ag)
-
A.
Ag, Mg.
-
B.
Cu, Fe.
-
C.
Fe, Cu.
-
D.
Mg, Ag.
Đáp án : C
Sử dụng dãy điện hóa
X là kim loại phản ứng được với dung dịch H2SO4 → X có tính khử mạnh hơn H+ trong dãy điện hóa
→ loại đáp án A và B
Y là kim loại tác dụng được với dung dịch Fe(NO3)3 → Y có tính khử mạnh hơn Fe3+ trong dãy điện hóa
→ loại đáp án D
Phương trình phản ứng :
Fe + H2SO4 → FeSO4 + H2
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Mệnh đề không đúng là
-
A.
Fe khử được Cu2+ trong dung dịch.
-
B.
Fe3+ có tính oxi hóa mạnh hơn Cu2+.
-
C.
Fe2+ oxi hóa được Cu.
-
D.
Tính oxi hóa của các ion tăng theo thứ tự: Fe2+, H+, Cu2+, Ag+.
Đáp án : C
xem lại lí thuyết dãy điện hóa kim loại
A đúng vì cặp Fe2+/Fe đứng trước Cu2+/Cu
B đúng vì cặp Fe3+/Fe2+ đứng sau cặp Fe2+/fe
C sai vì Fe2+/Fe đứng trước Cu2+/Cu nên Cu không đẩy được Fe2+ ra khỏi dung dịch
D đúng (xem lại dãy điện hóa kim loại)
Cho dung dịch ZnSO4 có lẫn tạp chất là dung dịch CuSO4. Hóa chất có thể dùng để loại bỏ tạp chất là
-
A.
Cu dư, lọc.
-
B.
Zn dư, lọc.
-
C.
Fe dư, lọc.
-
D.
Al dư, lọc.
Đáp án : B
KL mạnh đẩy KL yếu ra khỏi dung dịch muối
A sai vì Cu không phản ứng với tạp chất
B đúng vì Zn phản ứng được với CuSO4, dung dịch thu được chỉ gồm ZnSO4
Zn + CuSO4 → ZnSO4 + Cu
C sai vì Fe phản ứng được với CuSO4 nhưng dung dịch thu được lẫn FeSO4
D sai vì Al phản ứng được với CuSO4 nhưng dung dịch thu được lẫn Al2(SO4)3
Một tấm vàng kim loại bị bám một lớp Fe ở bề mặt. Ta có thể rửa lớp Fe để loại tạp chất bằng dung dịch
-
A.
CuSO4 dư.
-
B.
FeSO4 dư.
-
C.
FeCl3.
-
D.
ZnSO4 dư.
Đáp án : C
A sai vì CuSO4 tác dụng với Fe tạo muối CuSO4 tan nhưng tạo thành kim loại Cu bám vào tấm vàng.
B sai vì FeSO4 không tác dụng với Fe
C đúng vì FeCl3 tác dụng với Fe tạo ra muối FeCl2 tan và không tạo thành kim loại khác bám vào
Phương trình phản ứng : Fe +2FeCl3 → 3FeCl2
D sai vì ZnSO4 không tác dụng với Fe
Có dung dịch FeSO4 lẫn tạp chất là CuSO4. Để có thể thu được dung dịch chỉ chứa FeSO4 có thể dùng phương pháp hóa học đơn giản là
-
A.
Dùng Zn để khử ion Cu2+ trong dung dịch thành Cu không tan.
-
B.
Dùng Al để khử ion Cu2+ trong dung dịch thành Cu không tan.
-
C.
Dùng Mg để khử ion Cu2+ trong dung dịch thành Cu không tan.
-
D.
Dùng Fe để khử ion Cu2+ trong dung dịch thành Cu không tan.
Đáp án : D
KL mạnh đẩy KL yếu ra khỏi dung dịch muối
A, B, C sai vì dùng Zn hoặc Al, Mg khử ion Cu2+ thì sau phản ứng trong dung dịch lẫn muối Zn2+ hoặc Al3+, Mg2+.
Để loại bỏ CuSO4 ra khỏi FeSO4 mà không làm ảnh hưởng tới FeSO4 thì ta cho Fe vào
Fe + CuSO4 → FeSO4 + Cu
Ngâm lá niken vào các dung dịch muối sau : MgSO4, NaCl, CuSO4, AlCl3, ZnCl2, Pb(NO3)2. Các dung dịch có xảy ra phản ứng là
-
A.
MgSO4, CuSO4.
-
B.
AlCl3, Pb(NO3)2.
-
C.
ZnCl2, Pb(NO3)2.
-
D.
CuSO4, Pb(NO3)2.
Đáp án : D
KL mạnh đẩy KL yếu ra khỏi dung dịch muối
Ni tác dụng được với các muối của kim loại yếu hơn → các dung dịch có phản ứng là CuSO4, Pb(NO3)2
Phương trình phản ứng
Ni + CuSO4 → NiSO4 + Cu
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb
Cho Zn dư vào dung dịch AgNO3, Cu(NO3)2, Fe(NO3)3. Số phản ứng hoá học xảy ra là:
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : D
KL mạnh đẩy KL yếu ra khỏi dung dịch muối
Phương trình phản ứng
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Zn + 2Fe(NO3)3 → Zn(NO3)2 + 2Fe(NO3)2
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Zn + Fe(NO3)2 → Zn(NO3)2 + Fe
Nhúng một lá sắt nhỏ vào dung dịch chứa một trong những hoá chất sau : FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, AgNO3, H2SO4 (đặc, nóng, dư), NaNO3. Số trường hợp phản ứng tạo ra muối Fe (II) là
-
A.
5.
-
B.
3.
-
C.
4.
-
D.
6.
Đáp án : C
KL mạnh đẩy KL yếu ra khỏi dung dịch muối
Số phản ứng tạo muối Fe (II) là FeCl3, CuSO4, Pb(NO3)2, AgNO3
Thực hiện các thí nghiệm sau :
(1) Cho lượng dư kim loại Fe vào dung dịch HNO3.
(2) Cho dung dịch Fe(NO3)2 vào dung dịch HCl.
(3) Cho lượng dư kim loại Fe vào dung dịch AgNO3.
(4) Cho lượng dư dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(5) Cho dung dịch (KMnO4, H2SO4) vào dung dịch FeSO4.
(6) Cho dung dịch (K2Cr2O7, H2SO4) vào dung dịch FeSO4.
Những thí nghiệm sau khi kết thúc thu được sản phẩm muối sắt (III) là
-
A.
2, 4, 5, 6.
-
B.
1, 2, 3, 4.
-
C.
1, 4, 5, 6.
-
D.
1, 3, 5, 6.
Đáp án : A
Phương trình phản ứng :
(1) 3Fedư + 8HNO3 → 3Fe(NO3)2 + NO + H2O
(2) $3F{{e}^{2+}}+4{{H}^{+}}+NO_{3}^{-}\xrightarrow{{}}\,\,3F{{e}^{3+}}+\,\,NO\,\,+\,\,2{{H}_{2}}O$
(3) Fedư + 2AgNO3 → Fe(NO3)2 + 2Ag
(4) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
(5) 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
(6) 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
→ những thí nghiệm sau khi kết thúc thu được sản phẩm muối sắt (III) là (2), (4), (5), (6).
Cho các phát biểu sau :
(1) Các kim loại kiềm đều tan tốt trong nước.
(2) Các kim loại Mg, Fe, K và Al chỉ điều chế được bằng phương pháp điện phân nóng chảy.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Khi cho Al vào dung dịch FeCl3 dư thu được kim loại Fe.
Số phát biểu đúng là
-
A.
4.
-
B.
3.
-
C.
2.
-
D.
1.
Đáp án : D
KL mạnh đẩy KL yếu ra khỏi dung dịch muối
KL kiềm phản ứng với nước
(1) đúng
(2) sai vì Fe có thể điều chế bằng điện phân dung dịch
(3) sai K không khử được Ag+ trong dung dịch vì
2K + 2H2O → 2KOH + H2
2OH- + 2Ag+ → Ag2O + H2O
(4) sai vì FeCl3 dư : Al + 3FeCl3 → AlCl3 + 3FeCl2
Phản ứng giữa các cặp chất nào sau đây không tạo ra kim loại?
-
A.
Fe + CuSO4.
-
B.
AgNO3 + Fe(NO3)2
-
C.
Cu + AgNO3.
-
D.
Cu + FeCl3.
Đáp án : D
Dựa vào dãy hoạt động hóa học của kim loại, kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch muối.
A. Fe + CuSO4 → FeSO4 + Cu↓
B. AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
C. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
D. Cu + 2FeCl3 → CuCl2 + 2FeCl2 => không thu được kim loại
Vị trí của cặp Fe3+/Fe2+ trong dãy điện hóa học
Phản ứng giữa hai chất nào sau đây có thể xảy ra trong dung dịch?
-
A.
Fe + ZnCl2.
-
B.
Mg + NaCl
-
C.
Fe + Cu(NO3)2.
-
D.
Al + MgSO4
Đáp án : C
A. Loại vì Fe đứng sau Zn trong dãy hoạt động hóa học của kim loại nên Fe không đẩy được Zn ra khỏi dung dịch muối của kẽm.
B. Loại vì chỉ từ kim loại Mg trở về sau trong dãy hoạt động hóa học của kim loại thì kim loại đứng trước mới đẩy được kim loại đứng sau ra khỏi dung dịch muối.
C. Thỏa mãn: PTHH: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
D. Loại vì Al đứng sau Mg trong dãy hoạt động hóa học.
Cho các kim loại: Au, Al, Cu, Ag, Zn. Số kim loại tác dụng được với dung dịch H2SO4 loãng là
-
A.
4
-
B.
3
-
C.
5
-
D.
2
Đáp án : D
Các kim loại tác dụng được với dung dịch H2SO4 là các kim loại đứng trước H trong dãy hoạt động hóa học của kim loại.
Các kim loại tác dụng được với dung dịch H2SO4 là các kim loại đứng trước H trong dãy hoạt động hóa học của kim loại.
Vậy các kim loại tác dụng được với dung dịch H2SO4 loãng là Al và Zn (có 2 kim loại).
Thực nghiệm cho thấy Cu tác dụng được với dung dịch FeCl3 theo phương trình hoá học: Cu + 2 FeCl3 → 2FeCl2 + CuCl2. Như vậy,
-
A.
ion Fe3+ có tính khử mạnh hơn ion Fe2+.
-
B.
ion Fe3+ có tính oxi hoá yếu hơn ion Cu2+.
-
C.
ion Fe2+ có tính oxi hoá mạnh hơn ion Fe3+.
-
D.
ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+.
Đáp án : D
Phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh tác dụng với chất khử mạnh tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
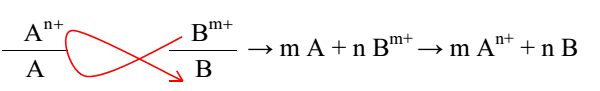
Dựa vào quy tắc α:
Phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh tác dụng với chất khử mạnh tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
Ta có:
Cu + 2 Fe3+ → 2Fe2+ + Cu2+
C.KH mạnh C.OXH mạnh C.KH yếu C.OXH yếu
Vậy ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag)
-
A.
Fe, Cu.
-
B.
Ag, Mg.
-
C.
Mg, Ag.
-
D.
Cu, Fe.
Đáp án : A
X là kim loại phản ứng được với dung dịch H2SO4 loãng nên X đứng trước H trong dãy hoạt động hóa học của kim loại.
Y là kim loại tác dụng được với dung dịch Fe(NO3)3 nên Y không thể là kim loại Ag.
Hai kim loại X, Y lần lượt là Fe, Cu vì:
Fe + H2SO4 loãng → FeSO4 + H2
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Cho hỗn hợp Al, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 được dung dịch X và chất rắn Y gồm 3 kim loại. Chất rắn Y gồm
-
A.
Al, Fe, Cu.
-
B.
Fe, Cu, Ag.
-
C.
Al, Cu, Ag.
-
D.
Al, Fe, Ag.
Đáp án : B
Dựa vào lí thuyết bài tính chất của kim loại, dãy điện hóa kim loại.
Al, Fe phản ứng với hai muối thu hai kim loại Cu, Ag
Al phản ứng với hai muối trước. Thu được ba kim loại → Fe dư
Sau phản ứng ba kim loại là Fe, Cu, Ag
Hỗn hợp X gồm 3 kim loại: Fe, Ag, Cu. Cho X vào dung dịch Y chỉ chứa 1 chất tan, khuấy kĩ cho đến khi phản ứng kết thúc thấy Fe và Cu tan hết và còn lại Ag không tan đúng bằng lượng Ag vốn có trong hỗn hợp X. Chất tan trong dung dịch Y là
-
A.
AgNO3.
-
B.
Cu(NO3)2.
-
C.
Fe2(SO4)3.
-
D.
FeSO4.
Đáp án : C
Ta thấy Fe và Cu tan hết và còn lại Ag không tan đúng bằng lượng Ag vốn có trong hỗn hợp X
→ Fe2(SO4)3 hòa tan được Cu, Fe.
Cho Fe tác dụng với dung dịch AgNO3 dư thu được dung dịch X. Cho Cu dư vào dung dịch X thu được dung dịch Y. Dung dịch Y chứa
-
A.
Fe(NO3)2
-
B.
Fe(NO3)3
-
C.
Fe(NO3)2 và Cu(NO3)2
-
D.
Fe(NO3)3 và AgNO3
Đáp án : C
\(Fe+ AgNO_3 \to Fe(NO_3)_2 + Ag\)
\(Fe(NO_3)_2+ AgNO_3 \to Fe(NO_3)_3 + Ag\)
Dung dịch X: Fe(NO3)3 và AgNO3
\(Cu + AgNO_3 \to Cu(NO_3)_2 +Ag\)
\(Cu + Fe(NO_3)_3 \to Cu(NO_3)_2 + Fe(NO_3)_2\)
→ Dung dịch Y: Fe(NO3)2 và Cu(NO3)2
Dung dịch Fe2(SO4)3 tác dụng với lượng dư kim loại nào tạo dung dịch chứa hai muối?
-
A.
Fe
-
B.
Zn
-
C.
Cu
-
D.
Ag
Đáp án : C
Đáp án A: Fe dư + Fe2(SO4)3 → FeSO4
Đáp án B: Zn dư + Fe2(SO4)3 → ZnSO4 + Fe
Đáp án C: Cu dư + Fe2(SO4)3 → FeSO4 + CuSO4
Đáp án D: Không phản ứng
Luyện tập và củng cố kiến thức Bài 20. Ăn mòn kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Điều chế kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Kim loại tác dụng với dung dịch muối (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Kim loại tác dụng với dung dịch muối (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Sự điện phân Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập sự điện phân 1 muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện phân hỗn hợp muối Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nhiệt luyện Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện phân hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập kim loại tác dụng với dung dịch muối hay và khó Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 5 Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 2) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit có tính oxi hóa (phần 1) Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Kim loại tác dụng với axit không có tính oxi hóa Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Lý thuyết chung về kim loại Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận