Trắc nghiệm Tổng hợp bài tập lý thuyết Vô cơ - Hóa 12
Đề bài
Cho các phát biểu sau:
(a) Thép là hợp kim của sắt chứa 2-5% khối lượng Cacbon
(b) Bột nhôm trộn với bột sắt (III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm
(c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
(d) Dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi khi nhiệt kế vỡ
(e) Khi làm thí nghiệm kim loại đồng tác dung với dung dịch HNO3, người ta nút ống nghiệm bằng bông tẩm dung dịch kiềm.
Số phát biểu đúng là:
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Cho các phát biểu sau:
(a) Để loại bỏ lớp cặn CaCO3 trong ấm đun nước, phích đựng nước nóng người ta có thể dùng giấm ăn.
(b) Để hàn gắn đường ray bị nứt, gãy người ta dùng hỗn hợp tecmit.
(c) Để bảo vệ nồi hơi bằng thép, người ta thường lót dưới đáy nồi hơi những tấm kim loại bằng kẽm.
(d) Hơp kim Na - K có nhiệt độ nóng chảy thấp, thường được dùng trong các thiết bị báo cháy.
(e) Để bảo quản thực phẩm nhất là rau quả tươi, người ta có thể dùng SO2.
Số phát biểu đúng là
-
A.
4
-
B.
2
-
C.
5
-
D.
3
Thực hiện các thí nghiệm sau:
(1) Cho Si vào dung dịch NaOH (dư).
(2) Điện phân dung dịch NaCl dư bằng điện cực trơ, không màng ngăn xốp.
(3) Cho khí H2S vào dung dịch chứa FeCl3.
(4) Dẫn luồng khí H2 qua ống sứ chứa CuO nung nóng.
(5) Cho bột Ni vào dung dịch FeCl3 dư.
Số thí nghiệm thu được đơn chất là
-
A.
5.
-
B.
3.
-
C.
2.
-
D.
4.
Cho Na, Zn, Fe, Cu, dung dịch Fe(NO3)3, dung dịch Cu(NO3)2, dung dịch AgNO3 lần lượt tác dụng với nhau đôi một. Số trường hợp xảy ra phản ứng ở điều kiện thường là
-
A.
9
-
B.
10
-
C.
11
-
D.
12
Cho các cặp chất (với tỉ lệ số mol tương ứng) như sau:
(a) Fe2O3 và Cu (1:1) (b) Fe và Cu (2:1) (c) Zn và Ag (1:1)
(d) Fe2(SO4)3 và Cu (1:1) (e) Cu và Ag (2:1) (g) FeCl3 và Cu (1:1)
Số cặp chất không tan hoàn toàn trong dung dịch HCl dư là
-
A.
3
-
B.
1
-
C.
2
-
D.
4
Có bao nhiêu chất trong các chất cho sau đây mà khi nung trong không khí đến khối lượng không đổi thu được chất rắn mới có khối lượng nhỏ hơn chất rắn ban đầu: NaHCO3, NaNO3, NH4Cl, I2, K2CO3, Fe, Fe(OH)3 và FeS2?
-
A.
4.
-
B.
6.
-
C.
3.
-
D.
5.
Cho các phát biểu sau:
(a) Cấu hình electron của nguyên tử crom (Z = 24) ở trạng thái cơ bản là [Ar]3d54s1.
(b) Các kim loại từ Cu về đầu dãy điện hóa đều tác dụng được với dung dịch muối sắt (III).
(c) Đinh thép để lâu ngày trong không khí ẩm bị gỉ chủ yếu do xảy ra hiện tượng ăn mòn điện hóa học.
(d) Khi thêm dung dịch NaOH vào dung dịch muối natriđicromat, dung dịch chuyển từ màu da cam sang màu vàng.
(e) Nước cứng là nước có chứa nhiều ion Cu2+, Zn2+.
(f) Nhôm, sắt, crom không tan trong HNO3 loãng, nguội.
Số phát biểu đúng là
-
A.
1
-
B.
3
-
C.
4
-
D.
2
Một học sinh làm thí nghiệm với dung dịch X đựng trong lọ không dán nhãn và thu được kết quả như sau:
X đều phản ứng với cả 3 dung dịch : NaHSO4 , Na2CO3, AgNO3
X không phản ứng với cả 3 dung dịch NaOH, Ba(NO3)2, HNO3
Vậy dung dịch X là dung dịch nào sau đây ?
-
A.
Mg(NO3)2
-
B.
CuSO4
-
C.
FeCl2
-
D.
BaCl2
Tiến hành các thí nghiệm sau :
(a) Cho dd AgNO3 vào dd HCl
(b) Cho Al2O3 vào dung dịch HCl loãng dư
(c) Cho Cu vào dung dịch HCl đặc nóng dư
(d) Cho Ba(OH)2 vào dung dịch KHCO3
Sau khi phản ứng kết thúc, số thí nghiệm thu được chất rắn là
-
A.
4
-
B.
2
-
C.
5
-
D.
3
Hòa tan hoàn toàn 2 chất rắn X, Y (số mol bằng nhau) vào nước thu được dung dịch Z. Tiến hành các thí nghiệm sau :
- Thí nghiệm 1 : Cho dung dịch NaOH dư vào V ml dung dịch Z thu được n1 mol kết tủa
- Thí nghiệm 2 : Cho dung dịch NH3 dư vào V ml dung dịch X thu được n2 mol kết tủa
- Thí nghiệm 3 : Cho dung dịch AgNO3 dư vào V ml dung dịch Z thu được n3 mol kết tủa
Biết các phản ứng xảy ra hoàn toàn và n1 = n2 < n3. Hai chất X, Y không thể là :
-
A.
ZnCl2 ; FeCl2
-
B.
Al(NO3)3 ; Fe(NO3)2
-
C.
FeCl2 ; FeCl3
-
D.
FeCl2 ; Al(NO3)3
Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu trắng không tan trong NaOH dư. Chất X là
-
A.
FeCl3.
-
B.
MgCl2.
-
C.
CuCl2.
-
D.
AlCl3.
Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl (điện cực trơ, có màng ngăn), thu được khí H2 ở anot.
(b) Cho a mol bột Fe vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được 2a mol Ag.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4 thì Zn bị ăn mòn điện hóa.
(d) Cho dung dịch FeCl3 vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được kết tủa gồm AgCl và Ag.
Số phát biểu đúng là
-
A.
2
-
B.
1
-
C.
3
-
D.
4
Cho hỗn hợp rắn gồm Na2O, BaO, NaHCO3, Al2O3 và NH4Cl có cùng số mol vào nước dư. Kết thúc các phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan là
-
A.
Na2CO3, NaCl và NaAlO2.
-
B.
BaCl2, NaAlO2, NaOH.
-
C.
NaCl và NaAlO2.
-
D.
AlCl3, NaCl, BaCl2.
Cho các chất sau: H2N- C2H4-COO-CH3, Al, Al(OH)3, KHSO4, CH3COONH4, H2N-CH2-COOH, NaHCO3, Pb(OH)2, Sn(OH)2, NaHS. Số chất có tính chất lưỡng tính là
-
A.
8
-
B.
7
-
C.
9
-
D.
6
Có 6 lọ mất nhãn đựng các dụng dịch: KNO3, Cu(NO3)2, FeCl3, FeCl2, AlCl3, NH4Cl. Có thể dùng hóa chất nào sau đây để nhận biết các dung dịch trên?
-
A.
Dung dịch Na2SO4
-
B.
Dung dịch AgNO3.
-
C.
Dung dịch NaOH.
-
D.
Dung dịch HCl.
Phương trình phản ứng nào sau đây không đúng?
-
A.
CuO + 2HCl → CuCl2 + H2O
-
B.
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓
-
C.
FeCO3 + H2SO4(đặc) \(\buildrel {{t^0}} \over\longrightarrow \) FeSO4 + CO2 + H2O
-
D.
Fe + 6HNO3(đặc) \(\buildrel {{t^0}} \over\longrightarrow \) Fe(NO3)3 + 3NO2 + 3H2O
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?

-
A.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
-
B.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
-
C.
Fe + 2HCl → FeCl2 + H2
-
D.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 (loãng, dư), thu được dung dịch X. Cho dãy gồm các chất: Fe, KNO3, KMnO4, BaCl2, NaOH, Cu. Số chất trong dãy phản ứng được với dung dịch X là
-
A.
3
-
B.
4
-
C.
5
-
D.
6
Oxit nào sau đây phản ứng được với nước ở điều kiện thường?
-
A.
Fe2O3.
-
B.
CrO3.
-
C.
SiO2.
-
D.
N2O.
X và Y là hai kim loại phản ứng được với dung dịch HCl nhưng không tác dụng được với dung dịch Fe(NO3)2. X,Y là
-
A.
Mg, Zn.
-
B.
Mg, Fe.
-
C.
Fe, Cu.
-
D.
Fe, Ni.
Cho một lượng hộp kim Ba – Na vào 200 ml dung dịch X gồm HCl 0,1M và CuCl2 0,1M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
-
A.
1,28.
-
B.
0,64.
-
C.
0,98.
-
D.
1,96.
Hòa tan hết 8,976 gam hỗn hợp X gồm FeS2, FeS, Cu2S và Cu trong 864 ml dung dịch HNO3 1M đun nóng, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,186 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu dược 11,184 gam kết tủa. Mặt khác, dung dịch Y phản ứng tối đa với m gam Fe, biết trong các quá trình trên, sản phẩm khử duy nhất của NO3- là NO. Giá trị của m là
-
A.
16,464.
-
B.
8,4.
-
C.
17,304.
-
D.
12,936.
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch gồm HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau phản ứng hoàn toàn thu được 16,5 gam kết tủa gồm hai chất. Mặt khác, cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây
-
A.
38,6
-
B.
27,4
-
C.
32,3
-
D.
46,3
Cho một lượng hỗn hợp X gồm Ba và Na vào 200 ml dung dịch Y gồm HCl 0,1M và CuCl2 0,04M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
-
A.
0,784.
-
B.
0,98.
-
C.
3,92.
-
D.
1,96.
Trong phòng thí nghiệm, có thể chứng minh khả năng hòa tan rất tốt trong nước của một số chất khí theo hình vẽ:

Thí nghiệm trên được sử dụng với các khí nào sau đây
-
A.
CO2 và Cl2
-
B.
HCl và NH3
-
C.
SO2 và N2
-
D.
O2 và H2
Phương trình hóa học nào sau đây viết sai?
-
A.
Cu + 2FeCl3 → CuCl2 + 2FeCl2
-
B.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
-
C.
Fe + CuCl2 → FeCl2 + Cu
-
D.
Cu + 2HNO3 → Cu(NO3)2 + H2
Dung dịch nào sau đây có pH < 7
-
A.
HCl
-
B.
NaNO3
-
C.
NaCl
-
D.
NaOH
Hòa tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y và dung dịch Z. Dẫn từ từ đến dư CO2 vào dung dịch Z thu được kết tủa T. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn R.Các chất trong T và R gồm
-
A.
BaSO4, FeO và Al(OH)3.
-
B.
BaSO4 và Fe2O3.
-
C.
Al2O3 và Fe2O3.
-
D.
BaSO4, Fe2O3 và Al(OH)3.
Tiến hành các thí nghiệm sau:
(a) Điện phân NaCl nóng chảy.
(b) Điện phân dung dịch CuSO4 (điện cực trơ).
(c) Cho mẩu K vào dung dịch AlCl3.
(d) Cho Fe vào dung dịch CuSO4.
(e) Cho Ag vào dung dịch HCl.
(g) Cho Cu vào dung dịch hỗn hợp Cu(NO3)2 và NaHSO4.
Số thí nghiệm thu được chất khí là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp), thu được dung dịch X. Hấp thụ CO2 dư vào X, thu được dung dịch chất Y. Cho Y tác dụng với Ca(OH)2 theo tỉ lệ mol 1:1 tạo ra chất Z tan trong nước. Chất Z là
-
A.
NaOH.
-
B.
NaHCO3.
-
C.
Ca(HCO3)2.
-
D.
Na2CO3.
Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường
(b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH
(c) Cho KMnO4 vào dung dịch HCl đặc, dư
(d) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl dư
(e) Cho CuO vào dung dịch HNO3
(f) Cho KHS vào dung dịch NaOH vừa đủ
Số thí nghiệm thu được 2 muối là
-
A.
6
-
B.
5
-
C.
3
-
D.
4
Cho kim loại X tác dụng với dung dịch H2SO4 loãng rồi lấy khí thu được để khử oxit kim loại Y. Hai kim loại X và Y lần lượt là
-
A.
Cu và Fe.
-
B.
Fe và Cu.
-
C.
Zn và Al.
-
D.
Cu và Ag
Thí nghiệm nào sau đây không xảy ra phản ứng oxi hóa khử?
-
A.
Nhỏ dung dịch HCl vào dung dịch Fe(NO3)2.
-
B.
Cho Fe3O4 vào dung dịch H2SO4 loãng.
-
C.
Nhiệt phân muối NH4NO2.
-
D.
Dẫn khí H2 qua CuO nung nóng.
Cho các chất: Cr2O3, FeSO4, Cr(OH)3, K2Cr2O7. Số chất phản ứng được với dung dịch NaOH đặc là
-
A.
4.
-
B.
1.
-
C.
2.
-
D.
3.
Hai chất nào sau đây không thể phản ứng với nhau?
-
A.
FeSO4 và HCl.
-
B.
Al2O3 và NaOH.
-
C.
CaO và H2O.
-
D.
Cu và FeCl3.
Cho 4 dung dịch được kí hiệu ngẫu nhiên là X, Y, Z, T. Trộn lẫn một số cặp dung dịch với nhau, kết quả thí nghiệm được ghi lại ở bảng sau:
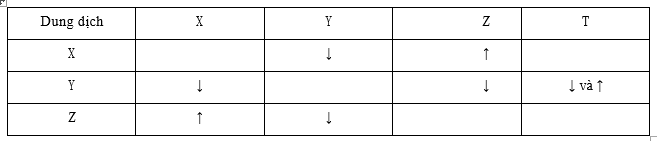
Các chất có trong dung dịch X, Y, Z, T lần lượt là
-
A.
(NH4)2CO3, Ba(OH)2, NaHSO4, NaOH.
-
B.
NaHCO3, Ba(OH)2, H2SO4, (NH4)2SO4.
-
C.
Ba(OH)2, (NH4)2SO4, H2SO4, NaOH.
-
D.
Ba(OH)2, Ba(HCO3)2, (NH4)2SO4, H2SO4.
Một học sinh nghiên cứu một dung dịch X đựng trong một lo không dán nhãn và thu được kết quả sau:
X có phản ứng với cả 3 dung dịch NaHSO4, Na2CO3 và AgNO3
X không phản ứng với cả 3 dung dịch NaOH, Ba(NO3)2, HNO3
Vậy dung dịch X là dung dịch nào sau đây
-
A.
BaCl2
-
B.
Mg(NO3)2
-
C.
FeCl2
-
D.
CuSO4
Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2 vừa thu được kết tủa, vừa có khí thoát ra
-
A.
HCl
-
B.
NaOH
-
C.
H2SO4
-
D.
Ca(OH)2
Thực hiện các thí nghiệm sau
(a) Sục khí CO2 dư vào dung dịch BaCl2
(b) Cho dung dịch NH3 dư vào dung dịch AlCl3
(c) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3
(d) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ mol 1:1) vào nước dư
(e) Cho dung dịch Ba(OH)2 dư vào dung dịch Cr2(SO4)3
(f) Cho hỗn hợp bột Cu và Fe3O4 (tỉ lệ mol 1:1) vào dung dịch HCl dư
Sau khi các phản ứng xảy ra, số thí nghiệm thu được kết tủa là
-
A.
4
-
B.
2
-
C.
5
-
D.
3
Cho dung dịch NaOH vào dung dịch X, thu được kết tủa màu nâu đỏ. Chất X là
-
A.
FeCl2
-
B.
MgCl2
-
C.
FeCl3
-
D.
CuCl2
Lời giải và đáp án
Cho các phát biểu sau:
(a) Thép là hợp kim của sắt chứa 2-5% khối lượng Cacbon
(b) Bột nhôm trộn với bột sắt (III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm
(c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
(d) Dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi khi nhiệt kế vỡ
(e) Khi làm thí nghiệm kim loại đồng tác dung với dung dịch HNO3, người ta nút ống nghiệm bằng bông tẩm dung dịch kiềm.
Số phát biểu đúng là:
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Đáp án : D
Lý thuyết tổng hợp hóa học vô cơ
(a) Thép là hợp kim của sắt chứa 2-5% khối lượng Cacbon
=> Sai. Thép chỉ chứa 0,01 – 2% Cacbon. Gang có Cacbon chiếm 2 – 5%
(b) Bột nhôm trộn với bột sắt (III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm
=> Đúng
(c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
=> Đúng. Vì ion CO32- sẽ làm kết tủa Mg2+ và Ca2+ làm mất tính cứng của nước
(d) Dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi khi nhiệt kế vỡ
=> Đúng. Vì: Hg + S → HgS ↓ để dễ thu gom.
(e) Khi làm thí nghiệm khim loại đồng tác dụng với dung dịch HNO3, người ta nút ống nghiệm bằng bông tẩm dung dịch kiềm.
=> Đúng. Vì sản phẩm phản ứng tạo ra NO2 là khí độc sẽ phản ứng với NaOH
2NaOH + 2NO2 → NaNO3 + NaNO2 + H2O
=> Có 4 ý đúng
Cho các phát biểu sau:
(a) Để loại bỏ lớp cặn CaCO3 trong ấm đun nước, phích đựng nước nóng người ta có thể dùng giấm ăn.
(b) Để hàn gắn đường ray bị nứt, gãy người ta dùng hỗn hợp tecmit.
(c) Để bảo vệ nồi hơi bằng thép, người ta thường lót dưới đáy nồi hơi những tấm kim loại bằng kẽm.
(d) Hơp kim Na - K có nhiệt độ nóng chảy thấp, thường được dùng trong các thiết bị báo cháy.
(e) Để bảo quản thực phẩm nhất là rau quả tươi, người ta có thể dùng SO2.
Số phát biểu đúng là
-
A.
4
-
B.
2
-
C.
5
-
D.
3
Đáp án : C
Dựa vào kiến thức lí thuyết về vô cơ
(a) đúng vì giấm ăn là dd CH3COOH từ 2-5% có thể loại bỏ được lớp cặn CaCO3 trong ấm theo PT
CaCO3↓ + CH3COOH → (CH3COO)2Ca + H2O
(b) đúng, hỗn hợp tecmit là hỗn hợp Al và FeO
(c) đúng, vì nồi hơi bằng thép (hợp kim Fe và C) lót dưới đáy nồi miếng kim loại Zn để khi hiện tượng ăn mòn xảy ra thì Zn bị ăn mòn trước, tránh cho thép không bị ăn mòn
(d) đúng
(e) đúng Khí SO2 là một chất khử với tác dụng chống oxy hóa. Có hai phương pháp bảo quản rau quả sau khi thu hoạch bao gồm: sunfit hóa khí và sunfit hóa ướt
+ Sunfit hóa khí: SO2 được nạp vào bình chứa và được phun trực tiếp vào sản phẩm rau quả cần bảo quản. Phương pháp này khá tốn sức lao động và cần nhiều thùng chứa nên khá tốn kém.
+ Sunfit ướt: SO2 sẽ được nạp trực tiếp từ bình thép hoặc được điều chế bằng cách đốt lưu huỳnh trong phòng. Nhờ vậy khí SO2 sẽ chiếm đầy thể tích phòng và thấm vào bề mặt quả để phát huy tác dụng sát trùng.
Thực hiện các thí nghiệm sau:
(1) Cho Si vào dung dịch NaOH (dư).
(2) Điện phân dung dịch NaCl dư bằng điện cực trơ, không màng ngăn xốp.
(3) Cho khí H2S vào dung dịch chứa FeCl3.
(4) Dẫn luồng khí H2 qua ống sứ chứa CuO nung nóng.
(5) Cho bột Ni vào dung dịch FeCl3 dư.
Số thí nghiệm thu được đơn chất là
-
A.
5.
-
B.
3.
-
C.
2.
-
D.
4.
Đáp án : D
Viết từng phản ứng xảy ra, chọn các phản ứng có sinh ra đơn chất
Chú ý: điều kiện xảy ra phản ứng trao đổi là tạo thành chất kết tủa, bay hơi hoặc chất điện li yếu
(1) Si + 2NaOH + H2O → Na2SiO3 + H2↑
(2) \(2NaCl + {H_2}O\xrightarrow{{dien\,\,phan\,\,dung\,\,dich}}NaCl + NaClO + {H_2}\)
(3) H2S + 2FeCl3 → 2FeCl2 + 2HCl + S↓
(4) H2+ CuO \(\buildrel {{t^0}} \over\longrightarrow \) Cu↓ + H2O
(5) Ni + 2FeCl3 \(\to \) NiCl2+ 2FeCl2
→ có 4 thí nghiệm thu được đơn chất
Cho Na, Zn, Fe, Cu, dung dịch Fe(NO3)3, dung dịch Cu(NO3)2, dung dịch AgNO3 lần lượt tác dụng với nhau đôi một. Số trường hợp xảy ra phản ứng ở điều kiện thường là
-
A.
9
-
B.
10
-
C.
11
-
D.
12
Đáp án : C
Dựa vào tính chất hóa học của các chất để xác định các phản ứng có thể xảy ra.
Các trường hợp xảy ra phản ứng ở điều kiện thường:
- Na + dd Fe(NO3)3
- Na + dd Cu(NO3)2
- Na + dd AgNO3
-Zn + dd Fe(NO3)3
- Zn + dd Cu(NO3)2
- Zn + dd AgNO3
- Fe + dd Fe(NO3)3
- Fe + dd Cu(NO3)2
- Fe + dd AgNO3
- Cu + dd Fe(NO3)3
- Cu + dd AgNO3
Vậy có tất cả 11 trường hợp có thể xảy ra phản ứng
Cho các cặp chất (với tỉ lệ số mol tương ứng) như sau:
(a) Fe2O3 và Cu (1:1) (b) Fe và Cu (2:1) (c) Zn và Ag (1:1)
(d) Fe2(SO4)3 và Cu (1:1) (e) Cu và Ag (2:1) (g) FeCl3 và Cu (1:1)
Số cặp chất không tan hoàn toàn trong dung dịch HCl dư là
-
A.
3
-
B.
1
-
C.
2
-
D.
4
Đáp án : D
Viết các phản ứng xảy ra, chú ý đến tỉ lệ phản ứng, các kim loại có thể không tan trong dd HCl nhưng tan được trong dd muối theo quy tắc anpha
(a) Fe2O3 + 6HCl → FeCl2 + 2FeCl3 + 3H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2 → tan hết trong HCl
(b) không tan hết vì Cu không tan được trong HCl
(c) Ag không tan trong dd HCl
(d) Fe2(SO4)3 + Cu → CuSO4 + 2FeSO4 → tan hết trong HCl
(e) Cu và Ag không tan được trong dd HCl
(g) 2FeCl3 + Cu → CuCl2 + 2FeCl2 → Cu vẫn còn dư không tan hết
Vậy các thí nghiệm không tan hoàn toàn được trong dd HCl là: (b); (c); (e); (g) → có 4 thí nghiệm
Có bao nhiêu chất trong các chất cho sau đây mà khi nung trong không khí đến khối lượng không đổi thu được chất rắn mới có khối lượng nhỏ hơn chất rắn ban đầu: NaHCO3, NaNO3, NH4Cl, I2, K2CO3, Fe, Fe(OH)3 và FeS2?
-
A.
4.
-
B.
6.
-
C.
3.
-
D.
5.
Đáp án : A
Các chất có phản ứng tạo ra chất mới ở thể rắn và khí thì chất đó sẽ có khối lượng rắn nhỏ hơn.
Các chất có phản ứng tạo ra chất mới ở thể rắn và khí thì chất đó sẽ có khối lượng rắn nhỏ hơn.
Đặt số mol mỗi chất đem nung là 1 mol
Các chất khi nhiệt phân thu được rắn có khối lượng nhỏ hơn là: NaHCO3, NaNO3, Fe(OH)3, FeS2
2NaHCO3(r) \(\buildrel {{t^0}} \over\longrightarrow \) Na2CO3 (r) + CO2↑ (k) + H2O(h)
2NaNO3(r) \(\buildrel {{t^0}} \over\longrightarrow \) 2NaNO2(r) + O2(k)
2Fe(OH)3 (r)\(\buildrel {{t^0}} \over\longrightarrow \) Fe2O3 (r) + 3H2O(h)
4FeS2(r) + 11O2 \(\buildrel {{t^0}} \over\longrightarrow \) 2Fe2O3(r) + 8SO2(k)
→ có 4 chất
Cho các phát biểu sau:
(a) Cấu hình electron của nguyên tử crom (Z = 24) ở trạng thái cơ bản là [Ar]3d54s1.
(b) Các kim loại từ Cu về đầu dãy điện hóa đều tác dụng được với dung dịch muối sắt (III).
(c) Đinh thép để lâu ngày trong không khí ẩm bị gỉ chủ yếu do xảy ra hiện tượng ăn mòn điện hóa học.
(d) Khi thêm dung dịch NaOH vào dung dịch muối natriđicromat, dung dịch chuyển từ màu da cam sang màu vàng.
(e) Nước cứng là nước có chứa nhiều ion Cu2+, Zn2+.
(f) Nhôm, sắt, crom không tan trong HNO3 loãng, nguội.
Số phát biểu đúng là
-
A.
1
-
B.
3
-
C.
4
-
D.
2
Đáp án : C
Xem lại lý thuyết về crom và hợp chất của crom, ăn mòn kim loại, nước cứng
(a) (b) (c) (d) đúng
(e) sai. Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+
(f) sai, vì Al, Fe, Cr không tan trong dung dịch HNO3 đặc, nguội
Vậy có 4 phát biểu đúng
Một học sinh làm thí nghiệm với dung dịch X đựng trong lọ không dán nhãn và thu được kết quả như sau:
X đều phản ứng với cả 3 dung dịch : NaHSO4 , Na2CO3, AgNO3
X không phản ứng với cả 3 dung dịch NaOH, Ba(NO3)2, HNO3
Vậy dung dịch X là dung dịch nào sau đây ?
-
A.
Mg(NO3)2
-
B.
CuSO4
-
C.
FeCl2
-
D.
BaCl2
Đáp án : D
Dựa vào đáp án suy luận với kết quả thí nghiệm => từ đó chọn được X thỏa mãn
Mg(NO3)2; CuSO4; FeCl2 không phản ứng với NaHSO4
Tiến hành các thí nghiệm sau :
(a) Cho dd AgNO3 vào dd HCl
(b) Cho Al2O3 vào dung dịch HCl loãng dư
(c) Cho Cu vào dung dịch HCl đặc nóng dư
(d) Cho Ba(OH)2 vào dung dịch KHCO3
Sau khi phản ứng kết thúc, số thí nghiệm thu được chất rắn là
-
A.
4
-
B.
2
-
C.
5
-
D.
3
Đáp án : D
Viết PTHH
(a) đúng tạo AgCl
(b) sai vì Al2O3 tan hết trong HCl
(c) đúng vì Cu không tác dụng với HCl nên còn nguyên sau phản ứng
(d) đúng do tạo kết tủa BaCO3 : Ba(OH)2 + KHCO3 → BaCO3 + KOH + H2O
Vậy có 3 thí nghiệm thu được chất rắn sau phản ứng.
Hòa tan hoàn toàn 2 chất rắn X, Y (số mol bằng nhau) vào nước thu được dung dịch Z. Tiến hành các thí nghiệm sau :
- Thí nghiệm 1 : Cho dung dịch NaOH dư vào V ml dung dịch Z thu được n1 mol kết tủa
- Thí nghiệm 2 : Cho dung dịch NH3 dư vào V ml dung dịch X thu được n2 mol kết tủa
- Thí nghiệm 3 : Cho dung dịch AgNO3 dư vào V ml dung dịch Z thu được n3 mol kết tủa
Biết các phản ứng xảy ra hoàn toàn và n1 = n2 < n3. Hai chất X, Y không thể là :
-
A.
ZnCl2 ; FeCl2
-
B.
Al(NO3)3 ; Fe(NO3)2
-
C.
FeCl2 ; FeCl3
-
D.
FeCl2 ; Al(NO3)3
Đáp án : B
Xem lại lý thuyết tính chất hóa học của các hợp chất vô cơ
Xét thí nghiệm 1 và 2 có tạo số mol kết tủa bằng nhau
=> 2 chất X và Y không thể là Al3+ và Fe2+ vì Al(OH)3 tan trong NaOH và không tan trong NH3
Do đó số kết tủa ở thí nghiệm 1 sẽ phải nhỏ hơn thí nghiệm 2 => không thỏa mãn đề bài
Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu trắng không tan trong NaOH dư. Chất X là
-
A.
FeCl3.
-
B.
MgCl2.
-
C.
CuCl2.
-
D.
AlCl3.
Đáp án : B
Dựa vào màu sắc kết tủa của các hidroxit và tính tan của nó trong NaOH
3NaOH + FeCl3 → Fe(OH)3↓ (nâu đỏ) + 3NaCl
2NaOH + MgCl2 → Mg(OH)2↓ (trắng) + 2NaCl
2NaOH + CuCl2 → Cu(OH)2↓ (xanh) + 2NaCl
3NaOH + AlCl3 → Al(OH)3↓ (trắng) + 3NaCl
=> có Mg(OH)2 và Al(OH)3 kết tủa trắng nhưng Al(OH)3 tan được trong NaOH dư. Do vậy dd X là MgCl2
Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl (điện cực trơ, có màng ngăn), thu được khí H2 ở anot.
(b) Cho a mol bột Fe vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được 2a mol Ag.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4 thì Zn bị ăn mòn điện hóa.
(d) Cho dung dịch FeCl3 vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được kết tủa gồm AgCl và Ag.
Số phát biểu đúng là
-
A.
2
-
B.
1
-
C.
3
-
D.
4
Đáp án : B
Viết lần lượt các phản ứng hóa học của các phản ứng ở các phần ra, kết luận xem phát biểu đó đúng hay sai.
(a) sai, H2 thu được tại catot
(b) sai, a mol Fe thu được 3a mol Ag. Fe + 3AgNO3 dư → Fe(NO3)3 + 3Ag↓
(c) đúng
(d) sai, kết tủa chỉ thu được AgCl
=> có 1 phát biểu đúng
Chú ý đến chất cho hết, chất cho dư
Cho hỗn hợp rắn gồm Na2O, BaO, NaHCO3, Al2O3 và NH4Cl có cùng số mol vào nước dư. Kết thúc các phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan là
-
A.
Na2CO3, NaCl và NaAlO2.
-
B.
BaCl2, NaAlO2, NaOH.
-
C.
NaCl và NaAlO2.
-
D.
AlCl3, NaCl, BaCl2.
Đáp án : C
Giả sử đặt số mol của mỗi chất là 1 (mol)
Viết các phản ứng hóa học xảy ra (dạng ion rút gọn) từ đó sẽ xác định được các chất tan trong dd X
Giả sử đặt số mol của mỗi chất là 1 (mol)
Các PTHH xảy ra là:
Na2O + H2O → 2NaOH
1 → 2 (mol)
BaO + H2O → Ba(OH)2
1 → 1 (mol)
=> sinh ra tổng 4 mol OH- đủ để thực hiện các phản ứng
HCO3- + OH- → CO32- + H2O
Al2O3 + 2OH- → 2AlO2- + H2O
NH4+ + OH- → NH3 + H2O
Sau đó CO32- sinh ra phản ứng với Ba2+ theo phản ứng:
CO32- + Ba2+ → BaCO3↓
Vậy dung dịch sau phản ứng có chứa các ion: Na+, AlO2- , Cl-
=> Dung dịch chứa: NaCl và NaAlO2
Cho các chất sau: H2N- C2H4-COO-CH3, Al, Al(OH)3, KHSO4, CH3COONH4, H2N-CH2-COOH, NaHCO3, Pb(OH)2, Sn(OH)2, NaHS. Số chất có tính chất lưỡng tính là
-
A.
8
-
B.
7
-
C.
9
-
D.
6
Đáp án : B
Chất có tính chất lưỡng tính là vừa có thể cho proton (tức H+) và vừa có thể nhận proton (tức H+)
Các chất có tính chất lưỡng tính là: H2N- C2H4-COO-CH3, Al(OH)3, H2N-CH2-COOH, NaHCO3, Pb(OH)2, Sn(OH)2, NaHS.
=> có tất cả 7 chất
Nếu đề bài hỏi là có bao nhiêu chất tác dụng với cả HCl và NaOH thì có thêm cả Al nữa
Có 6 lọ mất nhãn đựng các dụng dịch: KNO3, Cu(NO3)2, FeCl3, FeCl2, AlCl3, NH4Cl. Có thể dùng hóa chất nào sau đây để nhận biết các dung dịch trên?
-
A.
Dung dịch Na2SO4
-
B.
Dung dịch AgNO3.
-
C.
Dung dịch NaOH.
-
D.
Dung dịch HCl.
Đáp án : C
Ta thấy các dung dịch trên đều là các muối có cùng anion là NO3- và Cl- còn các gốc kim loại khác nhau
→ chọn thuốc thử là dd kiềm để phân biệt được các cation kim loại.

Phương trình phản ứng nào sau đây không đúng?
-
A.
CuO + 2HCl → CuCl2 + H2O
-
B.
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓
-
C.
FeCO3 + H2SO4(đặc) \(\buildrel {{t^0}} \over\longrightarrow \) FeSO4 + CO2 + H2O
-
D.
Fe + 6HNO3(đặc) \(\buildrel {{t^0}} \over\longrightarrow \) Fe(NO3)3 + 3NO2 + 3H2O
Đáp án : C
điều kiện phản ứng trao đổi xảy ra: tạo thành chất kết tủa, bay hơi hoặc chất điện li yếu
các chất phản ứng với H2SO4 đặc, nóng hoặc HNO3 đặc sẽ bị oxi hóa lên số oxi hóa cao nhất
dựa vào quy tắc anpha khi 2 muối phản ứng với nhau để biết được phản ứng có xảy ra hay không
C. sai, sửa lại 2FeCO3 + 4H2SO4(đặc) \(\buildrel {{t^0}} \over\longrightarrow \) Fe2(SO4)3 + 2CO2↑ + SO2↑ + 4H2O
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?

-
A.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
-
B.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
-
C.
Fe + 2HCl → FeCl2 + H2
-
D.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Đáp án : C
Khí X thu được bằng cách úp ngược ống nghiệm => khí X nhẹ hơn không khí => chọn khí có phân tử khối nhẹ hơn kk (Mkk ≈ 29)
Khí X thu được bằng cách úp ngược ống nghiệm => khí X nhẹ hơn không khí
1. loại NO2 nặng hơn không khí
2. loại CO2 nặng hơn không khí
3. Thỏa mãn vì H2 nhẹ hơn không khí
4. loại vì Cl2 nhẹ nặng hơn không khí
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 (loãng, dư), thu được dung dịch X. Cho dãy gồm các chất: Fe, KNO3, KMnO4, BaCl2, NaOH, Cu. Số chất trong dãy phản ứng được với dung dịch X là
-
A.
3
-
B.
4
-
C.
5
-
D.
6
Đáp án : D
Dung dịch X thu được có chứa: Fe2+, Fe3+, SO42- ; H+. Từ đó chọn được các chất có phản ứng với dd X
Fe3O4 + 4H2SO4 loãng dư → FeSO4 + Fe2(SO4)3 + 4H2O
Dung dịch X thu được có chứa: Fe2+, Fe3+, SO42- ; H+
Cả 6 chất đều tác dụng được với dung dịch X là: Fe, KNO3, KMnO4, BaCl2, NaOH, Cu.
Các phương trình minh họa
Fe + 2H+ → Fe2+ + H2
NO3- + 4H+ + 3Fe2+ → 3Fe3+ + NO + 2H2O
MnO4- + 4H+ + 3Fe2+ → 3Fe3+ + MnO2↓ + 2H2O
Ba2+ + SO42- → BaSO4↓
OH- + H+ → H2O
Cu + 2Fe3+ → 2Fe2+ + Cu2+
NO3- trong môi trường H+ có tính oxi hóa trương tự như HNO3
Oxit nào sau đây phản ứng được với nước ở điều kiện thường?
-
A.
Fe2O3.
-
B.
CrO3.
-
C.
SiO2.
-
D.
N2O.
Đáp án : B
CrO3 + H2O → H2CrO4
ghi nhớ CrO3 là oxit axit, có tính chất hóa học tương tự SO3.
X và Y là hai kim loại phản ứng được với dung dịch HCl nhưng không tác dụng được với dung dịch Fe(NO3)2. X,Y là
-
A.
Mg, Zn.
-
B.
Mg, Fe.
-
C.
Fe, Cu.
-
D.
Fe, Ni.
Đáp án : D
Suy luận
X, Y đều tác dụng được với dd HCl => X, Y là 2 kim loại đứng trước H trong dãy điện hóa
X,Y không có phản ứng với dd Fe(NO3)2 => X,Y là kim loại đứng từ Fe trở về sau trong dãy điện hóa
=> X, Y là 2 kim loại Fe, Ni thoãn mãn
Cho một lượng hộp kim Ba – Na vào 200 ml dung dịch X gồm HCl 0,1M và CuCl2 0,1M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
-
A.
1,28.
-
B.
0,64.
-
C.
0,98.
-
D.
1,96.
Đáp án : C
Kim loại sau khi phản ứng xong với axit sẽ tiếp tục phản ứng với H2O có trong dung dịch
2nH2 = nHCl + nOH => nOH = ?
Kết tủa thu được là Cu(OH)2
nHCl = nCuCl2= 0,2. 0,1 = 0,02 (mol) => nH+ = 0,02 (mol); nCu2+ = 0,02(mol)
nH2 = 0,448 :22,4 = 0,02 (mol)
Gọi chung kim loại Ba – Na là M hóa trị n
Kim loại sau khi phản ứng xong với axit sẽ tiếp tục phản ứng với H2O có trong dung dịch
PTHH:
M + 2nH+ → Mn+ + nH2↑
0,02→ 0,01 (mol)
M + 2nH2O → Mn+ + 2nOH- + nH2↑
0,02← (0,02-0,01) (mol)
Cu2+ + 2OH- → Cu(OH)2
0,02 → 0,01 (mol)
=> mCu(OH)2↓ = 0,01. 98 = 0,98 (g)
Hòa tan hết 8,976 gam hỗn hợp X gồm FeS2, FeS, Cu2S và Cu trong 864 ml dung dịch HNO3 1M đun nóng, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,186 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu dược 11,184 gam kết tủa. Mặt khác, dung dịch Y phản ứng tối đa với m gam Fe, biết trong các quá trình trên, sản phẩm khử duy nhất của NO3- là NO. Giá trị của m là
-
A.
16,464.
-
B.
8,4.
-
C.
17,304.
-
D.
12,936.
Đáp án : A
nHNO3 > nNO => Trong dd Y có chứa NO3-: nNO3- = nHNO3 – nNO
Sơ đồ phản ứng:
\(X\left\{ \begin{gathered}Fe \hfill \\Cu \hfill \\S \hfill \\ \end{gathered} \right. + HN{O_3} \to Y\left\{ \begin{gathered}F{e^{3 + }} \hfill \\C{u^{2 + }} \hfill \\{H^ + } \hfill \\S{O_4}^{2 - } \hfill \\N{O_3}^ - \hfill \\\end{gathered} \right. + NO + {H_2}O\)
Cho Y tác dụng với tối đa Fe:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Fe + 2Fe3+ → 3Fe2+
Fe + Cu2+ → Fe2+ + Cu
nHNO3 = 0,864 mol; nNO = 0,186 mol
nHNO3 > nNO => Trong dd Y có chứa NO3-: nNO3- = 0,864 – 0,186 = 0,678 mol
Khi cho BaCl2 dư tác dụng với Y: m kết tủa = mBaSO4 = 11,184 gam
=> nSO42- = nBaSO4 = 11,184:233 = 0,048 mol
BTNT “O”: 3nHNO3 = 4nSO42- + 3nNO3- + nNO + nH2O
=> 3.0,864 = 0,048.4 + 0,678.3 + 0,186 + nH2O => nH2O = 0,18 mol
BTNT “H”: nHNO3 = nH+ (Y) + 2nH2O => 0,864 = nH+(Y) + 0,18.2 => nH+(Y) = 0,504 mol
Như vậy ta có sơ đồ sau:
\(8,976(g)\left\{ \begin{gathered}Fe:x \hfill \\Cu:y \hfill \\ S:0,048 \hfill \\ \end{gathered} \right. + HN{O_3}:0,864 \to Y\left\{ \begin{gathered}F{e^{3 + }}:x \hfill \\C{u^{2 + }}:y \hfill \\{H^ + }:0,504 \hfill \\S{O_4}^{2 - }:0,048 \hfill \\N{O_3}^ - :0,678 \hfill \\ \end{gathered} \right. + NO:0,186 + {H_2}O:0,18\)
56x + 64y = 8,976 – 0,048.32 (1)
BTĐT dd Y: 3x + 2y + 0,504 = 0,048.2 + 0,678 (2)
Giải (1) và (2) được x = 0,03 và y = 0,09
Cho Y tác dụng với tối đa Fe:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,189 ← 0,504
Fe + 2Fe3+ → 3Fe2+
0,015 ← 0,03
Fe + Cu2+ → Fe2+ + Cu
0,09 ← 0,09
=> m = (0,189 + 0,015 + 0,09).56 = 16,464 gam
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch gồm HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau phản ứng hoàn toàn thu được 16,5 gam kết tủa gồm hai chất. Mặt khác, cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây
-
A.
38,6
-
B.
27,4
-
C.
32,3
-
D.
46,3
Đáp án : A
Khi thêm 0,85 mol NaOH vào X thì thu được dung dịch chứa NaCl: 0,52 mol và Na2SO4 : 0,14mol;
Vì nNaOH > nNaCl + 2nNa2SO4 nên còn NaAlO2→ nNaAlO2
Kết tủa thu được là Mg(OH)2 : x mol và Al(OH)3 : y mol
Ta có hệ sau \(\left\{ \begin{gathered}{m_ \downarrow } = 58x + 78y = 16.5 \hfill \\{m_{hh{\text{ bd}}}} = 24x + 27(x + {n_{NaAl{O_2}}}) = 7,65 \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}x \hfill \\y \hfill \\\end{gathered} \right.\) → dd X có Al+3 ; Mg+2 ; Cl- ; SO42-
Ta thấy X có 3nAl + 2nMg < nCl + 2nSO4 nên X có dư H+ → nH+ theo bào toàn điện tích
OH- + H+ → H2O
OH- + Mg+2 → Mg(OH)2
3OH- + Al+3 → Al(OH)3
Ba2+ + SO42- → BaSO4
Al(OH)3 + OH- → AlO2- + 2H2O
Khi thêm 8x mol KOH và x mol Ba(OH)2 vào dung dịch X thì để thu được lượng kết tủa lớn nhất ta xét các TH sau
TH1 : kết tủa có tối đa BaSO4 và Mg(OH)2và có thể có Al(OH)3
TH2: Kết tủa có tối đa Al(OH)3 và Mg(OH)2 và có BaSO4
Khi thêm 0,85 mol NaOH vào X thì thu được dung dịch chứa NaCl: 0,52 mol và Na2SO4 : 0,14mol;
Vì nNaOH > nNaCl + 2nNa2SO4 nên còn NaAlO2
Bảo toàn Na có nNaOH = nNaCl + 2nNa2SO4 + nNaAlO2 → 0,85 = 0,52 + 2.0,14 + nNaAlO2
→ nNaAlO2 = 0,05 mol
Kết tủa thu được là Mg(OH)2 : x mol và Al(OH)3 : y mol
Ta có hệ sau \(\left\{ \begin{gathered}{m_ \downarrow } = 58x + 78y = 16.5 \hfill \\{m_{hh{\text{ bd}}}} = 24x + 27(x + 0,05) = 7,65 \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}x = 0,15 \hfill \\y = 0,1 \hfill \\\end{gathered} \right.\)
→ dd X có Al+3 : 0,15 mol; Mg+2 : 0,15 mol; Cl- : 0,52 mol; SO42- : 0,14 mol
Ta thấy X có 3nAl + 2nMg < nCl + 2nSO4 nên X có dư H+ → nH+ = 0,52 + 0,14.2 -0,15.3 -0,15.2 = 0,05 mol
OH- + H+ → H2O
OH- + Mg+2 → Mg(OH)2
3OH- + Al+3 → Al(OH)3
Ba2+ + SO42- → BaSO4
Al(OH)3 + OH- → AlO2- + 2H2O
Khi thêm 8x mol KOH và x mol Ba(OH)2 vào dung dịch X thì để thu được lượng kết tủa lớn nhất ta xét các TH sau
TH1 : kết tủa có BaSO4 : 0,14 mol và Mg(OH)2: 0,15 mol và có thể có Al(OH)3
Bảo toàn Ba có x = 0,14 mol → nOH =8x + 2x =10x =1,4 mol > 2nMg + 4nAl +nH+ = 0,95
→ phản ứng có kết tủa Al(OH)3 bị hòa tan hết → kết tủa thu được là BaSO4 và Mg(OH)2
→ đem nung thu được BaSO4 : 0,14 mol và MgO : 0,15 mol → m = 38,62g
TH2: Kết tủa có Al(OH)3 : 0,15 mol và Mg(OH)2: 0,15 mol; BaSO4
Ta có nOH = 10x = 0,15.3 + 0,15.2 +0,05=0,8 → x = 0,08 mol→ có 0,08 mol BaSO4
→ Đem nhiệt phân thu được 0,08 mol BaSO4; 0,075 mol Al2O3 và 0,15mol MgO
→ m = 0,08.233 + 0,075.102 +0,15.40 =32,29g
Nên TH1 khối lượng kết tủa lớn nhất là 38,62 g gần nhất với 38,6 nhất
Cho một lượng hỗn hợp X gồm Ba và Na vào 200 ml dung dịch Y gồm HCl 0,1M và CuCl2 0,04M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
-
A.
0,784.
-
B.
0,98.
-
C.
3,92.
-
D.
1,96.
Đáp án : B
Ta thấy: nH+ = 2nH2 = 0,04 (mol) > nH+(trong HCl) = 0,02 (mol)
=> Ba và Na phản ứng với HCl sau đó tiếp tục phản ứng với H2O có trong dung dịch để tạo ra H2.
BT e ta có: 2nBa + nNa = 2nH2 = 0,04 (mol)
Mặt khác: 2nH2 = nHCl + nOH- (sinh ra do KL pư với H2O)
=> nOH- = ? (mol)
Cu2+ + 2OH- → Cu(OH)2↓
Từ đó tính được khối lượng kết tủa Cu(OH)2
nHCl = 0,2.0,1 = 0,02 (mol)
nCuCl2 = 0,2.0,4 = 0,08 (mol)
nH2(đktc) = 0,448 : 22,4 = 0,02 (mol)
Ta thấy: nH+ = 2nH2 = 0,04 (mol) > nH+(trong HCl) = 0,02 (mol)
=> Ba và Na phản ứng với HCl sau đó tiếp tục phản ứng với H2O có trong dung dịch để tạo ra H2.
BT e ta có: 2nBa + nNa = 2nH2 = 0,04 (mol)
Mặt khác: 2nH2 = nHCl + nOH- (sinh ra do KL pư với H2O)
=> nOH- = 2.0,02 - 0,02 = 0,02 (mol)
Cu2+ + 2OH- → Cu(OH)2↓
0,02 → 0,01 (mol)
=> Khối lượng kết tủa là mCu(OH)2 = 0,01.98 = 0,98 (g)
Trong phòng thí nghiệm, có thể chứng minh khả năng hòa tan rất tốt trong nước của một số chất khí theo hình vẽ:

Thí nghiệm trên được sử dụng với các khí nào sau đây
-
A.
CO2 và Cl2
-
B.
HCl và NH3
-
C.
SO2 và N2
-
D.
O2 và H2
Đáp án : B
Theo hình vẽ thì khí này tan tốt trong nước
Xem lại tính tan của các khí CO2, Cl2, SO2,N2,O2,H2,HCl và NH3
Theo hình vẽ chất khí này tan tốt trong nước
→ Thí nghiệm trên được sử dụng với các khí : HCl và NH3 là hai khí tan tốt trong nước
Phương trình hóa học nào sau đây viết sai?
-
A.
Cu + 2FeCl3 → CuCl2 + 2FeCl2
-
B.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
-
C.
Fe + CuCl2 → FeCl2 + Cu
-
D.
Cu + 2HNO3 → Cu(NO3)2 + H2
Đáp án : D
Dựa vào tính chất hóa học chung của kim loại
Dựa vào quy tắc anpha khi cho kim loại tác dụng với muối
A,B,C đúng
D sai vì Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO
Dung dịch nào sau đây có pH < 7
-
A.
HCl
-
B.
NaNO3
-
C.
NaCl
-
D.
NaOH
Đáp án : A
Dung dịch axit có pH < 7. Dung dịch có tính bazo có pH > 7 và dung dịch trung tính có pH = 7
Dung dịch nào sau đây có pH < 7 là dung dịch axit HCl
Hòa tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y và dung dịch Z. Dẫn từ từ đến dư CO2 vào dung dịch Z thu được kết tủa T. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn R.Các chất trong T và R gồm
-
A.
BaSO4, FeO và Al(OH)3.
-
B.
BaSO4 và Fe2O3.
-
C.
Al2O3 và Fe2O3.
-
D.
BaSO4, Fe2O3 và Al(OH)3.
Đáp án : D
Viết các phương trình hóa học xảy ra sẽ xác định được các chất
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2↑
Fe + H2SO4 loãng → FeSO4 + H2↑
Dung dịch X chứa: Al2(SO4)3; FeSO4 và H2SO4 loãng dư. Dd X tác dụng với Ba(OH)2 dư có PTHH sau:
Ba(OH)2 + H2SO4 loãng → BaSO4↓ + 2H2O
Ba(OH)2 + FeSO4 → BaSO4↓ + Fe(OH)2↓
4Ba(OH)2 + Al2(SO4)3 → Ba(AlO2)2 + 3BaSO4↓ + 4H2O
Kết tủa Y là: BaSO4 và Fe(OH)2
Dung dịch Z: Ba(AlO2)2 và Ba(OH)2 dư. Sục CO2 từ từ đến dư xảy ra phản ứng
2CO2 + Ba(AlO2)2 + 4H2O → 2Al(OH)3↓ + Ba(HCO3)2
2CO2 + Ba(OH)2 → Ba(HCO3)2
Kết tủa T là Al(OH)3.
Nung Y trong không khí đến khối lượng không đổi xảy ra pư
4Fe(OH)2 + O2 \(\xrightarrow{{{t^0}}}\) 2Fe2O3 + 4H2O
Rắn R gồm: Fe2O3 và BaSO4
Tiến hành các thí nghiệm sau:
(a) Điện phân NaCl nóng chảy.
(b) Điện phân dung dịch CuSO4 (điện cực trơ).
(c) Cho mẩu K vào dung dịch AlCl3.
(d) Cho Fe vào dung dịch CuSO4.
(e) Cho Ag vào dung dịch HCl.
(g) Cho Cu vào dung dịch hỗn hợp Cu(NO3)2 và NaHSO4.
Số thí nghiệm thu được chất khí là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : C
Viết PTHH từ đó suy ra các thí nghiệm thu được chất khí.
(a) NaCl \(\xrightarrow{{dpnc}}\) Na + Cl2 => thu được khí Cl2
(b) 2CuSO4 + 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) 2Cu + O2 + 2H2SO4 => thu được khí O2
(c) 2K + 2H2O → 2KOH + H2 => thu được khí H2
AlCl3 + 3KOH → Al(OH)3 + 3KCl
Al(OH)3 + KOH → KAlO2 + 2H2O
(d) Fe + CuSO4 → FeSO4 + Cu => không thu được khí
(e) Ag không phản ứng với HCl
(g) 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O => thu được khí NO
Vậy có tất cả 4 thí nghiệm thu được khí sau phản ứng
Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp), thu được dung dịch X. Hấp thụ CO2 dư vào X, thu được dung dịch chất Y. Cho Y tác dụng với Ca(OH)2 theo tỉ lệ mol 1:1 tạo ra chất Z tan trong nước. Chất Z là
-
A.
NaOH.
-
B.
NaHCO3.
-
C.
Ca(HCO3)2.
-
D.
Na2CO3.
Đáp án : A
Suy luận
\(2NaCl + 2{H_2}O\buildrel {} \over
\longrightarrow 2NaOH + C{l_2} + {H_2}\)
Dd X là NaOH
CO2 dư + 2NaOH → NaHCO3
Dd Y là NaHCO3 + Ca(OH)2 theo tỉ lệ 1:1
NaHCO3 + Ca(OH)2 → CaCO3↓ + NaOH + H2O
Z tan trong nước => Z là NaOH
CO2 dư + NaOh chỉ tạo muối axit
Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường
(b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH
(c) Cho KMnO4 vào dung dịch HCl đặc, dư
(d) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl dư
(e) Cho CuO vào dung dịch HNO3
(f) Cho KHS vào dung dịch NaOH vừa đủ
Số thí nghiệm thu được 2 muối là
-
A.
6
-
B.
5
-
C.
3
-
D.
4
Đáp án : D
Viết PTHH để suy ra những phản ứng thu được dung dịch chứa 2 muối.
(a) Cl2 + 2NaOH → NaCl + NaClO + H2O
=> thu được 2 muối NaCl, NaClO
(b) nNaOH : nCO2 = 3 : 2 = 1,5 => thu được NaHCO3 và Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
(c) 2KMnO4 + 16HCl đặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
=> thu được 2 muối KCl, MnCl2
(d) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl dư
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
2 4
Cu + 2FeCl3 → 2FeCl2 + CuCl2
1 → 2 dư 2 → 2 → 1
=> Thu được 3 muối là FeCl3, FeCl2, CuCl2
(e) CuO + 2HNO3 → Cu(NO3)2 + H2O
=> thu được 1 muối là Cu(NO3)2
(f) 2KHS + 2NaOH → Na2S + K2S + 2H2O
=> thu được 2 muối là K2S và Na2S
Vậy có 4 phản ứng thu được 2 muối
Cho kim loại X tác dụng với dung dịch H2SO4 loãng rồi lấy khí thu được để khử oxit kim loại Y. Hai kim loại X và Y lần lượt là
-
A.
Cu và Fe.
-
B.
Fe và Cu.
-
C.
Zn và Al.
-
D.
Cu và Ag
Đáp án : B
Kim loại X tác dụng được với dd H2SO4 loãng → X phải đứng trước H trong dãy hoạt động hóa học.
H2 khử được oxit của kim loại Y → kim loại Y phải đứng sau Al trong dãy điện hóa.
A sai vì Cu không tác dụng với H2SO4
B đúng vì Fe + H2SO4 → FeSO4 + H2 và H2 + CuO → Cu + H2O
C sai vì H2 không tác dụng được với Al2O3
D sai vì Cu không tác dụng với H2SO4
Thí nghiệm nào sau đây không xảy ra phản ứng oxi hóa khử?
-
A.
Nhỏ dung dịch HCl vào dung dịch Fe(NO3)2.
-
B.
Cho Fe3O4 vào dung dịch H2SO4 loãng.
-
C.
Nhiệt phân muối NH4NO2.
-
D.
Dẫn khí H2 qua CuO nung nóng.
Đáp án : B
Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của các chất trước và sau phản ứng. Những phản ứng không có sự thay đổi số oxi hóa của các chất thì không phải là phản ứng oxi hóa khử.
\(\eqalign{
& A.\,12HCl\, + \,\mathop {9Fe}\limits^{ + 2} {(\mathop N\limits^{ + 5} {O_3})_2}\buildrel {} \over
\longrightarrow \,\mathop {4Fe}\limits^{ + 3} C{l_3} + \,\mathop {5Fe}\limits^{ + 3} {(N{O_3})_3} + \mathop {3N}\limits^{ + 2} O + 6{H_2}{O_{}} \cr
& B.\,F{e_3}{O_4} + {H_2}S{O_4}\buildrel {} \over
\longrightarrow FeS{O_4} + F{e_2}{(S{O_4})_3} + {H_2}O \cr
& C.\mathop N\limits^{ - 3} {H_4}\mathop N\limits^{ + 5} {O_2}\buildrel {{t^0}} \over
\longrightarrow \mathop {{N_2}}\limits^0 + 2{H_2}O \cr
& D.\mathop {{H_2}}\limits^0 + \mathop {Cu}\limits^{ + 2} O\buildrel {{t^0}} \over
\longrightarrow \mathop {Cu}\limits^0 + \mathop {{H_2}}\limits^{ + 1} O \cr} \)
Cho các chất: Cr2O3, FeSO4, Cr(OH)3, K2Cr2O7. Số chất phản ứng được với dung dịch NaOH đặc là
-
A.
4.
-
B.
1.
-
C.
2.
-
D.
3.
Đáp án : A
Các chất phản ứng được với NaOH đặc là các oxit lưỡng tính, hiđroxit lưỡng tính, một số muối...
Tất cả các chất đều phản ứng được với NaOH đặc.
PTHH:
Cr2O3 + 2NaOH đặc → 2NaCrO2 + H2O
FeSO4 + 2NaOH → Fe(OH)2 ↓ + Na2SO4
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
K2Cr2O7 + 2NaOH → K2CrO4 + Na2CrO4 + H2O
Hai chất nào sau đây không thể phản ứng với nhau?
-
A.
FeSO4 và HCl.
-
B.
Al2O3 và NaOH.
-
C.
CaO và H2O.
-
D.
Cu và FeCl3.
Đáp án : A
Hai chất không sinh ra chất kết tủa, bay hơi, chất điện li yếu hoặc không xảy ra phản ứng oxi hóa khử thì không có phản ứng xảy ra.
A. Không phản ứng
B. Al2O3 + 2NaOH → 2NaAlO2 + H2O
C. CaO + H2O → Ca(OH)2
D. Cu + 2FeCl3 → CuCl2 + 2FeCl2
Cho 4 dung dịch được kí hiệu ngẫu nhiên là X, Y, Z, T. Trộn lẫn một số cặp dung dịch với nhau, kết quả thí nghiệm được ghi lại ở bảng sau:

Các chất có trong dung dịch X, Y, Z, T lần lượt là
-
A.
(NH4)2CO3, Ba(OH)2, NaHSO4, NaOH.
-
B.
NaHCO3, Ba(OH)2, H2SO4, (NH4)2SO4.
-
C.
Ba(OH)2, (NH4)2SO4, H2SO4, NaOH.
-
D.
Ba(OH)2, Ba(HCO3)2, (NH4)2SO4, H2SO4.
Đáp án : B
Dựa vào các đáp án, kết hợp với hiện tượng cho trong bảng trên. Các chất nào thỏa mãn đúng điều kiện cho như bảng thì chọn
A. Loại vì trộn X với Y có kết tủa và có khí bay ra trái với giả thiết chỉ có kết tủa
(NH4)2CO3 + Ba(OH)2 → BaCO3↓ + NH3↑ + H2O
B. Thỏa mãn
2NaHCO3 (X) + Ba(OH)2 (Y) → BaCO3↓ + Na2CO3 + 2H2O
2NaHCO3 (X) + H2SO4 (Z) → Na2SO4 + 2CO2↑ + 2H2O
Ba(OH)2 (Y) + H2SO4 (Z) → BaSO4↓ + 2H2O
Ba(OH)2 (Y) + (NH4)2SO4 (T) → BaSO4↓ + 2NH3↑ + 2H2O
C. Loại vì X + Y có kết tủa và khí trái với giả thiết chỉ có kết tủa
Ba(OH)2 (X) + (NH4)2SO4 (Y) → BaSO4↓ + 2NH3↑ + 2H2O
D. Loại vì Loại vì X + Z có kết tủa và khí trái với giả thiết chỉ có khí
Ba(OH)2 (X) + (NH4)2SO4 (Z) → BaSO4↓ + 2NH3↑ + 2H2O
Một học sinh nghiên cứu một dung dịch X đựng trong một lo không dán nhãn và thu được kết quả sau:
X có phản ứng với cả 3 dung dịch NaHSO4, Na2CO3 và AgNO3
X không phản ứng với cả 3 dung dịch NaOH, Ba(NO3)2, HNO3
Vậy dung dịch X là dung dịch nào sau đây
-
A.
BaCl2
-
B.
Mg(NO3)2
-
C.
FeCl2
-
D.
CuSO4
Đáp án : A
Quan sát đáp án dùng phương pháp loại trừ ví dụ Mg(NO3)2 không tác dụng với \(AgNO_3\)
A đúng vì BaCl2 thỏa mãn hết các tính chất của X
B sai vì Mg(NO3)2 không tác dụng với NaHSO4,AgNO3
C sai vì FeCl2 tác dụng với NaOH
D sai vì CuSO4 không tác dụng với NaHSO4
Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2 vừa thu được kết tủa, vừa có khí thoát ra
-
A.
HCl
-
B.
NaOH
-
C.
H2SO4
-
D.
Ca(OH)2
Đáp án : C
Viết PTHH của Ba(HCO3)2 với các chất
A. sai vì chỉ tạo khí CO2.
2HCl + Ba(HCO3)2 → BaCl2 + 2CO2↑ + 2H2O
B. sai vì chỉ tạo kết tủa BaCO3
2NaOH + Ba(HCO3)2 → BaCO3↓ + Na2CO3 + 2H2O
C. đúng vì Ba(HCO3)2 + H2SO4 → BaSO4↓ + 2H2O + 2CO2↑
D. sai vì chỉ có kết tủa là CaCO3 và BaCO3
Thực hiện các thí nghiệm sau
(a) Sục khí CO2 dư vào dung dịch BaCl2
(b) Cho dung dịch NH3 dư vào dung dịch AlCl3
(c) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3
(d) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ mol 1:1) vào nước dư
(e) Cho dung dịch Ba(OH)2 dư vào dung dịch Cr2(SO4)3
(f) Cho hỗn hợp bột Cu và Fe3O4 (tỉ lệ mol 1:1) vào dung dịch HCl dư
Sau khi các phản ứng xảy ra, số thí nghiệm thu được kết tủa là
-
A.
4
-
B.
2
-
C.
5
-
D.
3
Đáp án : D
Viết PTHH xảy ra, chọn các thí nghiệm thu được kết tủa
(a) Phản ứng không xảy ra
(b) Phản ứng tạo kết tủa Al(OH)3 do
3NH3 + AlCl3 +H2O → 3NH4Cl + Al(OH)3
(c) Phản ứng tạo kết tủa là Ag do
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
(d) Phản ứng không tạo kết tủa do :
Na2O + H2O → 2NaOH
Al2O3 +2NaOH → 2NaAlO2 + H2O
(e) Phản ứng tạo kết tủa :
4Ba(OH)2 + Cr2(SO4)3 → 3BaSO4 + Ba(CrO2)2 + 4H2O
(f) Phản ứng không tạo kết tủa do :
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 +4H2O
2FeCl3 + Cu → 2FeCl2 + CuCl2
Số thí nghiệm thu được kết tủa là 3
Cho dung dịch NaOH vào dung dịch X, thu được kết tủa màu nâu đỏ. Chất X là
-
A.
FeCl2
-
B.
MgCl2
-
C.
FeCl3
-
D.
CuCl2
Đáp án : C
Viết PTHH và nhận định màu kết tủa
Cu(OH)2: màu xanh; Fe(OH)3: nâu đỏ
Fe(OH)2 và Mg(OH)2 : màu trắng
X là FeCl3 vì FeCl3 + 3NaOH → 3NaCl + Fe(OH)3 là kết tủa màu nâu đỏ
Luyện tập và củng cố kiến thức Bài 41. Nhận biết một số chất khí và chất rắn Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 40. Nhận biết một số ion trong dung dịch Hóa 12 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận