Trắc nghiệm Tổng hợp bài tập cacbon - silic hay và khó (phần 1) - Hóa 11
Đề bài
Trộn 100 ml dung dịch A gồm KHCO3 1M và K2CO3 1M vào 100 ml dung dịch B gồm NaHCO3 1M và Na2CO3 1M thu được dung dịch C. Nhỏ từ từ 100 ml dung dịch D gồm H2SO4 1M và HCl 1M vào dung dịch C thu được V lít CO2 (đktc) và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào dung dịch E thì thu được m gam kết tủa.Giá trị của m và V lần lượt là :
-
A.
82,4 gam và 2,24 lít.
-
B.
4,3 gam và 1,12 lít.
-
C.
43 gam và 2,24 lít.
-
D.
3,4 gam và 5,6 lít.
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào lượng nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
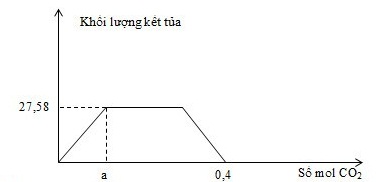
Giá trị của m là
-
A.
24,1 gam
-
B.
22,9 gam
-
C.
21,4 gam
-
D.
24,2 gam
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa đồng thời 0,1 mol Ba(OH)2; 0,255 mol KOH và 0,2 mol NaOH. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và kết tủa Y. Nhỏ từ từ đến hết dung dịch X vào dung dịch chứa 0,35 mol HCl, sinh ra 0,25 mol CO2. Giá trị của V là
-
A.
9,520.
-
B.
12,432.
-
C.
7,280.
-
D.
5,600.
Dung dịch Z gồm Na2CO3 0,4M, KHCO3 xM. Thêm từ từ 0,5 lít dung dịch Z vào 500 ml dung dịch HCl 1M sau phản ứng hoàn toàn thu được khí và dung dịch Y. Cho dung dịch Ba(OH)2 dư vào dung dịch Y sau phản ứng hoàn toàn thu được 78,8 gam kết tủa. Giá trị x là
-
A.
1,6.
-
B.
2.
-
C.
0,8.
-
D.
1,2.
Hấp thụ hết 4,480 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ 100 ml X vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
-
A.
0,15.
-
B.
0,06.
-
C.
0,10.
-
D.
0,20.
Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta thu được kết quả biểu diễn theo hình bên. Giá trị của x bằng bao nhiêu?
-
A.
0,64.
-
B.
0,58.
-
C.
0,68.
-
D.
0,62.
Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với đung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
-
A.
0,30.
-
B.
0,10.
-
C.
0,20.
-
D.
0,05.
Cho một luồng khí CO đi qua ống sứ đựng m gam Fe2O3 nung nóng. Sau một thời gian thu được 44,46 gam hỗn hợp X gồm Fe3O4, FeO, Fe, Fe2O3 dư. Cho X tác dụng hết với dung dịch HNO3 loãng thu được 3,136 lít NO (đktc) duy nhất. Thể tích khí CO (đktc) và m gam Fe2O3 đã dùng là:
-
A.
VCO = 4,5 lít; m = 45.
-
B.
VCO = 4,5 lít; m = 47,82
-
C.
VCO = 4,704 lít; m = 45.
-
D.
VCO = 4,704 lít; m = 47,82
Hòa tan hết 34,6 gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 dư vào dung dịch X, phản ứng được biểu diễn theo sơ đồ sau:
Nếu cho 34,6 gam X tác dụng với 300 ml dung dịch H2SO4 0,4M và HCl 0,6M. Kết thúc phản ứng, thu được dung dịch Y có khối lượng tăng x gam so với dung dịch ban đầu. Giá trị của x là
-
A.
11,02
-
B.
6,36
-
C.
13,15
-
D.
6,64
Cho từ từ dung dịch HCl 1M đến dư vào 200 ml dung dịch X chứa Na2CO3 và NaHCO3. Phản ứng được biểu diễn theo đồ thị sau:
Nếu cho từ từ 200 ml dung dịch X vào 175 ml dung dịch HCl 1M, thu được V lít khí CO2 (đktc). Giá trị của V là
-
A.
3,920 lít.
-
B.
2,128 lít.
-
C.
2,800 lít.
-
D.
1,232 lít.
Lời giải và đáp án
Trộn 100 ml dung dịch A gồm KHCO3 1M và K2CO3 1M vào 100 ml dung dịch B gồm NaHCO3 1M và Na2CO3 1M thu được dung dịch C. Nhỏ từ từ 100 ml dung dịch D gồm H2SO4 1M và HCl 1M vào dung dịch C thu được V lít CO2 (đktc) và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào dung dịch E thì thu được m gam kết tủa.Giá trị của m và V lần lượt là :
-
A.
82,4 gam và 2,24 lít.
-
B.
4,3 gam và 1,12 lít.
-
C.
43 gam và 2,24 lít.
-
D.
3,4 gam và 5,6 lít.
Đáp án : A
Khi cho từ từ dd HCl vào dung dịch X thì ta có
\(\begin{array}{l}{H^ + } + C{O_3}^{2 - } \to HC{O_3}^ - \\HC{O_3}^ - + {H^ + } \to {H_2}O + C{O_2}{\rm{ }}\end{array}\)
+) Tính theo PTHH => V
+) Tính số mol ion HCO3- và SO42- trong E => số mol kết tủa
Dd C có: \({{n}_{HCO_{3}^{-}}}=0,2\text{ }mol;\text{ }{{n}_{CO_{3}^{2-}}}=0,2\text{ }mol\) và Na+ , K+
Dd D: ${{n}_{{{H}^{+}}}}=0,3\,mol;\,{{n}_{SO_{4}^{2-}}}=0,1\,mol$và Cl-
Nhỏ từ từ D vào C
CO32- + H+ → HCO3-
0,2 → 0,2 → 0,2
H+ + HCO3- → CO2 + H2O
0,1 → 0,1 → 0,1
=> V = 0,1.22,4 = 2,24 lít
E chứa HCO3- (0,3 mol); SO42- (0,1 mol) và các ion khác
Cho Ba(OH)2 dư vào E
Ba2+ + HCO3- + OH- → BaCO3 + H2O
0,3 → 0,3
Ba2+ + SO42- → BaSO4
0,1 → 0,1
=> m = 0,3.197 + 0,1.233 = 82,4 gam
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào lượng nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:

Giá trị của m là
-
A.
24,1 gam
-
B.
22,9 gam
-
C.
21,4 gam
-
D.
24,2 gam
Đáp án : B
+ Tại thời điểm ${{n}_{C{{O}_{2}}}}~=a$ thì: ${{n}_{B{{a}^{2+}}}}~=\text{ }{{n}_{\downarrow \text{ }max}}~={{n}_{C{{O}_{2}}}}$
+ Tại thời điểm ${{n}_{C{{O}_{2}}}}~=0,4\text{ }mol$ thì ${{n}_{HC{{O}_{3}}^{-}}}~={{n}_{C{{O}_{2}}}}~=0,4\text{ }mol$
BTĐT => ${{n}_{N{{a}^{+}}}}~={{n}_{HC{{O}_{3}}^{-}~}}-2{{n}_{B{{a}^{2+}}}}$
BT e: 2nBa + nNa = 2nO + 2nH2 => nO
=> m = mBa + mNa + mO
${{n}_{B{{a}^{2+}}~}}={{n}_{\downarrow max}}~=\frac{27,58}{197}=0,14\text{ }mol$ (tại thời điểm ${{n}_{C{{O}_{2}}~}}=a=0,14$)
Khi ${{n}_{C{{O}_{2}}}}~=0,4\text{ }mol$ : dung dịch thu được gồm: Ba2+ (0,14 mol), HCO3- (0,4 mol) và Na+
BTĐT => ${{n}_{N{{a}^{+}}}}~={{n}_{HC{{O}_{3}}^{-}~}}-2{{n}_{B{{a}^{2+}}}}$ = 0,12 mol
BT e: 2nBa + nNa = 2nO + 2nH2 => nO = 0,06 mol
m = mBa + mNa + mO = 22,9 gam
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa đồng thời 0,1 mol Ba(OH)2; 0,255 mol KOH và 0,2 mol NaOH. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và kết tủa Y. Nhỏ từ từ đến hết dung dịch X vào dung dịch chứa 0,35 mol HCl, sinh ra 0,25 mol CO2. Giá trị của V là
-
A.
9,520.
-
B.
12,432.
-
C.
7,280.
-
D.
5,600.
Đáp án : A
Tính nOH-
Do nH+ > nCO2 nên X có cả CO32- => X không có Ba2+ => ${{n}_{BaC{{O}_{3}}}}~={{n}_{Ba{{\left( OH \right)}_{2}}}}$
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x + y = ${{n}_{C{{O}_{2}}}}$
2x + y = ${{n}_{{{H}^{+}}}}$
=> x và y
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (xk mol), HCO3- (yk mol)
BTĐT => k
BTNT C: ${{n}_{C{{O}_{2}}}}$ban đầu $={{n}_{BaC{{O}_{3}}}}+{{n}_{CO_{3}^{2-}}}~+\text{ }{{n}_{HCO_{3}^{-}}}$ => V
${{n}_{O{{H}^{-}}}}=0,1.2+0,225+0,2=0,625\text{ }mol$
Do ${{n}_{{{H}^{+}}}}>{{n}_{C{{O}_{2}}}}$ nên X có cả CO32- => X không có Ba2+ => ${{n}_{BaC{{O}_{3}}}}~={{n}_{Ba{{\left( OH \right)}_{2}}}}$= 0,1 mol
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x + y = ${{n}_{C{{O}_{2}}}}$ = 0,25
2x + y = ${{n}_{{{H}^{+}}}}$ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k = 1,3
BTNT C: ${{n}_{C{{O}_{2}}}}$ban đầu $={{n}_{BaC{{O}_{3}}}}+{{n}_{CO_{3}^{2-}}}~+\text{ }{{n}_{HCO_{3}^{-}}}$ = 0,1 + 0,13 + 0,195 = 0,425 mol
=> V = 9,52 lít
Dung dịch Z gồm Na2CO3 0,4M, KHCO3 xM. Thêm từ từ 0,5 lít dung dịch Z vào 500 ml dung dịch HCl 1M sau phản ứng hoàn toàn thu được khí và dung dịch Y. Cho dung dịch Ba(OH)2 dư vào dung dịch Y sau phản ứng hoàn toàn thu được 78,8 gam kết tủa. Giá trị x là
-
A.
1,6.
-
B.
2.
-
C.
0,8.
-
D.
1,2.
Đáp án : D
Khi sục từ từ CO32- và HCO3- vào H+ thì phản ứng xảy ra đồng thời và theo đúng tỉ lệ mol
$\left\{ {\begin{array}{*{20}{l}}{CO_3^{2 - }:0,2}\\{HCO_3^ - :a}\end{array}} \right. \to \frac{{HCO_3^ - }}{{CO_3^{2 - }}} = 5{\rm{a}}$
CO32- + 2H+ → CO2 + H2O
y → 2y
HCO3- + H+ → CO2 + H2O
5ay 5ay
+) Từ số mol H+ => PT (1) ẩn y và ay
+) tính được nBaCO3
+) BTNT C => PT (2) ẩn y và ay
=> a và y
+) $x=\frac{n}{V}$
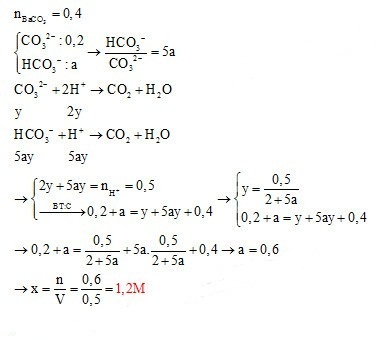
Hấp thụ hết 4,480 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ 100 ml X vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
-
A.
0,15.
-
B.
0,06.
-
C.
0,10.
-
D.
0,20.
Đáp án : C
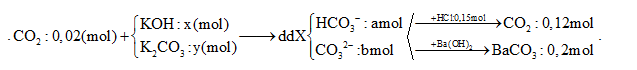
Xét trong 100 ml dung dịch X
BTNT: C => nBaCO3 = PT (1)
Gọi u và v lần lượt là số mol HCO3- và CO32- tác dụng với HCl với tỉ lệ u/v = a/b
HCO3- + H+ → CO2 + H2O
CO32- + 2H+ → CO2 + H2O
+) Từ 2 PT => hệ u và v
$=>\frac{a}{b}=\frac{u}{v}=?(2)$
Từ (1) và (2) => a = ? và b = ? (mol)
Xét trong 200 ml dd X chứa: CO32-: 2b ; HCO3-: 2a; K+ : ? (mol) ( Bảo toàn điện tích ra được số mol của K+)
BTNT K, C => x, y = ?
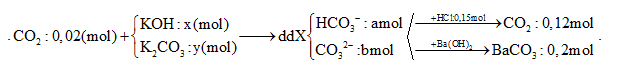
Xét trong 100 ml dung dịch X
BTNT: C => nBaCO3 = a + b = 0,2 (1)
Gọi u và v lần lượt là số mol HCO3- và CO32- tác dụng với HCl với tỉ lệ u/v = a/b
HCO3- + H+ → CO2 + H2O
u → u → u (mol)
CO32- + 2H+ → CO2 + H2O
v → 2v → v (mol)
Ta có hệ phương trình
$\begin{array}{*{20}{l}}{\left\{ {\begin{array}{*{20}{l}}{\sum {{n_{{H^ + }}} = u + 2v = 0,15} }\\{\sum {{n_{C{O_2}}} = u + v = 0,12} }\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{l}}{u = 0,09(mol)}\\{v = 0,03(mol)}\end{array}} \right.}\\{ =>\frac{a}{b} = \frac{u}{v} = \frac{1}{3}\Rightarrow 3a - b = 0,2{\mkern 1mu} {\mkern 1mu} (2)}\end{array}$
Từ (1) và (2) => a = 0,05 và b = 0,15 (mol)
Xét trong 200 ml dd X chứa: CO32-: 0,1 ; HCO3-: 0,3; K+ : 0,5 (mol) (Bảo toàn điện tích ra được số mol của K+)
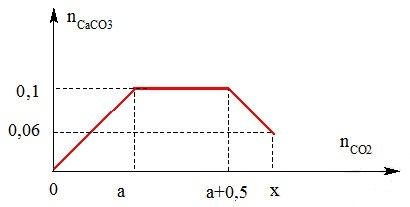
Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta thu được kết quả biểu diễn theo hình bên. Giá trị của x bằng bao nhiêu?

-
A.
0,64.
-
B.
0,58.
-
C.
0,68.
-
D.
0,62.
Đáp án : A
+ Tại nCO2 = a mol:
CO2 + Ca(OH)2 → CaCO3 + H2O
=> a = ?
+ Từ nCO2 = a+0,5 đến nCO2 = x có thêm giai đoạn:
CO2 + CaCO3 + H2O → Ca(HCO3)2
=> x = ?
+ Tại nCO2 = a mol:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,1 ← 0,1
a = 0,1 mol
+ Từ nCO2 = a+0,5 đến nCO2 = x có thêm giai đoạn:
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,04←0,04
=> x = 0,04 + a + 0,5 = 0,04 + 0,1 + 0,5 = 0,64 mol
Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với đung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
-
A.
0,30.
-
B.
0,10.
-
C.
0,20.
-
D.
0,05.
Đáp án : B
Khi cho từ từ dd chứa HCO3- và CO32- vào dd HCl sẽ xảy ra phản ứng:
HCO3- + H+ → CO2 + H2O
CO32- + 2H+ → CO2 + H2O
Gọi x và y là số mol khi tham gia phản ứng với HCl với tỉ lệ này trùng với tỉ lệ HCO3- và CO32- ban đầu.
Bảo toàn nguyên tố C
Bảo toàn điện tích
Bảo toàn nguyên tố K
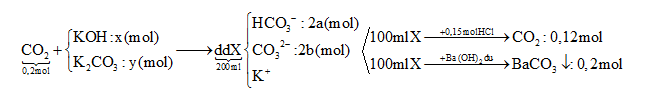
TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+
Khi cho từ từ 100 ml dd X vào 0,15 mol HCl
OH- + H+ → H2O
CO32- + 2H+ → CO2 ↑+ H2O
=> ${{n}_{{{H}^{+}}}}~={{n}_{O{{H}^{-}}}}+2{{n}_{C{{O}_{2}}}}~>0,12.2=0,24\text{ }\left( mol \right)$
=> loại vì ${{n}_{{{H}^{+}}}}=0,15\left( mol \right)$
Vậy dd X không chứa OH- dư
TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên
Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng:
HCO3- + H+ → CO2 + H2O
x → x → x (mol)
CO32- + 2H+ → CO2 + H2O
y → 2y → y (mol)
Gọi x và y là số mol khi tham gia phản ứng với HCl với tỉ lệ $\frac{x}{y}=\frac{a}{b}$
Ta có:
$\left\{ {\begin{array}{*{20}{l}}{\sum {{n_{C{O_2}}} = x + y = 0,12} }\\{\sum {{n_{HCl}} = x + 2y = 0,15} }\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{l}}{x = 0,09\left( {mol} \right)}\\{y = 0,03\left( {mol} \right)}\end{array}} \right. \Rightarrow \frac{a}{b} = \frac{x}{y} = \frac{3}{1} = > a = 3b{\mkern 1mu} {\mkern 1mu} (1)$
BTNT C: ${{n}_{BaC{{O}_{3}}}}$ = a + b = 0,2 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05 (mol)
Trong 200 ml dd X: ${{n}_{HCO_{3}^{-}}}~=0,3\left( mol \right);\,{{n}_{CO_{3}^{2-}}}~=0,1\left( mol \right)$
Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol)
BTNT C: ${{n}_{CO2(b)}}+{{n}_{{{K}_{2}}C{{O}_{3}}}}={{n}_{HCO_{3}^{-}}}+{{n}_{CO_{3}^{2-}}}~$=> 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol)
BTNT K: ${{n}_{K+}}={{n}_{KOH}}+2{{n}_{{{K}_{2}}C{{O}_{3}}}}=>{{n}_{KOH}}=0,52.0,2=0,1\left( mol \right)$
=> x = 0,1 (mol)
Cho một luồng khí CO đi qua ống sứ đựng m gam Fe2O3 nung nóng. Sau một thời gian thu được 44,46 gam hỗn hợp X gồm Fe3O4, FeO, Fe, Fe2O3 dư. Cho X tác dụng hết với dung dịch HNO3 loãng thu được 3,136 lít NO (đktc) duy nhất. Thể tích khí CO (đktc) và m gam Fe2O3 đã dùng là:
-
A.
VCO = 4,5 lít; m = 45.
-
B.
VCO = 4,5 lít; m = 47,82
-
C.
VCO = 4,704 lít; m = 45.
-
D.
VCO = 4,704 lít; m = 47,82
Đáp án : D
Coi hỗn hợp các oxit sắt chỉ gồm Fe (x mol) và O (y mol)
+) Bảo toàn e cho cả quá trình: ne (CO) nhường = n e (HNO3) nhận
+) Bảo toàn e và bảo toàn khối lượng => x và y
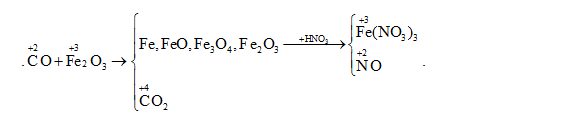
Bảo toàn e cho cả quá trình
=> ne (CO) nhường = n e (HNO3) nhận
=> ${{n}_{~CO}}~=\frac{0,14.3}{2}=0,21\left( \text{ }mol \right)$
=> VCO = 4,704 (lít)
Coi X gồm Fe : x (mol) và O : y (mol)
Dùng bảo toàn e và bảo toàn khối lượng
$ \to \left\{ {\begin{array}{*{20}{l}}{56{\rm{x}} + 16y = 44,46}\\{3{\rm{x}} - 2y = 0,14.3}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{x = 0,59775 = {n_{F{\rm{e}}}} \Rightarrow {n_{F{{\rm{e}}_2}{O_3}}} = 0,298875}\\{y = 0,686625 = {n_O}}\end{array}} \right.$
=> mFe2O3 = 0,298875.160 = 47,82 (gam)
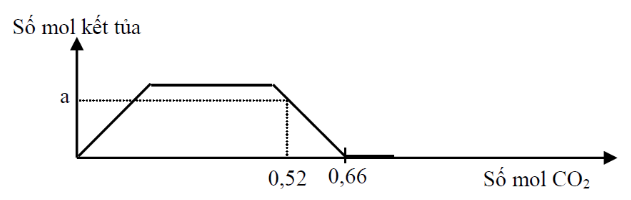
Hòa tan hết 34,6 gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 dư vào dung dịch X, phản ứng được biểu diễn theo sơ đồ sau:

Nếu cho 34,6 gam X tác dụng với 300 ml dung dịch H2SO4 0,4M và HCl 0,6M. Kết thúc phản ứng, thu được dung dịch Y có khối lượng tăng x gam so với dung dịch ban đầu. Giá trị của x là
-
A.
11,02
-
B.
6,36
-
C.
13,15
-
D.
6,64
Đáp án : B
Hỗn hợp ban đầu chứa Na (x mol); Ba (y mol) và O (z mol)
+) Khối lượng hỗn hợp => PT (1)
+) Bảo toàn electron => PT (2)
Trên đồ thị, khi CO2 = 0,66 thì kết tủa bị hòa tan hết => ${{n}_{HCO_{3}^{-}}}$
+) Bảo toàn điện tích => Pt (3)
Tại nCO2 = 0,53 thì kết tủa bị hòa tan 1 phần
${{n}_{BaC{{O}_{3}}}}=a\Rightarrow {{n}_{Ba{{\left( HC{{O}_{3}} \right)}_{2}}}}=y-a$ và ${{n}_{NaHC{{O}_{3}}}}=x$
+) Bảo toàn C => Pt (4)
Từ (1), (2), (3), (4) => x; y; z; a
+) $\Delta m=34,6{-{m}_{BaS{{O}_{4}}}}-{{m}_{{{H}_{2}}}}$
Hỗn hợp ban đầu chứa Na (x mol); Ba (y mol) và O (z mol)
=> 23x + 137y + 16z = 34,6 (1)
Bảo toàn electron: x + 2y = 2z + 2a (2)
Trên đồ thị, khi CO2 = 0,66 thì kết tủa bị hòa tan hết => ${{n}_{HCO_{3}^{-}}}=0,66$
Bảo toàn điện tích => x + 2y = 0,66 (3)
Tại nCO2 = 0,53 thì kết tủa bị hòa tan 1 phần
${{n}_{BaC{{O}_{3}}}}=a\Rightarrow {{n}_{Ba{{\left( HC{{O}_{3}} \right)}_{2}}}}=y-a$ và ${{n}_{NaHC{{O}_{3}}}}=x$
Bảo toàn C => a + 2.(y – a) + x = 0,52 (4)
Từ (1), (2), (3), (4) => x = 0,3; y = 0,18; z = 0,19; a = 0,14
${{n}_{{{H}_{2}}S{{O}_{4}}}}=0,12\Rightarrow {{n}_{BaS{{O}_{4}}}}=0,12$
$\Delta m=34,6{-{m}_{BaS{{O}_{4}}}}-{{m}_{{{H}_{2}}}}=6,36$ => tăng 6,36 gam
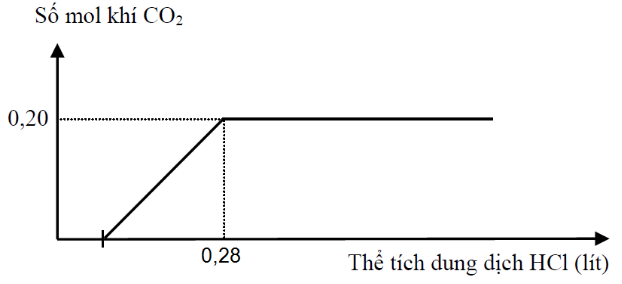
Cho từ từ dung dịch HCl 1M đến dư vào 200 ml dung dịch X chứa Na2CO3 và NaHCO3. Phản ứng được biểu diễn theo đồ thị sau:

Nếu cho từ từ 200 ml dung dịch X vào 175 ml dung dịch HCl 1M, thu được V lít khí CO2 (đktc). Giá trị của V là
-
A.
3,920 lít.
-
B.
2,128 lít.
-
C.
2,800 lít.
-
D.
1,232 lít.
Đáp án : C
X chứa ${{n}_{CO_{3}^{2-}}}=a\text{ }v\grave{a}\text{ }{{n}_{HCO_{3}^{-}}}=b$
=> nCO2 max => Pt (1)
+) nHCl => Pt (2)
=> a và b => a / b
Khi cho từ từ X vào HCl, đặt 2x và 3x là số mol CO32- và HCO3- phản ứng
+) Từ nH+ => x
=> nCO2
X chứa ${{n}_{CO_{3}^{2-}}}=a\text{ }v\grave{a}\text{ }{{n}_{HCO_{3}^{-}}}=b$
=> nCO2 max = a + b = 0,2
nHCl = 2a + b = 0,28
=> a = 0,08 và b = 0,12 => a/b = 2/3
Khi cho từ từ X vào HCl, đặt 2x và 3x là số mol CO32- và HCO3- phản ứng
=> nH+ = 2x.2 + 3x = 0,175
=> x = 0,025
=> nCO2 = 5x = 0,125
=> V = 2,8 lít
Luyện tập và củng cố kiến thức Tổng hợp bài tập cacbon - silic hay và khó (phần 2) Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 3 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Silic và hợp chất của silicghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập muối cacbonat tác dụng với H+ Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập CO2 tác dụng với dung dịch kiềm Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập tính khử của C, CO, H2 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 16. Hợp chất của cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 15. Cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận