Trắc nghiệm Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li - Hóa 11
Đề bài
Dãy gồm các chất có thể cùng tồn tại trong một dung dịch:
-
A.
H2SO4, Na2CO3, BaCl2, Na2SO4
-
B.
H2SO4, HCl, NaCl, NaNO3
-
C.
Ba(OH)2, NaNO3, Na2CO3, BaCl2
-
D.
NaOH, NaNO3, Na2CO3, HCl
Trong một dung dịch có thể cùng tồn tại các ion sau:
-
A.
$NH_4^ + ,\,N{a^ + },\,C{l^ - },\,SO_4^{2 - }$
-
B.
$NH_4^ + ,\,N{a^ + },\,C{l^ - },\,O{H^ - }$
-
C.
$NO_3^ - ,\,F{e^{2 + }},\,C{l^ - },\,{H^ + }$
-
D.
$B{a^{2 + }},\,N{a^ + },\,C{l^ - },\,SO_4^{2 - }$
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là
-
A.
$N{a^ + },\,\,M{g^{2 + }},\,\,NO_3^ - ,\,\,SO_4^{2 - }$
-
B.
$N{a^ + },\,\,{K^ + },\,\,HSO_4^ - ,\,\,O{H^ - }$
-
C.
$B{a^{2 + }},\,\,A{l^{3 + }},\,\,NO_3^ - ,\,\,C{l^ - }$
-
D.
$F{e^{3 + }},\,\,C{u^{2 + }},\,\,SO_4^{2 - },\,\,C{l^ - }$
Cho các phản ứng hoá học sau:
(1) (NH4)2SO4 + BaCl2 (2) CuSO4 + Ba(NO3)2
(3) Na2SO4 + BaCl2 (4) H2SO4 + BaSO3
(5) (NH4)2SO4 + Ba(OH)2 (6) Fe2(SO4)3 + Ba(NO3)2
Các phản ứng đều có cùng phương trình ion rút gọn là
-
A.
(1), (2), (3), (6).
-
B.
(1), (3), (5), (6).
-
C.
(2), (3), (4), (6).
-
D.
(3), (4), (5), (6).
Cho 0,1 mol Ca2+ và x mol NO3− cùng tồn tại trong một dung dịch. Giá trị của x là:
-
A.
0,1
-
B.
0,2
-
C.
0,3
-
D.
0,4
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
-
A.
0,01 và 0,03.
-
B.
0,01 và 0,01.
-
C.
0,03 và 0,02.
-
D.
0,02 và 0,01.
Dựa vào định luật bảo toàn điện tích cho biết dung dịch nào sau đây không thể tồn tại ?
-
A.
dung dịch chứa ${\text{N}}{{\text{a}}^ + }\,0,1M;\,\,B{a^{2 + }}\,0,1M;\,\,{K^ + }\,0,15M;\,\,C{l^ - }\,0,25M;\,\,NO_3^ - \,0,1M$
-
B.
dung dịch chứa ${\text{C}}{{\text{a}}^{{\text{2}} + }}\,0,2M;\,\,{{\text{K}}^ + }\,0,25M;\,\,C{l^ - }\,0,25M;\,\,NO_3^ - \,0,4M$
-
C.
dung dịch chứa ${{\text{K}}^ + }\,0,1M;\,\,N{a^ + }\,0,2M;\,\,NO_3^ - \,0,05M;\,\,C{H_3}CO{O^ - }\,0,05M;\,\,C{l^ - }\,0,2M$
-
D.
dung dịch chứa ${\text{M}}{{\text{g}}^{2 + }}\,0,2M;\,\,{K^ + }\,0,1M;\,\,NH_4^ + \,0,1M;\,\,SO_4^{2 - }\,0,25M;\,\,C{l^ - }\,0,05M;\,\,NO_3^ - \,0,05M$
Dung dịch Y chứa Ca2+ 0,1 mol; Mg2+ 0,3 mol; Cl− 0,4 mol; HCO3− y mol. Cô cạn dung dịch ta thu được m gam muối khan. Giá trị của m là:
-
A.
49,8
-
B.
49,4
-
C.
37,4
-
D.
30,5
Cho hỗn hợp X gồm x mol FeS2 và 0,025 mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại và giải phóng khí NO duy nhất. Giá trị của x là :
-
A.
0,045
-
B.
0,075
-
C.
0,050
-
D.
0,025
Dụng dịch X có chứa 5 ion: Mg2+, Ba2+, Ca2+; 0,125 mol Cl- và 0,25 mol NO3-. Thêm dần V lít dung dịch Na2CO3 1M vào X đến khi thu được lượng kết tủa lớn nhất. Giá trị của V là:
-
A.
0,1250
-
B.
0,1500
-
C.
0,1875
-
D.
0,3750
Hoà tan hoàn toàn 16 gam hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 3M. Kết thúc thí nghiệm thu được dung dịch Y và 8,96 lít khí H2 (đktc). Để kết tủa phản ứng hoàn toàn với dung dịch Y cần vừa đủ 300 ml NaOH 2M. Thể tích dung dịch HCl đã dùng là:
-
A.
0,20 lít
-
B.
0,24 lít
-
C.
0,30 lít
-
D.
0,40 lít
Chia hỗn hợp X gồm 2 kim loại có hóa trị không đổi thành 2 phần bằng nhau.
Phần 1: Hòa tan hoàn toàn bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc).
Phần 2: Nung trong không khí dư, thu được 2,84 gam hỗn hợp rắn chỉ gồm các oxit.
Khối lượng hỗn hợp X là:
-
A.
1,56 gam
-
B.
2,40 gam
-
C.
1,80 gam
-
D.
3,12 gam
Trộn dung dịch chứa Ba2+ ; OH− 0,06 mol và Na+ 0,02 mol với dung dịch HCO3− 0,04 mol; CO32− 0,03 mol và Na+. Khối lượng kết tủa thu được sau khi trộn là:
-
A.
3,94 gam
-
B.
5,91 gam
-
C.
7,88 gam
-
D.
1,71 gam
Dung dịch X chứa 0,025 mol CO32-; 0,1 mol Na+ ; 0,25 mol NH4+ và 0,3 mol Cl−. Cho 270 ml dung dịch Ba(OH)2 0,2 M vào và đun nhẹ (giả sử H2O bay hơi không đáng kể).Tổng khối lượng dung dịch X và dung dịch Ba(OH)2 sau quá trình phản ứng giảm đi là:
-
A.
4,215 gam
-
B.
5,296 gam
-
C.
6,761 gam
-
D.
7,015 gam
Dung dịch X chứa các ion: Fe3+ ; SO42 ; NH4+; Cl−. Chia dung dịch thành 2 phần bằng nhau:
- Phần 1: Cho tác dụng với lượng dư dung dịch NaOH , đun nóng thu được 0,672 lít khí ở đktc và 1,07 gam kết tủa.
- Phần 2: Tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa.
Tổng khối lượng các muối khan thu được khi cô cạn dung dịch X là (quá trình cô cạn chỉ có nước bay hơi)
-
A.
3,73 gam
-
B.
7,04 gam
-
C.
7,46 gam
-
D.
7,35 gam
Cho 22,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thì thu được bao nhiêu gam muối clorua khan?
-
A.
2,66 gam
-
B.
22,6 gam
-
C.
26,6 gam
-
D.
24,6 gam
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
-
A.
x=y
-
B.
x=2y
-
C.
2x=y
-
D.
x=3y
Dung dịch B chứa ba ion K+; Na+; PO43-. 1 lít dung dịch B tác dụng với CaCl2 dư thu được 31 gam kết tủa. Mặt khác nếu cô cạn 1 lít dung dịch B thu được 37,6 gam chất rắn khan. Nồng độ của 3 ion K+; Na+; PO43- lần lượt là:
-
A.
0,3M; 0,3M; 0,6M
-
B.
0,1M; 0,1M; 0,2M
-
C.
0,3M; 0,3M; 0,2M
-
D.
0,3M; 0,2M; 0,2M
Phản ứng nào sau đây không phải là phản ứng trao đổi?
-
A.
FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
-
B.
NH4Cl + NaOH → NaCl + NH3 + H2O.
-
C.
Na2SO4 + BaCl2 → BaSO4 + 2NaCl.
-
D.
2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O.
Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
-
A.
NaClO và AlCl3.
-
B.
NaOH và KCl.
-
C.
KNO3 và HCl.
-
D.
Ba(OH)2 và AlCl3.
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
-
A.
các chất phản ứng phải là những chất dễ tan.
-
B.
các chất phản ứng phải là những chất điện li mạnh.
-
C.
một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
-
D.
phản ứng không phải là thuận nghịch.
Phương trình ion rút gọn của phản ứng cho biết
-
A.
Những ion nào tồn tại trong dung dịch.
-
B.
Nồng độ những ion nào trong dung dịch lớn nhất.
-
C.
Bản chất của phản ứng trong dung dịch các chất điện li.
-
D.
Không tồn tại phân tử trong dung dịch các chất điện li.
Ion \(CO_3^{2 - }\) cùng tồn tại với các ion sau trong một dung dịch:
-
A.
\(NH_4^ + \), Na+, K+.
-
B.
Cu2+, Mg2+, Al3+.
-
C.
Fe2+, Zn2+, Al3+ .
-
D.
Fe3+, \(H{\text{S}}O_4^ - \).
Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
-
A.
AlCl3 và CuSO4.
-
B.
NH3 và AgNO3.
-
C.
Na2ZnO2 và HCl.
-
D.
NaHSO4 và NaHCO3.
Trong các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2, có bao nhiêu chất tác dụng được với dung dịch Ba(HCO3)2?
-
A.
4
-
B.
5
-
C.
2
-
D.
3
Trộn các cặp dung dịch các chất sau với nhau:
1) NaHSO4 + NaHSO3 2) Na3PO4 + K2SO4
3) AgNO3 + Fe(NO3)2 4) C6H5ONa + H2O
5) CuS + HNO3 6) BaHPO4 + H3PO4
7) NH4Cl + NaNO2 (đun nóng) 8) Ca(HCO3)2 + NaOH
9) NaOH + Al(OH)3 10) MgSO4 + HCl.
Số phản ứng xảy ra là
-
A.
8
-
B.
5
-
C.
7
-
D.
6
Cho dãy các chất: H2SO4,KOH, Ca(NO3)2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
-
A.
4
-
B.
6
-
C.
3
-
D.
5
Phương trình phân tử: BaHPO4 + H2SO4 →BaSO4 ↓+ H3PO4 tương ứng với phương trình ion thu gọn nào sau đây?
-
A.
\(B{a^{2 + }} + SO_4^{2 - } \to BaS{O_4}\)
-
B.
\(B{a^{2 + }} + HPO_4^{2 - } + SO_4^{2 - } + 2{H^ + } \to BaS{O_4} + {H_3}P{O_4}\)
-
C.
\(HPO_4^{2 - } + 2{H^ + } \to {H_3}P{O_4}\)
-
D.
\(B{a^{2 + }} + PO_4^{3 - } + SO_4^{2 - } + 3{H^ + } \to BaS{O_4} + {H_3}P{O_4}\)
Dung dịch NaHSO4 tác dụng được với tất cá các chất có trong nhóm nào sau đây?
-
A.
NaNO3, AlCl3, BaCl2, NaOH, KOH.
-
B.
BaCl2, NaOH, FeCl3, Fe(NO3)3 , KCl.
-
C.
NaHCO3, BaCl2, Na2S, Na2CO3, KOH.
-
D.
Na2S, Cu(OH)2, Na2CO3, FeCl2, NaNO3.
Cho sơ đồ sau: X + Y → CaCO3 + BaCO3 + H2O
X,Y có thể là
-
A.
Ba(AlO2)2 và Ca(OH)2
-
B.
Ba(OH)2 và Ca(HCO3)2
-
C.
Ba(OH)2 và CO2
-
D.
BaCl2 và Ca(HCO3)2
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
-
A.
các chất phản ứng phải là chất điện li mạnh.
-
B.
một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
-
C.
các chất phản ứng phải là những chất dễ tan.
-
D.
phản ứng phải là thuận nghịch.
Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng?
-
A.
KNO3.
-
B.
AgNO3.
-
C.
NaOH.
-
D.
Na2CO3.
Một dung dịch chứa x mol Na+, y mol Ca2+, z mol HCO3-, t mol Cl-. Hệ thức quan hệ giữa x, y , z, t được xác định là:
-
A.
x + 2z = y + 2t.
-
B.
z + 2x = y + t.
-
C.
x + 2y = z + 2t.
-
D.
x + 2y = z + t.
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
-
A.
0,1
-
B.
1
-
C.
10
-
D.
100
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
-
A.
C và CuO
-
B.
CO2 và NaOH.
-
C.
CO và Fe2O3.
-
D.
C và H2O.
Phương trình hóa học nào viết sai so với phản ứng xảy ra?
-
A.
CaCl2 + CO2 + H2O → CaCO3 + 2HCl
-
B.
BaCl2 + H2SO4 → BaSO4 + 2HCl
-
C.
FeS + 2HCl → FeCl2 + H2S
-
D.
CH3COONa + HCl → CH3COOH + NaCl
Cho phản ứng NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
-
A.
2KOH + FeCl2 → Fe(OH)2 + 2KCl.
-
B.
NaOH + NH4Cl → NaCl + NH3 + H2O.
-
C.
KOH + HNO3 → KNO3 + H2O.
-
D.
NaOH + NaHCO3 → Na2CO3 + H2O.
Trung hòa 10 ml dung dịch HCl 1M cần 20 ml dung dịch KOH nồng độ a mol/l. Giá trị của a là
-
A.
0,5.
-
B.
2,0.
-
C.
0,2.
-
D.
1,0.
Cần thêm ít nhất bao nhiêu lít NH3 (đktc) vào 250 ml dung dịch Al2(SO4)3 0,2M để làm kết tủa hoàn toàn ion nhôm dưới dạng Al(OH)3.
-
A.
8,96 lít
-
B.
3,36 lít
-
C.
4,48 lít
-
D.
6,72 lít
Dung dịch X được tạo ra từ 2 muối chứa đồng thời các ion: Al3+, Fe2+, Cl-, SO42-. Cho dung dịch BaCl2 dư vào dung dịch chứa 200 ml dung dịch X thu được 13,98 gam kết tủa. Mặt khác, cho dung dịch Ba(OH)2 đến dư vào 200 ml dung dịch X thu được 21,18 gam kết tủa. Nồng độ mol/l của Cl- là?
-
A.
0,16M
-
B.
0,4M
-
C.
0,12M
-
D.
0,8M
Nhỏ từ từ 0,125 lít dung dịch Ba(OH)2 1M vào dung dịch gồm 0,024 mol FeCl3; 0,016 mol Al2(SO4)3 và 0,04 mol H2SO4 thu được m gam kết tủa. Tính giá trị m?
-
A.
5,064
-
B.
20,504
-
C.
25,412
-
D.
4,908
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn thu được 16,5 gam kết tủa gồm 2 chất. Mặt khác cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi thu được lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây?
-
A.
32,3
-
B.
38,6
-
C.
46,3
-
D.
27,4
Dung dịch X gồm 0,25 mol Ba2+; 1,3 mol Na+; a mol OH- và b mol Cl-. Cho 400 ml dung dịch Y gồm H2SO4 0,25M; HCl 0,25M và ZnSO4 1M vào dung dịch X. Sau khi các phản ứng kết thúc, thu được kết tủa G. Nung toàn bộ G đến khối lượng không đổi thu được 69,59 gam chất rắn H. Giá trị của b là:
-
A.
0,58 hoặc 1,62
-
B.
1,52 hoặc 0,48
-
C.
0,18 hoặc 0,58
-
D.
0,18 hoặc 1,22
Dung dịch X gồm NaOH 0,2M và Ba(OH)2 0,05M. Dung dịch Y gồm Al2(SO4)3 0,4M và H2SO4 xM. Trộn 0,1 lít dung dịch Y với 1 lít dung dịch X thu được 16,33 gam kết tủa. Giá trị của x là:
-
A.
0,2M
-
B.
0,2M; 0,6M
-
C.
0,2M, 0,4M
-
D.
0,2M, 0,5M
Dung dịch X chứa các cation gồm Mg2+, Ba2+, Ca2+ và các anion gồm Cl- và NO3-. Thêm từ từ 250 ml dung dịch Na2CO3 1M vào dung dịch X thì thu được lượng kết tủa lớn nhất. Tổng số mol các anion có trong dung dịch X là:
-
A.
1,0.
-
B.
0,25.
-
C.
0,75.
-
D.
0,5.
Trộn lẫn hỗn hợp các ion sau:
(I) K+, CO32-, S2- với H+, Cl-, NO3-
(II) Na+, Ba2+, OH- với H+, Cl-, SO42-
(III) NH4+, H+, SO42- với Na+, Ba2+, OH-
(IV) H+, Fe2+, SO42- với Ba2+, K+, OH-
(V) K+, Na+, HSO3- với Ba2+, Ca2+, OH-
(VI) Cu2+, Zn2+, Cl- với K+, Na+, OH-
Trường hợp có thể xảy ra 3 phản ứng là :
-
A.
I, II, VI
-
B.
III, IV, V, VI
-
C.
IV, V, VI
-
D.
III, IV, VI
Có 2 dung dịch chứa 2 cation và 2 anion không trùng nhau trong các ion sau: K+ (0,15 mol), Mg2+ (0,1 mol), NH4+ (0,25 mol), H+ (0,25 mol), Cl- (0,1 mol), SO42- (0,075 mol), NO3- (0,25 mol), CO32- (0,15 mol). Một trong 2 dung dịch trên chứa các ion nào dưới đây?
-
A.
K+, Mg2+, SO42-, Cl-
-
B.
K+, NH4+, CO32-, Cl-
-
C.
NH4+, H+, NO3-, SO42-
-
D.
Mg2+, H+, SO42-, Cl-
Cho dãy các ion sau:
(a) H+, Fe3+, NO3-, SO42- (b) Ag+, Na+, NO3-, Cl-
(c) Al3+, NH4+, Br-+, OH- (d) Mg2+, K+, SO42-, PO43-
(e) K+, HPO42-, Na+, OH- (g) Fe2+, Na+, HSO4-, NO3-
(h) Ag+, NH4+, SO42-, I- (i) Mg2+, Na+, SO42-
Số dãy gồm các ion cùng tồn tại trong 1 dung dịch là:
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
-
A.
1,5M.
-
B.
2M.
-
C.
1M.
-
D.
1,75M.
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
-
A.
dd 1 : Fe2+ ; H+ ; SO42- ; Cl- và dd 2 : K+ ; NH4+ ; CO32- ; NO3-
-
B.
dd 1 : NH4+ ; H+ ; SO42- ; CO32- và dd 2 : K+ ; Fe2+ ; NO3- ; Cl-
-
C.
dd 1 : Fe2+ ; H+ ; NO3- ; SO42- và dd 2 : K+ ; NH4+ ; CO32- ; Cl-
-
D.
dd 1 : Fe2+ ; K+ ; SO42- ; NO3- và dd 2 : H+ ; NH4+ ; CO32- ; Cl-
Hỗn hợp X gồm Na và Ba có tỉ lệ mol 1 : 1. Hòa tan một lượng X vào nước được 3,36 lít H2 (đktc) và dung dịch Y. Cho 4,48 lít CO2 hấp thụ hết vào dung dịch Y thì thu được m gam kết tủa. Giá trị của m là:
-
A.
1,97 gam.
-
B.
39,4 gam.
-
C.
19,7 gam.
-
D.
3,94 gam.
Hòa tan hoàn toàn hỗn hợp X gồm 0,12 mol FeS2 và a mol Cu2S vào dung dịch HNO3 đặc (đủ) sau phản ứng thu được dung dịch A chỉ chứa muối sunfat và khí NO2. Giá trị của a là:
-
A.
0,12.
-
B.
0,06.
-
C.
0,03.
-
D.
0,45.
Cho dung dịch KOH 1 M tới dư vào dung dịch X sau phản ứng thu được kết tủa. Dung dịch X có thể chứa đồng thời các chất
-
A.
Al2(SO4)3 và ZnSO4.
-
B.
Al2(SO4)3 và NaCl.
-
C.
Al2(SO4)3 và CuSO4.
-
D.
ZnSO4 và Na2SO4.
Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:
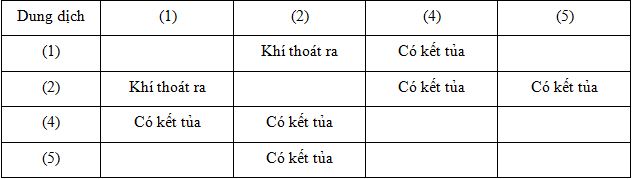
Các dung dịch (1), (3), (5) lần lượt là
-
A.
H2SO4, NaOH, MgCl2.
-
B.
Na2CO3, NaOH, BaCl2.
-
C.
H2SO4, MgCl2, BaCl2.
-
D.
Na2CO3, BaCl2, BaCl2.
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4.
(b) Cho Na vào dung dịch FeCl2 dư.
(c) Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2.
(d) Sục khí CO2 dư vào dung dịch hỗn hợp NaOH và Ba(OH)2.
(e) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả kết tủa và khí là
-
A.
5.
-
B.
2.
-
C.
3.
-
D.
4.
Lời giải và đáp án
Dãy gồm các chất có thể cùng tồn tại trong một dung dịch:
-
A.
H2SO4, Na2CO3, BaCl2, Na2SO4
-
B.
H2SO4, HCl, NaCl, NaNO3
-
C.
Ba(OH)2, NaNO3, Na2CO3, BaCl2
-
D.
NaOH, NaNO3, Na2CO3, HCl
Đáp án : B
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li
Dãy gồm các chất có thể cùng tồn tại trong 1 dung dịch là các chất không phản ứng được với nhau
A sai vì BaCl2 có thể tác dụng với Na2SO4; Na2CO3 có thể tác dụng với H2SO4
C sai vì Na2CO3 có thể tác dụng với BaCl2
D sai vì HCl có thể tác dụng với NaOH và Na2CO3
Trong một dung dịch có thể cùng tồn tại các ion sau:
-
A.
$NH_4^ + ,\,N{a^ + },\,C{l^ - },\,SO_4^{2 - }$
-
B.
$NH_4^ + ,\,N{a^ + },\,C{l^ - },\,O{H^ - }$
-
C.
$NO_3^ - ,\,F{e^{2 + }},\,C{l^ - },\,{H^ + }$
-
D.
$B{a^{2 + }},\,N{a^ + },\,C{l^ - },\,SO_4^{2 - }$
Đáp án : A
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li
Các ion có thể cùng tồn tại với nhau trong dung dịch thì không phản ứng với nhau
B sai vì: NH4+ + OH- → NH3 + H2O
C sai vì: 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
D sai vì Ba2+ + SO42- → BaSO4
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là
-
A.
$N{a^ + },\,\,M{g^{2 + }},\,\,NO_3^ - ,\,\,SO_4^{2 - }$
-
B.
$N{a^ + },\,\,{K^ + },\,\,HSO_4^ - ,\,\,O{H^ - }$
-
C.
$B{a^{2 + }},\,\,A{l^{3 + }},\,\,NO_3^ - ,\,\,C{l^ - }$
-
D.
$F{e^{3 + }},\,\,C{u^{2 + }},\,\,SO_4^{2 - },\,\,C{l^ - }$
Đáp án : B
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là $N{a^ + },\,\,{K^ + },\,\,HSO_4^ - ,\,\,O{H^ - }$
Vì: HSO4- + OH- → SO42- + H2O
Cho các phản ứng hoá học sau:
(1) (NH4)2SO4 + BaCl2 (2) CuSO4 + Ba(NO3)2
(3) Na2SO4 + BaCl2 (4) H2SO4 + BaSO3
(5) (NH4)2SO4 + Ba(OH)2 (6) Fe2(SO4)3 + Ba(NO3)2
Các phản ứng đều có cùng phương trình ion rút gọn là
-
A.
(1), (2), (3), (6).
-
B.
(1), (3), (5), (6).
-
C.
(2), (3), (4), (6).
-
D.
(3), (4), (5), (6).
Đáp án : A
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li
(1) SO42- + Ba2+ → BaSO4 (4) 2H+ + SO42- + BaSO3 → BaSO4 + SO2 + H2O
(2) SO42- + Ba2+ → BaSO4 (5) 2NH4+ + SO42- + Ba2+ + OH- → BaSO4 + NH3 + H2O
(3) SO42- + Ba2+ → BaSO4 (6) SO42- + Ba2+ → BaSO4
=> Các phản ứng có cùng phương trình ion rút gọn là: (1), (2), (3), (6).
Cho 0,1 mol Ca2+ và x mol NO3− cùng tồn tại trong một dung dịch. Giá trị của x là:
-
A.
0,1
-
B.
0,2
-
C.
0,3
-
D.
0,4
Đáp án : B
Áp dụng ĐLBT điện tích: $\sum {{n_{( + )}}} = \sum {{n_{( - )}}} $
Áp dụng ĐLBT điện tích: dung dịch luôn trung hòa về điện
$= > {\text{ }}2.{n_{C{a^{2 + }}}}{\text{ }} = {\text{ }}1.{n_{N{O_3}^ - }}{\text{ = > 2}}{\text{.0,1 = 1}}{\text{.x }} = > {\text{ x = 0,2 (mol)}}$
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
-
A.
0,01 và 0,03.
-
B.
0,01 và 0,01.
-
C.
0,03 và 0,02.
-
D.
0,02 và 0,01.
Đáp án : D
+) Áp dụng định luật bảo toàn điện tích có PT(1)
+) Áp dụng định luật bảo toàn khối lượng ta có:
mmuối = ${\text{ }}\sum {{m_{ion}}} $ => PT (2)
Áp dụng định luật bảo toàn điện tích ta có:
0,01.2 + 0,03.1 = x.1 + y.3 (1)
Áp dụng định luật bảo toàn khối lượng ta có:
mmuối = ${\text{ }}\sum {{m_{ion}}} {\text{ = > 2,59 = 0,01}}{\text{.24 + 0,03}}{\text{.23 + x}}{\text{.35,5 + y}}{\text{.95 (2)}}$
- Giải hệ hai phương trình (1) và (2) ta được: x = 0,02; y = 0,01
Dựa vào định luật bảo toàn điện tích cho biết dung dịch nào sau đây không thể tồn tại ?
-
A.
dung dịch chứa ${\text{N}}{{\text{a}}^ + }\,0,1M;\,\,B{a^{2 + }}\,0,1M;\,\,{K^ + }\,0,15M;\,\,C{l^ - }\,0,25M;\,\,NO_3^ - \,0,1M$
-
B.
dung dịch chứa ${\text{C}}{{\text{a}}^{{\text{2}} + }}\,0,2M;\,\,{{\text{K}}^ + }\,0,25M;\,\,C{l^ - }\,0,25M;\,\,NO_3^ - \,0,4M$
-
C.
dung dịch chứa ${{\text{K}}^ + }\,0,1M;\,\,N{a^ + }\,0,2M;\,\,NO_3^ - \,0,05M;\,\,C{H_3}CO{O^ - }\,0,05M;\,\,C{l^ - }\,0,2M$
-
D.
dung dịch chứa ${\text{M}}{{\text{g}}^{2 + }}\,0,2M;\,\,{K^ + }\,0,1M;\,\,NH_4^ + \,0,1M;\,\,SO_4^{2 - }\,0,25M;\,\,C{l^ - }\,0,05M;\,\,NO_3^ - \,0,05M$
Đáp án : A
Áp dụng định luật bảo toàn điện tích: $\sum {{n_{{\text{( + )}}}}} = \sum {{n_{{\text{( - )}}}}} $
Dung dịch luôn trung hòa về điện nên: $\sum {{n_{{\text{( + )}}}}} = \sum {{n_{{\text{( - )}}}}} $
A. 0,1.1 + 0,1.2 + 0,15 ≠ 0,25.1 + 0,1. 1
B. 0,2.2 + 0,25.1 = 0,25.1 + 0,4.1
C. 0,1.1 + 0,2.2 = 0,05.1 + 0,05.1 + 0,2.1
D. 0,2.2 + 0,1.1 + 0,1.1 = 0,25.2 + 0,05.1 + 0,05.1
Dung dịch Y chứa Ca2+ 0,1 mol; Mg2+ 0,3 mol; Cl− 0,4 mol; HCO3− y mol. Cô cạn dung dịch ta thu được m gam muối khan. Giá trị của m là:
-
A.
49,8
-
B.
49,4
-
C.
37,4
-
D.
30,5
Đáp án : C
Bước 1: Tìm y: Áp dụng ĐLBTĐT => y
Bước 2: Tính số mol của CO32−
Khi cô cạn : 2HCO3− → CO32− + H2O + CO2
${n_{C{O_3}^{2 - }}} = \frac{1}{2}{\text{ }}{n_{HC{O_3}^ - }} $
Bước 3: Tính khối lượng muối
$ {m_{muối}} = {m_{C{a^{2 + }}}} + {\text{ }}{m_{M{g^{2 + }}}}{\text{ }} + {\text{ }}{m_{C{l^ - }}}{\text{ }} + {\text{ }}{m_{C{O_3}^{2 - }}}$
Bước 1: Áp dụng ĐLBT điện tích:
${n_{C{a^{2 + }}}} + {n_{M{g^{2 + }}}} = {n_{C{l^ - }}} + {n_{HCO_3^ - }}$
$=>{n_{HCO_3^ - }} = (0,1.2 + 0,3.2) - 0,4 = 0,4(mol)$
Bước 2: Khi cô cạn dung dịch $HCO_3^ - $ chuyển thành $CO_3^{2 - }$theo phương trình:
$=>{n_{CO_3^{2 - }}} = \frac{1}{2}.{n_{HCO_3^ - }} = 0,2(mol)$
Bước 3: Khối lượng của muối
m = mkim loại + mgốc axit
$m = {m_{C{a^{2 + }}}} + {m_{M{g^{2 + }}}} + {m_{C{l^ - }}} + {m_{CO_3^{2 - }}}$
$m = 40.0,1 + 24.0,3 + 35,5.0,4 + 60.0,2 = 37,4(g)$
Cho hỗn hợp X gồm x mol FeS2 và 0,025 mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại và giải phóng khí NO duy nhất. Giá trị của x là :
-
A.
0,045
-
B.
0,075
-
C.
0,050
-
D.
0,025
Đáp án : C
Bảo toàn điện tích, bảo toàn nguyên tố
\(\left\{ \begin{array}{l}F{\rm{e}}{S_2}\\C{u_2}S\end{array} \right. + HN{O_3} \to \left\{ \begin{array}{l}F{{\rm{e}}_2}{(S{O_4})_3}\\CuS{O_4}\end{array} \right. + NO + {H_2}O\)
- Bảo toàn nguyên tố S ta có: ${{n}_{SO_{4}^{2-}}}=2.{{n}_{F\text{e}{{S}_{2}}}}+{{n}_{C{{u}_{2}}S}}=2\text{x}+0,025$
→ dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 0,05; SO42-: (2x + 0,025) mol
- Áp dụng định luật bảo toàn điện tích: 3x + 2.0,05 = 2.(2x + 0,025) → x = 0,05
Dụng dịch X có chứa 5 ion: Mg2+, Ba2+, Ca2+; 0,125 mol Cl- và 0,25 mol NO3-. Thêm dần V lít dung dịch Na2CO3 1M vào X đến khi thu được lượng kết tủa lớn nhất. Giá trị của V là:
-
A.
0,1250
-
B.
0,1500
-
C.
0,1875
-
D.
0,3750
Đáp án : C
+) Vì cả ba ion Mg2+, Ca2+ và Ba2+ đều tạo kết tủa với CO32- nên đến khi được kết tủa lớn nhất thì dung dịch chỉ chứa Na+, Cl-, và NO3-.
+) Áp dụng định luật bảo toàn toàn điện tích: ${{n}_{N{{a}^{+}}}}={{n}_{C{{l}^{-}}}}+{{n}_{NO_{3}^{-}}}$
Vì cả ba ion Mg2+, Ca2+ và Ba2+ đều tạo kết tủa với CO32- nên đến khi được kết tủa lớn nhất thì dung dịch chỉ chứa Na+, Cl-, và NO3-.
Gọi nNa2CO3 = a mol => nNa+ = 2a mol
Áp dụng định luật bảo toàn toàn điện tích ta có:
$\sum {{\text{ }}{n_{{\text{( + )}}}}} {\text{ }} = {\text{ }}\sum {{\text{ }}{n_{{\text{( - )}}}}} = > 2a.1 = {\text{ }}0,125.1 + 0,25.1 = > {\text{ }}a = 0,1875{\text{ }}(mol)$
$ = > V = n:{C_M} = 0,1875(l)$
Hoà tan hoàn toàn 16 gam hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 3M. Kết thúc thí nghiệm thu được dung dịch Y và 8,96 lít khí H2 (đktc). Để kết tủa phản ứng hoàn toàn với dung dịch Y cần vừa đủ 300 ml NaOH 2M. Thể tích dung dịch HCl đã dùng là:
-
A.
0,20 lít
-
B.
0,24 lít
-
C.
0,30 lít
-
D.
0,40 lít
Đáp án : A
+) Dung dịch Y chứa Mg2+, Fe2+, H+ dư (nếu có), Cl-. Khi cho Y tác dụng với dung dịch NaOH vừa đủ thì dung dịch thu được sau phản ứng chỉ còn lại Na+ và Cl-.
Áp dụng định luật bảo toàn điện tích:
${n_{C{l^ - }}} = {n_{N{a^ + }}}$
$ = > {V_{HCl}}$
${n_{N{a^ + }}}{\text{ }} = {\text{ }}{n_{O{H^ - }}}{\text{ }} = {\text{ }}{n_{NaOH}}{\text{ }} = {\text{ }}0,3.2{\text{ }} = {\text{ }}0,6{\text{ }}(mol)$
Dung dịch Y chứa Mg2+, Fe2+, H+ dư (nếu có), Cl-. Khi cho Y tác dụng với dung dịch NaOH vừa đủ thì dung dịch thu được sau phản ứng chỉ còn lại Na+ và Cl-.
Áp dụng định luật bảo toàn điện tích cho dung dịch này ta có:
${n_{C{l^ - }}} = {n_{N{a^ + }}} = 0,6{\text{ }}(mol)$
$ = > {V_{HCl}}{\text{ }} = {\text{ }}n:{C_M}{\text{ }} = {\text{ }}0,6:3{\text{ }} = {\text{ }}0,2(l)$
Chia hỗn hợp X gồm 2 kim loại có hóa trị không đổi thành 2 phần bằng nhau.
Phần 1: Hòa tan hoàn toàn bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc).
Phần 2: Nung trong không khí dư, thu được 2,84 gam hỗn hợp rắn chỉ gồm các oxit.
Khối lượng hỗn hợp X là:
-
A.
1,56 gam
-
B.
2,40 gam
-
C.
1,80 gam
-
D.
3,12 gam
Đáp án : D
$ +) {\text{ }}{n_{HCl}}{\text{ }} = {\text{ }}2{n_{{H_2}}} = > {n_{C{l^ - }}}{\text{ }}$
$ +) 2.{n_{{O^{2 - }}(trong{\text{ oxit)}}}}{\text{ }} = {\text{ }}1.{n_{C{l^ - }(trong{\text{ muối )}}}}$
Áp dụng định luật bảo toàn khối lượng cho phản ứng ở phần 2:
${m_{oxit}} = {\text{ }}{m_{KL}}{\text{ }} + {\text{ }}{m_O} = > {\text{ }}{m_{KL}} $
$ = > {m_X}$
Nhận xét: Tổng số mol điện tích ion dương (của 2 kim loại) ở 2 phần là bằng nhau. Suy ra, tổng số mol điện tích ion âm ở 2 phần cũng bằng nhau.
${n_{{H_2}(KTC)}} = {\text{ }}0,08{\text{ }}(mol){\text{ }} = > {\text{ }}{n_{HCl}}{\text{ }} = {\text{ }}2{n_{{H_2}}} = {\text{ }}0,16(mol) = > {n_{C{l^ - }}}{\text{ }} = {\text{ }}0,16{\text{ }}(mol)$
$ = > 2.{n_{{O^{2 - }}(trong{\text{ oxit)}}}}{\text{ }} = {\text{ }}1.{n_{C{l^ - }(trong{\text{ muối )}}}}$
$ = > 2.{n_{{O^{2 - }}(trong{\text{ oxit)}}}}{\text{ }} = {\text{ }}1.0,16{\text{ }} = > {\text{ }}{n_{{O^{2 - }}(trong{\text{ oxit)}}}}{\text{ }} = {\text{ }}0,08{\text{ (mol)}}$
Áp dụng định luật bảo toàn khối lượng cho phản ứng ở phần 2:
${m_{oxit}} = {\text{ }}{m_{KL}}{\text{ }} + {\text{ }}{m_O} = > 2,84 = {\text{ }}{m_{KL}}{\text{ }} + {\text{ }}0,08.16 = > {\text{ }}{m_{KL}} = 1,56{\text{ }}(g){\text{ }}$
$ = > {m_X} = 2.1,56 = 3,12(g)$
Trộn dung dịch chứa Ba2+ ; OH− 0,06 mol và Na+ 0,02 mol với dung dịch HCO3− 0,04 mol; CO32− 0,03 mol và Na+. Khối lượng kết tủa thu được sau khi trộn là:
-
A.
3,94 gam
-
B.
5,91 gam
-
C.
7,88 gam
-
D.
1,71 gam
Đáp án : A
- Tính số mol Ba2+
\(BTDT:2{n_{B{a^{2 + }}}} + {n_{N{a^ + }}} = {n_{O{H^ - }}}\)
- Tính \({n_{C{O_3}^{2 - }}}\)
${\text{ HCO}}_3^ - {\text{ }} + {\text{ }}O{H^ - }{\text{ }}\xrightarrow{{}}{\text{ }}C{O_3}^{2 - }{\text{ }} + {\text{ }}{H_2}O$
=> \({n_{C{O_3}^{2 - }}}\)
- Tính \({{n}_{BaC{{O}_{3}}}}\)
So sánh \({n_{C{O_3}^{2 - }}}\) và nBa2+
\(=>{{n}_{BaC{{O}_{3}}}}=>\text{ }{{m}_{BaC{{O}_{3}}}}\)
- \(BTDT:2{n_{B{a^{2 + }}}} + {n_{N{a^ + }}} = {n_{O{H^ - }}}\)
\( = > {\text{2}}{\text{.}}{{\text{n}}_{B{a^{2 + }}}}{\text{ + 1}}{\text{.0}}{\text{,02 = 1}}.{\text{0}},{\text{06 = }} > {{\text{n}}_{B{a^{2 + }}}}{\text{ }} = {\text{ }}0,02(mol)\)
$- {\text{ HCO}}_3^ - {\text{ }} + {\text{ }}O{H^ - }{\text{ }}\xrightarrow{{}}{\text{ }}C{O_3}^{2 - }{\text{ }} + {\text{ }}{H_2}O$
=> \({n_{C{O_3}^{2 - }}}=0,07\)
- \({n_{C{O_3}^{2 - }}}\) > nBa2+
\({n_{Ba}}_{C{O_3}} = {n_{B{a^{2 + }}}} = 0,02mol\)
$= > {m_{BaC{O_3} \downarrow }}{\text{ }} = {\text{ }}0,02.197{\text{ }} = 3,94(g)$
Dung dịch X chứa 0,025 mol CO32-; 0,1 mol Na+ ; 0,25 mol NH4+ và 0,3 mol Cl−. Cho 270 ml dung dịch Ba(OH)2 0,2 M vào và đun nhẹ (giả sử H2O bay hơi không đáng kể).Tổng khối lượng dung dịch X và dung dịch Ba(OH)2 sau quá trình phản ứng giảm đi là:
-
A.
4,215 gam
-
B.
5,296 gam
-
C.
6,761 gam
-
D.
7,015 gam
Đáp án : C
- Khối lượng dung dịch giảm đi chính là khối lượng chất kết tủa và chất khí bay lên
$C{O_3}^{2 - } + B{a^{2 + }}\xrightarrow{{}}BaC{O_3} \downarrow $
$N{H_4}^ + + O{H^ - }\xrightarrow{{}}N{H_3} \uparrow + {H_2}O$
- Tính nBa(OH)2 và nNH3
=> m giảm
- Khối lượng dung dịch giảm đi chính là khối lượng chất kết tủa và chất khí bay lên
${n_{Ba{{(OH)}_2}}} = {\text{ }}0,27.0,2{\text{ }} = {\text{ }}0,054{\text{ }}(mol)$
$-C{O_3}^{2 - } + B{a^{2 + }}\xrightarrow{{}}BaC{O_3} \downarrow $
$N{H_4}^ + + O{H^ - }\xrightarrow{{}}N{H_3} \uparrow + {H_2}O$
$-{m_{BaC{O_3}}} + {m_{N{H_3}}} = 0,025.197 + 0,108.17 = 6,761(g)$
Dung dịch X chứa các ion: Fe3+ ; SO42 ; NH4+; Cl−. Chia dung dịch thành 2 phần bằng nhau:
- Phần 1: Cho tác dụng với lượng dư dung dịch NaOH , đun nóng thu được 0,672 lít khí ở đktc và 1,07 gam kết tủa.
- Phần 2: Tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa.
Tổng khối lượng các muối khan thu được khi cô cạn dung dịch X là (quá trình cô cạn chỉ có nước bay hơi)
-
A.
3,73 gam
-
B.
7,04 gam
-
C.
7,46 gam
-
D.
7,35 gam
Đáp án : C
- Tính số mol \(N{H_4}^ + ,{\text{ }}{n_{F{e^{3 + }}}},{\text{ }}{n_{S{O_4}^{2 - }}}\)
\({n_{N{H_4}^ + }} = {n_{N{H_3}}},{\text{ }}{n_{F{e^{3 + }}}} = {n_{Fe{{(OH)}_3}}},{\text{ }}{n_{S{O_4}^{2 - }}} = {n_{BaS{O_4}}}\)
- Tính số mol Cl-
Bảo toàn điện tích: $3.{n_{F{e^{3 + }}}} + {\text{ }}1.{n_{NH_4^ + }} = {\text{ }}2.{n_{SO_4^{2 - }}} + {\text{ }}1.{n_{C{l^ - }}}$
=> nCl-
- Tính khối lượng phần 1:
Bảo toàn khối lượng trong 1 phần
${m_{F{e^{3 + }}}} + {\text{ }}{{\text{m}}_{NH_4^ + }}{\text{ + }}{{\text{m}}_{SO_4^{2 - }}} + {\text{ }}{{\text{m}}_{C{l^ - }}} $
=> cô cạn dung dịch X thu được: mmuối = 2.m phần 1
- Phần 1: nNH3 = 0,03 mol; nFe(OH)3 = 0,01 mol => nFe3+ = 0,01 mol
NH4+ + OH- → NH3 + H2O
nNH4+ = nNH3 = 0,03 mol
Phần 2: nBaSO4 = 0,02 mol => nSO4 = 0,02 mol
- Bảo toàn điện tích: $3.{n_{F{e^{3 + }}}} + {\text{ }}1.{n_{NH_4^ + }} = {\text{ }}2.{n_{SO_4^{2 - }}} + {\text{ }}1.{n_{C{l^ - }}}$
=> 3.0,01 + 1.0,03 = 2.0,02 + nCl- => nCl- = 0,02 mol
- Bảo toàn khối lượng (trong 1 phần)
${m_{F{e^{3 + }}}} + {\text{ }}{{\text{m}}_{NH_4^ + }}{\text{ + }}{{\text{m}}_{SO_4^{2 - }}} + {\text{ }}{{\text{m}}_{C{l^ - }}} = 0,01.56 + 0,03.18 + 0,02.96 + 0,02.35,5 = 3,73\,\,gam$
=> cô cạn dung dịch X thu được: mmuối = 2.3,73 = 7,46 gam
Cho 22,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thì thu được bao nhiêu gam muối clorua khan?
-
A.
2,66 gam
-
B.
22,6 gam
-
C.
26,6 gam
-
D.
24,6 gam
Đáp án : D
- Muối thu được chứa: Na+; K+; Cl−
- Tính nCl-, mK+ + mNa+
\(\begin{gathered}
{n_{C{l^ - }}} = {\text{ }}2{n_{B{a^{2 + }}}} \hfill \\
{n_{B{a^{2 + }}}} = {n_{BaC{O_3} \downarrow }} = {\text{ }}{n_{C{O_3}^{2 - }}} \hfill \\
\end{gathered} \)
\({m_{hh}} = {m_{N{a^ + }}} + {\text{ }}{m_{{K^ + }}}{\text{ }} + {\text{ }}{m_{C{O_3}^{2 - }}} = > {m_{N{a^ + }}} + {m_{{K^ + }}}\)
- Tính mmuối clorua khan
$= > {m_{muối{\text{ }}clorua}} = {m_{N{a^ + }}} + {\text{ }}{m_{{K^ + }}}{\text{ }} + {\text{ }}{m_{Cl - }}$
- Muối thu được chứa: Na+; K+; Cl−
$- {n_{BaC{O_3} \downarrow }} = {\text{ }}0,2(mol){\text{ }} = > {n_{B{a^{2 + }}}} = {\text{ }}{n_{C{O_3}^{2 - }}} = {\text{ }}0,2{\text{ }}(mol)$
$= > {n_{C{l^ - }}} = {\text{ }}2{n_{B{a^{2 + }}}} = {\text{ }}0,4{\text{ }}(mol)$
$-{m_{hh}} = {m_{N{a^ + }}} + {\text{ }}{m_{{K^ + }}}{\text{ }} + {\text{ }}{m_{C{O_3}^{2 - }}}$
$= > {m_{N{a^ + }}} + {m_{{K^ + }}} = {\text{ }}2,24 - 0,2.60{\text{ }} = {\text{ }}10,4{\text{ }}(g)$
$= > {m_{muối{\text{ }}clorua}} = {\text{ }}10,4 + 0,4.35,5{\text{ }} = {\text{ }}24,6{\text{ }}(g)$
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
-
A.
x=y
-
B.
x=2y
-
C.
2x=y
-
D.
x=3y
Đáp án : B
- Áp dụng bảo toàn nguyên tố
→ dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol
- Áp dụng định luật bảo toàn điện tích :
\(3{n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} = 2{n_{S{O_4}^{2 - }}}\)
=> Mối liên hệ giữa x và y
- Áp dụng bảo toàn nguyên tố
→ dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol
- Áp dụng định luật bảo toàn điện tích :
\(3{n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} = 2{n_{S{O_4}^{2 - }}}\)
=> 3x + 2.2y = 2.(2x + y) → x = 2y
Dung dịch B chứa ba ion K+; Na+; PO43-. 1 lít dung dịch B tác dụng với CaCl2 dư thu được 31 gam kết tủa. Mặt khác nếu cô cạn 1 lít dung dịch B thu được 37,6 gam chất rắn khan. Nồng độ của 3 ion K+; Na+; PO43- lần lượt là:
-
A.
0,3M; 0,3M; 0,6M
-
B.
0,1M; 0,1M; 0,2M
-
C.
0,3M; 0,3M; 0,2M
-
D.
0,3M; 0,2M; 0,2M
Đáp án : C
- Tính nồng độ \(P{O_4}^{3 - }\)
\({n_{P{O_4}^{3 - }}} = 2{n_{C{a_3}{{(P{O_4})}_2}}}\)
=> CM
- Tính nNa+ và nK+
\(\begin{gathered}BTĐT:{n_{{K^ + }}} + {n_{N{a^ + }}} = 3{n_{P{O_4}^{3 - }}} \hfill \\BTKL:m{\,_{ran\,khan}} = {m_{{K^ + }}} + {m_{N{a^ + }}} + {m_{P{O_4}^{3 - }}} \hfill \\
\end{gathered} \)
=> \({n_{{K^ + }}}\, và \,\,{n_{N{a^ + }}}\)
=> CM
$-{n_{C{a_3}{{(P{O_4})}_2}}}{\text{ }} = {\text{ }}0,1{\text{ }}(mol){\text{ }} = > {\text{ }}{n_{P{O_4}^{3 - }}}{\text{ }} = {\text{ }}0,2{\text{ }}(mol){\text{ }} = > {\text{ }}{C_M}{\text{ }} = {\text{ }}0,2{\text{ }}M$
- Áp dụng BTĐT và BTKL ta có
\(\left\{ \begin{gathered}
{n_{{K^ + }}} + \,{n_{N{a^ + }}} = 3{n_{P{O_4}^{3 - }}} \hfill \\
m{\,_{ran\,khan}} = {m_{{K^ + }}} + {m_{N{a^ + }}} + {m_{P{O_4}^{3 - }}} \hfill \\
\end{gathered} \right.\)
$=>\left\{ {\begin{array}{*{20}{c}}{1.x + 1.y{\text{ }} = {\text{ }}3.0,2} \\ {39x + 23y + 95.0,2{\text{ }} = {\text{ }}37,6} \end{array}} \right.{\text{ }} = > {\text{ }}\left\{ {\begin{array}{*{20}{c}}{x{\text{ }} = {\text{ }}0,3{\text{ }} = {\text{ }}{n_{{K^ + }}} = > {\text{ }}{C_M} = {\text{ }}0,3{\text{ }}M} \\ {y{\text{ }} = {\text{ }}0,3{\text{ }} = {\text{ }}{n_{N{a^ + }}}{\text{ }} = >{\text{ }}{C_M} = {\text{ }}0,3{\text{ }}M} \end{array}} \right.$
Phản ứng nào sau đây không phải là phản ứng trao đổi?
-
A.
FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
-
B.
NH4Cl + NaOH → NaCl + NH3 + H2O.
-
C.
Na2SO4 + BaCl2 → BaSO4 + 2NaCl.
-
D.
2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O.
Đáp án : D
Phản ứng trao đổi là phản ứng hóa học, trong đó các chất trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi số oxi hóa. Từ sự trao đổi này, tạo ra các sản phẩm mới.
Phản ứng: 2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O là phản ứng oxi hóa khử, không phải pư trao đổi, vì số oxi hóa của các nguyên tố trước và sau phản ứng thay đổi
Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
-
A.
NaClO và AlCl3.
-
B.
NaOH và KCl.
-
C.
KNO3 và HCl.
-
D.
Ba(OH)2 và AlCl3.
Đáp án : D
Điều kiện để các chất cùng tồn tại trong một dung dịch là chúng không được phản ứng với nhau.
Ba(OH)2 và AlCl3 không thể cùng tồn tại trong một dung dịch vì chúng phản ứng với nhau:
3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
-
A.
các chất phản ứng phải là những chất dễ tan.
-
B.
các chất phản ứng phải là những chất điện li mạnh.
-
C.
một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
-
D.
phản ứng không phải là thuận nghịch.
Đáp án : C
Phản ứng trao đổi ion trong dung dịch các chất điện ly chỉ xảy ra khi có ít nhất một trong các điều kiện: tạo thành chất kết tủa, chất khí hoặc chất điện ly yếu.
\( \to\) Phản ứng trao đổi ion trong dung dịch các chất điện ly chỉ xảy ra khi một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng
Phương trình ion rút gọn của phản ứng cho biết
-
A.
Những ion nào tồn tại trong dung dịch.
-
B.
Nồng độ những ion nào trong dung dịch lớn nhất.
-
C.
Bản chất của phản ứng trong dung dịch các chất điện li.
-
D.
Không tồn tại phân tử trong dung dịch các chất điện li.
Đáp án : C
Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch các chất điện ly
Ion \(CO_3^{2 - }\) cùng tồn tại với các ion sau trong một dung dịch:
-
A.
\(NH_4^ + \), Na+, K+.
-
B.
Cu2+, Mg2+, Al3+.
-
C.
Fe2+, Zn2+, Al3+ .
-
D.
Fe3+, \(H{\text{S}}O_4^ - \).
Đáp án : A
Đáp án B:
\(C{u^{2 + }} + CO_3^{2 - } \to CuC{{\text{O}}_3}\)
\(M{g^{2 + }} + CO_3^{2 - } \to MgC{O_3}\)
\(2{\text{A}}{l^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2{\text{A}}l{(OH)_3} + 3C{O_2}\)
Đáp án C:
\(2F{{\text{e}}^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2F{\text{e}}{(OH)_3} + 3C{O_2}\)
\(Z{n^{2 + }} + CO_3^{2 - } \to ZnC{O_3}\)
\(2{\text{A}}{l^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2{\text{A}}l{(OH)_3} + 3C{O_2}\)
Đáp án D:
\(2F{{\text{e}}^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2F{\text{e}}{(OH)_3} + 3C{O_2}\)
\(CO_3^{2 - } + 2H{\text{S}}O_4^ - \to C{O_2} + {H_2}O + SO_4^{2 - }\)
Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
-
A.
AlCl3 và CuSO4.
-
B.
NH3 và AgNO3.
-
C.
Na2ZnO2 và HCl.
-
D.
NaHSO4 và NaHCO3.
Đáp án : A
B. AgNO3 + H2O + 3NH3 → NH4NO3 + (Ag(NH3)2)OH
C. Na2ZnO2 + 2HCl → 2NaCl + Zn(OH)2
Nếu HCl dư : Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
D. NaHCO3 + NaHSO4 → H2O + Na2SO4 + CO2
Trong các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2, có bao nhiêu chất tác dụng được với dung dịch Ba(HCO3)2?
-
A.
4
-
B.
5
-
C.
2
-
D.
3
Đáp án : A
Các chất phản ứng: HNO3, Na2SO4, Ca(OH)2, KHSO4
\(2HN{O_3} + Ba{(HC{O_3})_2} \to Ba{(N{O_3})_2} + C{O_2} + {H_2}O\)
\(N{a_2}S{O_4} + Ba{(HC{O_3})_2} \to BaS{O_4} + 2NaHC{O_3}\)
\(Ca{(OH)_2} + Ba{(HC{O_3})_2} \to CaC{{\text{O}}_3} + BaC{{\text{O}}_3} + {H_2}O\)
\(2KH{\text{S}}{O_4} + Ba{(HC{O_3})_2} \to {K_2}S{O_4} + BaS{O_4} + C{O_2} + {H_2}O\)
Trộn các cặp dung dịch các chất sau với nhau:
1) NaHSO4 + NaHSO3 2) Na3PO4 + K2SO4
3) AgNO3 + Fe(NO3)2 4) C6H5ONa + H2O
5) CuS + HNO3 6) BaHPO4 + H3PO4
7) NH4Cl + NaNO2 (đun nóng) 8) Ca(HCO3)2 + NaOH
9) NaOH + Al(OH)3 10) MgSO4 + HCl.
Số phản ứng xảy ra là
-
A.
8
-
B.
5
-
C.
7
-
D.
6
Đáp án : B
Các phản ứng xảy ra: (1); (3); (7); (8); (9)
Cho dãy các chất: H2SO4,KOH, Ca(NO3)2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
-
A.
4
-
B.
6
-
C.
3
-
D.
5
Đáp án : D
Các phản ứng tạo kết tủa:
H2SO4 + BaCl2 → BaSO4↓ + 2 HCl
H2O + SO3 + BaCl2 → BaSO4↓ + 2 HCl
NaHSO4 + BaCl2 → BaSO4↓ + NaCl + HCl
Na2SO3 + BaCl2 → BaSO3↓ + 2 NaCl
K2SO4 + BaCl2 → BaSO4 ↓ + 2 KCl
Phương trình phân tử: BaHPO4 + H2SO4 →BaSO4 ↓+ H3PO4 tương ứng với phương trình ion thu gọn nào sau đây?
-
A.
\(B{a^{2 + }} + SO_4^{2 - } \to BaS{O_4}\)
-
B.
\(B{a^{2 + }} + HPO_4^{2 - } + SO_4^{2 - } + 2{H^ + } \to BaS{O_4} + {H_3}P{O_4}\)
-
C.
\(HPO_4^{2 - } + 2{H^ + } \to {H_3}P{O_4}\)
-
D.
\(B{a^{2 + }} + PO_4^{3 - } + SO_4^{2 - } + 3{H^ + } \to BaS{O_4} + {H_3}P{O_4}\)
Đáp án : B
Phương trình ion đầy đủ: \(B{a^{2 + }} + HPO_4^{2 - } + 2{H^ + } + SO_4^{2 - } \to BaS{O_4} + {H_3}P{O_4}\)
Phương trình ion thu gọn: \(B{a^{2 + }} + HPO_4^{2 - } + 2{H^ + } + SO_4^{2 - } \to BaS{O_4} + {H_3}P{O_4}\)
Dung dịch NaHSO4 tác dụng được với tất cá các chất có trong nhóm nào sau đây?
-
A.
NaNO3, AlCl3, BaCl2, NaOH, KOH.
-
B.
BaCl2, NaOH, FeCl3, Fe(NO3)3 , KCl.
-
C.
NaHCO3, BaCl2, Na2S, Na2CO3, KOH.
-
D.
Na2S, Cu(OH)2, Na2CO3, FeCl2, NaNO3.
Đáp án : C
A. NaHSO4 không phản ứng với AlCl3; NaNO3
B. NaHSO4 không phản ứng với FeCl3, Fe(NO3)3 , KCl.
C. Tất cả các chất đều phản ứng với NaHSO4
D. NaHSO4 không phản ứng với NaNO3, FeCl2
Cho sơ đồ sau: X + Y → CaCO3 + BaCO3 + H2O
X,Y có thể là
-
A.
Ba(AlO2)2 và Ca(OH)2
-
B.
Ba(OH)2 và Ca(HCO3)2
-
C.
Ba(OH)2 và CO2
-
D.
BaCl2 và Ca(HCO3)2
Đáp án : B
A. không có phản ứng
B. Ba(OH)2 + Ca(HCO3)2 → CaCO3 + BaCO3 +2 H2O
C. \(Ba{(OH)_2} + C{O_2} \to BaC{{\text{O}}_3} + {H_2}O\)
Hoặc \(Ba{(OH)_2} + C{O_2} \to Ba{(HC{O_3})_2}\)
D. không có phản ứng
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
-
A.
các chất phản ứng phải là chất điện li mạnh.
-
B.
một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
-
C.
các chất phản ứng phải là những chất dễ tan.
-
D.
phản ứng phải là thuận nghịch.
Đáp án : B
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng?
-
A.
KNO3.
-
B.
AgNO3.
-
C.
NaOH.
-
D.
Na2CO3.
Đáp án : A
Điều kiện xảy ra phản ứng trao đổi:
Phản ứng trao đổi xảy ra khi thỏa mãn ít nhất 1 trong 3 điều kiện sau:
1. Tạo chất khí
2. Tạo kết tủa
3. Tạo chất điện li yếu
A. KNO3 không phản ứng vì không thỏa mãn điều kiện của phản ứng trao đổi.
B. AgNO3 có phản ứng vì tạo kết tủa (AgCl).
C. NaOH có phản ứng vì tạo chất điện li yếu (H2O).
D. Na2CO3 có phản ứng vì tạo ra khí (CO2).
Một dung dịch chứa x mol Na+, y mol Ca2+, z mol HCO3-, t mol Cl-. Hệ thức quan hệ giữa x, y , z, t được xác định là:
-
A.
x + 2z = y + 2t.
-
B.
z + 2x = y + t.
-
C.
x + 2y = z + 2t.
-
D.
x + 2y = z + t.
Đáp án : D
Áp dụng định luật bảo toàn điện tích.
Áp dụng định luật bảo toàn điện tích trong một dung dịch ta có:
n (+) = n (-) => \({n_{N{a^ + }}} + 2{n_{C{a^{2 + }}}} = {n_{HCO_3^ - }} + {n_{C{l^ - }}}\)
=> x + 2y = z + t
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
-
A.
0,1
-
B.
1
-
C.
10
-
D.
100
Đáp án : D
Tính theo PTHH: NaOH + HCl → NaCl + H2O
nHCl = 3.0,01 = 0,03 mol
PTHH: NaOH + HCl → NaCl + H2O
nNaOH = nHCl = 0,03 mol
=> V dd NaOH = n : CM = 0,03 : 0,3 = 0,1 lít = 100 ml
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
-
A.
C và CuO
-
B.
CO2 và NaOH.
-
C.
CO và Fe2O3.
-
D.
C và H2O.
Đáp án : D
Ta có: C + H2O → CO + H2 hoặc C + 2H2O → CO2 + 2H2
=> Sản phẩm đều là chất khí
Phương trình hóa học nào viết sai so với phản ứng xảy ra?
-
A.
CaCl2 + CO2 + H2O → CaCO3 + 2HCl
-
B.
BaCl2 + H2SO4 → BaSO4 + 2HCl
-
C.
FeS + 2HCl → FeCl2 + H2S
-
D.
CH3COONa + HCl → CH3COOH + NaCl
Đáp án : A
Một phản ứng trao đổi xảy ra khi thỏa mãn ít nhất 1 trong số các điều kiện sau:
+ Tạo chất khí
+ Tạo chất kết tủa
+ Tạo chất điện li yếu
(Trong đó các chất sau phản ứng không phản ứng được với nhau)
Phản ứng A không xảy ra do CaCO3 lại tan được trong HCl
Cho phản ứng NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
-
A.
2KOH + FeCl2 → Fe(OH)2 + 2KCl.
-
B.
NaOH + NH4Cl → NaCl + NH3 + H2O.
-
C.
KOH + HNO3 → KNO3 + H2O.
-
D.
NaOH + NaHCO3 → Na2CO3 + H2O.
Đáp án : C
Nắm được cách chuyển đổi từ phương trình phân tử sang phương trình ion rút gọn
Phương trình ion rút gọn của phản ứng NaOH + HCl → NaCl + H2O là:
OH- + H+ → H2O
A. 2OH- + Fe2+ → Fe(OH)2
B. OH- + NH4+ → NH3 + H2O
C. OH- + H+ → H2O
D. OH- + HCO3- → CO32- + H2O
Trung hòa 10 ml dung dịch HCl 1M cần 20 ml dung dịch KOH nồng độ a mol/l. Giá trị của a là
-
A.
0,5.
-
B.
2,0.
-
C.
0,2.
-
D.
1,0.
Đáp án : A
Từ nHCl → nH+
H+ + OH- → H2O → nOH-
nHCl = 0,01 mol → nH+
H+ + OH- → H2O
→ nOH- = → nH+ = 0,01 mol → a = 0,01 : 0,02 = 0,5M
Cần thêm ít nhất bao nhiêu lít NH3 (đktc) vào 250 ml dung dịch Al2(SO4)3 0,2M để làm kết tủa hoàn toàn ion nhôm dưới dạng Al(OH)3.
-
A.
8,96 lít
-
B.
3,36 lít
-
C.
4,48 lít
-
D.
6,72 lít
Đáp án : D
Tính theo PTHH: 6NH3 + 6H2O + Al2(SO4)3 → 2Al(OH)3 + 3(NH4)2SO4
6NH3 + 6H2O + Al2(SO4)3 → 2Al(OH)3 + 3(NH4)2SO4
0,3 mol ← 0,05 mol
→ VNH3 = 0,3 .22,4 = 6,72 lít
Dung dịch X được tạo ra từ 2 muối chứa đồng thời các ion: Al3+, Fe2+, Cl-, SO42-. Cho dung dịch BaCl2 dư vào dung dịch chứa 200 ml dung dịch X thu được 13,98 gam kết tủa. Mặt khác, cho dung dịch Ba(OH)2 đến dư vào 200 ml dung dịch X thu được 21,18 gam kết tủa. Nồng độ mol/l của Cl- là?
-
A.
0,16M
-
B.
0,4M
-
C.
0,12M
-
D.
0,8M
Đáp án : D
200 ml X + BaCl2 có Ba2+ + SO42-→ BaSO4
nBaSO4 → nSO42-
200 ml X + Ba(OH)2 thì Ba2+ + SO42-→ BaSO4
Fe2+ + 2OH- → Fe(OH)2
→ mkết tủa = mBaSO4 + mFe(OH)2 → mFe(OH)2 → mFe(OH)2 → nFe(OH)2 → nFe2+
So sánh số mol Fe2+ và SO42-
Nếu số mol 2 ion bằng nhau thì có muối FeSO4 và muối còn lại AlCl3
Nếu số mol 2 ion khác nhau thì có muối FeCl2 và Al2(SO4)3
*Cho 200 ml X tác dụng với BaCl2 dư: nBaSO4 = 0,06 mol
Ba2+ + SO42-→ BaSO4
0,06 ← 0,06
*200 ml X tác dụng với Ba(OH)2 dư:
Ba2+ + SO42-→ BaSO4
Fe2+ + 2OH- → Fe(OH)2
→ mkết tủa = mBaSO4 + mFe(OH)2 → 0,06.233 + mFe(OH)2 = 21,18 → mFe(OH)2 = 7,2 gam
→ nFe(OH)2 = 0,08 mol → nFe2+ = 0,08 mol
Vì số mol Fe2+ và số mol SO42- khác nhau nên muối ban đầu cho vào X không có FeSO4
→ 2 muối là FeCl2 và Al2(SO4)3
→ nCl-= 2nFe2+ = 2.0,08 = 0,16 mol → [Cl-] = 0,16 : 0,2 = 0,8M
Nhỏ từ từ 0,125 lít dung dịch Ba(OH)2 1M vào dung dịch gồm 0,024 mol FeCl3; 0,016 mol Al2(SO4)3 và 0,04 mol H2SO4 thu được m gam kết tủa. Tính giá trị m?
-
A.
5,064
-
B.
20,504
-
C.
25,412
-
D.
4,908
Đáp án : C
Các phản ứng giữa các ion:
OH- + H+ → H2O
Fe3+ + 3OH- → Fe(OH)3
Al3+ + 3OH- → Al(OH)3
→ nếu nOH- dư → Al(OH)3 hòa tan một phần
OH- + Al(OH)3 → AlO2- + 2H2O
Ba2+ +SO42- → BaSO4
Ta có: nBa(OH)2 = 0,125 mol → Ba2+: 0,125 mol và OH-: 0,25 mol
Dung dịch còn lại có Fe3+: 0,024 mol; Al3+: 0,032 mol; SO42-: 0,088 mol; Cl-: 0,072 mol và H+: 0,08 mol
Khi nhỏ từ từ Ba(OH)2 vào thì
OH- + H+ → H2O
0,08 ← 0,08
Fe3+ + 3OH- → Fe(OH)3
0,024 → 0,072 → 0,072
Al3+ + 3OH- → Al(OH)3
0,032 → 0,096 → 0,032
→ nOH- dư = 0,25 - 0,08 - 0,072 - 0,096 = 0,002 mol → Al(OH)3 hòa tan một phần
OH- + Al(OH)3 → AlO2- + 2H2O
0,002 → 0,002 mol
Ba2+ + SO42- → BaSO4
0,088 ← 0,088 → 0,088
→ Kết tủa tạo ra có 0,024 mol Fe(OH)3; 0,03 mol Al(OH)3 và 0,088 mol BaSO4
→ m = 25,412 gam
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn thu được 16,5 gam kết tủa gồm 2 chất. Mặt khác cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi thu được lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây?
-
A.
32,3
-
B.
38,6
-
C.
46,3
-
D.
27,4
Đáp án : B
- Đặt n Al là x mol; n Mg là y mol
- Biện luận OH- có tham gia phản ứng hòa tan Al(OH)3
- Gọi n OH- có tham gia phản ứng hòa tan Al(OH)3 là z
* Áp dung BTDT, BTKL lập hệ tìm ra x,y,z
Đặt V dung dịch chứa KOH, Ba(OH)2 là a lít
*Khi cho dung dịch chứa 0,8a mol KOH, 0,1a mol Ba(OH)2 vào dung dịch X để thu được lượng kết tủa lớn nhất:
Trường hợp 1: Kết tủa là Al(OH)3 cực đại, Mg(OH)2, BaSO4
Trường hợp 2: Kết tủa là BaSO4 cực đại, Mg(OH)2
Ta tính lượng kết tủa thu được trong 2 trường hợp để tìm ra trường hợp kết tủa cực đại.
Từ đó tính được khối lượng chất rắn thu được sau khi nung đến khối lượng không đổi.
Đặt số mol Al là x mol; số mol Mg là y mol
Ta có: nHCl = 0,52 mol; nH2SO4 = 0,14 mol
Dung dịch X chứa {Al3+ (x mol); Mg2+ (y mol); H+ dư (0,8-3x-2y mol); Cl-, SO42-}
*Khi cho 0,85 mol NaOH vào dung dịch X: Đặt nAl(OH)3 (4)= z mol
Ta thấy:
+) nH+ dư + 3nAl3+ + 2nMg2+ = (0,8-3x-2y) + 3x + 2y = 0,8 mol
+) nOH- = 0,85 mol
=> nOH- > nH+ dư + 3nAl3+ + 2nMg2+ => OH- dư, đã có sự hòa tan Al(OH)3
OH- + H+ → H2O (1)
(0,8-3x-2y) (0,8-3x-2y) mol
3OH- + Al3+ → Al(OH)3 ↓ (2)
3x ← x x mol
2OH-+ Mg2+ → Mg(OH)2 (3)
2y ← y y mol
Al(OH)3 + OH- → Al(OH)3 (4)
z → z mol
Kết tủa thu được sau phản ứng có y mol Mg(OH)2 và (x-z) mol Al(OH)3
Ta có hệ:
(1) m hh = 27x + 24y = 7,65
(2) m kết tủa = 58y + 78(x - z) = 16,5
(3) nOH-= 0,8 - 3x - 2y + 3x + 2y + z = 0,85 mol
Giải hệ trên ta có: x = 0,15; y =0,15 và z = 0,05 mol
Vậy dung dịch X có chứa 0,05 mol H+, 0,15 mol Al3+, 0,15 mol Mg2+, 0,14 mol SO42-, 0,52 mol Cl-
Đặt thể tích dung dịch chứa KOH, Ba(OH)2 là a lít
*Khi cho dung dịch chứa 0,8a mol KOH, 0,1a mol Ba(OH)2 vào dung dịch X để thu được lượng kết tủa lớn nhất:
- Trường hợp 1: Kết tủa là Al(OH)3 cực đại, Mg(OH)2, BaSO4
OH- + H+ → H2O (5)
3OH-+ Al3+ → Al(OH)3 ↓ (6)
2OH-+ Mg2+ → Mg(OH)2 ↓ (7)
→ nOH-= 0,05 + 3.0,15 + 2.0,15 = 0,8 mol
→ 0,8a + 2.0,1a = 0,8 mol → a = 0,8 lít → nBa(OH)2 = 0,1a = 0,08 mol
Ba2+ + SO42- → BaSO4↓
0,08 0,14 0,08 mol
→ mkết tủa = mBaSO4 + mAl(OH)3 + mMg(OH)2 = 0,08.233 + 0,15.78 + 0,15.58 = 39,04 gam
Khi nung kết tủa đến khối lượng không đổi thu được: BaSO4, Al2O3 và MgO
→ mchất rắn = mAl2O3 + mMgO + mBaSO4
= 0,075.102 + 0,15.40 + 0,08.233 = 32,29 gam
Trường hợp 2: Kết tủa là BaSO4 cực đại, Mg(OH)2
→ nBa2+ max = nSO4(2-) = 0,14 mol → 0,1a = 0,14 → a =1,4
→ nOH- = 0,8a + 2.0,1a = a =1,4 mol
Khi đó Al(OH)3 tan hết.
Kết tủa thu được có 0,14 mol BaSO4 và 0,15 mol Mg(OH)2
→ mkết tủa = 0,14.233 + 0,15.58 = 41,32 gam > 39,04 gam
Do đó ta chọn trường hợp 2 sẽ cho khối lượng kết tủa cực đại
Khi đó: mchất rắn = mBaSO4 + mMgO = 0,14.233 + 0,15.40 = 38,62 gam
Vậy giá trị của m gần nhất với giá trị 38,6
Dung dịch X gồm 0,25 mol Ba2+; 1,3 mol Na+; a mol OH- và b mol Cl-. Cho 400 ml dung dịch Y gồm H2SO4 0,25M; HCl 0,25M và ZnSO4 1M vào dung dịch X. Sau khi các phản ứng kết thúc, thu được kết tủa G. Nung toàn bộ G đến khối lượng không đổi thu được 69,59 gam chất rắn H. Giá trị của b là:
-
A.
0,58 hoặc 1,62
-
B.
1,52 hoặc 0,48
-
C.
0,18 hoặc 0,58
-
D.
0,18 hoặc 1,22
Đáp án : D
Áp dụng định luật bảo toàn điện tích dung dịch X.
Xét Y: \({{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}{\rm{ = 0,5 mol}};{\rm{ }}{{\rm{n}}_{{H^{\rm{ + }}}}}{\rm{ = 0,3 mol; }}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}}{\rm{ = 0,4 mol;}}\)
Khi cho X + Y => \({{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}{{\rm{n}}_{B{a^{{\rm{2 + }}}}}}{\rm{ = 0,25 mol}}\)
Sau khi nung thu được H. ta có: \({{\rm{m}}_{\rm{H}}}{\rm{ = }}{{\rm{m}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ + }}{{\rm{m}}_{{\rm{ZnO}}}} \Rightarrow {{\rm{n}}_{{\rm{ZnO}}}} = {{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,14 mol}}\)
Xét 2 trường hợp :
Trường hợp 1: Tạo kết tủa và kết tủa không tan
Trường hợp 2: Kết tủa tan một phần
Xét X: Theo ĐLBTĐT ta có: 0,25.2 + 1,3 = a + b = 1,8 mol
Xét Y: \({{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}{\rm{ = 0,5 mol}};{\rm{ }}{{\rm{n}}_{{H^{\rm{ + }}}}}{\rm{ = 0,3 mol; }}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}}{\rm{ = 0,4 mol;}}\)
Khi cho X + Y => \({{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}{{\rm{n}}_{B{a^{{\rm{2 + }}}}}}{\rm{ = 0,25 mol}}\)
Sau khi nung thu được H. ta có: \({{\rm{m}}_{\rm{H}}}{\rm{ = }}{{\rm{m}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ + }}{{\rm{m}}_{{\rm{ZnO}}}} \Rightarrow {{\rm{n}}_{{\rm{ZnO}}}} = {{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,14 mol}}\)
Trường hợp 1: Tạo kết tủa và kết tủa không tan => OH- hết
\( \Rightarrow a = {{\rm{n}}_{{H^ + }}}{\rm{ + 2}}{{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,58 mol; b = 1,22 mol}}\)
Trường hợp 2: Kết tủa tan một phần
\( \Rightarrow a = {{\rm{n}}_{{H^ + }}}{\rm{ + 4}}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}} - {\rm{2}}{{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 1,62 mol; b = 0,18 mol}}\)
Dung dịch X gồm NaOH 0,2M và Ba(OH)2 0,05M. Dung dịch Y gồm Al2(SO4)3 0,4M và H2SO4 xM. Trộn 0,1 lít dung dịch Y với 1 lít dung dịch X thu được 16,33 gam kết tủa. Giá trị của x là:
-
A.
0,2M
-
B.
0,2M; 0,6M
-
C.
0,2M, 0,4M
-
D.
0,2M, 0,5M
Đáp án : B
Tính được n BaSO4 => nAl(OH)3
=> Trong dung dịch còn Al3+ nên có 2 trường hợp xảy ra:
TH1: Kết tủa không bị hòa tan
TH2: Kết tủa bị hòa tan 1 phần
Khi đó ta tìm được hai giá trị của x.
nNaOH = 0,2 mol ; nBa(OH)2 = 0,05 mol; nOH- = 0,3 mol
nAl2(SO4)3 = 0,04 mol; nH2SO4 = 0,1.x mol; nH+ = 0,2x mol
H+ + OH- → H2O
0,2x 0,2x mol
Ba2+ + SO42- → BaSO4
0,05 0,12 0,05
Suy ra nAl(OH)3 = 0,06 mol < nAl3+ nên có 2 trường hợp xảy ra:
TH1: Kết tủa không bị hòa tan
Al3+ + 3OH- → Al(OH)3
0,08 0,18← 0,06 mol
nOH- tổng = 0,22x + 0,18 = 0,3 suy ra x = 0,6M
TH2: Kết tủa bị hòa tan 1 phần
Al3+ + 3OH- → Al(OH)3
0,08 0,24 0,08
Al(OH)3 + OH- → AlO2- + 2H2O
0,02 0,02
nOH- tổng = 0,2x + 0,24 + 0,02 = 0,3 suy ra x = 0,2 M
Dung dịch X chứa các cation gồm Mg2+, Ba2+, Ca2+ và các anion gồm Cl- và NO3-. Thêm từ từ 250 ml dung dịch Na2CO3 1M vào dung dịch X thì thu được lượng kết tủa lớn nhất. Tổng số mol các anion có trong dung dịch X là:
-
A.
1,0.
-
B.
0,25.
-
C.
0,75.
-
D.
0,5.
Đáp án : D
Viết các PTHH xảy ra và áp dụng định luật bảo toàn điện tích để tìm tổng số mol các anion trong X.
Mg2+ + CO32- → MgCO3
Ba2+ + CO32- → BaCO3
Ca2+ + CO32- → CaCO3
Ta có: nMg2+ + nBa2+ + nCa2+ = nCO3 2- = nNa2CO3= 0,25 mol
Áp dụng định luật bảo toàn điện tích với dung dịch X ta có:
2. (nMg2+ + nBa2+ + nCa2+)= nCl- + nNO3-
→ nCl- + nNO3- = 0,5 mol
Trộn lẫn hỗn hợp các ion sau:
(I) K+, CO32-, S2- với H+, Cl-, NO3-
(II) Na+, Ba2+, OH- với H+, Cl-, SO42-
(III) NH4+, H+, SO42- với Na+, Ba2+, OH-
(IV) H+, Fe2+, SO42- với Ba2+, K+, OH-
(V) K+, Na+, HSO3- với Ba2+, Ca2+, OH-
(VI) Cu2+, Zn2+, Cl- với K+, Na+, OH-
Trường hợp có thể xảy ra 3 phản ứng là :
-
A.
I, II, VI
-
B.
III, IV, V, VI
-
C.
IV, V, VI
-
D.
III, IV, VI
Đáp án : B
Dựa vào điều kiện phản ứng xảy ra trong dung dịch để tìm các trường hợp xảy ra phản ứng, chú ý một số hiđroxit lưỡng tính.
(III) NH4+, H+, SO42- với Na+, Ba2+, OH-
H+ + OH- → H2O
Ba2+ + SO42- → BaSO4
NH4+ + OH- → NH3 + H2O
(IV) H+, Fe2+, SO42- với Ba2+, K+, OH-
H+ + OH- → H2O
Ba2+ + SO42- → BaSO4
Fe2+ + 2OH- → Fe(OH)2
(V) K+, Na+, HSO3- với Ba2+, Ca2+, OH-
HSO3- + OH- → SO32- + H2O
Ba2+ + SO32- → BaSO3
Ca2+ + SO32- → CaSO3
(VI) Cu2+, Zn2+, Cl- với K+, Na+, OH-
Cu2+ + 2OH- → Cu(OH)2
Zn2+ + 2OH- → Zn(OH)2
Zn(OH)2 + 2OH- → ZnO22- + 2H2O
Có 2 dung dịch chứa 2 cation và 2 anion không trùng nhau trong các ion sau: K+ (0,15 mol), Mg2+ (0,1 mol), NH4+ (0,25 mol), H+ (0,25 mol), Cl- (0,1 mol), SO42- (0,075 mol), NO3- (0,25 mol), CO32- (0,15 mol). Một trong 2 dung dịch trên chứa các ion nào dưới đây?
-
A.
K+, Mg2+, SO42-, Cl-
-
B.
K+, NH4+, CO32-, Cl-
-
C.
NH4+, H+, NO3-, SO42-
-
D.
Mg2+, H+, SO42-, Cl-
Đáp án : B
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn điện tích được thỏa mãn.
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn điện tích được thỏa mãn.
- Xét đáp án A: Tổng số mol điện tích dương không bằng tổng số mol điện tích âm nên không tồn tại dung dịch này.
- Xét đáp án B: Dung dịch tồn tại vì các ion không phản ứng với nhau và định luật bảo toàn điện tích được thỏa mãn.
- Xét đáp án C: Tổng số mol điện tích dương không bằng tổng số mol điện tích âm nên không tồn tại dung dịch này.
- Xét đáp án D: Tổng số mol điện tích dương không bằng tổng số mol điện tích âm nên không tồn tại dung dịch này.
Cho dãy các ion sau:
(a) H+, Fe3+, NO3-, SO42- (b) Ag+, Na+, NO3-, Cl-
(c) Al3+, NH4+, Br-+, OH- (d) Mg2+, K+, SO42-, PO43-
(e) K+, HPO42-, Na+, OH- (g) Fe2+, Na+, HSO4-, NO3-
(h) Ag+, NH4+, SO42-, I- (i) Mg2+, Na+, SO42-
Số dãy gồm các ion cùng tồn tại trong 1 dung dịch là:
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : A
Các ion cùng tồn tại trong 1 dung dịch là các ion không phản ứng với nhau tạo chất kết tủa, chất khí hoặc chất điện li yếu.
(a) Các ion không phản ứng với nhau tạo chất kết tủa, chất khí hoặc chất điện li yếu nên các ion này cùng tồn tại trong 1 dung dịch.
(b) Ag+ + Cl- → AgCl ↓ nên các ion không cùng tồn tại trong 1 dung dịch.
(c) NH4+ + OH- → NH3 ↑ + H2O nên các ion không cùng tồn tại trong 1 dung dịch.
(d) 3Mg2+ + 2PO43- → Mg3(PO4)2 ↓ nên các ion không cùng tồn tại trong 1 dung dịch.
(e) HPO42- + OH- → PO43- + H2O nên các ion không cùng tồn tại trong 1 dung dịch.
(g) 4HSO4- + NO3- + 3Fe2+ → 3Fe3+ + 4SO42- + NO + 2H2O nên các ion không cùng tồn tại trong 1 dung dịch.
(h) Ag+ + I- → AgI↓ nên các ion không cùng tồn tại trong 1 dung dịch.
(i) Các ion không phản ứng với nhau tạo chất kết tủa, chất khí hoặc chất điện li yếu nên các ion này cùng tồn tại trong 1 dung dịch.
Vậy các ion cùng tồn tại trong 1 dung dịch là: (a), (i) (Có 2 dãy thỏa mãn).
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
-
A.
1,5M.
-
B.
2M.
-
C.
1M.
-
D.
1,75M.
Đáp án : C
MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion:
MgCl2 → Mg2+ + 2Cl-
NaCl → Na+ + Cl-
nMgCl2 = 0,15.0,5 = 0,075 mol; nNaCl = 0,05.1 = 0,05 mol
MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion:
MgCl2 → Mg2+ + 2Cl-
0,075 → 0,15 (mol)
NaCl → Na+ + Cl-
0,05 → 0,05 (mol)
=> nCl- = 0,15 + 0,05 = 0,2 mol
=> [Cl-] = n : V = 0,2 : (0,15 + 0,05) = 1M
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
-
A.
dd 1 : Fe2+ ; H+ ; SO42- ; Cl- và dd 2 : K+ ; NH4+ ; CO32- ; NO3-
-
B.
dd 1 : NH4+ ; H+ ; SO42- ; CO32- và dd 2 : K+ ; Fe2+ ; NO3- ; Cl-
-
C.
dd 1 : Fe2+ ; H+ ; NO3- ; SO42- và dd 2 : K+ ; NH4+ ; CO32- ; Cl-
-
D.
dd 1 : Fe2+ ; K+ ; SO42- ; NO3- và dd 2 : H+ ; NH4+ ; CO32- ; Cl-
Đáp án : A
H+ và CO32- không thể cùng tồn tại trong cùng một dung dịch
Tương tự với Fe2+ ; H+ ; NO3- cũng không thể cùng tồn tại trong một dung dịch
H+ + CO32- → HCO3-
3Fe2+ + 4H+ + NO3- → 3Fe3+ NO + 2H2O
Hỗn hợp X gồm Na và Ba có tỉ lệ mol 1 : 1. Hòa tan một lượng X vào nước được 3,36 lít H2 (đktc) và dung dịch Y. Cho 4,48 lít CO2 hấp thụ hết vào dung dịch Y thì thu được m gam kết tủa. Giá trị của m là:
-
A.
1,97 gam.
-
B.
39,4 gam.
-
C.
19,7 gam.
-
D.
3,94 gam.
Đáp án : C
- Tính được nNa , nBa => nOH-
- Từ n OH-, n CO2 => Sau phản ứng tạo ra cả 2 muối axit và trung hòa (Viết phương trình ion thu gọn)
- Gọi n HCO3-, n CO32- lần lượt là b, a mol
=> a, b => Khối lượng kết tủa
Đặt số mol mỗi kim loại là x (mol).
Na + H2O → NaOH + ½ H2
x → x → 0,5x
Ba + 2H2O → Ba(OH)2 + H2
x → x → x
=> nH2 = 0,5x + x = 0,15 => x = 0,1 mol
=> nOH- = x + 2x = 0,3 mol
*Hấp thụ 0,2 mol CO2 vào {0,3 mol OH-; 0,1 mol Ba2+; Na+}:
Ta thấy: nOH- : nCO2 = 0,3 : 0,2 = 1,5
=> Phản ứng tạo CO32- (a mol) và HCO3- (b mol)
CO2 + 2OH- → CO32- + H2O
CO2 + OH- → HCO3-
+ nCO2 = nCO32- + nHCO3- => a + b = 0,2 (1)
+ nOH- = 2nCO32- + nHCO3- => 2a + b = 0,3 (2)
Giải hệ (1) và (2) được a = b = 0,1
Ta thấy: nBa2+ (0,1 mol) = nCO32- (0,1 mol) => nBaCO3 = 0,1 mol
=> mBaCO3 = 0,1.197 = 19,7g
Hòa tan hoàn toàn hỗn hợp X gồm 0,12 mol FeS2 và a mol Cu2S vào dung dịch HNO3 đặc (đủ) sau phản ứng thu được dung dịch A chỉ chứa muối sunfat và khí NO2. Giá trị của a là:
-
A.
0,12.
-
B.
0,06.
-
C.
0,03.
-
D.
0,45.
Đáp án : B
Bảo toàn điện tích.
Dung dịch sau phản ứng gồm Fe3+ ; Cu2+ ; SO42-
Bảo toàn điện tích: \(3{{n}_{F{{e}^{3+}}}}+\text{ }2{{n}_{C{{u}^{2+}}}}=2{{n}_{S{{O}_{4}}^{2-}}}\)
=> 3.0,12 + 2.2a = 2.(2.0,12 + a) => a = 0,06 mol
Cho dung dịch KOH 1 M tới dư vào dung dịch X sau phản ứng thu được kết tủa. Dung dịch X có thể chứa đồng thời các chất
-
A.
Al2(SO4)3 và ZnSO4.
-
B.
Al2(SO4)3 và NaCl.
-
C.
Al2(SO4)3 và CuSO4.
-
D.
ZnSO4 và Na2SO4.
Đáp án : C
- Vì Zn(OH)2 và Al(OH)3 đều tan trong KOH nên loại A, B, D.
- Cu(OH)2 không tan trong KOH nên thỏa mãn đề bài
Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:

Các dung dịch (1), (3), (5) lần lượt là
-
A.
H2SO4, NaOH, MgCl2.
-
B.
Na2CO3, NaOH, BaCl2.
-
C.
H2SO4, MgCl2, BaCl2.
-
D.
Na2CO3, BaCl2, BaCl2.
Đáp án : A
Bước 1: Đọc đề bài và các đáp án xác định các khả năng loại trừ, loại đáp án nhiễu
(1) không phản ứng với (5) ⟹ B ; C ; D loại.
Chất (2) tạo kết tủa 2 lần + tạo khí 1 lần nên (2) là Na2CO3
Chất (1) tạo khí với chất (2) —> (1) là H2SO4
Chất (4) tạo kết tủa với (1) và (2) —> (4) là BaCl2
Chất (5) tạo kết tủa với (2) —> (5) là MgCl2
—> Còn lại (3) là NaOH
(1) không phản ứng với (5) ⟹ B ; C ; D loại.
Các dung dịch (1), (3), (5) lần lượt là H2SO4, NaOH, MgCl2.
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4.
(b) Cho Na vào dung dịch FeCl2 dư.
(c) Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2.
(d) Sục khí CO2 dư vào dung dịch hỗn hợp NaOH và Ba(OH)2.
(e) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả kết tủa và khí là
-
A.
5.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : C
(a) Ba(HCO3)2 + 2NaHSO4 → BaSO4↓+ Na2SO4 + 2H2O + 2CO2 ↑
(b) 2Na + 2H2O → 2NaOH + H2↑
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
(c) (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
(d) CO2 dư nên không thu được kết tủa.
(e) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
Vậy có 3 phản ứng vừa thu được khí và kết tủa là (a), (b), (c).
Luyện tập và củng cố kiến thức Tổng hợp bài tập điện li hay và khó Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 1 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3. Bài tập về pH Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3. Sự điện li của nước. pH. Chất chỉ thị axit - bazo Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2. Axit - bazơ - muối Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Bài tập độ điện li alpha Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Sự điện li Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận