Trắc nghiệm Ôn tập chương 3 - Hóa 11
Đề bài
Phản ứng nào sau đây không đúng
-
A.
Si + 2Mg → Mg2Si
-
B.
Na2CO3 + SiO2 + H2O → H2CO3 + Na2SiO3
-
C.
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
-
D.
Si + 2F2 → SiF4
Trong công nghiệp CO được điều chế bằng phương pháp nào?
-
A.
Đun nóng axit HCOOH có mặt H2SO4 đặc
-
B.
Cho SiO2 tác dụng với C
-
C.
Cho hơi nước đi qua than nóng đỏ ở 10500C
-
D.
Cho C tác dụng với oxi
Ứng dụng nào sau đây không sử dụng tính bán dẫn của Si?
-
A.
Dùng trong vô tuyến, điện tử
-
B.
Tạo tế bào quang điện, bộ khuếch đại
-
C.
Tạo pin mặt trời
-
D.
Tạo ferosilic
Khi nhiệt phân hỗn hợp chất rắn sau: (NH4)2CO3, KHCO3, Mg(HCO3)2, FeCO3 đến khối lượng không đổi trong môi trường không có không khí thì sản phẩm rắn gồm các chất:
-
A.
FeO, MgO, K2CO3
-
B.
FeO, MgCO3, K2CO3
-
C.
Fe2O3, MgO, K2O
-
D.
Fe2O3, MgO, K2CO3
Dãy chất nào sau đây có thể tác dụng với cacbon ?
-
A.
HCl, Ca, H2SO4 đặc, O2
-
B.
Al, NaOH, H2, CO2, HNO3
-
C.
H2, NaCl, Al, H2O, CO2
-
D.
O2, H2, Mg, CO2, H2O
Trong các phản ứng hoá học sau đây phản ứng nào mà C, Si thể hiện tính oxi hoá?
1- C + H2 2-C + H2O 3-C + Ca 4-Si + Mg
5- Si + dd NaOH 6-C + O2 7-Si + Cl2
-
A.
1,3,4,5
-
B.
1, 3, 4
-
C.
1,2,3,4,5
-
D.
1,3,4,5,7
Cho khí CO dư đi qua hỗn hợp rắn: MgO, CuO, Al2O3, Fe3O4 khi đun nóng thì chất rắn còn lại trong bình là
-
A.
MgO, CuO, Fe3O4
-
B.
MgO, Al, Cu, Fe
-
C.
MgO, Cu, Fe, Al2O3
-
D.
Mg, Cu, Al, Fe
Trong các cặp chất sau đây:
a) C + H2O b)(NH4)2CO3 + KOH c) NaOH + CO2
d) CO2 + Ca(OH)2 e) K2CO3 + BaCl2 g) Na2CO3 + Ca(OH)2
h) CaCO3 + HCl i) HNO3 + NaHCO3 k) CO + CuO.
Nhóm gồm các cặp chất mà phản ứng giữa các chất sinh ra sản phẩm khí là:
-
A.
a, b, d, i, k
-
B.
b, c, d, h, k
-
C.
c, d, e, g, k
-
D.
a, b, h, i, k
Cho các nhận xét sau, nhận xét nào không đúng ?
-
A.
Khí CO được dùng làm nhiên liệu vì khi cháy toả nhiều nhiệt.
-
B.
Si là nguyên tố phổ biến thứ 2 sau oxi, chiếm 29,5% khối lượng và tồn tại dạng hợp chất.
-
C.
Trong tự nhiên C cũng như Si đều chỉ tồn tại dạng hợp chất.
-
D.
Khí CO2 trong công nghiệp được thu hồi từ quá trình đốt cháy than; chuyển hoá khí thiên nhiên; sản phảm dầu mỏ; nung vôi, nấu rượu... đồng thời lượng dư sẽ gây hiệu ứng nhà kính.
Cho các câu nhận xét sau, câu nhận xét không đúng là:
-
A.
Than cốc được dùng trong quá trình luyện kim
-
B.
Than muội làm chất độn cao su, sản xuất mực in và si đánh giầy
-
C.
Than gỗ và than xương có cấu tạo xốp nên có khả năng hấp phụ mạnh, được dùng làm mặt nạ phòng chống độc và công nghiệp hoá chất
-
D.
CO2 là chất khí dùng để chữa cháy, nhất là các đám cháy kim loại.
Sục V lít khí CO2 (đktc) vào 100 ml dung dịch Ba(OH)2 2,5M thu được 23,64 gam kết tủa. Giá trị lớn nhất của V là:
-
A.
5,6 lít
-
B.
8,512 lít
-
C.
8,512 lít hoặc 2,688 lít
-
D.
2,688 lít
Sục hoàn toàn 6,72 lít khí CO2 (đktc) vào 100 ml hỗn hợp dung dịch NaOH 2M và Ca(OH)2 1,5M thu được a gam kết tủa. Giá trị của a là:
-
A.
20 gam
-
B.
10 gam
-
C.
5 gam
-
D.
15 gam
Cho luồng khí CO dư đi qua ống sứ đựng 20 gam hỗn hợp A gồm MgO và CuO nung nóng. Sau khi phản ứng hoàn toàn đem cân lại thấy khối lượng chất rắn giảm đi 3,2 gam. Tính % CuO trong hỗn hợp
-
A.
20%
-
B.
40%
-
C.
30%
-
D.
80%
Dẫn khí CO dư qua ống đựng bột một oxit sắt (FexOy) ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 0,84 gam sắt và dẫn khí sinh ra vào nước vôi trong dư thì thu được 2 gam kết tủa. Xác định công thức phân tử của FexOy.
-
A.
FeO
-
B.
Fe2O3
-
C.
Fe3O4
-
D.
không xác định được
Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
-
A.
3,36.
-
B.
2,24.
-
C.
4,48.
-
D.
1,12.
Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
-
A.
0,02
-
B.
0,03
-
C.
0,015
-
D.
0,01
Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dd Ca(OH)2 0,05 M thu được kết tủa X và dd Y. Cho biết khổi lượng dd Y tăng hay giảm bao nhiêu so với dd Ca(OH)2 ban đầu?
-
A.
Tăng 2,04g
-
B.
Giảm 3,04g
-
C.
Tăng 3,04g
-
D.
Giảm 2,04g
Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m gam muối clorua. Tính m.
-
A.
26,6 gam
-
B.
26,4 gam
-
C.
25,9 gam
-
D.
27,4 gam
Đem nhiệt phân hoàn toàn 15 gam muối cacbonat của một kim loại hóa trị II. Dẫn hết khí sinh ra vào 200 gam dung dịch NaOH 4% (vừa đủ) thì thu được dung dịch mới có nồng độ các chất tan là 6,63%. Xác định công thức muối đem nhiệt phân.
-
A.
MgCO3
-
B.
BaCO3
-
C.
FeCO3
-
D.
CaCO3
Đổ từ từ 200 ml dung dịch A (Na2CO3 1M và K2CO3) vào 200 ml dung dịch (Na+ 1M, Ba2+ 1M, Ca2+ 1M, Cl- 2,5 M và HCO3-) thu được m gam kết tủa và dung dịch B. Đổ thêm 100 ml dung dịch A vào B, sau phản ứng thấy nồng độ CO32- trong dung dịch bằng 1/4 nồng độ của HCO3-. Hãy tìm nồng độ của K2CO3 trong A:
-
A.
0,75M
-
B.
1,125M
-
C.
2,625M
-
D.
2,5M
Cho các phát biểu sau:
(1) Nguyên nhân ngộ độc khi sưởi ấm bằng than trong phòng kín chủ yếu do khí CO2.
(2) Trong các mặt nạ chống độc người ta thường cho bột than hoạt tính.
(3) Ure là loại phân đạm tốt nhất có công thức là (NH2)2CO.
(4) Thuốc nổ đen (người Trung Quốc tìm ra) là hỗn hợp: KNO3 + S + C.
(5) Tinh thể Al2O3 có lẫn tạp chất Fe2+, Fe3+ và Ti4+ ta có đá saphia dùng làm đồ trang sức.
Số phát biểu đúng là
-
A.
6
-
B.
5
-
C.
3
-
D.
4
Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đây biểu diễn sự phụ thuộc giữa số mol kết tủa và thể tích dung dịch Ba(OH)2.
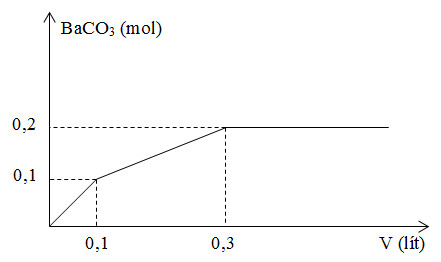
Giá trị x, y tương ứng là
-
A.
0,2 và 0,05.
-
B.
0,4 và 0,05.
-
C.
0,2 và 0,10.
-
D.
0,1 và 0,05.
Chọn phát biểu đúng.
-
A.
Silic có tính oxi hóa mạnh hơn cacbon.
-
B.
Cacbon có tính oxi hóa mạnh hơn silic.
-
C.
Silic có tính khử yếu hơn cacbon.
-
D.
Silic và cacbon có tính oxi hóa bằng nhau.
Hấp thụ hết 0,1 mol CO2 vào dung dịch có chứa 0,08 mol NaOH và 0,1 mol Na2CO3, thu được dung dịch X. Nhỏ từ từ dung dịch HCl vào dung dịch X đến khi thoát ra 0,08 mol khí CO2 thì thấy hết x mol HCl. Giá trị của x là
-
A.
0,16.
-
B.
0,15.
-
C.
0,18.
-
D.
0,17.
Tiến hành các thí nghiệm sau ở điều kiện thường:
(a) Sục khí SO2 vào dung dịch H2S.
(b) Sục khí F2 vào nước.
(c) Cho KMnO4 vào dung dịch HCl đặc.
(d) Sục khí CO2 vào dung dịch NaOH.
(e) Cho Si vào dung dịch NaOH.
(g) Cho Na2SO3 vào dung dịch H2SO4.
(h) C + H2O(hơi) ở nhiệt độ cao.
(i) Nung Cu(NO3)2.
(k) Dẫn CO qua FeO nung nóng.
Số thí nghiệm có sinh ra đơn chất là
-
A.
6
-
B.
5
-
C.
7
-
D.
8
Lời giải và đáp án
Phản ứng nào sau đây không đúng
-
A.
Si + 2Mg → Mg2Si
-
B.
Na2CO3 + SiO2 + H2O → H2CO3 + Na2SiO3
-
C.
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
-
D.
Si + 2F2 → SiF4
Đáp án : B
B sai vì axit H2SiO3 yếu hơn axit H2CO3 nên phản ứng không xảy ra
Trong công nghiệp CO được điều chế bằng phương pháp nào?
-
A.
Đun nóng axit HCOOH có mặt H2SO4 đặc
-
B.
Cho SiO2 tác dụng với C
-
C.
Cho hơi nước đi qua than nóng đỏ ở 10500C
-
D.
Cho C tác dụng với oxi
Đáp án : C
Trong công nghiệp CO được điều chế bằng phương pháp : cho hơi nước đi qua than nóng đỏ ở 10500C
C + H2O $\xrightarrow{{{t^o}}}$ CO + H2
Ứng dụng nào sau đây không sử dụng tính bán dẫn của Si?
-
A.
Dùng trong vô tuyến, điện tử
-
B.
Tạo tế bào quang điện, bộ khuếch đại
-
C.
Tạo pin mặt trời
-
D.
Tạo ferosilic
Đáp án : D
Ứng dụng không sử dụng tính bán dẫn của Si là tạo ferosilic. Vì ferosilic là hợp kim của sắt được sử dụng trong ngành luyện thép.
Khi nhiệt phân hỗn hợp chất rắn sau: (NH4)2CO3, KHCO3, Mg(HCO3)2, FeCO3 đến khối lượng không đổi trong môi trường không có không khí thì sản phẩm rắn gồm các chất:
-
A.
FeO, MgO, K2CO3
-
B.
FeO, MgCO3, K2CO3
-
C.
Fe2O3, MgO, K2O
-
D.
Fe2O3, MgO, K2CO3
Đáp án : A
Nắm được phản ứng nhiệt phân muối cacbonat:
- Muối cacbonat trung hòa của kim loại kiềm đều không bị nhiệt phân
- Các muối cacbonat trung hòa của KL khác bị nhiệt phân thành oxit tương ứng và CO2 (trong muôi trường không có không khí)
- Muối hidrocacbonat bị nhiệt phân (đến khối lượng không đổi):
+ Nếu là muối của KL kiềm: tạo muối cacbonat trung hòa, CO2, H2O
+ Nếu là muối của các KL khác: tạo oxit tương ứng, CO2, H2O
- Muối amoni cacbonat nhiệt phân tạo NH3, CO2 , H2O
Nhiệt phân đến khối lượng không đổi:
(NH4)2CO3 → 2NH3 + CO2 + H2O
2KHCO3 → K2CO3 + H2O + CO2
Mg(HCO3)2 → MgO + CO2 + H2O
FeCO3 → FeO + CO2
Như vậy chất rắn sau phản ứng gồm: FeO, MgO, K2CO3
Trong điều kiện không có không khí nhiệt phân muối cacbonat thì số oxi hóa của kim loại không bị thay đổi nên dễ nhầm sang đáp án D
Dãy chất nào sau đây có thể tác dụng với cacbon ?
-
A.
HCl, Ca, H2SO4 đặc, O2
-
B.
Al, NaOH, H2, CO2, HNO3
-
C.
H2, NaCl, Al, H2O, CO2
-
D.
O2, H2, Mg, CO2, H2O
Đáp án : D
+) C là vừa có tính khử vừa có tính oxi hóa
=> C có thể tác dụng với kim loại, phi kim, oxit kim loại...
C không tác dụng với HCl loại A
C không tác dụng với NaOH loại B
C không tác dụng với NaCl loại C
Trong các phản ứng hoá học sau đây phản ứng nào mà C, Si thể hiện tính oxi hoá?
1- C + H2 2-C + H2O 3-C + Ca 4-Si + Mg
5- Si + dd NaOH 6-C + O2 7-Si + Cl2
-
A.
1,3,4,5
-
B.
1, 3, 4
-
C.
1,2,3,4,5
-
D.
1,3,4,5,7
Đáp án : B
+) Chất oxi hóa là chất nhận e
=> số oxi hóa giảm
1. Tạo thành CH4 => số oxi hóa giảm xuống -4 => tính oxi hóa
2. Tạo thành CO hoặc CO2 => số oxi tăng lên +2 hoặc +4 => tính khử
3. Tạo thành CaC2 => số oxi hóa giảm xuống -1 => tính oxi hóa
4. Tạo thành Mg2Si => số oxi hóa giảm xuống -4 => tính oxi hóa
5. Tạo thành Na2SiO3 => số oxi hóa tăng lên +4 => tính khử
6. Tạo thành CO hoặc CO2 => số oxi tăng lên +2 hoặc +4 => tính khử
7. Tạo thành SiCl4 => số oxi hóa tăng lên +4 => tính khử
Cho khí CO dư đi qua hỗn hợp rắn: MgO, CuO, Al2O3, Fe3O4 khi đun nóng thì chất rắn còn lại trong bình là
-
A.
MgO, CuO, Fe3O4
-
B.
MgO, Al, Cu, Fe
-
C.
MgO, Cu, Fe, Al2O3
-
D.
Mg, Cu, Al, Fe
Đáp án : C
Các oxit của kim loại đứng sau nhôm mới bị khử bởi CO, H2, C, Al
Những oxit bị khử tạo KL là: CuO và Fe3O4
Chất rắn sau phản ứng gồm: MgO, Cu, Al2O3, Fe
Trong các cặp chất sau đây:
a) C + H2O b)(NH4)2CO3 + KOH c) NaOH + CO2
d) CO2 + Ca(OH)2 e) K2CO3 + BaCl2 g) Na2CO3 + Ca(OH)2
h) CaCO3 + HCl i) HNO3 + NaHCO3 k) CO + CuO.
Nhóm gồm các cặp chất mà phản ứng giữa các chất sinh ra sản phẩm khí là:
-
A.
a, b, d, i, k
-
B.
b, c, d, h, k
-
C.
c, d, e, g, k
-
D.
a, b, h, i, k
Đáp án : D
Dựa vào phản ứng hóa học giữa các chất để trả lời
Ta có PTHH của phản ứng:
a) C + H2O $\xrightarrow{{{t^o}}}$ CO↑ + H2↑
C + 2H2O $\xrightarrow{{{t^o}}}$ CO2↑ + 2H2↑
b) (NH4)2CO3 + 2KOH → 2NH3↑+ K2CO3 + 2H2O
c) NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
d) 2CO2 + Ca(OH)2 → Ca(HCO3)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
e) K2CO3 + BaCl2 → BaCO3↓ + 2KCl
g) Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
h) CaCO3 + HCl → CaCl2 + H2O + CO2↑
i) HNO3 + NaHCO3 → NaNO3 + H2O + CO2↑
k) CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2↑
Vậy các phản ứng tạo khí là: a, b, h, i, k
Cho các nhận xét sau, nhận xét nào không đúng ?
-
A.
Khí CO được dùng làm nhiên liệu vì khi cháy toả nhiều nhiệt.
-
B.
Si là nguyên tố phổ biến thứ 2 sau oxi, chiếm 29,5% khối lượng và tồn tại dạng hợp chất.
-
C.
Trong tự nhiên C cũng như Si đều chỉ tồn tại dạng hợp chất.
-
D.
Khí CO2 trong công nghiệp được thu hồi từ quá trình đốt cháy than; chuyển hoá khí thiên nhiên; sản phảm dầu mỏ; nung vôi, nấu rượu... đồng thời lượng dư sẽ gây hiệu ứng nhà kính.
Đáp án : C
Nhận xét không đúng là: Trong tự nhiên C cũng như Si đều chỉ tồn tại dạng hợp chất.
Cho các câu nhận xét sau, câu nhận xét không đúng là:
-
A.
Than cốc được dùng trong quá trình luyện kim
-
B.
Than muội làm chất độn cao su, sản xuất mực in và si đánh giầy
-
C.
Than gỗ và than xương có cấu tạo xốp nên có khả năng hấp phụ mạnh, được dùng làm mặt nạ phòng chống độc và công nghiệp hoá chất
-
D.
CO2 là chất khí dùng để chữa cháy, nhất là các đám cháy kim loại.
Đáp án : D
Câu không đúng là: CO2 là chất khí dùng để chữa cháy, nhất là các đám cháy kim loại.
Không dùng CO2 để dập tắt các đám cháy kim loại Mg, Al vì
$\mathop C\limits^{ + 4} {O_2}$+ 2Mg $\xrightarrow{{{t^0}}}\mathop C\limits^0 $ + 2MgO
Sục V lít khí CO2 (đktc) vào 100 ml dung dịch Ba(OH)2 2,5M thu được 23,64 gam kết tủa. Giá trị lớn nhất của V là:
-
A.
5,6 lít
-
B.
8,512 lít
-
C.
8,512 lít hoặc 2,688 lít
-
D.
2,688 lít
Đáp án : B
Viết dạng phương trình song song và đặt mol:
CO2 + Ba(OH)2 → BaCO3 +H2O
2CO2 + Ba(OH)2 → Ba(HCO3)2
nBa(OH)2 = 0,25mol
n kết tủa = 0,12mol
CO2 + Ba(OH)2 → BaCO3 +H2O
0,12$ \leftarrow $ 0,12$ \leftarrow $ 0,12
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,26 $ \leftarrow $0,13 $ \leftarrow $0,13
nCO2 = 0,26 + 0,12 = 0,38 mol => V = 8,512 lít
Sục hoàn toàn 6,72 lít khí CO2 (đktc) vào 100 ml hỗn hợp dung dịch NaOH 2M và Ca(OH)2 1,5M thu được a gam kết tủa. Giá trị của a là:
-
A.
20 gam
-
B.
10 gam
-
C.
5 gam
-
D.
15 gam
Đáp án : D
Tính tỉ lệ: (*) = nOH-/nCO2
+ (*) ≤ 1 => chỉ tạo muối HCO3-
+ 1 < (*) < 2 => tạo 2 muối HCO3- và CO32-
+ (*) ≥ 2 => chỉ tạo muối CO32-
Viết Phương trình ion, tính toán
CO2 + 2OH- → CO32- +H2O
CO2 + CO32- +H2O - → 2HCO3-
Ca2+ + CO32- → CaCO3
\(\begin{array}{*{20}{l}}
{{n_{C{O_2}}} = {\rm{ }}0,3mol}\\
{{n_{O{H^ - }}} = {\rm{ }}0,5mol}
\end{array}\)
$\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \frac{{0,5}}{{0,3}} = 1,67$
Vì 1 < 1,67 <2 nên phản ứng tạo CO32- và HCO3-
CO2 + 2OH- → CO32- +H2O
0,25 \( \leftarrow \)0,5 → 0,25
CO2 + CO32- +H2O - → HCO3-
0,05 → 0,05
\({n_{C{O_3}^{2 - }}} = \) 0,25 – 0,05 =0,2 mol
\({n_{C{a^{2 + }}}} = {\rm{ }}0,15mol\)
Ca2+ + CO32- → CaCO3
0,15 → 0,15
a = 0,15 . 100 = 15g
Cho luồng khí CO dư đi qua ống sứ đựng 20 gam hỗn hợp A gồm MgO và CuO nung nóng. Sau khi phản ứng hoàn toàn đem cân lại thấy khối lượng chất rắn giảm đi 3,2 gam. Tính % CuO trong hỗn hợp
-
A.
20%
-
B.
40%
-
C.
30%
-
D.
80%
Đáp án : D
+) CO không khử được MgO
+) Vậy khối lượng chất rắn giảm là mO (trong CuO)
Từ đó tính được nO (trong CuO) = nCuO
CO không khử được MgO
m chất rắn giảm = mO (trong CuO) = 3,2 gam
=> nO (trong CuO) = nCuO = 3,2 : 16 = 0,2 mol
=> mCuO = 0,2 . 80 = 16g
=> % CuO =$\frac{{16}}{{20}}*100\% = $ 80%
Dẫn khí CO dư qua ống đựng bột một oxit sắt (FexOy) ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 0,84 gam sắt và dẫn khí sinh ra vào nước vôi trong dư thì thu được 2 gam kết tủa. Xác định công thức phân tử của FexOy.
-
A.
FeO
-
B.
Fe2O3
-
C.
Fe3O4
-
D.
không xác định được
Đáp án : C
+) BTNT Cacbon => ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}}$
+) Viết PTHH tính toán
+) ${n_{F{\text{e}}}} = \dfrac{x}{y}.{n_{C{O_2}}} \Rightarrow \dfrac{x}{y}$
${n_{CaC{O_3}}} = \dfrac{2}{{100}} = 0,02{\text{ }}mol;{\text{ }}{n_{Fe}} = \dfrac{{0,84}}{{56}} = 0,015{\text{ }}mol$
Phản ứng :
FexOy + yCO $\xrightarrow{{{t^o}}}$ xFe + yCO2 (1)
0,02x/y ← 0,02
${n_{CaC{{\text{O}}_3}}} = 0,02\,mol \Rightarrow \,{n_{C{O_2}}} = 0,02\,mol$
Theo phản ứng (1): ${n_{F{\text{e}}}} = \dfrac{x}{y}.{n_{C{O_2}}} = \dfrac{{0,02{\text{x}}}}{y} = 0,015 \Rightarrow \dfrac{x}{y} = \dfrac{{0,015}}{{0,02}} = \dfrac{3}{4}$
Vậy CTPT của oxit là Fe3O4
Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
-
A.
3,36.
-
B.
2,24.
-
C.
4,48.
-
D.
1,12.
Đáp án : D
Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có :
+) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là:
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O
+) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là:
2H+ + CO32- → CO2 + H2O
HCO3- + H+ → CO2 + H2O
Phản ứng xảy ra theo thứ tự sau:
CO32- + H+ → HCO3- (1)
0,15mol→0,15mol→0,15mol
HCO3- + H+ → CO2 + H2O(2)
0,05mol ←0,05mol → 0,05mol
Sau phản ứng (2) HCO3- còn dư 0,2 mol
V = 1,12 lít
Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
-
A.
0,02
-
B.
0,03
-
C.
0,015
-
D.
0,01
Đáp án : D
Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có :
+) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là:
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O
+) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là:
2H+ + CO32- →CO2 + H2O
HCO3- + H+ → CO2 + H2O
Phản ứng xảy ra theo thứ tự sau:
CO32- + H+ → HCO3- (1)
0,02mol ← 0,02mol →0,02mol
HCO3- + H+ → CO2 + H2O(2)
0,01mol ← 0,01mol → 0,01mol
Sau phản ứng (2) HCO3- còn dư 0,01 mol
Vậy số mol CO2 là 0,01 mol.
Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dd Ca(OH)2 0,05 M thu được kết tủa X và dd Y. Cho biết khổi lượng dd Y tăng hay giảm bao nhiêu so với dd Ca(OH)2 ban đầu?
-
A.
Tăng 2,04g
-
B.
Giảm 3,04g
-
C.
Tăng 3,04g
-
D.
Giảm 2,04g
Đáp án : C
+) Viết PTHH tính toán tìm khối lượng kết tủa (${m_{CaC{O_3}}}$)
+) Khối lượng dung dịch tăng giảm là $m = {m_{C{O_2}}} - m$ kết tủa
Ta có PTHH:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,1 ← 0,1 ← 0,1
2CO2 + CaCO3 + H2O → Ca(HCO3)2
0,16 – 0,1 → 0,06
=> n↓= 0,04 mol
n↓= 0,04 mol => m ↓ = 4g < 0,16.44 = 7,04g
=> mdd tăng = 7,04 – 4 = 3,04g
Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m gam muối clorua. Tính m.
-
A.
26,6 gam
-
B.
26,4 gam
-
C.
25,9 gam
-
D.
27,4 gam
Đáp án : A
+) ${n_{BaC{l_2}}} = {n_{BaC{O_3}}}$
+) bảo toàn khối lượng: ${m_{hh}} + {m_{BaC{l_2}}} = {m_ \downarrow } + m$
${n_{BaC{l_2}}} = {n_{BaC{O_3}}} = 0,2{\text{ }}mol$
Áp dụng định luật bảo toàn khối lượng: ${m_{hh}} + {m_{BaC{l_2}}} = {m_ \downarrow } + m$ muối Clorua
=> m = 24,4 + 0,2.208 - 39,4 = 26,6 gam
Đem nhiệt phân hoàn toàn 15 gam muối cacbonat của một kim loại hóa trị II. Dẫn hết khí sinh ra vào 200 gam dung dịch NaOH 4% (vừa đủ) thì thu được dung dịch mới có nồng độ các chất tan là 6,63%. Xác định công thức muối đem nhiệt phân.
-
A.
MgCO3
-
B.
BaCO3
-
C.
FeCO3
-
D.
CaCO3
Đáp án : D
TH1: Chất tan là 2 muối nên ta đặt Na2CO3 có số mol là x => tính số mol NaHCO3
+) mdd sau phản ứng = mCO2 + mdd NaOH
+) m chất tan = mNa2CO3 + mNaHCO3 = 106.x + 84.(0,2 - 2x)
Thay vào biểu thức tính c% => x
+) Bảo toàn nguyên tố C: ${n_{RC{O_3}}} = {n_{C{O_2}}}$
=> ${M_{MC{O_3}}}$
TH2: Chất tan là NaOH và Na2CO3 sau đó làm tương tự như TH1
Gọi công thức phân tử của muối cacbonat là RCO3
nNaOH = 0,2 mol
TH1 chất tan là 2 muối nên ta đặt Na2CO3 có số mol là x
2NaOH + CO2 → Na2CO3 + H2O
2x ← x ← x
NaOH + CO2 → NaHCO3
(0,2-2x)→(0,2-2x)→(0,2-2x)
nCO2 = 0,2 - x => mCO2 = (0,2 - x).44
Sau phản ứng : mdd = 200 + (0,2 - x).44
m chất tan = mNa2CO3 + mNaHCO3 = 106.x + 84.(0,2 - 2x)
Theo gt: nồng độ các chất tan là 6,63%
=> $\dfrac{{106.x + 84.\left( {0,2 - 2x} \right)}}{{200 + 44.(0,2 - x)}} = \dfrac{{6,63}}{{100}} \Rightarrow x = 0,05$
=> x = 0,05
$ \Rightarrow {n_{C{O_2}}} = {n_{N{a_2}C{O_3}}} + {n_{NaHC{O_3}}} = 0,05 + 0,2 - 2.0,05 = 0,15\,mol$
Bảo toàn nguyên tố C: ${n_{RC{O_3}}} = {n_{C{O_2}}} = 0,15\,mol$
=> MRCO3 = 15 / 0,15 = 100
=> R = 40
Công thức muối cacbonat là CaCO3
TH2: NaOH dư
Số mol NaOH dư = 2x
2NaOH + CO2 → Na2CO3 + H2O
0,2-2x ← 0,1-x ←0,1-x
Sau phản ứng : mdd = 200 + (0,1 - x).44
m chất tan = mNa2CO3 + mNaOH = 106.(0,1-x )+ 40*2.x
Theo gt: nồng độ các chất tan là 6,63%
=> $\dfrac{{106.(0,1-x) + 80.\left( {x} \right)}}{{200 + 44.(0,1 - x)}} = \dfrac{{6,63}}{{100}} \Rightarrow x = 0,128$
=> x = 0,128 >0,1 (loại)
Đổ từ từ 200 ml dung dịch A (Na2CO3 1M và K2CO3) vào 200 ml dung dịch (Na+ 1M, Ba2+ 1M, Ca2+ 1M, Cl- 2,5 M và HCO3-) thu được m gam kết tủa và dung dịch B. Đổ thêm 100 ml dung dịch A vào B, sau phản ứng thấy nồng độ CO32- trong dung dịch bằng 1/4 nồng độ của HCO3-. Hãy tìm nồng độ của K2CO3 trong A:
-
A.
0,75M
-
B.
1,125M
-
C.
2,625M
-
D.
2,5M
Đáp án : A
Bảo toàn điện tích
Bảo toàn điện tích: \({C_{HCO_3^ - }}\) trong 200 ml dung dịch là 2,5M.
⇒\({n_{HCO_3^ - }}\) =2,5 . 0,2 = 0,5 mol
Xét tổng thể: đổ 300 ml dung dịch A và 200 ml dung dịch.
Sau khi trộn:
⇒\({n_{HCO_3^ - }}\)=\({n_{CO_3^ 2- }}\) /4 =0,125 mol
Gọi nồng độ K2CO3 trong A là x
⇒ \({n_{HCO_3^ - }}\) tổng= 0,3.(1 + x)
Sau trộn sẽ phản ứng với Ca2+, Ba2+
\({n_{HCO_3^ 2- }}\) còn lại = 0,3 . (1 + x) - 0,2 - 0,2 = 0,125
⇒ x = 0,75M
Cho các phát biểu sau:
(1) Nguyên nhân ngộ độc khi sưởi ấm bằng than trong phòng kín chủ yếu do khí CO2.
(2) Trong các mặt nạ chống độc người ta thường cho bột than hoạt tính.
(3) Ure là loại phân đạm tốt nhất có công thức là (NH2)2CO.
(4) Thuốc nổ đen (người Trung Quốc tìm ra) là hỗn hợp: KNO3 + S + C.
(5) Tinh thể Al2O3 có lẫn tạp chất Fe2+, Fe3+ và Ti4+ ta có đá saphia dùng làm đồ trang sức.
Số phát biểu đúng là
-
A.
6
-
B.
5
-
C.
3
-
D.
4
Đáp án : D
Dựa vào kiến thức tổng hợp các chất vô cơ
(1) sai do khí CO chứ không phải CO2
(2) đúng, vì than hoạt tính có tính hấp phụ
(3) đúng, vì ure có hàm lượng nito cao nhất nhé
(4) đúng
(5) đúng
→ có 4 phát biểu đúng
Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đây biểu diễn sự phụ thuộc giữa số mol kết tủa và thể tích dung dịch Ba(OH)2.

Giá trị x, y tương ứng là
-
A.
0,2 và 0,05.
-
B.
0,4 và 0,05.
-
C.
0,2 và 0,10.
-
D.
0,1 và 0,05.
Đáp án : A
- Tại V = 0,3 thì lượng BaCO3 đạt cực đại và không đổi. Khi đó:
+ nBaCO3 max = nCO32- max = nNaHCO3 = x
+ BTNT "Ba": nBaCO3 = nBa(OH)2 + nBaCl2 => y
- Tại V = 0,3 thì lượng BaCO3 đạt cực đại và không đổi. Khi đó:
+ nBaCO3 max = nCO32- max = nNaHCO3 = x = 0,2 mol
+ BTNT "Ba": nBaCO3 = nBa(OH)2 + nBaCl2 hay 0,2 = 0,3.0,5 + y => y = 0,05 mol
Chọn phát biểu đúng.
-
A.
Silic có tính oxi hóa mạnh hơn cacbon.
-
B.
Cacbon có tính oxi hóa mạnh hơn silic.
-
C.
Silic có tính khử yếu hơn cacbon.
-
D.
Silic và cacbon có tính oxi hóa bằng nhau.
Đáp án : B
Cacbon và silic thuộc cùng một nhóm A, mà điện tích hạt nhân của Silic lớn hơn Cacbon nên Silic có tính khử lớn hơn Cacbon hay Silic có tính oxi hóa yếu hơn Cacbon
Hấp thụ hết 0,1 mol CO2 vào dung dịch có chứa 0,08 mol NaOH và 0,1 mol Na2CO3, thu được dung dịch X. Nhỏ từ từ dung dịch HCl vào dung dịch X đến khi thoát ra 0,08 mol khí CO2 thì thấy hết x mol HCl. Giá trị của x là
-
A.
0,16.
-
B.
0,15.
-
C.
0,18.
-
D.
0,17.
Đáp án : A
Giả sử hấp thụ CO2 vào dung dịch NaOH và Na2CO3 thu được CO32- (a mol) và HCO3- (b mol)
BTNT “C”: nCO2 + nNa2CO3 = nCO3 2- + nHCO3- => (1)
BTĐT: nNa+ = 2nCO32- + nHCO3- => (2)
Giải (1) và (2) thu được a và b
*Nhỏ từ từ HCl vào dd X (CO32- và HCO3-)
Thứ tự phản ứng:
H+ + CO32- → HCO3-
H+ + HCO3- → H2O + CO2
Giả sử hấp thụ CO2 vào dung dịch NaOH và Na2CO3 thu được CO32- (a mol) và HCO3- (b mol)
BTNT “C”: nCO2 + nNa2CO3 = nCO3 2- + nHCO3- => a + b = 0,1 + 0,1 => a + b = 0,2 (1)
BTĐT: nNa+ = 2nCO32- + nHCO3- => 2a + b = 0,08 + 2.0,1 => 2a + b = 0,28 (2)
Giải (1) và (2) thu được a = 0,08 và b = 0,12 mol
*Nhỏ từ từ HCl vào dd X (0,08 mol CO32- và 0,12 mol HCO3-)
Thứ tự phản ứng:
H+ + CO32- → HCO3-
0,08← 0,08
H+ + HCO3- → H2O + CO2
0,08 ← 0,08
=> nHCl = 0,08 + 0,08 = 0,16 mol
Tiến hành các thí nghiệm sau ở điều kiện thường:
(a) Sục khí SO2 vào dung dịch H2S.
(b) Sục khí F2 vào nước.
(c) Cho KMnO4 vào dung dịch HCl đặc.
(d) Sục khí CO2 vào dung dịch NaOH.
(e) Cho Si vào dung dịch NaOH.
(g) Cho Na2SO3 vào dung dịch H2SO4.
(h) C + H2O(hơi) ở nhiệt độ cao.
(i) Nung Cu(NO3)2.
(k) Dẫn CO qua FeO nung nóng.
Số thí nghiệm có sinh ra đơn chất là
-
A.
6
-
B.
5
-
C.
7
-
D.
8
Đáp án : C
Viết PTHH
Chú ý: Đơn chất là các chất được tạo nên từ một nguyên tố.
(a) SO2 + 2H2S → 3S + 2H2O => tạo đơn chất S
(b) 2F2 + 2H2O → 4HF + O2 => tạo đơn chất O2
(c) 2KMnO4 + 16HCl đặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O => tạo đơn chất Cl2
(d) CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
=> không tạo đơn chất
(e) Si + 2NaOH + H2O → Na2SiO3 + 2H2 => tạo đơn chất H2
(g) Na2SO3 + H2SO4 → Na2SO4 + H2O + CO2 => không tạo đơn chất
(h) C + H2O → CO + H2
C + 2H2O → CO2 + 2H2
=> tạo đơn chất H2
(i) 2Cu(NO3)2 \(\xrightarrow{{{t}^{o}}}\) 2CuO + 4NO2 + O2 => tạo đơn chất O2
(k) CO + FeO \(\xrightarrow{{{t}^{o}}}\) Fe + CO2 => tạo đơn chất Fe
Vậy các phản ứng sinh ra đơn chất là: a, b, c, e, h, i, k
Luyện tập và củng cố kiến thức Tổng hợp bài tập cacbon - silic hay và khó (phần 2) Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập cacbon - silic hay và khó (phần 1) Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Silic và hợp chất của silicghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập muối cacbonat tác dụng với H+ Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập CO2 tác dụng với dung dịch kiềm Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập tính khử của C, CO, H2 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 16. Hợp chất của cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 15. Cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận