Trắc nghiệm Bài 11. Hợp chất của photpho - Hóa 11
Đề bài
Hòa tan 142 gam P2O5 vào 500 gam dung dịch H3PO4 24,5%. Nồng độ % của H3PO4 trong dung dịch thu được là
-
A.
49,61%.
-
B.
56,32%.
-
C.
48,86%.
-
D.
68,75%.
Hoà tan 100 gam P2O5 vào m gam dung dịch H3PO4 48% ta được dung dịch H3PO4 60%. Giá trị của m là :
-
A.
550 gam.
-
B.
460 gam.
-
C.
300 gam.
-
D.
650 gam.
Cho 200 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M, muối thu được có khối lượng là :
-
A.
14,2 gam.
-
B.
15,8 gam.
-
C.
16,4 gam.
-
D.
11,9 gam.
Cho 14,2 gam P2O5 vào 200 gam dung dịch NaOH 8% thu được dung dịch A. Muối thu được và nồng độ % tương ứng là
-
A.
Na2HPO4 và 11,2%.
-
B.
Na3PO4 và 7,66%.
-
C.
Na2HPO4 và 13,26%.
-
D.
Na2HPO4; NaH2PO4 đều là 7,66%.
Cho 1,32 gam (NH4)2SO4 tác dụng với dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là:
-
A.
NH4H2PO4.
-
B.
(NH4)2HPO4.
-
C.
(NH4)3PO4.
-
D.
NH4H2PO4 và (NH4)2HPO4.
Cho 200 ml dung dịch NaOH 2M tác dụng với 100 ml dung dịch H3PO4 aM thu được 25,95 gam hai muối. Giá trị của a là:
-
A.
1.
-
B.
1,75.
-
C.
1,25.
-
D.
1,5.
Đốt cháy hoàn toàn 3,1 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32%, thu được muối Na2HPO4. Giá trị của m là :
-
A.
25.
-
B.
50.
-
C.
75.
-
D.
100.
Để trung hoà hoàn toàn dung dịch thu được khi thuỷ phân 4,5375 gam một photpho trihalogenua cần dùng 55 ml dung dịch NaOH 3M. Biết rằng phản ứng thuỷ phân tạo ra hai axit, trong đó có axit H3PO3 là axit hai nấc. Công thức của photpho trihalogenua đó là
-
A.
PF3.
-
B.
PCl3.
-
C.
PBr3.
-
D.
PI3.
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau :
$Quặng -photphorit\xrightarrow{{{t}^{0}},Si{{O}_{2}},C}P\xrightarrow{{{t}^{0}}}{{P}_{2}}{{O}_{5}}\to {{H}_{3}}P{{O}_{4}}$
Biết hiệu suất chung của quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần khối lượng quặng photphorit chứa 73% Ca3(PO4)2 là
-
A.
1,18 tấn.
-
B.
1,81 tấn.
-
C.
1,23 tấn.
-
D.
1,32 tấn.
Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,56 gam hỗn hợp chất rắn khan. Giá trị của m là
-
A.
1,76.
-
B.
2,13.
-
C.
4,46.
-
D.
2,84.
Cho 4,26 gam P2O5 vào dung dịch chứa x mol KOH và 0,04 mol K3PO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 16,64 gam hai chất tan. Giá trị của x là
-
A.
0,15.
-
B.
0,09.
-
C.
0,06.
-
D.
0,14.
Cho m gam P2O5 tác dụng với 400 ml dung dịch NaOH 0,3M, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được 1,55m gam chất rắn. Giá trị của m gần nhất với:
-
A.
15,6
-
B.
15,5
-
C.
15,8
-
D.
15,7
Cho 17,04 gam P2O5 vào 200 ml dung dịch NaOH nồng độ aM thu được dung dịch có tổng khối lượng các chất tan bằng 30,12 gam. Giá trị của a là:
-
A.
0,6.
-
B.
0,9.
-
C.
1,2.
-
D.
1,5.
Hòa tan hết 17,94 gam một kim loại kiềm vào một lượng nước dư thu được dung dịch X. Cho dung dịch X tác dụng với 36,92 gam P2O5 thì thu được dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau. Kim loại kiềm là:
-
A.
Na
-
B.
Rb
-
C.
K
-
D.
Li
Trộn 100 ml dung dịch gồm Na3PO4 1M và Na2HPO4 1,5M với 200 ml dung dịch H3PO4 1M phản ứng xong thu được dung dịch X. Cô cạn dung dịch X thu được khối lượng chất rắn khan là:
-
A.
53,7 gam
-
B.
57,3 gam
-
C.
54,5 gam
-
D.
55,4 gam
Trộn 200 ml dung dịch Ca(H2PO4)2 1M với 200 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là:
-
A.
31 gam.
-
B.
45 gam.
-
C.
54,4 gam.
-
D.
54 gam.
Hòa tan 3,82 gam hỗn hợp X gồm NaH2PO4, Na2HPO4 và Na3PO4 vào nước dư thu được dung dịch Y. Trung hòa hoàn toàn Y cần 50 ml dung dịch KOH 1M, thu được dung dịch Z. Khối lượng kết tủa thu được khi cho Z tác dụng hết với dung dịch AgNO3 dư là
-
A.
8,38 gam.
-
B.
16,76 gam.
-
C.
12,57 gam.
-
D.
20,95 gam.
Đốt cháy hoàn toàn m gam P bằng oxi rồi hòa tan hoàn toàn sản phẩm cháy vào dung dịch chứa 0,1 mol H2SO4 thu được dung dịch X. Cho 0,5 mol KOH vào X, sau khi các phản ứng xảy ra hoàn toàn cô cạn dung dịch thu được 943m/62 gam chất rắn. Giá trị của m là:
-
A.
2,17
-
B.
2,48
-
C.
3,1
-
D.
3,72
Đun nóng hỗn hợp Ca và P đỏ (trong điều kiện không có không khí). Hoà tan sản phẩm thu được vào dung dịch HCl dư thu được 28 lít khí ở đktc. Đốt cháy khí này thành P2O5. Lượng oxit thu được tác dụng vừa đủ với dung dịch NaOH tạo thành dung dịch chỉ chứa 142g Na2HPO4. Xác định thành phần % về khối lượng mỗi chất trong hỗn hợp đầu. Biết các phản ứng xảy ra hoàn toàn.
-
A.
69,31%; 30,69%
-
B.
35,57%; 64,43%
-
C.
30%; 70%
-
D.
40%; 60%
Lời giải và đáp án
Hòa tan 142 gam P2O5 vào 500 gam dung dịch H3PO4 24,5%. Nồng độ % của H3PO4 trong dung dịch thu được là
-
A.
49,61%.
-
B.
56,32%.
-
C.
48,86%.
-
D.
68,75%.
Đáp án : A
P2O5 + 3H2O → 2H3PO4
+) Tính tổng số mol H3PO4 trong dung dịch thu được
+) mdung dịch thu được = mP2O5 + mdung dịch ban đầu
nP2O5 = 1 mol; nH3PO4 ban đầu = 1,25 mol
P2O5 + 3H2O → 2H3PO4
1 mol → 2 mol
=> tổng số mol H3PO4 trong dung dịch thu được = 2 + 1,25 = 3,25 mol
=> mH3PO4 = 318,5 gam
mdung dịch thu được = mP2O5 + mdung dịch ban đầu = 142 + 500 = 642 gam
=> C% = 318,5 / 642 . 100% = 49,61%
Hoà tan 100 gam P2O5 vào m gam dung dịch H3PO4 48% ta được dung dịch H3PO4 60%. Giá trị của m là :
-
A.
550 gam.
-
B.
460 gam.
-
C.
300 gam.
-
D.
650 gam.
Đáp án : D
+) Tính số mol H3PO4 sinh ra theo PT: P2O5 + 3H2O → 2H3PO4
+) Coi P2O5 là dung dịch H3PO4 có nồng độ phần trăm là : C% = \(\frac{{138}}{{100}}.100\% = 138\% \)
Gọi m1, m2 lần lượt là khối lượng của P2O5 và dung dịch H3PO4 48% => sử dụng sơ đồ đường chéo để giải
Phương trình phản ứng :
P2O5 + 3H2O → 2H3PO4
142 → 196 gam
100 → x gam
\( \Rightarrow x = \frac{{100.196}}{{142}} = 138\,\,gam\)
Coi P2O5 là dung dịch H3PO4 có nồng độ phần trăm là : C% = \(\frac{{138}}{{100}}.100\% = 138\% \)
Gọi m1, m2 lần lượt là khối lượng của P2O5 và dung dịch H3PO4 48%.
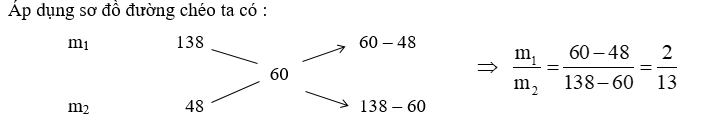
=> \({m_{{\rm{dd}}\,\,{H_3}P{O_4}\,\,48\% }} = {m_2} = \frac{{13}}{2}.100 = 650\,\,gam.\)
Cho 200 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M, muối thu được có khối lượng là :
-
A.
14,2 gam.
-
B.
15,8 gam.
-
C.
16,4 gam.
-
D.
11,9 gam.
Đáp án : A
\( \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{2}{1}\)\( \Rightarrow \) Sản phẩm tạo thành là Na2HPO4
+) Tính số mol muối theo PT: 2NaOH + H3PO4 \( \to \) Na2HPO4 + 2H2O
Theo giả thiết ta có :
\({n_{NaOH}} = 0,2.1 = 0,2\,\,mol;\,\,{n_{{H_3}P{O_4}}} = 0,2.0,5 = 0,1\,\,mol \Rightarrow \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{2}{1}\)\( \Rightarrow \) Sản phẩm tạo thành là Na2HPO4
Phương trình phản ứng :
2NaOH + H3PO4 \( \to \) Na2HPO4 + 2H2O (1)
0,2 → 0,1 → 0,1
Theo (1) ta thấy : \({n_{N{a_2}HP{O_4}}} = 0,1\,\,mol \Rightarrow {n_{N{a_2}HP{O_4}}} = 142.0,1 = 14,2\,\,gam\)
Cho 14,2 gam P2O5 vào 200 gam dung dịch NaOH 8% thu được dung dịch A. Muối thu được và nồng độ % tương ứng là
-
A.
Na2HPO4 và 11,2%.
-
B.
Na3PO4 và 7,66%.
-
C.
Na2HPO4 và 13,26%.
-
D.
Na2HPO4; NaH2PO4 đều là 7,66%.
Đáp án : C
+) nH3PO4 = 2.nP2O5
+) \(\dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \dfrac{2}{1}\)\( \Rightarrow \) Sản phẩm tạo thành là Na2HPO4
+) Bảo toàn nguyên tố P: \({n_{N{a_2}HP{O_4}}} = {n_{{H_3}P{O_4}}}\)
+) Khối lượng dung dịch sau phản ứng là : \(m = {m_{{\rm{dd}}\,\,NaOH}} + {m_{{P_2}{O_5}}}\)
\({n_{{P_2}{O_5}}} = \dfrac{{14,2}}{{142}} = 0,1\,\,mol;\,\,{n_{NaOH}} = \dfrac{{200.8\% }}{{40}} = 0,4\,\,mol\)
P2O5 + 3H2O → 2H3PO4 (1)
0,1 → 0,2 mol
Tỉ lệ \(\dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \dfrac{2}{1}\)\( \Rightarrow \) Sản phẩm tạo thành là Na2HPO4
Bảo toàn nguyên tố P: \({n_{N{a_2}HP{O_4}}} = {n_{{H_3}P{O_4}}} = 0,2\,\,mol \Rightarrow {m_{N{a_2}HP{O_4}}} = 142.0,2 = 28,4\,\,gam\)
Khối lượng dung dịch sau phản ứng là : \(m = {m_{{\rm{dd}}\,\,NaOH}} + {m_{{P_2}{O_5}}} = 200 + 14,2 = 214,2\,\,mol\)
=> \(C{\% _{N{a_2}HP{O_4}}} = \dfrac{{28,4}}{{214,2}}.100 = 13,26\% \)
Cho 1,32 gam (NH4)2SO4 tác dụng với dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là:
-
A.
NH4H2PO4.
-
B.
(NH4)2HPO4.
-
C.
(NH4)3PO4.
-
D.
NH4H2PO4 và (NH4)2HPO4.
Đáp án : A
Xét tỉ lệ \(\frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}} \) => muối thu được
n(NH4)2SO4 = 0,01 mol; nH3PO4 = 0,04 mol
Khí thu được là NH3 => nNH3 = 2.n(NH4)2SO4 = 0,02 mol
Ta có: nOH- = nNH3 = 0,02 mol
Xét tỉ lệ \(\frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,02}}{{0,04}} = \frac{1}{2} < 1\) => muối thu được là NH4H2PO4
Cho 200 ml dung dịch NaOH 2M tác dụng với 100 ml dung dịch H3PO4 aM thu được 25,95 gam hai muối. Giá trị của a là:
-
A.
1.
-
B.
1,75.
-
C.
1,25.
-
D.
1,5.
Đáp án : B
+) Sau phản ứng thu được 2 muối => NaOH phản ứng hết
+) Bản chất của phản ứng :
H+ + OH- → H2O
mol: 0,4 ← 0,4 → 0,4
+) Áp dụng định luật bảo toàn khối lượng ta có : mNaOH + mH3PO4 = mmuối + mH2O
ta có:
nNaOH =0,4(mol)
vì dung dịch sau phản ứng có hai muối => NaOH phản ứng hết
OH- + H+ → H2O
Mol : 0,4 → 0,4 → 0,4
Bảo toàn khối lượng có : mNaOH + mH3PO4 = mmuối + mH2O
=> mH3PO4 = 25,95 + 0,4.18 – 0,4.40 = 17,15 gam
=>nH3PO4 = 0,175 => CH3PO4= 1,75(M)
Đốt cháy hoàn toàn 3,1 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32%, thu được muối Na2HPO4. Giá trị của m là :
-
A.
25.
-
B.
50.
-
C.
75.
-
D.
100.
Đáp án : A
+) Bảo toàn nguyên tố P : nH3PO4 = nNa2HPO4 = nP
+) Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO4 => mdung dịch NaOH
nP = 0,1 mol
Bảo toàn nguyên tố P : nH3PO4 = nNa2HPO4 = nP = 0,1 mol
Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO4 = 0,2 mol
=> mdung dịch NaOH = 0,2.40.100 / 32 = 25 gam
Để trung hoà hoàn toàn dung dịch thu được khi thuỷ phân 4,5375 gam một photpho trihalogenua cần dùng 55 ml dung dịch NaOH 3M. Biết rằng phản ứng thuỷ phân tạo ra hai axit, trong đó có axit H3PO3 là axit hai nấc. Công thức của photpho trihalogenua đó là
-
A.
PF3.
-
B.
PCl3.
-
C.
PBr3.
-
D.
PI3.
Đáp án : B
Trung hòa X bằng NaOH => 2 muối thu được là Na2HPO3 và NaX
+) Bảo toàn nguyên tố P và X: nNa2HPO3 = nH3PO3 ; nNaX = nHX
+) Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO3 + nNaX => tính x
Gọi x là số mol PX3 phản ứng
Phương trình phản ứng :
PX3 + 3H2O → H3PO3 + 3HX (1)
mol: x → x → 3x
Trung hòa X bằng NaOH => 2 muối thu được là Na2HPO3 và NaX
Bảo toàn nguyên tố P và X: nNa2HPO3 = nH3PO3 = x mol; nNaX = nHX = 3x mol
Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO3 + nNaX => 0,165 = 2x + 3x
=> x = 0,033
\( = > {\rm{ }}{M_{PX3}} = \frac{{4,5375}}{{0,033}} = 137,5\,\)
=> X = 35,5 (Cl)
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau :
$Quặng -photphorit\xrightarrow{{{t}^{0}},Si{{O}_{2}},C}P\xrightarrow{{{t}^{0}}}{{P}_{2}}{{O}_{5}}\to {{H}_{3}}P{{O}_{4}}$
Biết hiệu suất chung của quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần khối lượng quặng photphorit chứa 73% Ca3(PO4)2 là
-
A.
1,18 tấn.
-
B.
1,81 tấn.
-
C.
1,23 tấn.
-
D.
1,32 tấn.
Đáp án : A
+) Viết sơ đồ chuyển hóa rút gọn: Ca3(PO4)2 → 2H3PO4
+) Tính nCa3(PO4)2 lí thuyết theo số mol H3PO4
+) mCa3(PO4)2 thực tế dùng = mCa3(PO4)2 lí thuyết / H => mquặng
mH3PO4 = 1.49 / 100 = 0,49 tấn
Ca3(PO4)2 → 2H3PO4
310 196
0,775 tấn ← 0,49 tấn
=> mCa3(PO4)2 thực tế dùng = 0,775.100 / 90 = 31/36 tấn
=> mquặng = 31/36 . 100/73 = 1,18 tấn
Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,56 gam hỗn hợp chất rắn khan. Giá trị của m là
-
A.
1,76.
-
B.
2,13.
-
C.
4,46.
-
D.
2,84.
Đáp án : D
+) Giả sử kiềm có công thức chung là MOH => số mol và khối lượng mol trung bình
+) Nếu phản ứng chỉ tạo 1 muối => tính khối lượng mỗi muối tạo thành và biện luận phản ứng tạo muối nào
+) Đặt nM3PO4 = x mol; nMOH = y mol => mchất rắn = PT(1)
+) Bảo toàn nguyên tố M: nMOH = 3.nM3PO4 + nMOH => PT(2)
Giả sử kiềm có công thức chung là MOH (M = \(\frac{{0,1.23 + 0,05.39}}{{0,15}} = \frac{{85}}{3}\)) với số mol là 0,15 mol
Nếu phản ứng chỉ tạo 1 muối:
MH2PO4: mmuối = 0,15.376 / 3 = 18,8 gam
M2HPO4: mmuối = \(\frac{{0,15}}{2}.\frac{{458}}{3} = 11,45\,\,gam\)
M3PO4: mmuối = \(\frac{{0,15}}{3}.180 = 9\,gam\)
Vì mchất rắn = 8,56 gam < 9 gam => MOH còn dư, phản ứng tạo muối M3PO4
Đặt nM3PO4 = x mol; nMOH = y mol
mmuối = 180x + 136y/3 = 8,56 (1)
Bảo toàn nguyên tố M: nMOH = 3.nM3PO4 + nMOH => 3x + y = 0,15 (2)
Từ (1) và (2) => x = 0,04 mol; y = 0,03 mol
=> nP2O5 = 0,04 / 2 = 0,02 mol => mP2O5 = 2,84 gam
Cho 4,26 gam P2O5 vào dung dịch chứa x mol KOH và 0,04 mol K3PO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 16,64 gam hai chất tan. Giá trị của x là
-
A.
0,15.
-
B.
0,09.
-
C.
0,06.
-
D.
0,14.
Đáp án : C
Nếu phản ứng chỉ tạo 1 muối
⟹ Tính khối lượng từng muối trong từng trường hợp đó.
⟹ Giá trị chất rắn thu được nằm trong khoảng nào.
nP2O5 = 4,26/142 = 0,03 mol
Nếu phản ứng chỉ tạo 1 muối:
+ KH2PO4 : (0,03.2 + 0,04).136 = 13,6 gam.
+ K2HPO4 : 0,1.174 = 17,4 gam.
+ K3PO4 : 0,1.212 = 21,2 gam.
Ta thấy: 13,6 < mc/tan = 16,64 < 17,4
⟹ chất tan chứa KH2PO4 (a mol) và K2HPO4 (b mol)
⟹ mc/tan = 16,64 = 136a + 174b (1)
BTNT P ⟹ a + b = 0,03.2 + 0,04 (2)
Từ (1)(2) ⟹ a = 0,02 và b = 0,08.
BTNT K ⟹ x + 3.0,04 = 0,02 + 2.0,08
⟹ x = 0,06
Cho m gam P2O5 tác dụng với 400 ml dung dịch NaOH 0,3M, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được 1,55m gam chất rắn. Giá trị của m gần nhất với:
-
A.
15,6
-
B.
15,5
-
C.
15,8
-
D.
15,7
Đáp án : A
Xét các trường hợp sau:
TH1: P2O5 và NaOH pứ vừa đủ tạo muối: nH2O = nNaOH
Dùng bảo toàn khối lượng để tìm m.
TH2:Chất rắn gồm: NaOHdư; Na3PO4
Dùng bảo toàn khối lượng để tìm m.
TH1: P2O5 và NaOH pứ vừa đủ tạo muối: nH2O = nNaOH = 0,12mol
P2O5 + H2O → 2H3PO4
m/142 → 2m/142 mol
Có thể xảy ra các PT:
H3PO4 + NaOH → NaH2PO4+ H2O (3)
H3PO4 + 2NaOH → Na2HPO4+ 2H2O (4)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (5)
Bảo toàn khối lượng ta có: mH3PO4 + mNaOH = m rắn + mH2O
(2m/142) . 98 + 0,12 . 40 = 1,55m + 0,12 . 18 →m = 15,555 gam gần nhất với 15,6 gam
TH2: Chất rắn gồm: NaOHdư; Na3PO4
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
m/142 0,12 2m/142 3m/142
Bảo toàn khối lượng ta có: mP2O5 + mNaOHbđ = m rắn + mH2O
m + 0,12 . 40 = 1,55m + 18 . 3m/142 → m = 5,16g (Loại)
Cho 17,04 gam P2O5 vào 200 ml dung dịch NaOH nồng độ aM thu được dung dịch có tổng khối lượng các chất tan bằng 30,12 gam. Giá trị của a là:
-
A.
0,6.
-
B.
0,9.
-
C.
1,2.
-
D.
1,5.
Đáp án : D
P2O5 + 3H2O → 2H3PO4 (1)
H3PO4 + NaOH → NaH2PO4 + H2O (2)
H3PO4 + 2NaOH → Na2HPO4 + 2H2O (3)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (4)
Đặt \((*) = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\)
Ta xét các trường hợp sau:
Trường hợp 1: Khi đó chất tan thu được chứa H3PO4 dư và NaH2PO4
Trường hợp 2: Chất tan thu được chứa 2 muối.
Trường hợp 3: Chất tan thu được chứa Na3PO4và NaOH dư
Từ đó ta tìm được giá trị a.
P2O5 + 3H2O → 2H3PO4 (1)
Ta có: nH3PO4 = 2.nP2O5 = 0,24 mol; nNaOH = 0,2 a (mol)
H3PO4 + NaOH → NaH2PO4 + H2O (2)
H3PO4 + 2NaOH → Na2HPO4 + 2H2O (3)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (4)
Đặt \((*) = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\)
Ta xét các trường hợp sau:
Trường hợp 1: Nếu (*) ≤ 1 → 0,2a / 0,24 ≤ 1→ a ≤ 1,2.
Khi đó chất tan thu được chứa (0,24 – 0,2a) mol H3PO4 dư và 0,2a mol NaH2PO4
→ mchất tan = (0,24 – 0,2a) . 98 + 0,2a . 120 = 30,12 gam → a = 1,5 (Loại)
Trường hợp 2:
+ Nếu 1 < (*) < 3 → 1 < 0,2a / 0,24 < 3 → 1,2 < a < 3,6
Khi đó nNaOH = nH2O = 0,2a (mol)
Dùng định luật bảo toàn khối lượng ta có: mH3PO4 + mNaOH = mmuối + mH2O
→ 0,24 . 98 + 0,2a . 40 = 30,12 + 0,2a . 18 → a = 1,5 (thỏa mãn)
+ Nếu (*) ≥ 3 → 0,2a / 0,24 ≥ 3 → a ≥ 3,6
→ Khi đó chất tan thu được chứa 0,24 mol Na3PO4và (0,2a – 0,24.3) mol NaOH dư
→ mchất tan = 0,24 . 164 + mNaOH dư > 30,12 gam → Loại
Vậy giá trị của a = 1,5.
Hòa tan hết 17,94 gam một kim loại kiềm vào một lượng nước dư thu được dung dịch X. Cho dung dịch X tác dụng với 36,92 gam P2O5 thì thu được dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau. Kim loại kiềm là:
-
A.
Na
-
B.
Rb
-
C.
K
-
D.
Li
Đáp án : A
Gọi kim loại kiềm cần tìm là M.
M + H2O → MOH + ½ H2 ↑
Phản ứng xảy ra theo thứ tự:
P2O5 + 3H2O → 2H3PO4
H3 PO4 + MOH → MH2PO4 + H2O
MH2PO4 + MOH → M2HPO4 + H2O
M2HPO4 + MOH → M3PO4 + H2O
Xét hai trường hợp:
TH1: Hai muối là M2HPO4 và MH2PO4
TH2: Hai muối là M2HPO4 và M3PO4
Bảo toàn nguyên tố M để tìm được số mol M, từ đó tính được khối lượng mol của M.
nH3PO4 = 2nP2O5 = 2.36,92/142 = 0,52 mol
Gọi kim loại kiềm cần tìm là M.
M + H2O → MOH + ½ H2 ↑
Phản ứng xảy ra theo thứ tự:
P2O5 + 3H2O → 2H3PO4
H3 PO4 + MOH → MH2PO4 + H2O
MH2PO4 + MOH → M2HPO4 + H2O
M2HPO4 + MOH → M3PO4 + H2O
Xét hai trường hợp:
TH1: Hai muối là M2HPO4 và MH2PO4
Dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau →n MH2PO4 = nM2HPO4 = 0,26 (mol)
Bảo toàn nguyên tố M ta có: nM = nMH2PO4 + 2n M2HPO4 = 0,78 mol → M = 17,94/0,78 = 23 (Na)
TH2: Hai muối là: M2HPO4 và M3PO4 → n M2HPO4 = n M3PO4 = 0,26 (mol)
Bảo toàn nguyên tố M ta có: nM = 2nM2HPO4 + 3nM3PO4 = 1,3 mol → M = 17,94/1,3 = 13,8 (loại)
Vậy kim loại kiềm cần tìm là Na.
Trộn 100 ml dung dịch gồm Na3PO4 1M và Na2HPO4 1,5M với 200 ml dung dịch H3PO4 1M phản ứng xong thu được dung dịch X. Cô cạn dung dịch X thu được khối lượng chất rắn khan là:
-
A.
53,7 gam
-
B.
57,3 gam
-
C.
54,5 gam
-
D.
55,4 gam
Đáp án : B
Tính toán theo các phương trình hóa học xảy ra:
2Na3PO4 + H3PO4 → 3Na2HPO4
Na2HPO4 + H3PO4 → 2NaH2PO4
Từ đó tính được khối lượng các muối trong dung dịch X.
Ta có: nNa3PO4 = 0,1 mol; nNa2HPO4 = 0,15 mol; nH3PO4 = 0,2 mol
(1) 2Na3PO4 + H3PO4 → 3Na2HPO4
Bđ: 0,1 0,2 0,15
Pư: 0,1 → 0,05 → 0,15
Sau: 0 0,2 - 0,05 = 0,15 0,15 + 0,15 = 0,3
Sau phản ứng (1) có 0,15 mol H3PO4 và 0,3 mol Na2HPO4
(2) Na2HPO4 + H3PO4 → 2NaH2PO4
Bđ: 0,3 0,15
Pư: 0,15 ← 0,15 → 0,3
Sau: 0,15 0 0,3
Vậy dung dịch X có chứa 0,3 mol NaH2PO4 và 0,15 mol Na2HPO4.
Cô cạn dung dịch X thu được khối lượng chất rắn khan là:
mchất rắn khan = mNaH2PO4 + mNa2HPO4 = 0,3 . 120 + 0,15 . 142 = 57,3 (gam)
Trộn 200 ml dung dịch Ca(H2PO4)2 1M với 200 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là:
-
A.
31 gam.
-
B.
45 gam.
-
C.
54,4 gam.
-
D.
54 gam.
Đáp án : C
Thứ tự các phản ứng xảy ra:
H2PO4- + OH- → HPO42- + H2O
Ca2+ + HPO42- → CaHPO4↓
Tính toán lần lượt theo các phương trình hóa học xảy ra để tính khối lượng kết tủa thu được.
Ta có: nH2PO4- = 0,4 mol; nCa2+ = 0,4 mol và nOH- = 0,4 mol
Phản ứng trung hòa:
H2PO4- + OH- → HPO42- + H2O
0,4 0,4 0,4 mol
Phản ứng tạo kết tủa:
Ca2+ + HPO42- → CaHPO4↓
0,4 0,4 0,4 mol
mCaHPO4v = 0,4 . 136 = 54,4 gam
Hòa tan 3,82 gam hỗn hợp X gồm NaH2PO4, Na2HPO4 và Na3PO4 vào nước dư thu được dung dịch Y. Trung hòa hoàn toàn Y cần 50 ml dung dịch KOH 1M, thu được dung dịch Z. Khối lượng kết tủa thu được khi cho Z tác dụng hết với dung dịch AgNO3 dư là
-
A.
8,38 gam.
-
B.
16,76 gam.
-
C.
12,57 gam.
-
D.
20,95 gam.
Đáp án : C
HPO42- + OH- → PO43- + H2O
H2PO4-+ 2OH- → PO43- + 2H2O
PO43- + 3Ag+ → Ag3PO4
Gọi số mol của NaH2PO4, Na2HPO4 và Na3PO4 lần lượt là a, b, c mol → Phương trình khối lượng
Và phương trình số mol OH-
→ a + b + c → mAg3PO4
HPO42- + OH- → PO43- + H2O
H2PO4-+ 2OH- → PO43- + 2H2O
PO43- + 3Ag+ → Ag3PO4
Gọi số mol của NaH2PO4, Na2HPO4 và Na3PO4 lần lượt là a,b, c mol
+ mX = 120a + 142b + 164c = 3,82 (1)
+ nKOH = 2a + b = 0,05 mol (2)
→ 120a + 142b + 164b + 22.(2a + b) = 3,82 + 0,05.22 = 4,92
→ 164.(a + b + c) = 4,92 → a + b + c = 0,03
→ mAg3PO4 = nPO4 3- = a + b + c = 0,03.419 = 12,57 gam
Đốt cháy hoàn toàn m gam P bằng oxi rồi hòa tan hoàn toàn sản phẩm cháy vào dung dịch chứa 0,1 mol H2SO4 thu được dung dịch X. Cho 0,5 mol KOH vào X, sau khi các phản ứng xảy ra hoàn toàn cô cạn dung dịch thu được 943m/62 gam chất rắn. Giá trị của m là:
-
A.
2,17
-
B.
2,48
-
C.
3,1
-
D.
3,72
Đáp án : B
Ta có: 4P + 5O2 → 2P2O5 (1)
Cho sản phẩm cháy vào dung dịch chứa 0,1 mol H2SO4 thì:
P2O5 + 3H2O → 2H3PO4 (2)
nH3PO4 = nP = m/31 (mol)
Dung dịch X chứa H3PO4 và H2SO4
Cho 0,5 mol KOH phản ứng với dung dịch X:
2KOH + H2SO4 → K2SO4 + 2H2O (3)
Khi cho KOH phản ứng với H3PO4 có thể xảy ra các PTHH sau:
KOH + H3PO4 → KH2PO4 + H2O (4)
2KOH + H3PO4 → K2HPO4 + 2H2O (5)
3KOH + H3PO4 → K3PO4 + 3H2O (6)
Xét các trường hợp sau:
- TH1: Chất rắn sau phản ứng chỉ chứa các muối
Dùng định luật bảo toàn khối lượng tính giá trị m.
- TH2: Chất rắn sau phản ứng có KOH dư
3KOH + H3PO4 → K3PO4 + 3H2O (6)
3m/31 m/31 m/31
Từ khối lượng chất rắn sau phản ứng tính được giá trị m.
Ta có: 4P + 5O2 → 2P2O5 (1)
Cho sản phẩm cháy vào dung dịch chứa 0,1 mol H2SO4 thì:
P2O5 + 3H2O → 2H3PO4 (2)
Ta có:
nH3PO4 = nP = m/31 (mol)
Dung dịch X chứa H3PO4 và H2SO4
Cho 0,5 mol KOH phản ứng với dung dịch X:
2KOH + H2SO4 → K2SO4+ 2H2O (3)
0,2 ← 0,1 → 0,1 mol
→ Số mol KOH phản ứng với H3PO4 là 0,5 - 0,2 = 0,3 mol
KOH + H3PO4 → KH2PO4 + H2O (4)
2KOH + H3PO4 → K2HPO4 + 2H2O (5)
3KOH + H3PO4 → K3PO4 + 3H2O (6)
Xét các trường hợp sau:
-TH1: Chất rắn sau phản ứng chỉ chứa các muối
→ nH2O = nKOH = 0,5 mol
Theo định luật bảo toàn khối lượng ta có:
mKOH + maxit = mmuối + mH2O
→\(0,5.56 + {\rm{ }}0,1.98 + {\rm{ }}98.\frac{m}{{31}} = \frac{{943m}}{{62}} + {\rm{ }}0,5.18\)
→ m = 2,39 gam
→ nH3PO4 = nP = 0,077 mol
→ \(T = \frac{{{n_{KOH}}}}{{{n_{H3PO4}}}} = \frac{{0,3}}{{0,077}} = 3,89 > 3\) → Loại vì khi đó chất rắn sau phản ứng ngoài muối còn có KOH dư.
- TH2: Chất rắn sau phản ứng có KOH dư
3KOH + H3PO4 → K3PO4 + 3H2O (6)
3m/31 m/31 m/31
Chất rắn sau phản ứng có chứa \(\left\{ \begin{array}{l}\;0,1{\rm{ }}mol\,{\rm{ }}{K_2}S{O_4}\\\frac{m}{{31}}mol\,{K_3}P{O_4}\\(0,3 - \frac{{3m}}{{31}})mol\,KOH{\rm{ }}du\end{array} \right.\)
→ \(0,1.174 + \frac{m}{{31}}.{\rm{ }}212 + {\rm{ }}(0,3 - \frac{{3m}}{{31}}).56 = \frac{{943m}}{{62}}\) → m = 2,48 gam
Đun nóng hỗn hợp Ca và P đỏ (trong điều kiện không có không khí). Hoà tan sản phẩm thu được vào dung dịch HCl dư thu được 28 lít khí ở đktc. Đốt cháy khí này thành P2O5. Lượng oxit thu được tác dụng vừa đủ với dung dịch NaOH tạo thành dung dịch chỉ chứa 142g Na2HPO4. Xác định thành phần % về khối lượng mỗi chất trong hỗn hợp đầu. Biết các phản ứng xảy ra hoàn toàn.
-
A.
69,31%; 30,69%
-
B.
35,57%; 64,43%
-
C.
30%; 70%
-
D.
40%; 60%
Đáp án : A
Tính toán theo các phương trình hóa học:
3Ca + 2P → Ca3P2 (1)
Sản phẩm thu được có chứa Ca3P2, có thể có Ca dư hoặc P dư
Ca3P2 + 6HCl → 3CaCl2 + 2PH3↑ (2)
Ca + 2HCl → CaCl2 + H2 ↑ (3)
2PH3 + 4O2 \(\xrightarrow{{{t^0}}}\) P2O5 + 3H2O (4)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (5)
Tính toán theo phương trình hóa học để tìm số mol Ca và số mol P ban đầu. Từ đó tính được % khối lượng mỗi chất trong hỗn hợp ban đầu.
Ta có nkhí = 1,25 mol; nNa2HPO4 = 1 mol
3Ca + 2P → Ca3P2 (1)
Sản phẩm thu được có chứa Ca3P2, có thể có Ca dư hoặc P dư
Ca3P2 + 6HCl → 3CaCl2 + 2PH3↑ (2)
Ca + 2HCl → CaCl2 + H2 ↑ (3)
2PH3 + 4O2 \(\xrightarrow{{{t^0}}}\)P2O5 + 3H2O (4)
1 ← 0,5 mol
P2O5 + 4NaOH → 2Na2HPO4 + H2O (5)
0,5 ← 1 mol
Theo PT (2), (4), (5) ta thấy nPH3 = nNa2HPO4 = 1 mol < 1,25 mol → Sản phẩm khí phải có H2
→ nH2 = 1,25 - 1 = 0,25 mol → nCa dư = nH2 = 0,25 mol
Theo PT (2): nCa3P2 = 0,5.nPH3 = 0,5 mol
Theo PT (1): nCa pứ = 3.nCa3P2 = 1,5 mol; nP pứ = 2.nCa3P2 = 2.0,5 = 1 mol
nCa banđầu = nCa pứ + nCa dư = 0,25 + 1,5 = 1,75 mol
→ Trong hỗn hợp đầu có: mCa = 1,75.40 = 70 gam; mP = 1.31 = 31 gam
→%mCa = 69,31%; %mP = 30,69%
Luyện tập và củng cố kiến thức Bài 12. Phân bón hóa học Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nitơ - photpho Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 2 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 11. Axit photphoric và muối photphat Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Photpho Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập tính oxi hóa của HNO3 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Axit nitric và muối nitrat Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 8. Muối amoni Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 8. Amoniac Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7. Nitơ Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận