Trắc nghiệm Bài 35. Stiren - Hóa 11
Đề bài
Cho hiđrocacbon thơm :
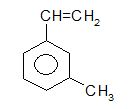
Tên gọi của của hiđrocacbon trên là:
-
A.
m-vinyltoluen.
-
B.
3-metyl-1-vinylbenzen.
-
C.
m-metylstiren.
-
D.
A, B, C đều đúng.
A + 4H2 $\xrightarrow{{Ni,\,p,\,{t^o}}}$ etylxiclohexan. Cấu tạo của A là :
-
A.
C6H5CH2CH3.
-
B.
C6H5CH3.
-
C.
C6H5CH2CH=CH2.
-
D.
C6H5CH=CH2.
Số lượng đồng phân chỉ chứa vòng benzen ứng với công thức phân tử C9H10 là :
-
A.
7
-
B.
8
-
C.
9
-
D.
6
Stiren không phản ứng được với chất nào sau đây ?
-
A.
dung dịch Br2.
-
B.
H2, Ni, to.
-
C.
dung dịch KMnO4.
-
D.
dung dịch NaOH.
Để phân biệt benzen, toluen, stiren ta chỉ dùng 1 thuốc thử duy nhất là :
-
A.
dung dịch brom.
-
B.
Br2 (Fe).
-
C.
dung dịch KMnO4.
-
D.
dung dịch Br2 hoặc dung dịch KMnO4.
Để phân biệt được các chất hex-1-in, toluen, benzen ta dùng 1 thuốc thử duy nhất là:
-
A.
dung dịch AgNO3/NH3.
-
B.
dung dịch brom.
-
C.
dung dịch KMnO4.
-
D.
dung dịch HCl.
A có công thức phân tử là C8H8, tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức. 1 mol A tác dụng tối đa với:
-
A.
4 mol H2 ; 1 mol brom.
-
B.
3 mol H2 ; 1 mol brom.
-
C.
3 mol H2 ; 3 mol brom.
-
D.
4 mol H2 ; 4 mol brom.
Tiến hành trùng hợp 10,4 gam stiren được hỗn hợp X gồm polistiren và stiren (dư). Cho X tác dụng với 200 ml dung dịch Br2 0,15M, sau đó cho dung KI dư vào thấy xuất hiện 1,27 gam iot. Hiệu suất trùng hợp stiren là:
-
A.
60,00%
-
B.
75,00%
-
C.
80,00%
-
D.
83,33%
Đề hiđro hoá etylbenzen ta được stiren; trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là:
-
A.
13,52 tấn.
-
B.
10,60 tấn.
-
C.
13,25 tấn.
-
D.
8,48 tấn.
1,3 gam chất hữu cơ A cháy hoàn toàn thu được 4,4 gam CO2 và 0,9 gam H2O. Tỉ khối hơi của A đối với oxi là d thỏa mãn điều kiện 3 < d < 3,5. Công thức phân tử của A là :
-
A.
C2H2.
-
B.
C8H8.
-
C.
C4H4.
-
D.
C6H6.
Đốt cháy hết 9,18 gam hai đồng đẳng kế tiếp thuộc dãy của stiren A, B thu được H2O và 30,36 gam CO2. Công thức phân tử của A và B lần lượt là :
-
A.
C8H8; C9H10.
-
B.
C11H14; C12H16
-
C.
C7H8; C9H12.
-
D.
C10H12; C11H14.
Đốt X thu được ${m_{C{O_2}}}:\,\,{m_{{H_2}O}}\,\, = \,\,44\,\,:\,\,9$ . Biết X làm mất màu dung dịch brom. X là :
-
A.
C6H5–C2H3.
-
B.
CH$ \equiv$C–CH=CH2.
-
C.
CH$ \equiv$CH
-
D.
A hoặc B hoặc C
Đốt cháy hoàn toàn một thể tích hơi hợp chất hữu cơ A cần 10 thể tích oxi (đo cùng điều kiện nhiệt độ và áp suất), sản phẩm thu được chỉ gồm CO2 và H2O với = 44 : 9. Biết MA < 150. A có công thức phân tử là :
-
A.
C4H6O.
-
B.
C8H8O.
-
C.
C8H8.
-
D.
C2H2.
Lời giải và đáp án
Cho hiđrocacbon thơm :

Tên gọi của của hiđrocacbon trên là:
-
A.
m-vinyltoluen.
-
B.
3-metyl-1-vinylbenzen.
-
C.
m-metylstiren.
-
D.
A, B, C đều đúng.
Đáp án : D
Xem lại cách gọi tên của hợp chất chứa vòng thơm
Tên gọi của của hiđrocacbon trên là : m-vinyltoluen; 3-metyl-1-vinylbenzen hoặc m-metylstiren.
=> A, B, C đều đúng.
A + 4H2 $\xrightarrow{{Ni,\,p,\,{t^o}}}$ etylxiclohexan. Cấu tạo của A là :
-
A.
C6H5CH2CH3.
-
B.
C6H5CH3.
-
C.
C6H5CH2CH=CH2.
-
D.
C6H5CH=CH2.
Đáp án : D
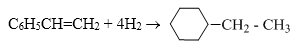
Số lượng đồng phân chỉ chứa vòng benzen ứng với công thức phân tử C9H10 là :
-
A.
7
-
B.
8
-
C.
9
-
D.
6
Đáp án : A
+) Tính độ bất bão hòa => số liên kết pi ở vòng benzen và ở mạch nhánh
=> CTCT
Độ bất bão hòa: k = (2.9 + 2 – 10) / 2 = 5 => mạch nhánh ngoài vòng có 1 liên kết p
=> Các đồng phân của C9H10 là
\(C_6H_5CH_2CH=CH_2\)
Stiren không phản ứng được với chất nào sau đây ?
-
A.
dung dịch Br2.
-
B.
H2, Ni, to.
-
C.
dung dịch KMnO4.
-
D.
dung dịch NaOH.
Đáp án : D
Stiren không phản ứng được với dung dịch NaOH
Để phân biệt benzen, toluen, stiren ta chỉ dùng 1 thuốc thử duy nhất là :
-
A.
dung dịch brom.
-
B.
Br2 (Fe).
-
C.
dung dịch KMnO4.
-
D.
dung dịch Br2 hoặc dung dịch KMnO4.
Đáp án : C
Để phân biệt benzen, toluen, stiren ta chỉ dùng 1 thuốc thử duy nhất là dung dịch KMnO4
Benzen: không hiện tượng
Sitren: mất màu ở nhiệt độ thường
Toluen: mất màu khi đun nóng
Để phân biệt được các chất hex-1-in, toluen, benzen ta dùng 1 thuốc thử duy nhất là:
-
A.
dung dịch AgNO3/NH3.
-
B.
dung dịch brom.
-
C.
dung dịch KMnO4.
-
D.
dung dịch HCl.
Đáp án : C
Xem lại phản ứng oxi hóa không hoàn toàn của hợp chất chứa vòng benzen với dd KMnO4
- dùng dung dịch KMnO4
Hex-1-in: mất màu ở nhiệt độ thường
Toluen: Mất màu khi đun nóng
Benzen không phản ứng
A có công thức phân tử là C8H8, tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức. 1 mol A tác dụng tối đa với:
-
A.
4 mol H2 ; 1 mol brom.
-
B.
3 mol H2 ; 1 mol brom.
-
C.
3 mol H2 ; 3 mol brom.
-
D.
4 mol H2 ; 4 mol brom.
Đáp án : A
Tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức => chứa nối đôi C=C
=> A là C6H5-CH=CH2 (stiren)
=> 1 mol A tác dụng tối đa với 4 mol H2 ; 1 mol brom.
Tiến hành trùng hợp 10,4 gam stiren được hỗn hợp X gồm polistiren và stiren (dư). Cho X tác dụng với 200 ml dung dịch Br2 0,15M, sau đó cho dung KI dư vào thấy xuất hiện 1,27 gam iot. Hiệu suất trùng hợp stiren là:
-
A.
60,00%
-
B.
75,00%
-
C.
80,00%
-
D.
83,33%
Đáp án : B
+) Từ nBr2 dư => nBr2 phản ứng = nC8H8 dư
=> nC8H8 phản ứng => hiệu suất
${n_{{C_8}{H_8}}} = \frac{{10,4}}{{104}} = 0,1\,\,mol;\,\,{n_{B{r_2}}} = 0,15.0,2 = 0,03\,\,mol;\,\,{n_{{I_2}}} = \frac{{1,27}}{{254}} = 0,005\,\,mol.$
Phương trình phản ứng :
$nCH({C_6}{H_5}) = C{H_2}\,\,\,\;\xrightarrow{{xt,\,\,\,\,\,{t^o}}}{{\text{[ - }}CH({C_6}{H_5}) - C{H_2} - {\text{]}}_n}$ (1)
mol: 0,075
${C_6}{H_5} - CH = C{H_2}\, + \,B{r_2}\; \to \;\;{C_6}{H_5} - CHB{\text{r}} - C{H_2}B{\text{r}}$ (2)
mol: 0,025 → 0,025
KI + Br2 → KBr + I2 (3)
mol: 0,005 → 0,005
Theo (3) : n Br2 dư = 0,005 =>nBr2 phản ứng = nC8H8 dư = 0,025 mol
=> nC8H8 phản ứng = 0,075 mol => H =$\dfrac{{0,075}}{{0,1}}.100 = 75\% $
Đề hiđro hoá etylbenzen ta được stiren; trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là:
-
A.
13,52 tấn.
-
B.
10,60 tấn.
-
C.
13,25 tấn.
-
D.
8,48 tấn.
Đáp án : C
$n{C_6}{H_5}C{H_2}C{H_3}\xrightarrow{{ - {H_2},{t^o},xt}}n{C_6}{H_5}CH = C{H_2}\;\xrightarrow{{{t^o},\,p,\,xt}}{\rlap{-} (CH({C_6}{H_5})-C{H_2}\rlap{-} )_n}$
gam: 106n → 104n
tấn: x.80% → 10,4
Sơ đồ phản ứng:
$n{C_6}{H_5}C{H_2}C{H_3}\xrightarrow{{-{H_2},\,{t^o},\,xt}}n{C_6}{H_5}CH = C{H_2}\;\xrightarrow{{{t^o},\,p,\,xt}}{\rlap{-} (\,CH({C_6}{H_5})-C{H_2}\rlap{-} )_n}$
gam: 106n → 104n
tấn: x.80% → 10,4
Vậy khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polistiren với hiệu suất 80% là :
x = $\frac{{10,4.106n}}{{104n.80\% }} = 13,25$ tấn
1,3 gam chất hữu cơ A cháy hoàn toàn thu được 4,4 gam CO2 và 0,9 gam H2O. Tỉ khối hơi của A đối với oxi là d thỏa mãn điều kiện 3 < d < 3,5. Công thức phân tử của A là :
-
A.
C2H2.
-
B.
C8H8.
-
C.
C4H4.
-
D.
C6H6.
Đáp án : B
+) Bảo toàn nguyên tố C và H: nC (trong A) = nCO2; nH (trong A) = 2.nH2O
+) mC + mH = mA => trong A không chứa O
+) $3 < {d_{A/O2}} < 3,5{\text{ }} = > {\text{ }}3 < \frac{{13n}}{{32}}{\text{ < }}3,5{\text{ }} = > 7 < n < 8,6\,\, = > \,\,n = 8$
nCO2 = 0,1 mol; nH2O = 0,05 mol
Bảo toàn nguyên tố C và H: nC (trong A) = nCO2 = 0,1 mol; nH (trong A) = 2.nH2O = 0,1 mol
=> mC + mH = 0,1.12 + 0,1 = 1,3 = mA => trong A không chứa O
CTPT của A là (CH)n
Ta có: $3 < {d_{A/O2}} < 3,5{\text{ }} = > {\text{ }}3 < \frac{{13n}}{{32}}{\text{ < }}3,5{\text{ }} = > 7 < n < 8,6\,\, = > \,\,n = 8$
=> CTPT của A là C8H8
Đốt cháy hết 9,18 gam hai đồng đẳng kế tiếp thuộc dãy của stiren A, B thu được H2O và 30,36 gam CO2. Công thức phân tử của A và B lần lượt là :
-
A.
C8H8; C9H10.
-
B.
C11H14; C12H16
-
C.
C7H8; C9H12.
-
D.
C10H12; C11H14.
Đáp án : B
+) đốt cháy A và B thu được nCO2 – nH2O = 4.nCnH2n-8
+) mhiđrocacbon = mC + mH => nH2O sinh ra = nH / 2
+) số C trung bình = nCO2 / nCnH2n-8
nCO2 = 0,69 mol
Gọi CTPT chung của A và B là CnH2n-8
CnH2n-8 + O2 → nCO2 + (n – 4)H2O
=> đốt cháy A và B thu được nCO2 – nH2O = 4.nCnH2n-8
mhiđrocacbon = mC + mH => mH = 9,18 – 0,69.12 = 0,9 gam => nH2O sinh ra = nH / 2 = 0,45 mol
=> nCnH2n-8 = (0,69 – 0,45) / 4 = 0,06 mol
=> số C trung bình = nCO2 / nCnH2n-8 = 11,5 => A và B là C11H14 và C12H16
Đốt X thu được ${m_{C{O_2}}}:\,\,{m_{{H_2}O}}\,\, = \,\,44\,\,:\,\,9$ . Biết X làm mất màu dung dịch brom. X là :
-
A.
C6H5–C2H3.
-
B.
CH$ \equiv$C–CH=CH2.
-
C.
CH$ \equiv$CH
-
D.
A hoặc B hoặc C
Đáp án : D
${m_{C{O_2}}}:{\text{ }}{m_{{H_2}O}} = {\text{ }}44{\text{ }}:{\text{ }}9{\text{ }} = > {\text{ }}{n_{C{O_2}}}:{n_{{H_2}O}} = \frac{{44}}{{44}}:\frac{9}{{18}} $
${m_{C{O_2}}}:{\text{ }}{m_{{H_2}O}} = {\text{ }}44{\text{ }}:{\text{ }}9{\text{ }} = > {\text{ }}{n_{C{O_2}}}:{n_{{H_2}O}} = \frac{{44}}{{44}}:\frac{9}{{18}} = 1:0,5$
=> nC : nH = 1 : 1 => CTĐGN của X là CH
Vì X làm mất màu dung dịch brom => X có liên kết đôi hoặc liên kết 3
Đốt cháy hoàn toàn một thể tích hơi hợp chất hữu cơ A cần 10 thể tích oxi (đo cùng điều kiện nhiệt độ và áp suất), sản phẩm thu được chỉ gồm CO2 và H2O với = 44 : 9. Biết MA < 150. A có công thức phân tử là :
-
A.
C4H6O.
-
B.
C8H8O.
-
C.
C8H8.
-
D.
C2H2.
Đáp án : C
+)${m_{C{O_2}}}:{\text{ }}{m_{{H_2}O}} = {\text{ }}44{\text{ }}:{\text{ }}9{\text{ }} = > {\text{ }}{n_{C{O_2}}}:{n_{{H_2}O}} = \frac{{44}}{{44}}:\frac{9}{{18}} $
+) Bảo toàn oxi: 2nO2 = 2.nCO2 + nH2O
Coi thể tích như số mol => đốt cháy 1 mol A cần 10 mol oxi
${m_{C{O_2}}}:{\text{ }}{m_{{H_2}O}} = {\text{ }}44{\text{ }}:{\text{ }}9{\text{ }} = > {\text{ }}{n_{C{O_2}}}:{n_{{H_2}O}} = \frac{{44}}{{44}}:\frac{9}{{18}} = 1:0,5$
Gọi nCO2 = a mol => nH2O = 0,5a
Bảo toàn oxi: 2nO2 = 2.nCO2 + nH2O => 2a + 0,5a = 2.10 => a = 8
=> nCO2 = 8 mol; nH2O = 4 mol
=> A: C8H8
Luyện tập và củng cố kiến thức Ôn tập chương 6 + 7 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 35. Benzen và ankyl benzen Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận