Trắc nghiệm Tổng hợp bài tập tính khử của C, CO, H2 - Hóa 11
Đề bài
Trộn 20 gam bột CuO và một lượng C rồi đem nung nóng, sau một thời gian phản ứng thấy có 3,36 lít khí thoát ra khỏi bình. Khối lượng chất rắn thu được là
-
A.
17,6 gam.
-
B.
8 gam.
-
C.
9,6 gam.
-
D.
15,6 gam.
Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp CuO và Al2O3, nung nóng đến khi phản ứng hoàn toàn thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
-
A.
0,8 gam.
-
B.
4,0 gam.
-
C.
8 gam.
-
D.
6 gam.
Cho khí CO dư qua 18 gam oxit kim loại M thu được 14 gam kim loại. Công thức của oxit là
-
A.
PbO
-
B.
NiO
-
C.
FeO
-
D.
CuO
Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 cần 4,48 lít H2 (đktc). khối lượng sắt thu được là
-
A.
12,0 gam
-
B.
14,4 gam.
-
C.
5,6 gam.
-
D.
11,2 gam
Khử hoàn toàn 32 gam hỗn hợp CuO và Fe2O3 bằng khí H2, thấy tạo ra 9 gam nước. Tính khối lượng hỗn hợp kim loại thu được?
-
A.
24 gam
-
B.
16 gam
-
C.
32 gam
-
D.
48 gam
Cho V lít (đktc) khí H2 đi qua bột CuO đun nóng, thu được 32 gam Cu. Nếu cho V lít H2 đi qua bột Fe3O4 đun nóng thì lượng Fe thu được là:
-
A.
21 gam.
-
B.
7 gam.
-
C.
28 gam.
-
D.
14 gam.
Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 2,24 lít H2 ở đktc. Nếu đem hỗn hợp kim loại thu được hoà tan hoàn toàn vào axit HCl thì thể tích khí H2 (đktc) thu được là
-
A.
1,12 lít.
-
B.
2,24 lít.
-
C.
3,36 lít.
-
D.
4,48 lít.
Cho khí CO dư đi qua 15 gam hỗn hợp X gồm CuO, NiO, Fe2O3, ZnO thu được 11,8 gam chất rắn Y gồm các kim loại. Thể tích dung dịch Z gồm H2SO4 1,0M và HCl 0,5M cần dùng để hoà tan hết 15,0 gam hỗn hợp X là
-
A.
0,16 lít
-
B.
0,2 lít
-
C.
0,8 lít
-
D.
0,6 lít
Đốt cháy không hoàn toàn một lượng sắt đã dùng hết 2,24 lít O2 ở đktc, thu được hỗn hợp A gồm các oxit sắt và sắt dư. Khử hoàn toàn A bằng khí CO dư, khí đi ra sau phản ứng được dẫn vào bình đựng nước vôi trong dư. Khối lượng kết tủa thu được là
-
A.
10 gam.
-
B.
20 gam.
-
C.
30 gam.
-
D.
40 gam.
Thổi một luồng khí CO dư đi qua ống đựng hỗn hợp 2 oxit Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra được đưa vào bình đựng dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa trắng. Khối lượng hỗn hợp 2 oxit kim loại ban đầu là:
-
A.
2,4 gam.
-
B.
1,12 gam
-
C.
3,12 gam.
-
D.
5,6 gam.
Thổi CO dư qua m gam hỗn hợp CuO, Fe2O3, ZnO, PbO nóng đỏ thu được 2,32 gam kim loại. Khí thoát ra cho vào bình nước vôi trong được 5 gam kết tủa, đun tiếp dung dịch lại thấy có thêm 10 gam kết tủa. Giá trị của m là:
-
A.
6,32
-
B.
3,12
-
C.
3,92
-
D.
4,72
Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là:
-
A.
FeO; 75%
-
B.
Fe3O4; 75%
-
C.
Fe2O3; 65%
-
D.
Fe2O3; 75%
Dẫn khí CO đi qua 12 gam CuO nung nóng thu được chất rắn X và khí CO2. Hấp thụ hoàn toàn khí CO2 sinh ra bằng 200 ml dung dịch Ba(OH)2 0,9M thì thu được 23,64 gam kết tủa. Cho chất rắn X vào dung dịch AgNO3 dư thu được m gam kết tủa. Tính m:
-
A.
25,92 gam
-
B.
28,32 gam
-
C.
86,4 gam
-
D.
24,4gam
Hỗn hợp A gồm 0,56 gam Fe và 16 gam Fe2O3 và x (mol) Al rồi nung ở nhiệt độ cao không có không khí (giả sử chỉ xảy ra sự khử Fe2O3 thành Fe), sau khi kết thúc phản ứng được hỗn hợp D. Nếu cho D tan trong H2SO4 loãng được V lít khí nhưng nếu cho D tác dụng với NaOH dư thì thu được 0,25V lít khí. Giá trị của x là
-
A.
0,233.
-
B.
0,247.
-
C.
0,333.
-
D.
0,125.
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO(nung nóng). Sau khi phản ứng xảy ra hoàn toàn chất rắn thu được gồm
-
A.
Cu, Al, MgO
-
B.
Cu, Al2O3, MgO
-
C.
Cu, Al, Mg
-
D.
Cu, Al2O3, Mg
Thổi từ từ V lít CO (đktc) đi qua ống sứ đựng 51,6 gam hỗn hợp X gồm CuO, Al2O3 và Fe3O4 (tỉ lệ mol lần lượt là 1:2:1). Các phản ứng xảy ra hoàn toàn, kết thúc phản ứng thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 19. Cho toàn bộ lượng khí Y hấp thụ vào dung dịch Ca(OH)2 thu được 30 gam kết tủa và dung dịch Z. Cho dung dịch Z phản ứng với lượng dư dung dịch Ba(OH)2 dư thấy tạo thành m gam kết tủa. Giá trị của V và m lần lượt là:
-
A.
17,92 lít và 29,7 gam.
-
B.
17,92 lít và 20 gam.
-
C.
11,20 lít và 20 gam.
-
D.
11,20 lít và 29,7 gam.
Khí CO không khử được chất nào sau đây ở nhiệt độ cao:
-
A.
CaO
-
B.
CuO
-
C.
PbO
-
D.
ZnO
Khử hoàn toàn 14g hỗn hợp X gồm CuO và một oxit sắt bằng CO thu được 10,32g hỗn hợp Y gồm 2 kim loại. Thể tích CO (đktc) đã dùng cho quá trình trên là:
-
A.
10,304 lít
-
B.
1,0304 lít
-
C.
5,152 lít
-
D.
51,52 lít
Cho từ từ khí CO đi qua ống đựng 3,2 gam CuO nung nóng. Khí thoát ra khỏi ống được hấp thụ hoàn toàn vào nước vôi trong dư tạo thành 1 gam kết tủa. Chất rắn còn lại trong ống sứ cho vào cốc đựng 500 ml dung dịch HNO3 0,16M thu được V1 lít khí NO và còn một phần kim loại chưa tan. Thêm tiếp vào cốc 760 ml dung dịch HCl 2/3 M, sau khi phản ứng xong thu thêm V2 lít khí NO. Biết NO là sản phẩm khử duy nhất của N+5, các phản ứng xảy ra hoàn toàn. V2 gần nhất với giá trị nào sau đây
-
A.
0,037.
-
B.
0,336.
-
C.
0,112.
-
D.
1,490.
Cho khí CO qua ống sứ chứa 10 gam hỗn hợp chất rắn X gồm CuO; Fe2O3; FeO; Fe3O4 và MgO nung nóng. Sau một thời gian thu được hỗn hợp khí Y và 8 gam rắn Z. Cho Y qua dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị m là
-
A.
50,0.
-
B.
12,5.
-
C.
25,0.
-
D.
20,0.
Cho hơi nước đi qua than nóng đỏ, thu được hỗn hợp khí X gồm CO, CO2 và H2. Cho toàn bộ X qua bình đựng dung dịch nước vôi dư thu được 10 gam kết tủa. Khí không bị hấp thụ thoát ra được dẫn qua ống đựng CuO (dư) nung nóng thu được hỗn hợp chất rắn Y. Hòa tan toàn bộ Y bằng dung dịch HNO3 (loãng, dư) thu được 8,96 lít khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO trong X là
-
A.
57,25%.
-
B.
28,57%.
-
C.
18,47%.
-
D.
14,29%.
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
-
A.
9,85.
-
B.
19,7.
-
C.
29,55.
-
D.
15,76.
Khử hoàn tàn 4,8 gam Fe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fe thu được sau phản ứng là
-
A.
3,36 gam
-
B.
1,68 gam
-
C.
2,52 gam
-
D.
1,44 gam
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4.Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến khi phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc nóng dư thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là:
-
A.
7,12
-
B.
13,52
-
C.
6,8
-
D.
5,68
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
-
A.
29,55.
-
B.
19,7.
-
C.
15,76.
-
D.
9,85.
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,8a mol hỗn hợp khí Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng hỗn hợp gồm CuO và Fe2O3 (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn giảm 1,28 gam. Giá trị của a là
-
A.
0,10.
-
B.
0,05.
-
C.
0,08.
-
D.
0,04.
Dẫn luồng khí CO dư qua hỗn hợp CuO, Al2O3, CaO, MgO có số mol bằng nhau (nung nóng ở nhiệt độ cao) thu được chất rắn A. Hòa tan A vào nước dư còn lại chất rắn X. X gồm:
-
A.
Cu, Mg.
-
B.
Cu, Mg, Al2O3.
-
C.
Cu, Al2O3, MgO.
-
D.
Cu, MgO.
Cho một luồng khí CO đi qua ống đựng 10g Fe2O3 nung nóng.Sau một thời gian thu được m gam hổn hợp X gồm 3 oxit sắt. Cho X tác dụng hết với dd HNO3 0,5M (vừa đủ) thu được dd Y và 1,12 lít NO (đktc) duy nhất. Thể tích CO đã dùng (đktc) và giá trị của m là
-
A.
1,68 lít, 8,8 gam
-
B.
2,24 lít , 8,8gam
-
C.
1,12 lít, 4,4 gam
-
D.
3,36 lít, 4,4 gam
Lời giải và đáp án
Trộn 20 gam bột CuO và một lượng C rồi đem nung nóng, sau một thời gian phản ứng thấy có 3,36 lít khí thoát ra khỏi bình. Khối lượng chất rắn thu được là
-
A.
17,6 gam.
-
B.
8 gam.
-
C.
9,6 gam.
-
D.
15,6 gam.
Đáp án : A
CuO + C $\xrightarrow{{{t}^{o}}}$ Cu + CO
+) nCO = nCuO phản ứng = nCu tạo thành
=> mchất rắn sau phản ứng = mCu + mCuO dư
CuO + C $\xrightarrow{{{t}^{o}}}$ Cu + CO
nCO = 3,36 / 22,4 = 0,15 mol => nCuO phản ứng = 0,15 mol
=> mCuO dư = 20 – 0,15.80 = 8 gam
nCu tạo thành = nCuO phản ứng = 0,15 mol => mCu = 0,15.64 = 9,6 gam
=> mchất rắn sau phản ứng = 8 + 9,6 = 17,6 gam
quên tính khối lượng CuO dư => chọn nhầm C
Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp CuO và Al2O3, nung nóng đến khi phản ứng hoàn toàn thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
-
A.
0,8 gam.
-
B.
4,0 gam.
-
C.
8 gam.
-
D.
6 gam.
Đáp án : B
CO + CuO $\xrightarrow{{{t}^{o}}}$ Cu + CO2
+) mCuO – mCu = mO phản ứng
Al2O3 không bị khử bởi CO
CO + CuO $\xrightarrow{{{t}^{o}}}$ Cu + CO2
x mol → x mol
=> mCuO – mCu = 9,1 – 8,3 = 0,8 => 80x – 64x = 0,8 => x = 0,05 mol
=> mCuO = 80.0,05 = 4 gam
Cho khí CO dư qua 18 gam oxit kim loại M thu được 14 gam kim loại. Công thức của oxit là
-
A.
PbO
-
B.
NiO
-
C.
FeO
-
D.
CuO
Đáp án : C
+) Bảo toàn khối lượng: moxit = mO + mkim loại
+) Tính Moxit => CTPT oxit
Bảo toàn khối lượng: moxit = mO + mkim loại => mO = 18 – 14 = 4 gam
=> nO trong oxit = 4 / 16 = 0,25 mol
Moxit = 18 : 0,25 = 72 g/mol (FeO)
Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 cần 4,48 lít H2 (đktc). khối lượng sắt thu được là
-
A.
12,0 gam
-
B.
14,4 gam.
-
C.
5,6 gam.
-
D.
11,2 gam
Đáp án : B
+) nO (trong oxit) = nH2
+) mFe = moxit - mO
nO (trong oxit) = nH2 = 0,2 mol => mO = 16.0,2 = 3,2 gam
mFe = 17,6 - 3,2 = 14,4 gam
Khử hoàn toàn 32 gam hỗn hợp CuO và Fe2O3 bằng khí H2, thấy tạo ra 9 gam nước. Tính khối lượng hỗn hợp kim loại thu được?
-
A.
24 gam
-
B.
16 gam
-
C.
32 gam
-
D.
48 gam
Đáp án : A
+) nO của oxit = nH2O
+) mkim loại = moxit – mO
nO của oxit = nH2O = 0,5 => mO = 16.0,5 = 8 gam
mkim loại = 32 - 8 = 24 gam
Cho V lít (đktc) khí H2 đi qua bột CuO đun nóng, thu được 32 gam Cu. Nếu cho V lít H2 đi qua bột Fe3O4 đun nóng thì lượng Fe thu được là:
-
A.
21 gam.
-
B.
7 gam.
-
C.
28 gam.
-
D.
14 gam.
Đáp án : A
H2 + CuO $\xrightarrow{{{t}^{o}}}$ Cu + H2O
+) nH2 = nO (trong oxit) = nCuO = nCu
+) nFe3O4 = ¼.nO (trong Fe3O4) ; nFe = 3.nFe3O4
H2 + CuO $\xrightarrow{{{t}^{o}}}$ Cu + H2O
nH2 = nO (trong oxit) = nCuO = nCu = 0,5 mol
Bảo toàn O: nFe3O4 = ¼.nO (trong Fe3O4) = ¼.nH2 phản ứng = 1/4 . 0,5 = 0,125 mol
Bảo toàn Fe: nFe = 3.nFe3O4 = 3.0,125 = 0,375 mol => mFe = 21 gam
+ quên nhân 3 ở biểu thức bảo toàn Fe => chọn nhầm B
+ lấy số mol Fe = số mol Cu => chọn nhầm C
Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 2,24 lít H2 ở đktc. Nếu đem hỗn hợp kim loại thu được hoà tan hoàn toàn vào axit HCl thì thể tích khí H2 (đktc) thu được là
-
A.
1,12 lít.
-
B.
2,24 lít.
-
C.
3,36 lít.
-
D.
4,48 lít.
Đáp án : B
+) nhh oxit = nH2 = nhh kim loại
+) Khi hoà tan hỗn hợp kim loại cùng hóa trị II vào axit thì : nH2 = nhh kim loại
nhh oxit = nH2 = nhh kim loại = 0,1 mol
Khi hoà tan hỗn hợp kim loại cùng hóa trị II vào axit thì : nH2 = nhh kim loại = 0,1
VH2 = 22,4.0,1 = 2,24 lít
Cho khí CO dư đi qua 15 gam hỗn hợp X gồm CuO, NiO, Fe2O3, ZnO thu được 11,8 gam chất rắn Y gồm các kim loại. Thể tích dung dịch Z gồm H2SO4 1,0M và HCl 0,5M cần dùng để hoà tan hết 15,0 gam hỗn hợp X là
-
A.
0,16 lít
-
B.
0,2 lít
-
C.
0,8 lít
-
D.
0,6 lít
Đáp án : A
Bảo toàn khối lượng: mO (trong X) = moxit – mkim loại
Bảo toàn nguyên tố H và O : ∑nH+ = 2.nH2O = 2.nO trong X
Bảo toàn khối lượng: mO (trong X) = moxit – mkim loại => nO trong X = (15 – 11,8) : 16 = 0,2 mol
Bảo toàn nguyên tố H và O : ∑nH+ = 2.nH2O = 2.nO trong X
=> 2V + 0,5V = 0,2.2
=> V = 0,16 lít
Đốt cháy không hoàn toàn một lượng sắt đã dùng hết 2,24 lít O2 ở đktc, thu được hỗn hợp A gồm các oxit sắt và sắt dư. Khử hoàn toàn A bằng khí CO dư, khí đi ra sau phản ứng được dẫn vào bình đựng nước vôi trong dư. Khối lượng kết tủa thu được là
-
A.
10 gam.
-
B.
20 gam.
-
C.
30 gam.
-
D.
40 gam.
Đáp án : B
nO đã dùng = nCO = nCO2 = nCaCO3
Bảo toàn nguyên tố O: nO đã phản ứng = nO trong oxit = nCO = nCO2 = 0,1.2 = 0,2 mol
=> nCaCO3 = nCO2 = 0,2 mol
=> mCaCO3 = 100.0,2 = 20 gam
Thổi một luồng khí CO dư đi qua ống đựng hỗn hợp 2 oxit Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra được đưa vào bình đựng dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa trắng. Khối lượng hỗn hợp 2 oxit kim loại ban đầu là:
-
A.
2,4 gam.
-
B.
1,12 gam
-
C.
3,12 gam.
-
D.
5,6 gam.
Đáp án : C
+) nO(trong oxit) = nCO = nCO2 = nCaCO3
+) moxit = mKL + moxi trong oxit
Ta có : nO(trong oxit) = nCO = nCO2 = nCaCO3 = 0,05 mol
moxit = mKL + moxi trong oxit = 2,32 + 0,05.16 = 3,12 gam
Thổi CO dư qua m gam hỗn hợp CuO, Fe2O3, ZnO, PbO nóng đỏ thu được 2,32 gam kim loại. Khí thoát ra cho vào bình nước vôi trong được 5 gam kết tủa, đun tiếp dung dịch lại thấy có thêm 10 gam kết tủa. Giá trị của m là:
-
A.
6,32
-
B.
3,12
-
C.
3,92
-
D.
4,72
Đáp án : A
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Ca(HCO3)2 $\xrightarrow{{{t}^{o}}}$ CaCO3 ↓ + CO2 + H2O (3)
+) nCaCO3 (3) = nCa(HCO3)2
+) nCO2 = nCaCO3 (1) + 2nCa(HCO3)2
+) m = mO trong oxit + mkim loại
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Ca(HCO3)2 $\xrightarrow{{{t}^{o}}}$ CaCO3 ↓ + CO2 + H2O (3)
nCaCO3 (1) = 0,05 mol
nCaCO3 (3) = 0,1 mol => nCa(HCO3)2 = 0,1 mol
nCO2 = nCaCO3 (1) + 2nCa(HCO3)2 = 0,05 + 0,1.2 = 0,25 mol
m = mO trong oxit + mkim loại = 0,25.16 + 2,32 = 6,32 gam
+ tính nhầm nCO2 = nCaCO3 (1) + nCaCO3 (3) => chọn nhầm D
Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là:
-
A.
FeO; 75%
-
B.
Fe3O4; 75%
-
C.
Fe2O3; 65%
-
D.
Fe2O3; 75%
Đáp án : D
+) Mkhí sau phản ứng = 40 => khí sau phản ứng gồm CO2 (x mol) và CO dư (y mol)
+) Bảo toàn C: nCO ban đầu = nCO2 + nCO dư => PT(1)
\(\bar M = \frac{{44x + 28y}}{{x + y}} = 40\) => PT(2)
+) nO trong oxit = nCO2
+) mFe = moxit – mO trong oxit
nCO ban đầu = 0,2 mol
Mkhí sau phản ứng = 40 => khí sau phản ứng gồm CO2 (x mol) và CO dư (y mol)
Bảo toàn C: nCO ban đầu = nCO2 + nCO dư => x + y = 0,2 (1)
\(\bar M = \frac{{44x + 28y}}{{x + y}} = 40\,\,\,(2)\)
Từ (1) và (2) => nCO2 = 0,15 mol và nCO dư = 0,05 mol
=> %CO2 = 75%
Ta có: nO trong oxit = nCO2 = 0,15 mol
mFe = moxit – mO trong oxit => nFe = (8 – 0,15.16) : 56 = 0,1 mol
Gọi công thức của oxit là FexOy
=> x : y = 0,1 : 0,15 = 2 : 3
Dẫn khí CO đi qua 12 gam CuO nung nóng thu được chất rắn X và khí CO2. Hấp thụ hoàn toàn khí CO2 sinh ra bằng 200 ml dung dịch Ba(OH)2 0,9M thì thu được 23,64 gam kết tủa. Cho chất rắn X vào dung dịch AgNO3 dư thu được m gam kết tủa. Tính m:
-
A.
25,92 gam
-
B.
28,32 gam
-
C.
86,4 gam
-
D.
24,4gam
Đáp án : B
nkết tủa < nBa(OH)2 => có 2 trường hợp
Trường hợp 1: CO2 hết, Ba(OH)2 dư
+) nCO2 = nkết tủa
+) nCu = nO tách ra = nCO2
+) mchất rắn = mAg + mCuO dư
Trường hợp 2: Kết tủa bị hòa tan 1 phần
So sánh nCO2 = 2nBa(OH)2 – n kết tủa với nO trong oxit
nCuO = 0,15mol; nBa(OH)2 = 0,18 mol
nkết tủa = 0,12 mol < nBa(OH)2 => có 2 trường hợp
Trường hợp 1: CO2 hết, Ba(OH)2 dư
nCO2 = nkết tủa = 0,12 mol
=> nCu = nO tách ra = nCO2 = 0,12 mol => mchất rắn = mAg + mCuO dư = 0,24.108 + 0,03.80 = 28,32 gam
Trường hợp 2: Kết tủa bị hòa tan 1 phần
nCO2 = 2nBa(OH)2 – n kết tủa = 2 . 0,18 – 0,15 = 0,21 > nO trong oxit (loại)
Hỗn hợp A gồm 0,56 gam Fe và 16 gam Fe2O3 và x (mol) Al rồi nung ở nhiệt độ cao không có không khí (giả sử chỉ xảy ra sự khử Fe2O3 thành Fe), sau khi kết thúc phản ứng được hỗn hợp D. Nếu cho D tan trong H2SO4 loãng được V lít khí nhưng nếu cho D tác dụng với NaOH dư thì thu được 0,25V lít khí. Giá trị của x là
-
A.
0,233.
-
B.
0,247.
-
C.
0,333.
-
D.
0,125.
Đáp án : B
+) D + NaOH tạo khí H2 => Al dư, Fe2O3 phản ứng hết
+) nAl pứ = 2.nFe2O3 => nAl dư
+) Bảo toàn Fe: nFe sau phản ứng = nFe ban đầu + 2.nFe2O3
+) nH2 = nFe
+) nH2 (3) = 1,5.nAl dư
=> ∑nH2 = PT(*)
2Al + 2NaOH + 6H2O → 2NaAl(OH)4 + 3H2
+) nH2 (0,25V) = PT(**)
nFe = 0,01 mol, nFe2O3 = 0,1 mol, nAl = x mol
2Al + Fe2O3 $\xrightarrow{{{t}^{o}}}$ Al2O3 + 2Fe
Vì D + NaOH tạo khí H2 => Al dư, Fe2O3 phản ứng hết
nAl pứ = 2.nFe2O3 = 0,2 mol => nAl dư = x – 0,2 mol
Bảo toàn Fe: nFe sau phản ứng = nFe ban đầu + 2.nFe2O3 = 0,01 + 0,2 = 0,21 mol
=> hỗn hợp D chứa Fe (0,21 mol) và Al dư (x – 0,2) mol
- D + H2SO4:
Fe + H2SO4 (l) → FeSO4 + H2
nH2 = nFe = 0,21 mol
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
nH2 (3) = 1,5.nAl dư = 1,5.(x – 0,2) mol
=> ∑nH2 (V) = 0,21 + 1,5.(x – 0,2) (*)
- D + NaOH:
2Al + 2NaOH + 6H2O → 2NaAl(OH)4 + 3H2
nH2 (0,25V) = 1,5.nAl dư = 1,5.(x – 0,2) (**)
Từ (*) và (**) => V – 0,25V = 0,21.22,4 => V = 6,272 lít
=> 0,21 + 1,5.(x – 0,2) = 0,28 => x = 0,247
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO(nung nóng). Sau khi phản ứng xảy ra hoàn toàn chất rắn thu được gồm
-
A.
Cu, Al, MgO
-
B.
Cu, Al2O3, MgO
-
C.
Cu, Al, Mg
-
D.
Cu, Al2O3, Mg
Đáp án : B
Viết PTHH biết CO chỉ khử được những oxit kim loại từ Zn trở đi
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO(nung nóng)→ chất rắn thu được gồm Cu, Al2O3, MgO
Vì CuO + CO \(\xrightarrow{{{t^o}}}\) Cu + CO2
Thổi từ từ V lít CO (đktc) đi qua ống sứ đựng 51,6 gam hỗn hợp X gồm CuO, Al2O3 và Fe3O4 (tỉ lệ mol lần lượt là 1:2:1). Các phản ứng xảy ra hoàn toàn, kết thúc phản ứng thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 19. Cho toàn bộ lượng khí Y hấp thụ vào dung dịch Ca(OH)2 thu được 30 gam kết tủa và dung dịch Z. Cho dung dịch Z phản ứng với lượng dư dung dịch Ba(OH)2 dư thấy tạo thành m gam kết tủa. Giá trị của V và m lần lượt là:
-
A.
17,92 lít và 29,7 gam.
-
B.
17,92 lít và 20 gam.
-
C.
11,20 lít và 20 gam.
-
D.
11,20 lít và 29,7 gam.
Đáp án : A
Đặt nCuO = nFe3O4 = x (mol) ; nAl2O3 = 2x (mol)
Từ khối lượng của hh X => x = ?
nCO2 = nO(oxit bị lấy đi) = nCuO + 4nFe3O4 = ?
Dùng quy tắc đường chéo tính được số mol của CO và CO2 trong hh khí Y
BTNT "C": nCO ban đầu = nCO2 + nCO dư = ? => VCO(đktc) = ?
Vì dd Z thu được sau phản ứng có phản ứng với Ba(OH)2 tạo kết tủa nên CO2 phản ứng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2
BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => nCa(HCO3)2 = ? (mol)
Ca(HCO3)2 + Ba(OH)2 dư → CaCO3↓ + BaCO3↓ + 2H2O
=> m↓ = mCaCO3 + mBaCO3 = ?
Đặt nCuO = nFe3O4 = x (mol) ; nAl2O3 = 2x (mol)
=> 80x + 102.2x + 232.x = 51,6
=> x = 0,1 (mol)
=> nCuO = nFe3O4 = 0,1 (mol) ; nAl2O3 = 0,2 (mol)
\(V(l)CO + \left\{ \matrix{
CuO:0,1 \hfill \cr
A{l_2}{O_3}:0,2 \hfill \cr
F{e_3}{O_4}:0,1 \hfill \cr} \right.\buildrel {} \over
\longrightarrow \underbrace {Y\left\{ \matrix{
C{O_2}:0,5 \hfill \cr
COdu: \hfill \cr} \right.}_{\overline M = 38}\buildrel { + Ca{{(OH)}_2}} \over
\longrightarrow \left\langle \matrix{
CaC{O_3}:0,3\,mol \hfill \cr
\underbrace {Ca{{(HC{O_3})}_2}}_{dd\,Z}\buildrel { + Ba{{(OH)}_2}} \over
\longrightarrow \underbrace {BaC{O_3},CaC{O_3} \downarrow }_{m = ?} \hfill \cr} \right.\)
nCO2 = nO(oxit bị lấy đi) = nCuO + 4nFe3O4 = 0,1 + 4.0,1 = 0,5 (mol)
Hỗn hợp Y là 2 khí CO2 và CO dư có M= 19.2 = 38
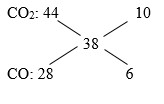
Ta có: \({{{n_{C{O_2}}}} \over {{n_{CO}}}} = {{10} \over 6} = {5 \over 3} \Rightarrow {{0,5} \over {{n_{CO}}}} = {5 \over 3} \Rightarrow {n_{CO}} = 0,3\,(mol)\)
BTNT "C": nCO ban đầu = nCO2 + nCO dư = 0,5 + 0,3 = 0,8 (mol)
=> VCO(đktc) = 0,8.22,4= 17,92 (l)
Hấp thụ hỗn hợp CO2 và CO vào dd Ca(OH)2 chỉ có CO2 tham gia phản ứng
Vì dd Z thu được sau phản ứng có phản ứng với Ba(OH)2 tạo kết tủa nên CO2 phản ứng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2
BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2
=> 0,5 = 0,3 + 2nCa(HCO3)2
=> nCa(HCO3)2 = 0,1 (mol)
Ca(HCO3)2 + Ba(OH)2 dư → CaCO3↓ + BaCO3↓ + 2H2O
0,1 → 0,1 0,1 (mol)
=> m↓ = mCaCO3 + mBaCO3 = 0,1.100 + 0,1.197 = 29,7 (g)
Khí CO không khử được chất nào sau đây ở nhiệt độ cao:
-
A.
CaO
-
B.
CuO
-
C.
PbO
-
D.
ZnO
Đáp án : A
CO chỉ khử được những oxit của KL đứng sau Al trong dãy hoạt động hóa học:
K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
- CO chỉ khử được những oxit của KL đứng sau Al trong dãy hoạt động hóa học.
- CaO là oxit của kim loại đứng trước Al.
=> CO không khử được CaO.
Khử hoàn toàn 14g hỗn hợp X gồm CuO và một oxit sắt bằng CO thu được 10,32g hỗn hợp Y gồm 2 kim loại. Thể tích CO (đktc) đã dùng cho quá trình trên là:
-
A.
10,304 lít
-
B.
1,0304 lít
-
C.
5,152 lít
-
D.
51,52 lít
Đáp án : C
Oxit + CO → KL + CO2
Đặt nCO = nCO2 = x mol
BTKL: m oxit + mCO = mKL + mCO2 => x = ? => VCO
Oxit + CO → KL + CO2
Đặt nCO = nCO2 = x mol
BTKL: m oxit + mCO = mKL + mCO2
=> 14 + 28x = 10,32 + 44x => x = 0,23 mol
=> VCO = 0,23.22,4 = 5,152 lít
Cho từ từ khí CO đi qua ống đựng 3,2 gam CuO nung nóng. Khí thoát ra khỏi ống được hấp thụ hoàn toàn vào nước vôi trong dư tạo thành 1 gam kết tủa. Chất rắn còn lại trong ống sứ cho vào cốc đựng 500 ml dung dịch HNO3 0,16M thu được V1 lít khí NO và còn một phần kim loại chưa tan. Thêm tiếp vào cốc 760 ml dung dịch HCl 2/3 M, sau khi phản ứng xong thu thêm V2 lít khí NO. Biết NO là sản phẩm khử duy nhất của N+5, các phản ứng xảy ra hoàn toàn. V2 gần nhất với giá trị nào sau đây
-
A.
0,037.
-
B.
0,336.
-
C.
0,112.
-
D.
1,490.
Đáp án : A
nCuO bđ = 3,2:80 = 0,04 mol
- Pư 1: Tính số mol CuO dư 0,03 mol và Cu sinh ra 0,01 mol
- Pư 2: Từ số mol HNO3 => số mol Cu dư
- Pư 3: Tính V của NO khi thêm HCl
*Phản ứng CuO +CO:
nCuO bđ = 3,2:80 = 0,04 mol
nCO2 = nCaCO3 = 1:100 = 0,01 mol
CuO + CO \(\xrightarrow{{{t}^{o}}}\) Cu + CO2
0,01 ← 0,01 ← 0,01 mol
=> CuO dư 0,03 mol
Chất rắn sau phản ứng gồm: Cu (0,01 mol) và CuO dư (0,03 mol)
*Phản ứng chất rắn + HNO3:
CuO + 2HNO3 → Cu(NO3)2 + H2O
0,03→ 0,06
=> Số mol HNO3 dư 0,02 mol
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
0,0075 ←0,02
Phần kim loại chưa tan là Cu (0,0025 mol)
*Phản ứng hòa tan kim loại chưa tan:
3Cu + 8H+ + NO3- → 3Cu2+ + 2NO + 4H2O
0,0025 → 1/600 mol
=> V2 = 1/600.22,4 = 0,037 lít
Cho khí CO qua ống sứ chứa 10 gam hỗn hợp chất rắn X gồm CuO; Fe2O3; FeO; Fe3O4 và MgO nung nóng. Sau một thời gian thu được hỗn hợp khí Y và 8 gam rắn Z. Cho Y qua dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị m là
-
A.
50,0.
-
B.
12,5.
-
C.
25,0.
-
D.
20,0.
Đáp án : B
m rắn giảm = mO pư => nO
CO + [O] → CO2
=> nCaCO3 = nCO2 = nO pư => mCaCO3
m rắn giảm = mO pư = 2 gam => nO = 0,125 mol
CO + [O] → CO2
0,125 → 0,125 (mol)
=> nCaCO3 = nCO2 = 0,125 mol => mCaCO3 = 12,5 gam
Cho hơi nước đi qua than nóng đỏ, thu được hỗn hợp khí X gồm CO, CO2 và H2. Cho toàn bộ X qua bình đựng dung dịch nước vôi dư thu được 10 gam kết tủa. Khí không bị hấp thụ thoát ra được dẫn qua ống đựng CuO (dư) nung nóng thu được hỗn hợp chất rắn Y. Hòa tan toàn bộ Y bằng dung dịch HNO3 (loãng, dư) thu được 8,96 lít khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO trong X là
-
A.
57,25%.
-
B.
28,57%.
-
C.
18,47%.
-
D.
14,29%.
Đáp án : B
Cách 1: Tính theo PTHH
Cho hơi nước đi qua than nóng đỏ:
C + H2O → CO + H2
C + 2H2O → CO2 + 2H2
Hỗn hợp X chứa: CO; CO2 và H2
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
CO + CuO dư → Cu + CO2 (đun nóng)
H2 + CuO dư → Cu + H2O (đun nóng)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cách 2: Sử dụng bảo toàn electron
nCO2 = nCaCO3
Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol)
- Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → (1)
- Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol)
- Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → (2)
Cách 1: Tính theo PTHH
Cho hơi nước đi qua than nóng đỏ:
C + H2O → CO + H2
a → a
C + 2H2O → CO2 + 2H2
b → 2b
Hỗn hợp X chứa: CO (a mol); CO2 (b mol) và H2 (a + 2b mol)
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
b → b = 0,1 mol
CO + CuO dư → Cu + CO2 (đun nóng)
a → a
H2 + CuO dư → Cu + H2O (đun nóng)
(a+2b) → (a+2b)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
(2a+2b) → 2/3.(2a+2b)
Vậy ta có: \(\left\{ \begin{array}{l}b = 0,1\\{n_{NO}} = \frac{2}{3}\left( {2{\rm{a}} + 2b} \right) = 0,4\end{array} \right. \to \left\{ \begin{array}{l}a = 0,2\\b = 0,1\end{array} \right.\)
Hỗn hợp X chứa: CO (0,2 mol); CO2 (0,1 mol) và H2 (0,4 mol)
⟹ %VCO = 28,57%
Cách 2: Sử dụng bảo toàn electron
nCO2 = nCaCO3 = 0,1 mol
Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol)
- Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → 2y = 2x + 0,4 (1)
- Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol)
- Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → 2(x + y) = 3.0,4 (2)
Giải hệ trên được x = 0,2 và y = 0,4
Hỗn hợp X chứa: CO (0,2 mol); H2 (0,4 mol); CO2 (0,1 mol)
⟹ %VCO = 28,57%
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
-
A.
9,85.
-
B.
19,7.
-
C.
29,55.
-
D.
15,76.
Đáp án : A
Tính được nC = nY - nX
Oxi hóa hoàn toàn hỗn hợp Y thì:
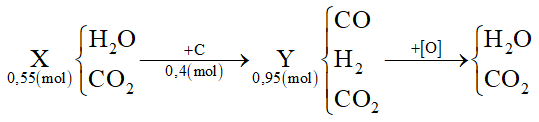
Áp dụng bảo toàn e cho toàn bộ quá trình sẽ tính được số mol O (cần dùng để oxi hóa hết Y)
Mà nO = ∑nCO(Y), H2(Y) ⟹ số mol CO2 trong Y
Sau đó giải tương tự như bài toán hấp thụ CO2 vào dung dịch kiềm
Ta thấy nC = nY - nX = 0,95 - 0,55 = 0,4 mol
Oxi hóa hoàn toàn hỗn hợp Y thì:

Áp dụng bảo toàn e cho toàn bộ quá trình thì: 4nC = 2nO → nO = 0,8 mol
Mà nO = ∑nCO(Y), H2(Y) = 0,8 mol ⟹ nCO2(Y) = 0,95 - 0,8 = 0,15 mol
Khi cho Y phản ứng với Ba(OH)2 tức là 0,15 mol CO2 phản ứng với 0,1 mol Ba(OH)2:
Tỉ lệ: 1 < nOH-/nCO2 = 0,2/0,15 = 1,33 < 2 → tạo CO32- (a) và HCO3- (b)
Giải hệ: \(\left\{ \begin{array}{l}{n_{C{O_2}}} = a + b = 0,15\\{n_{O{H^ - }}} = 2{\rm{a}} + b = 0,2\end{array} \right. \to \left\{ \begin{array}{l}a = 0,05\\b = 0,1\end{array} \right.\)
Ba2+ + CO32- → BaCO3
0,05 ← 0,05 → 0,05
→ m ↓ = 0,05.197 = 9,85 gam
Khử hoàn tàn 4,8 gam Fe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fe thu được sau phản ứng là
-
A.
3,36 gam
-
B.
1,68 gam
-
C.
2,52 gam
-
D.
1,44 gam
Đáp án : A
Bảo toàn nguyên tố Fe
nFe2O3 = 0,03 mol
Bảo toàn Fe ta có: nFe = 2nFe2O3 = 0,06 mol → m = 0,06.56 = 3,36 gam
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4.Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến khi phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc nóng dư thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là:
-
A.
7,12
-
B.
13,52
-
C.
6,8
-
D.
5,68
Đáp án : A
Quy hỗn hợp X chứa hai chất: FeO và Fe2O3
Cho X + khí CO → Chất rắn Y + khí Z chứa CO, CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Áp dụng định luật bảo toàn electron cho phản ứng với CO và phản ứng với H2SO4 đặc để tìm số mol FeO.
Dùng bảo toàn nguyên tố Fe để tìm số mol Fe2O3.
Từ đó xác định được giá trị của m.
Quy hỗn hợp X chứa hai chất: FeO x mol và Fe2O3 y mol
Cho X + khí CO → Chất rắn Y + khí Z chứa CO, CO2
CO2 + Ca(OH)2 dư → CaCO3 + H2O
Ta có: nCO2 = nCaCO3 = 0,04 mol
Cho Y + H2SO4 đặc nóng dư thu được nSO2 = 0,045 mol
- QT cho e:
FeO → Fe+3 + 1e
x → x mol
C +2 → C+4 + 2e
0,04 0,08 mol
- QT nhận e:
S +6 + 2e → SO2
0,09 ← 0,045 mol
Theo định luật bảo toàn electron: ne cho = ne nhận → x + 0,08 = 0,09 → x = 0,01 mol
Muối thu được sau phản ứng là Fe2(SO4)3 → nFe2(SO4)3 = 18/400 = 0,045 mol
Bảo toàn nguyên tố Fe ta có: nFeO + 2nFe2O3 = 2nFe2(SO4)3 => x + 2y = 0,045.2 → y = 0,04 mol
→ m = mFeO + mFe2O3 = 72x + 160y = 72.0,01 + 160.0,04 = 7,12 gam
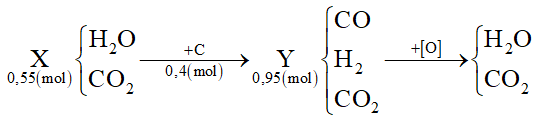
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
-
A.
29,55.
-
B.
19,7.
-
C.
15,76.
-
D.
9,85.
Đáp án : D
Từ PTHH => n C phản ứng = nY -nX
Áp dụng định luật bảo toàn e => n CO2
Từ n CO2,n Ba(OH)2 => Thành phần muối thu được sau phản ứng
=> Tính được thành phần muối BaCO3 => m
Ta có PTHH:
C + H2O → CO + H2 (1)
C + 2H2O → CO2 + 2H2(2)
Từ (1) và (2) => n C phản ứng = nY - nX = 0,4 (mol)
Áp dụng định luật bảo toàn electron
=> 4 * nC = 2* nH2 + 2 * nCO
=> nH2 + nCO = 0,8 (mol)
Mà nY = 0,95 mol => nCO2 (trong Y) = 0,95 - 0,8 = 0,15 (mol)
Ta có n Ba(OH)2 = 0,1
=> T = nOH/nCO2 = 0,2 : 0,15 = 1,3333
=> Sau phản ứng sinh ra 2 muối là Ba(HCO3)2 và BaCO3
Gọi số mol Ba(HCO3)2 và BaCO3 là x, y (mol)
Áp dụng định luật bảo toàn Ba => x + y = 0,1 (I)
Áp dụng định luật bảo toàn C => 2x + y = 0,15 (II)
=> x = 0,05; y = 0,05
=> n BaCO3 = 0,05 (mol)
=> m BaCO3 = 9,85 gam
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,8a mol hỗn hợp khí Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng hỗn hợp gồm CuO và Fe2O3 (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn giảm 1,28 gam. Giá trị của a là
-
A.
0,10.
-
B.
0,05.
-
C.
0,08.
-
D.
0,04.
Đáp án : B
\(a(mol)X\left\{ \begin{array}{l}{H_2}O\\C{O_2}\end{array} \right. + C \to 1,8a(mol)Y\left\{ \begin{array}{l}CO\\{H_2}\\C{O_2}\end{array} \right. + {\rm{\{ }}CuO,F{e_2}{O_3}{\rm{\} du}} \to {{\rm{m}}_{{\rm{ran}}\,giam}} = 1,28(g)\)
Nhận thấy, C là nguyên nhân làm cho số mol hỗn hợp khí tăng lên => nC = 1,8a - a = 0,8a mol
Sau khi cho Y tác dụng với Fe2O3, CuO dư tạo thành H2O, CO2 nên ta có thể coi hỗn hợp Y gồm {H2O, CO2, C} như vậy ta thấy chỉ có C có phản ứng: C + 2O → CO2
=> nO(pư) = 2nC = 2.0,8a = 1,6a mol
m chất rắn giảm = mO pư => nO pư = 1,6a = 1,28/16 => a = 0,05
Dẫn luồng khí CO dư qua hỗn hợp CuO, Al2O3, CaO, MgO có số mol bằng nhau (nung nóng ở nhiệt độ cao) thu được chất rắn A. Hòa tan A vào nước dư còn lại chất rắn X. X gồm:
-
A.
Cu, Mg.
-
B.
Cu, Mg, Al2O3.
-
C.
Cu, Al2O3, MgO.
-
D.
Cu, MgO.
Đáp án : D
CO chỉ khử được các oxi kim loại từ Al trở về sau trong dãy điện hóa
Các oxit bazo của kim loại kiềm, kiềm thổ (trừ Be, Mg) tan được trong nước
\(CO\,du + \left\{ \matrix{
CuO \hfill \cr
A{l_2}{O_3} \hfill \cr
CaO \hfill \cr
MgO \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow A\left\{ \matrix{
Cu \hfill \cr
A{l_2}{O_3} \hfill \cr
CaO \hfill \cr
MgO \hfill \cr} \right.\buildrel { + {H_2}O\,du} \over
\longrightarrow \left\langle \matrix{
dd:Ca{(Al{O_2})_2} \hfill \cr
X\left\{ \matrix{
Cu \hfill \cr
MgO \hfill \cr} \right. \hfill \cr} \right.\)
CO + Cu \(\buildrel {{t^0}} \over\longrightarrow \)Cu + H2O
CaO + H2O → Ca(OH)2
Ca(OH)2 + Al2O3 → Ca(AlO2)2 + H2O
Vì các chất ban đầu có cùng số mol nên Al2O3 phản ứng hết với dd Ca(OH)2.
Do vậy chất rắn sau phản ứng chỉ có Cu và MgO
Al2O3 không tan được trong nước nhưng tan được trong dd bazo
Cho một luồng khí CO đi qua ống đựng 10g Fe2O3 nung nóng.Sau một thời gian thu được m gam hổn hợp X gồm 3 oxit sắt. Cho X tác dụng hết với dd HNO3 0,5M (vừa đủ) thu được dd Y và 1,12 lít NO (đktc) duy nhất. Thể tích CO đã dùng (đktc) và giá trị của m là
-
A.
1,68 lít, 8,8 gam
-
B.
2,24 lít , 8,8gam
-
C.
1,12 lít, 4,4 gam
-
D.
3,36 lít, 4,4 gam
Đáp án : A
Phương pháp:
Trong cả quá trình chỉ có C và N thay đổi số oxi hóa
ĐL bảo toàn e: ne cho = ne nhận => VCO
mchất rắn = m = moxit - mO
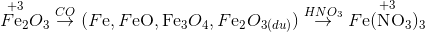
Trong cả quá trình chỉ có C và N thay đổi số oxi hóa
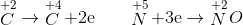
x 2x 0,15 0,05
ĐL bảo toàn e: ne cho = ne nhận => 2x=0,15 => x=0,075
=> VCO = 0,075.22,4=1,68 lít
mchất rắn = m = moxit - mO = 10- 0,075.16 = 8,8 gam
Luyện tập và củng cố kiến thức Tổng hợp bài tập CO2 tác dụng với dung dịch kiềm Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập muối cacbonat tác dụng với H+ Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Silic và hợp chất của silicghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập cacbon - silic hay và khó (phần 1) Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập cacbon - silic hay và khó (phần 2) Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Ôn tập chương 3 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 16. Hợp chất của cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 15. Cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận