Trắc nghiệm Tổng hợp bài tập cacbon - silic hay và khó (phần 2) - Hóa 11
Đề bài
Cho từ từ dung dịch X chứa 31,3 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được 9,85 gam kết tủa. Hai kim loại kiềm là:
-
A.
Li, Na
-
B.
Na, K
-
C.
K, Rb
-
D.
Li, K
Cho 4,2 gam muối cacbonat của kim loại hoá trị II. Hoà tan vào dung dịch HCl dư, thì có khí thoát ra. Toàn bộ lượng khí được hấp thụ vào 100ml dung dịch Ba(OH)2 0,46M thu được 8,274 gam kết tủa. Kim loại là
-
A.
Ca hoặc Mg
-
B.
Ca
-
C.
Mg
-
D.
Ba hoặc Ca
Hỗn hợp X gồm M2CO3, MHCO3 và MCl (M là kim loại kiềm). Cho 32,65 gam X tác dụng vừa đủ với dung dịch HCl thu được dung dịch Y và có 17,6 gam CO2 thoát ra. Dung dịch Y tác dụng với dung dịch AgNO3 dư được 100,45 gam kết tủa. Kim loại M là:
-
A.
Li.
-
B.
Na.
-
C.
K.
-
D.
Rb.
Hỗn hợp X gồm hai muối MgCO3 và RCO3. Cho 15,18 gam X vào dung dịch H2SO4 loãng, thu được 0,448 lít khí CO2 (đktc), dung dịch Y và chất rắn Z. Cô cạn Y thu được 1,6 gam muối khan. Nung Z đến khối lượng không đổi, thu được m gam chất rắn và 1,792 lít (đktc) khí CO2 duy nhất. Giá trị m và nguyên tố R là?
-
A.
11,14 và Ba
-
B.
11,14 và Ca.
-
C.
10,78 và Ca.
-
D.
10,78 và Ba.
Dung dịch A chứa a mol Ba(OH)2. Cho m gam NaOH vào A sau đó sục CO2 dư vào ta thấy lượng kết tủa biến đổi theo đồ thị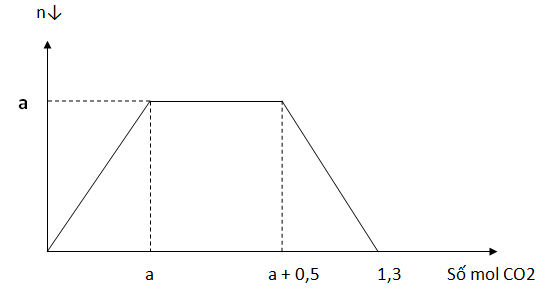
Giá trị của a và m là
-
A.
0,8 và 10
-
B.
0,5 và 20
-
C.
0,4 và 20
-
D.
0,4 và 30
Sục từ từ khí CO2 đến dư vào dung dịch X chứa m gam NaOH và a mol Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau: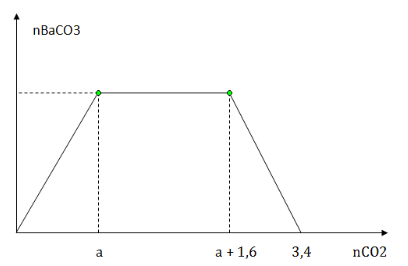
Giá trị của m và a lần lượt là
-
A.
64 và 0,9.
-
B.
32 và 0,9
-
C.
64 và 0,8.
-
D.
64 và 1,2
Hấp thụ 1,5x mol CO2 vào dung dịch hỗn hợp chứa 1,25x mol NaOH và 0,5x mol Na2CO3 thu được dung dịch X chứa 31,23 gam chất rắn tan. Cho dung dịch hỗn hợp chứa 1,15x mol NaOH và 1,2x mol CaCl2 vào dung dịch X thu được m gam kết tủa. Giá trị của m là
-
A.
25,2.
-
B.
23,6.
-
C.
21,6.
-
D.
20,2.
Hòa tan hết 26,98 gam hỗn hợp X gồm Na, K, KHCO3 và Na2CO3 vào nước thu được dung dịch muối Y và 1,12 lít H2 (đktc). Chia dung dịch Y thành 2 phần bằng nhau. Nhỏ rất từ từ 110 ml dung dịch HCl 1M vào phần một, khuấy đều thu được 0,672 lít CO2 (đktc). Nhỏ rất từ từ phần hai vào 50 ml dung dịch HCl 1M khuấy đều thu được 0,672 lít CO2 (đktc). Mặt khác, cho 40,47 gam hỗn hợp X tác dụng với một lượng dư dung dịch HCl rồi cô cạn thu được hỗn hợp muối A. Khối lượng muối NaCl có trong hỗn hợp A là
-
A.
11,7 gam.
-
B.
17,55 gam.
-
C.
14,04 gam.
-
D.
15,21 gam.
Cho 100 ml dung dịch Ba(OH)2 0,3M vào 300 ml dung dịch NaHCO3 aM và Na2CO3 (0,5aM) thu được kết tủa X và 400 ml dung dịch Y chứa các muối. Cho từ từ dung dịch HCl 0,45M vào 200 ml dung dịch Y đến khi bắt đầu thấy khí thoát ra thì đã dùng 200 ml. Nếu cho từ từ 200 ml dung dịch Y vào 200 ml dung dịch HCl 0,45M, thu được x mol khí CO2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của x là
-
A.
0,045.
-
B.
0,093.
-
C.
0,083.
-
D.
0,063
Hòa tan hết 25,88 gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước dư thu được 0,15 mol H2 và dung dịch X. Sục từ từ đến hết 0,32 mol CO2 vào X thu được dung dịch Y và kết tủa Z. Chia Y thành 2 phần bằng nhau. Cho từ từ phần một vào 200 ml dung dịch HCl 0,6M thu được 5x mol CO2. Mặt khác, cho từ từ 400 ml HCl 0,3M vào phần hai thu được 4x mol CO2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của x là
-
A.
0,03
-
B.
0,015
-
C.
0,02
-
D.
0,012
Lời giải và đáp án
Cho từ từ dung dịch X chứa 31,3 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được 9,85 gam kết tủa. Hai kim loại kiềm là:
-
A.
Li, Na
-
B.
Na, K
-
C.
K, Rb
-
D.
Li, K
Đáp án : B
Gọi công thức trung bình của hai muối là: M2CO3.
Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa là H+ hết và dư CO32-
Các phản ứng xảy ra:
CO32- + 2H+ → CO2 + H2O
CO32-dư + Ba2+ → BaCO3
Gọi công thức trung bình của hai muối là: M2CO3.
Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa à H+ hết và dư CO32-
Các phản ứng xảy ra:
CO32- + 2H+ → CO2 + H2O
0,2 0,4
CO32-dư + Ba2+ → BaCO3
0,05 0,05 0,05
→ $\sum {{n_{CO_3^{2 - }}} = 0,25} $ mol nên ${M_{_{{M_2}C{O_3}}}} = {\textstyle{{31,3} \over {0,25}}} = 125,2(g) \Rightarrow {M_M} = 32,6$
→ 2 kim loại kiềm là Na và K
Cho 4,2 gam muối cacbonat của kim loại hoá trị II. Hoà tan vào dung dịch HCl dư, thì có khí thoát ra. Toàn bộ lượng khí được hấp thụ vào 100ml dung dịch Ba(OH)2 0,46M thu được 8,274 gam kết tủa. Kim loại là
-
A.
Ca hoặc Mg
-
B.
Ca
-
C.
Mg
-
D.
Ba hoặc Ca
Đáp án : A
Vì chưa biết lương Ba(OH)2 dư hay thiếu => có 2 trường hợp
* TH1: Khi Ba(OH)2 dư, tính theo lượng kết tủa
Gọi công thức muối là MCO3
CO2 + Ba(OH)2 →BaCO3 + H2O
nCO2 = nkết tủa
MCO3 +2 HCl → MCl2 + CO2 + H2O
Mmuối = M+ 60 => M
* TH2: Khi Ba(OH)2 thiếu , Ba(OH)2 hết, 1 phẩn kết tủa bị hòa tan
CO2 + Ba(OH)2 → BaCO3 + H2O
BaCO3 + CO2 + H2O → Ba(HCO3)2
=> nCO2
MCO3 + 2HCl → MCl2 + CO2 + H2O
Mmuối = M + 60 => M
Vì chưa biết lương Ba(OH)2 dư hay thiếu => có 2 trường hợp
* TH1: khi Ba(OH)2 dư, tính theo lượng kết tủa
Gọi công thức muối là MCO3
CO2 + Ba(OH)2 → BaCO3 + H2O
0,042 0,042
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,042 0,042
Mmuối = M+ 60 = 4,2/0,042=100 => M = 40 (Ca)
* TH2: khi Ba(OH)2 thiếu , Ba(OH)2 hết, 1 phẩn kết tủa bị hòa tan
CO2 + Ba(OH)2 → BaCO3 + H2O
0,046 0,046
nkết tủa bị hòa tan = 0,046- 0,042=0,004
BaCO3 + CO2 + H2O → Ba(HCO3)2
0,004 0,004
=> nCO2 = 0,004+ 0,0046=0,05
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,05 0,05
Mmuối = M+ 60 = 4,2/0,05 = 84 => M = 24 (Mg)
Hỗn hợp X gồm M2CO3, MHCO3 và MCl (M là kim loại kiềm). Cho 32,65 gam X tác dụng vừa đủ với dung dịch HCl thu được dung dịch Y và có 17,6 gam CO2 thoát ra. Dung dịch Y tác dụng với dung dịch AgNO3 dư được 100,45 gam kết tủa. Kim loại M là:
-
A.
Li.
-
B.
Na.
-
C.
K.
-
D.
Rb.
Đáp án : A
+) nAgCl = nCl (Y)
Đặt số mol các chất trong X lần lượt là: a, b, c mol.
⇒ nCl(Y) = nMCl = nM => PT (1)
+) Từ nCO2 => PT (2)
Ta có:
${{m}_{X}}={{m}_{{{M}_{2}}C{{O}_{3}}}}+{{m}_{MHC{{O}_{3}}}}+{{m}_{MCl}}=a(2M+60)+b(M+61)+c(M+35,5)$
Kết hợp (1) và (2), biện luận tìm m
Sơ đồ:
X → MCl → AgCl
=> nAgCl = nCl (Y) = 0,7 mol
Đặt số mol các chất trong X lần lượt là: a, b, c mol.
⇒ nCl(Y) = nMCl = nM = 2a + b + c = 0,7 mol
Và nCO2 = a + b = 0,4 mol
Ta có:
${{m}_{X}}={{m}_{{{M}_{2}}C{{O}_{3}}}}+{{m}_{MHC{{O}_{3}}}}+{{m}_{MCl}}=a(2M+60)+b(M+61)+c(M+35,5)$
=> (2a + b + c)M + 60(a + b) + b + 35,5c = 32,65 g
=> 0,7M = 8,65 - b - 35,5c < 8,65
=> M < 12,36
=> M là Li (M = 7)
Hỗn hợp X gồm hai muối MgCO3 và RCO3. Cho 15,18 gam X vào dung dịch H2SO4 loãng, thu được 0,448 lít khí CO2 (đktc), dung dịch Y và chất rắn Z. Cô cạn Y thu được 1,6 gam muối khan. Nung Z đến khối lượng không đổi, thu được m gam chất rắn và 1,792 lít (đktc) khí CO2 duy nhất. Giá trị m và nguyên tố R là?
-
A.
11,14 và Ba
-
B.
11,14 và Ca.
-
C.
10,78 và Ca.
-
D.
10,78 và Ba.
Đáp án : D
+) Bảo toàn khối lượng => mX (đã phản ứng)
⇒ mZ
MCO3 (Z) → MO + CO2
+) Bảo toàn khối lượng: $m={{m}_{Z}}-{{m}_{C{{O}_{2}}}}$
Đặt ${{n}_{MgC{{O}_{3}}~}}=a\,mol;\text{ }{{n}_{RC{{O}_{3}}}}~=b~\,mol$ (trong X)
+) Bảo toàn CO2 => PT ẩn a, b
+) Từ khối lượng hh X => PT ẩn a, R
+) thử lần lượt R = 40 hoặc R = 137
MCO3(X) + H2SO4 → MSO4 + CO2 + H2O
${{n}_{C{{O}_{2}}}}=\frac{0,448}{22,4}=0,02\text{ }mol$
Bảo toàn khối lượng: mX (đã phản ứng) = 1,6 + 0,02.44 + 0,02.18 - 0,02.98 = 0,88 gam
⇒ mZ = mX - 0,88 = 14,3 gam
MCO3 (Z) → MO + CO2
${{n}_{C{{O}_{2}}}}~=\frac{1,792}{22,4}=0,08\text{ }mol$
Bảo toàn khối lượng: $m={{m}_{Z}}-{{m}_{C{{O}_{2}}}}~=14,3-0,08.44=10,78\text{ }g$
Đặt ${{n}_{MgC{{O}_{3}}~}}=a\,mol;\text{ }{{n}_{RC{{O}_{3}}}}~=b~\,mol$ (trong X)
Ta có:
$\left\{ {\begin{array}{*{20}{l}}{a + b = \sum {{n_{C{O_2}}} = 0,02 + 0,08} }\\{84a + (R + 60) = 15,18}\end{array}} \right.$
(thử lần lượt R = 40 hoặc R = 137) ⇒ R là Ba
Dung dịch A chứa a mol Ba(OH)2. Cho m gam NaOH vào A sau đó sục CO2 dư vào ta thấy lượng kết tủa biến đổi theo đồ thị
Giá trị của a và m là
-
A.
0,8 và 10
-
B.
0,5 và 20
-
C.
0,4 và 20
-
D.
0,4 và 30
Đáp án : C
Đoạn đồ thị nằm ngang ứng với sự tạo thành NaHCO3
=> ${{n}_{NaHC{{O}_{3}}}}={{n}_{C{{O}_{2}}}}$ => nNaOH => m
Khi nCO2 = 1,3 mol thì tạo 2 muối axit NaHCO3 và Ba(HCO3)2
Bảo toàn C => ${{n}_{C{{O}_{2}}}}={{n}_{NaHC{{O}_{3}}}}+{{n}_{Ba{{\left( HC{{O}_{3}} \right)}_{2}}}}\Rightarrow {{n}_{Ba{{\left( HC{{O}_{3}} \right)}_{2}}}}=?$
=> ${{n}_{Ba{{\left( OH \right)}_{2}}}}=?$
Đoạn đồ thị nằm ngang ứng với sự tạo thành NaHCO3
=> ${{n}_{NaHC{{O}_{3}}}}={{n}_{C{{O}_{2}}}}=a+0,5a=0,5$
=> nNaOH = 0,5
=> m = 20 gam
Khi nCO2 = 1,3 mol thì tạo 2 muối axit NaHCO3 và Ba(HCO3)2
Bảo toàn C => ${{n}_{Ba{{\left( HC{{O}_{3}} \right)}_{2}}}}=0,4\,mol$
=> ${{n}_{Ba{{\left( OH \right)}_{2}}}}=0,4\,mol$
Sục từ từ khí CO2 đến dư vào dung dịch X chứa m gam NaOH và a mol Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Giá trị của m và a lần lượt là
-
A.
64 và 0,9.
-
B.
32 và 0,9
-
C.
64 và 0,8.
-
D.
64 và 1,2
Đáp án : A
Ta chia đồ thị ra làm 3 giai đoạn:
+ Giai đoạn 1: đồ thị đi lên là xảy ra phản ứng:
CO2 + Ba(OH)2 → BaCO3↓ + H2O (1)
+ Giai đoạn 2: Đồ thị đi ngang là xảy ra phản ứng
CO2 + 2NaOH → Na2CO3 + H2O (2)
CO2 + Na2CO3 → 2NaHCO3 (3)
+ Giai đoạn 3 : đồ thị đi xuống là giai đoạn hòa tan kết tủa BaCO3
CO2 + BaCO3↓ + H2O → Ba(HCO3)2 (4)
=> Kết thúc cả 3 giai đoạn ta có:
Ba(OH)2 : a mol về muối Ba(HCO3)2: a ( mol) ( BTNT Ba)
NaOH: b mol về muối NaHCO3: b ( mol) ( BTNT Na)
+) Từ tổng số mol CO2 ở (1), (2), (3) => Pt (1)
+) Từ tổng số mol CO2 toàn bộ quá trình (3,4 mol) => Pt (2)
Ta chia đồ thị ra làm 3 giai đoạn:
+ Giai đoạn 1: đồ thị đi lên là xảy ra phản ứng:
CO2 + Ba(OH)2 → BaCO3↓ + H2O (1)
a← a → a (mol)
+ Giai đoạn 2: Đồ thị đi ngang là xảy ra phản ứng
CO2 + 2NaOH → Na2CO3 + H2O (2)
0,5b ←b → 0,5b (mol)
CO2 + Na2CO3 → 2NaHCO3 (3)
0,5b ← 0,5b → b (mol)
+ Giai đoạn 3 : đồ thị đi xuống là giai đoạn hòa tan kết tủa BaCO3
CO2 + BaCO3↓ + H2O → Ba(HCO3)2 (4)
a ← a (mol)
=> Kết thúc cả 3 giai đoạn ta có:
Ba(OH)2 : a mol về muối Ba(HCO3)2: a (mol) (BTNT Ba)
NaOH: b mol về muối NaHCO3: b (mol) (BTNT Na)
\(\begin{array}{l}\left\{ \begin{array}{l}\sum {{n_{C{O_{2}}}}_{(1) + (2) + (3)} = a + 0,5b + 0,5b = a + 1,6} \\\sum {{n_{C{O_2}}}_{(1) + (2) + (3) + (4)} = a + 0,5b + 0,5b + a = 3,4}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,9\\b = 1,6\end{array} \right.\\ \Rightarrow {m_{NaOH}} = 1,6.40 = 64\,g\end{array}\)
Hấp thụ 1,5x mol CO2 vào dung dịch hỗn hợp chứa 1,25x mol NaOH và 0,5x mol Na2CO3 thu được dung dịch X chứa 31,23 gam chất rắn tan. Cho dung dịch hỗn hợp chứa 1,15x mol NaOH và 1,2x mol CaCl2 vào dung dịch X thu được m gam kết tủa. Giá trị của m là
-
A.
25,2.
-
B.
23,6.
-
C.
21,6.
-
D.
20,2.
Đáp án : C
X chứa Na+ (2,25x mol), CO32- (y mol) và HCO3- (z mol)
+) Bảo toàn điện tích => PT (1)
+) Bảo toàn C => PT (2)
+) Từ mchất tan => PT (3)
=> x ; y ; z
=> nOH-
OH- + HCO3- → CO32- + H2O
=> $\sum{{{n}_{CO_{3}^{2-}}}}$
+) So sánh ${{n}_{CO_{3}^{2-}}}$ và ${{n}_{C{{a}^{2+}}}}\,\,\,\Rightarrow {{n}_{CaC{{\text{O}}_{3}}}}$
X chứa Na+ (2,25x mol), CO32- (y mol) và HCO3- (z mol)
Bảo toàn điện tích: 2,25x = 2y + z
Bảo toàn C: y + z = 1,5x + 0,5x
mchất tan = 23.2,25x + 60y + 61z = 31,23
=> x = 0,18; y = 0,045; z = 0,315
nOH- = 1,15x = 0,207
OH- + HCO3- → CO32- + H2O
0,207 → 0,207 → 0,207
=> $\sum{{{n}_{CO_{3}^{2-}}}}$= 0,207 + y = 0,252 mol
nCa2+ = 1,2x = 0,216 mol < ${{n}_{CO_{3}^{2-}}}$
=> nCaCO3 = 0,216 => m = 21,6 gam
Hòa tan hết 26,98 gam hỗn hợp X gồm Na, K, KHCO3 và Na2CO3 vào nước thu được dung dịch muối Y và 1,12 lít H2 (đktc). Chia dung dịch Y thành 2 phần bằng nhau. Nhỏ rất từ từ 110 ml dung dịch HCl 1M vào phần một, khuấy đều thu được 0,672 lít CO2 (đktc). Nhỏ rất từ từ phần hai vào 50 ml dung dịch HCl 1M khuấy đều thu được 0,672 lít CO2 (đktc). Mặt khác, cho 40,47 gam hỗn hợp X tác dụng với một lượng dư dung dịch HCl rồi cô cạn thu được hỗn hợp muối A. Khối lượng muối NaCl có trong hỗn hợp A là
-
A.
11,7 gam.
-
B.
17,55 gam.
-
C.
14,04 gam.
-
D.
15,21 gam.
Đáp án : B
+) ${{n}_{H+}}<2{{n}_{C{{O}_{2}}}}$ nên Y phải chứa HCO3- => Y không chứa OH-
Mỗi phần Y chứa CO32- (u mol) và HCO3- (v mol)
Phần 1: ${{n}_{H+}}={{n}_{CO_{3}^{2-}}}+{{n}_{C{{O}_{2}}}}$ => u
Phần 2: ${{n}_{CO_{3}^{2-}}}$ phản ứng = ku (mol) và ${{n}_{HCO_{3}^{-}}}$ phản ứng = kv (mol)
Từ ${{n}_{{{H}^{+}}}}$ và ${{n}_{C{{O}_{2}}}}$ => ku và kv
=> k, v
Vậy Y chứa CO32- (2u) và HCO3- (2v)
+) Từ ${{n}_{{{H}_{2}}}}\Rightarrow \text{ }{{n}_{O{{H}^{-}}}}$
Hòa tan X vào H2O, sau khi kim loại khử H2O tạo OH- thì:
OH- + HCO3- → CO32-
0,1 0,1 0,1
Quy đổi X thành Na (a mol), K (b mol), CO32- (0,16 – 0,1 = 0,06 mol) và HCO3- (0,08 + 0,1 = 0,18 mol)
+) Từ mX => PT (1)
+) Bảo toàn electron => PT (2)
=> a và b
=> mNaCl
Phần 2 tác dụng với HCl
Dễ thấy ${{n}_{H+}}<2{{n}_{C{{O}_{2}}}}$ nên Y phải chứa HCO3- => Y không chứa OH-
Mỗi phần Y chứa CO32- (u mol) và HCO3- (v mol)
Phần 1: ${{n}_{H+}}={{n}_{CO_{3}^{2-}}}+{{n}_{C{{O}_{2}}}}$
=> 0,11 = u + 0,03 => u = 0,08
Phần 2: ${{n}_{CO_{3}^{2-}}}$ phản ứng = ku (mol) và ${{n}_{HCO_{3}^{-}}}$ phản ứng = kv (mol)
${{n}_{{{H}^{+}}}}$ = 2ku + kv = 0,05
${{n}_{C{{O}_{2}}}}$ = ku + kv = 0,03
=> ku = 0,02 và kv = 0,01
Thay u = 0,08 => k = 0,25 và v = 0,04
Vậy Y chứa CO32- (2u = 0,16) và HCO3- (2v = 0,08)
${{n}_{{{H}_{2}}}}=0,05\text{ }=>\text{ }{{n}_{O{{H}^{-}}}}=0,1$
Hòa tan X vào H2O, sau khi kim loại khử H2O tạo OH- thì:
OH- + HCO3- → CO32-
0,1 0,1 0,1
Quy đổi X thành Na (a mol), K (b mol), CO32- (0,16 – 0,1 = 0,06 mol) và HCO3- (0,08 + 0,1 = 0,18 mol)
mX = 23a + 39b + 0,06.60 + 0,18.61 = 26,98
Bảo toàn electron: a + b = 0,06.2 + 0,18 + 0,05.2
=> a = b = 0,2
Tỉ lệ: 26,98 gam X + HCl → nNaCl = 0,2 mol
=> 40,47 gam X + HCl → nNaCl = 0,3 mol
=> mNaCl = 17,55 gam
Cho 100 ml dung dịch Ba(OH)2 0,3M vào 300 ml dung dịch NaHCO3 aM và Na2CO3 (0,5aM) thu được kết tủa X và 400 ml dung dịch Y chứa các muối. Cho từ từ dung dịch HCl 0,45M vào 200 ml dung dịch Y đến khi bắt đầu thấy khí thoát ra thì đã dùng 200 ml. Nếu cho từ từ 200 ml dung dịch Y vào 200 ml dung dịch HCl 0,45M, thu được x mol khí CO2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của x là
-
A.
0,045.
-
B.
0,093.
-
C.
0,083.
-
D.
0,063
Đáp án : D
Cho từ từ HCl vào Y không xuất hiện khí ngay nên Y chứa CO32- => Y không chứa Ba2+
=> nBaCO3
Dung dịch Y chứa Na+ (0,6a mol), CO32- (u mol) và HCO3- (v mol)
+) Bảo toàn điện tích => PT (1)
+) Bảo toàn C => PT (2)
Trong 200 ml dung dịch Y chứa ${{n}_{CO_{3}^{2-}}}=0,5u\,(mol)$
Từ ${{n}_{{{H}^{+}}}}\Rightarrow u$ => v và a
+) Tính $\frac{{{n}_{CO_{3}^{2-}}}}{{{n}_{HCO_{3}^{-}}}}$ trong 200 ml dd Y còn lại
Đặt 3p và 4p là số mol CO32- và HCO3- đã phản ứng
+) Từ ${{n}_{{{H}^{+}}}}\Rightarrow \text{ }p$
$\Rightarrow {{n}_{C{{O}_{2}}}}$
Cho từ từ HCl vào Y không xuất hiện khí ngay nên Y chứa CO32- => Y không chứa Ba2+
=> nBaCO3 = 0,03 mol
Dung dịch Y chứa Na+ (0,6a mol), CO32- (u mol) và HCO3- (v mol)
Bảo toàn điện tích: 0,6a = 2u + v
Bảo toàn C: 0,3a + 0,15a = u + v + 0,03
Trong 200 ml dung dịch Y chứa ${{n}_{CO_{3}^{2-}}}=0,5u\,(mol)$
$\Rightarrow {{n}_{{{H}^{+}}}}=0,5u=0,09\text{ }\Rightarrow u=0,18$
=> v = 0,24 và a = 1
200 ml Y còn lại chứa CO32- (0,09 mol), HCO3- (0,12 mol) và Na+
=> $\frac{{{n}_{CO_{3}^{2-}}}}{{{n}_{HCO_{3}^{-}}}}=\frac{3}{4}$
Đặt 3p và 4p là số mol CO32- và HCO3- đã phản ứng
$\Rightarrow {{n}_{{{H}^{+}}}}=2.3p+4p=0,09\text{ }\Rightarrow \text{ }p=0,009$
$\Rightarrow {{n}_{C{{O}_{2}}}}=3p+4p=0,063$
Hòa tan hết 25,88 gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước dư thu được 0,15 mol H2 và dung dịch X. Sục từ từ đến hết 0,32 mol CO2 vào X thu được dung dịch Y và kết tủa Z. Chia Y thành 2 phần bằng nhau. Cho từ từ phần một vào 200 ml dung dịch HCl 0,6M thu được 5x mol CO2. Mặt khác, cho từ từ 400 ml HCl 0,3M vào phần hai thu được 4x mol CO2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của x là
-
A.
0,03
-
B.
0,015
-
C.
0,02
-
D.
0,012
Đáp án : B
Dung dịch Y chứa CO32- (2a mol); HCO3- (2b mol) => Na+ (4a +2b)
Bảo toàn C => ${{n}_{Ba}}={{n}_{BaC{{O}_{3}}}}=?$
Bảo toàn electron: ${{n}_{Na}}+2.{{n}_{Ba}}=2.{{n}_{O}}+2.{{n}_{{{H}_{2}}}}$ => nO
=> PT (1)
Mỗi phần Y chứa CO32- (a mol) và HCO3- (b mol)
Do lượng HCl giống nhau (0,12 mol) nhưng lượng CO2 thu được khác nhau nên HCl không dư.
Phần 1: Đặt ka, kb là số mol CO32- và HCO3- phản ứng
+) Từ nHCl và nCO2 => ka và kb
=> PT (2) tỉ lệ a/b
Phần 2:
nHCl = a + 4x = 0,12 => PT (3)
Thay (2) và (3) vào (1) => x
Dung dịch Y chứa CO32- (2a mol); HCO3- (2b mol) => Na+ (4a +2b)
Bảo toàn C => ${{n}_{Ba}}={{n}_{BaC{{O}_{3}}}}=0,322a2b$
Bảo toàn electron: ${{n}_{Na}}+2.{{n}_{Ba}}=2.{{n}_{O}}+2.{{n}_{{{H}_{2}}}}$
=> nO = 0,17 – b
=> 23.(4a + 2b) + 137.(0,32 – 2a – 2b) + 16.(0,17 – b) = 25,88
=> 182a + 244b = 20,68
=> $182+\frac{244.b}{a}=\frac{20,68}{a~}$ (1)
Mỗi phần Y chứa CO32- (a mol) và HCO3- (b mol)
Do lượng HCl giống nhau (0,12 mol) nhưng lượng CO2 thu được khác nhau nên HCl không dư.
Phần 1: Đặt ka, kb là số mol CO32- và HCO3- phản ứng
=> nHCl = 2ka + kb = 0,12
Và nCO2 = ka + kb = 5x
=> ka = 0,12 – 5x và kb = 10x – 0,12
=> $\frac{b}{a}=\frac{10x0,12}{0,12-5x}$ (2)
Phần 2:
nHCl = a + 4x = 0,12 => a = 0,12 - 4x (3)
Thay (2) và (3) vào (1)
$182+244.\frac{10x0,12}{0,125x}=\frac{20,68}{0,124x}\Rightarrow x=0,015$
loại nghiệm làm (3) vô nghĩa
Luyện tập và củng cố kiến thức Ôn tập chương 3 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập cacbon - silic hay và khó (phần 1) Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 17. Silic và hợp chất của silicghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập muối cacbonat tác dụng với H+ Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập CO2 tác dụng với dung dịch kiềm Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập tính khử của C, CO, H2 Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 16. Hợp chất của cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 15. Cacbon Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận