Bài 12.20 trang 31 SBT Hóa học 10
Giải bài 12.20 trang 31 sách bài tập Hóa học 10. a) Tại sao các hợp chất ion lại thường tồn tại ở trạng thái tinh thể?
Đề bài
a) Tại sao các hợp chất ion lại thường tồn tại ở trạng thái tinh thể ?
b) Hãy vẽ sơ đồ mạng tinh thể NaCl và hãy mô tả sự phân bố các ion trong mạng tinh thể đó.
Phương pháp giải - Xem chi tiết
Xem lại lý thuyết liên kết ion. Tại đây
Lời giải chi tiết
a) Lực hút tĩnh điện giữa các ion không định hướng : một ion dương có tác dụng hút đối với nhiều ion âm và ngược lại. Vì vậy, các hợp chất ion thường tồn tại ở dạng tinh thể. Các phân tử ion riêng rẽ chỉ tồn tại ở nhiệt độ cao (1440 °C đối với NaCl).
b) Hình bên là sơ đồ mạng tinh thể NaCl.
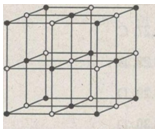
Trong tinh thể NaCl, các ion Na+; Cl- luân phiên phân bố trên các đỉnh của các hình lập phương nhỏ.
Mỗi ion được bao quanh bởi 6 ion khác dấu gần nhất.
Loigiaihay.com













Danh sách bình luận