Bài 26.8 trang 61 SBT Hóa học 10
Giải bài 26.8 trang 61 sách bài tập Hóa học 10. Có 4 lọ không có nhãn đựng riêng biệt các muối : KF, KCl, KBr, KI.
Đề bài
Có 4 lọ không có nhãn đựng riêng biệt các muối : KF, KCl, KBr, KI.
Hãy cho biết :
a)Cách phân biệt muối đựng trong mỗi lọ bằng phương pháp hoá học.
b)Từ những muối đã cho điều chế các halogen tương ứng và các hiđro halogenua tương ứng.
Phương pháp giải - Xem chi tiết
Xem lại lý thuyết về nhóm halogen. Tại đây
Lời giải chi tiết
a) Lấy một ít muối trong mỗi lọ đem hoà tan vào nước được các dung dịch riêng biệt.
Dung dịch nào tác dụng được với \(Br_2\) hoặc nước brom tạo ra tinh thể có màu đen tím, đó là dung dịch KI.
\(Br_2 + 2KI → 2KBr + I_2\)
Những dung dịch còn lại, dung dịch nào tác dụng được với \(Cl_2\) tạo ra dung dịch có màu vàng nâu (màu của\( Br_2\) tan trong nước), đó là dung dịch KBr.
\(Cl_2 + 2KBr → 2KCl + Br_2\)
Hai dung dịch còn lại là KF và KCl : cho tác dụng với dung dịch \(AgNO_3\), dung dịch nào tạo kết tủa trắng, đó là dung dịch KCl.
\(KCl + AgNO_3 → AgCl↓ + KNO_3\)
Dung dịch còn lại là KF.
b) Điều chế halogen tương ứng từ muối đã cho :
Điều chế \(F_2\) : Điện phân muối KF tan trong chất lỏng HF khan thu được \(F_2\) ở anôt.
Điều chế \(Cl_2\) : Điện phân dung dịch KCl trong nước, có màng ngăn.
Điều chế \(Br_2\) : Cho \(H_2SO_4\) đặc tác dụng với hỗn hợp rắn là KBr và \(MnO_2\), đun nóng. Các phản ứng xảy ra như sau :
Phản ứng tổng của (1), (2), (3) là :
\(2KBr + MnO_2 + 2H_2SO_4 \buildrel {{t^o}} \over \longrightarrow K_2SO_4 + MnSO_4 + Br_2 + 2H_2O\) (4)
Điều chế \(I_2\) tương tự điểu chế \(Br_2\) và có phản ứng tổng là :
\(2KI + MnO_2 + 2H_2SO_4 \buildrel {{t^o}} \over \longrightarrow K_2SO_4 + MnSO_4 + I_2 + 2H_2O\)
- Điều chế các hiđro halogenua từ các muối tương ứng :
- Điều chế HF : \(KF + H_2SO_4\buildrel {{t^o}} \over \longrightarrow KHSO_4 + HF↑\)
- Điều chế HCl : \(KCl + H_2SO_4\buildrel {{t^o}} \over \longrightarrow KHSO_4 + HCl↑\)
Điều chế HBr : Điện phân dung dịch KBr có màng ngăn (hoặc cho \(Cl_2\) tác dụng với dung dịch KBr, hoặc cho muối KBr tác dụng với hỗn hợp \(MnO_2\) và \(H_2SO_4\) đặc) được \(Br_2\), sau đó cho \(Br_2\) tác dụng với \(H_2\) ở nhiệt độ cao được HBr.
\(H_2 + Br_2 \buildrel {{t^o}} \over \longrightarrow 2HBr\)
Điều chế HI : Tương tự như điều chế HBr ở trên hoặc từ \(I_2\) ta điều chế HI bằng cách dùng khí \(H_2S\) khử \(I_2\).
\(I_2 + H_2S \buildrel {{t^o}} \over \longrightarrow 2HI + S↓\)
Loigiaihay.com





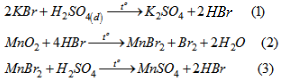








Danh sách bình luận