Bài 17.6, 17.7, 17.8, 17.9, 17.10 trang 41 SBT Hóa học 10
Giải bài 17.6, 17.7, 17.8, 17.9, 17.10 trang 41 sách bài tập Hóa học 10. 17.6.Cho sơ đồ phản ứng sau:
Câu 17.6.
Cho sơ đồ phản ứng sau:
\({H_2}S + KMn{O_4} + {H_2}S{O_{4(l)}} \to {H_2}O + S + MnS{O_4} + {K_2}S{O_4}\)
Hệ số của các chất tham gia trong PTHH của phản ứng trên lần lượt là
A. 3, 2, 5.
B. 5, 2, 3.
C. 2, 2, 5.
D. 5, 2, 4.
Phương pháp giải:
Lập phương trình phản ứng oxi hoá - khử theo phương pháp thăng bằng electron, ta thực hiện các bước sau đây:
Bước 1 : Ghi số oxi hoá của những nguyên tố có số oxi hoá thay đổi:
Bước 2 : Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình:
Bước 3 : Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hoá nhận.
Lời giải chi tiết:
Bước 1:
\({H_2}\mathop S\limits^{ - 2} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}S{O_{4(l)}} \to {H_2}O + \mathop S\limits^0 + \mathop {Mn}\limits^{ + 2} S{O_4} + {K_2}S{O_4}\)
Bước 2:
Bước 3:
\(5{H_2}S + 2KMn{O_4} + 3{H_2}S{O_{4(l)}} \to 8{H_2}O + 5S + 2MnS{O_4} + {K_2}S{O_4}\)
=> Chọn B
Câu 17.7.
Cho dãy các chất và ion : \(Zn, ZnO, Fe, FeO, S, SO_2, SO_3, N_2, HBr, Cu^{2+}, Br^-\) Số chất và ion có cả tính oxi hoá và tính khử là
A. 7 B. 5
C. 4 D. 6
Phương pháp giải:
Xác định số oxi hóa của các nguyên tố trong từng hợp chất, so sánh với các số oxi hóa có thể có của nguyên tố đó.
Lời giải chi tiết:
\(\mathop {Zn}\limits^0 \), \(\mathop {Fe}\limits^0 \), \(B{r^ - }\) : chỉ có tính khử
\(\mathop {Fe}\limits^{ + 2} \mathop O\limits^{ - 2} \), \(\mathop S\limits^0 \), \(\mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} \),\(\mathop H\limits^{ + 1} \mathop {Br}\limits^{ - 1} \),\(\mathop {{N_2}}\limits^0 \): có cả tính khử và oxi hóa
\(\mathop {Zn}\limits^{ + 2} \mathop O\limits^{ - 2} \),\(\mathop S\limits^{ + 6} \mathop {{O_3}}\limits^{ - 2} \),\(C{u^{2 + }}\): chỉ có tính oxi hóa
=> Chọn B
Câu 17.8.
Cho các phản ứng sau :
\(\begin{array}{l}
\left( a \right)\,4HCl + Pb{O_2} \to PbC{l_2} + C{l_2} + 2{H_2}O\\
\left( b \right)\,HCl + N{H_4}HC{O_3} \to N{H_4}Cl + C{O_2} + {H_2}O\\
\left( c \right)\,2HCl + 2HN{O_3} \to 2N{O_2} + C{l_2} + 2{H_2}O\\
\left( d \right)\,2HCl + Zn \to ZnC{l_2} + {H_2}
\end{array}\)
Số phản ứng trong đó HCl thể hiện tính khử là
A.2 B. 3.
C. 1. D. 4.
Phương pháp giải:
Xác định số oxi hóa của HCl trong các phương trình
HCl thể hiện tính khử khi số oxi hóa tăng
Lời giải chi tiết:
\(\left( a \right)4\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} + Pb{O_2}\xrightarrow{{}}PbC{l_2} + \mathop {C{l_2}}\limits^0 + 2\mathop {{H_2}}\limits^{ + 1} O\)
\(\left( b \right)\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} + N{H_4}HC{O_3}\xrightarrow{{}}N{H_4}\mathop {Cl}\limits^{ - 1} + \mathop {C{O_2}}\limits^{} + \mathop {{H_2}}\limits^{ + 1} O\)
\(\left( c \right)2\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} + 2HN{O_3}\xrightarrow{{}}2N{O_2} + \mathop {C{l_2}}\limits^0 + 2\mathop {{H_2}}\limits^{ + 1} O\)
\(\left( d \right)2\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} + Zn\xrightarrow{{}}ZnC{l_2} + \mathop {{H_2}}\limits^{ + 1} \)
Phương trình a, c HCl thể hiện tính khử
=> Chọn A
Câu 17.9.
Khi cho Cu tác dụng với dung dịch chứa \(H_2SO_4\) loãng và \(NaNO_3\), vai trò của \(NaNO_3\) trong phản ứng là
A. chất xúc tác.
B. Chất oxi hóa
C. môi trường.
D. chất khử
Phương pháp giải:
viết PTHH, xác định số oxi hóa của NaNO3 trước và sau phản ứng
Lời giải chi tiết:
\(3Cu + 4{H_2}S{O_4} + 2Na\mathop N\limits^{ + 5} {O_3}\xrightarrow{{}}3CuS{O_4} + N{a_2}S{O_4} + 2\mathop N\limits^{ + 2} O + 4{H_2}O\)
Số oxi hóa của N giảm => NaNO3 là chất oxi hóa
=> Chọn B
Câu 17.10.
Cho các phản ứng :
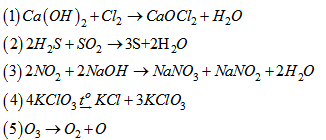
Phản ứng oxi hoá - khử là
A. 1, 2, 3,4,5.
B. 1,2,3.
C. 1,2, 3,4.
D. 1,4.
Phương pháp giải:
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố
Xác định số oxi hóa của các nguyên tố trong từng phương trình
Lời giải chi tiết:
\(Ca{\left( {OH} \right)_2} + \mathop {C{l_2}}\limits^0 \xrightarrow{{}}Ca\mathop {C{l_2}}\limits^{ - 1} + Ca{(\mathop {Cl}\limits^{ + 1} O)_2} + {H_2}O\)
\(2{H_2}\mathop S\limits^{ - 2} + \mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}3\mathop S\limits^0 + 2{H_2}O\)
\(2\mathop N\limits^{ + 4} {O_2} + 2NaOH\xrightarrow{{}}Na\mathop N\limits^{ + 5} {O_3} + Na\mathop N\limits^{ + 3} {O_2} + {H_2}O\)
\(4K\mathop {Cl}\limits^{ + 5} {O_3}\xrightarrow{{{t^o}}}K\mathop {Cl}\limits^{ - 1} + 3K\mathop {Cl}\limits^{ + 7} {O_4}\)
\(\mathop {{O_3}}\limits^0 \xrightarrow{{}}\mathop {{O_2}}\limits^0 + \mathop O\limits^0 \)
=> (1), (2), (3), (4) là phản ứng oxi hóa-khử
=> Chọn C
Loigiaihay.com













Danh sách bình luận