Bài 24.8 trang 58 SBT Hóa học 10
Giải bài 24.8 trang 58 sách bài tập Hóa học 10. Đưa một bình cầu đựng 250 gam nước clo ra ngoài ánh sáng mặt trời thì có 0,112 lít (đktc) khí được giải phóng.
Đề bài
Đưa một bình cầu đựng 250 gam nước clo ra ngoài ánh sáng mặt trời thì có 0,112 lít (đktc) khí được giải phóng. Hỏi khí nào được giải phóng? Tính nồng độ % của clo trong dung dịch đầu, cho rằng tất cả clo tan trong nước, đã phản ứng với nước.
Phương pháp giải - Xem chi tiết
Khí được giải phóng là \(O_2\). Tính toán theo PTHH
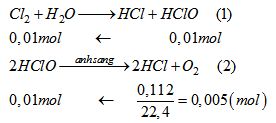
Lời giải chi tiết
Khí được giải phóng là \(O_2\)
Từ (1) và (2) suy ra:
\(\begin{array}{l}
{n_{C{l_2}}} = 0,01\left( {mol} \right)\\
C{\% _{\left( {Clo} \right)}} = \dfrac{{71.0,01}}{{250}}.100\% = 0,284\%
\end{array}\)
Loigiaihay.com













Danh sách bình luận