Trắc nghiệm Tổng hợp bài tập CO tác dụng với oxit kim loại - Hóa học 9
Đề bài
Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
-
A.
Cu, Fe, ZnO, MgO.
-
B.
Cu, Fe, Zn, Mg.
-
C.
Cu, Fe, Zn, MgO.
-
D.
Cu, FeO, ZnO, MgO.
Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
-
A.
MgO, Fe3O4, Cu.
-
B.
MgO, Fe, Cu.
-
C.
Mg, Fe, Cu.
-
D.
Mg, Al, Fe, Cu.
Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
-
A.
12,8
-
B.
25,6
-
C.
32,0
-
D.
16,0
Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
-
A.
17,6
-
B.
4,8
-
C.
20,8
-
D.
24,0
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
-
A.
0,8 gam.
-
B.
8,3 gam.
-
C.
2,0 gam.
-
D.
4,0 gam.
Cho V lít khí CO (ở đktc) phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
-
A.
0,224
-
B.
0,560
-
C.
0,112
-
D.
0,448
Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là
-
A.
0,896
-
B.
1,120
-
C.
0,224
-
D.
0,448
Hoà tan hoàn toàn 20 gam một oxit kim loại bằng dung dịch H2SO4 loãng thu được 50 gam muối. Khử hoàn toàn lượng oxit đó thành kim loại ở nhiệt độ cao cần V lít khí CO (đktc). Giá trị của V là
-
A.
2,80
-
B.
5,60
-
C.
6,72
-
D.
8,40
Cho H2 dư qua 8,14 gam hỗn hợp A gồm CuO, Al2O3 và FexOy nung nóng. Sau khi phản ứng xong, thu được 1,44 gam H2O và a gam chất rắn. Giá trị của a là :
-
A.
6,70
-
B.
6,86
-
C.
6,78
-
D.
6,80
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
-
A.
Fe3O4.
-
B.
Fe2O3.
-
C.
FeO.
-
D.
ZnO.
Cho khí CO qua ống chứa 15,2 gam hỗn hợp A gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6 gam chất rắn C. Cho B tác dụng với dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là :
-
A.
15
-
B.
10
-
C.
20
-
D.
25
Dẫn một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của m là :
-
A.
6,24
-
B.
5,32
-
C.
3,12
-
D.
4,56
Lời giải và đáp án
Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
-
A.
Cu, Fe, ZnO, MgO.
-
B.
Cu, Fe, Zn, Mg.
-
C.
Cu, Fe, Zn, MgO.
-
D.
Cu, FeO, ZnO, MgO.
Đáp án : C
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ.
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ
=> chỉ khử được CuO, Fe2O3, ZnO tạo thành Cu, Fe, Zn
=> hỗn hợp chất rắn thu được là Cu, Fe, Zn, MgO.
Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
-
A.
MgO, Fe3O4, Cu.
-
B.
MgO, Fe, Cu.
-
C.
Mg, Fe, Cu.
-
D.
Mg, Al, Fe, Cu.
Đáp án : B
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ. Al2O3 tan được trong dung dịch NaOH
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ.
=> trong hỗn hợp X, CO khử được Fe3O4 và CuO tạo ra Fe và Cu
=> chất rắn Y gồm: Al2O3, MgO, Fe, Cu
Cho Y vào dung dịch NaOH dư, chỉ có Al2O3 tan => chất rắn Z sau phản ứng gồm MgO, Fe, Cu
Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
-
A.
12,8
-
B.
25,6
-
C.
32,0
-
D.
16,0
Đáp án : B
CuO + CO $\xrightarrow{{{t^o}}}$ Cu + CO2
+) nCu = nCuO
PTHH: CuO + CO $\xrightarrow{{{t^o}}}$ Cu + CO2
=> nCu = nCuO = 0,4 mol => mCu = 25,6 gam
Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
-
A.
17,6
-
B.
4,8
-
C.
20,8
-
D.
24,0
Đáp án : C
PTHH: CuO + CO $\xrightarrow{{{t^o}}}$ Cu + CO2
0,2 → 0,2
Chất rắn gồm MgO và Cu
MgO không phản ứng với CO
PTHH: CuO + CO $\xrightarrow{{{t^o}}}$ Cu + CO2
0,2 → 0,2
Chất rắn gồm MgO và Cu
=> x = mMgO + mCu = 0,2.40 + 0,2.64 = 20,8 gam
Viết cả MgO phản ứng với CO => chọn nhầm A
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
-
A.
0,8 gam.
-
B.
8,3 gam.
-
C.
2,0 gam.
-
D.
4,0 gam.
Đáp án : D
Gọi số mol của CuO và Al2O3 lần lượt là a và b mol => mhỗn hợp đầu = PT(1)
CuO + CO $\xrightarrow{{{t^o}}}$ Cu + CO2
a mol → a mol
Hỗn hợp chất rắn sau phản ứng gồm Cu (a mol) và Al2O3 (b mol) => mhỗn hợp sau = PT(2)
Gọi số mol của CuO và Al2O3 lần lượt là a và b mol
=> mhỗn hợp đầu = 80a + 102b = 9,1 (1)
Khí CO chỉ phản ứng với CuO
CuO + CO $\xrightarrow{{{t^o}}}$ Cu + CO2
a mol → a mol
Hỗn hợp chất rắn sau phản ứng gồm Cu (a mol) và Al2O3 (b mol)
=> mhỗn hợp sau = 64a + 102b = 8,3 (2)
Lấy (1) trừ (2) ta có: 16a = 0,8 => a = 0,05 mol
=> mCuO = 0,05.80 = 4 gam
Cho V lít khí CO (ở đktc) phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
-
A.
0,224
-
B.
0,560
-
C.
0,112
-
D.
0,448
Đáp án : D
CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2
3CO + Fe2O3 $\xrightarrow{{{t^o}}}$ 2Fe + 3CO2
Từ 2 PTHH ta có: ${n_{CO}} = {n_{C{O_2}}} = a\,mol$
Bảo toàn khối lượng: ${m_{CO}} + {m_{CuO,{\text{ }}F{e_2}{O_3}}} = {m_{C{O_2}}}$ + mrắn sau phản ứng => a
Giả sử khối lượng hỗn hợp rắn ban đầu là m gam => khối lượng rắn sau phản ứng là (m – 0,32) gam
CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2
3CO + Fe2O3 $\xrightarrow{{{t^o}}}$ 2Fe + 3CO2
Từ 2 PTHH ta có: ${n_{CO}} = {n_{C{O_2}}} = a\,mol$
Bảo toàn khối lượng: ${m_{CO}} + {m_{CuO,{\text{ }}F{e_2}{O_3}}} = {m_{C{O_2}}}$ + mrắn sau phản ứng
=> 28a + m = 44a + m – 0,32
=> a = 0,02 mol
=> V = 0,02.22,4 = 0,448 lít
Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là
-
A.
0,896
-
B.
1,120
-
C.
0,224
-
D.
0,448
Đáp án : A
+) ${n_{CO}} = {n_{C{O_2}}}$
CO2 + Ca(OH)2 → CaCO3↓ + H2O
+) ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}} = 0,04\,mol$
CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2
3CO + Fe2O3 $\xrightarrow{{{t^o}}}$ 2Fe + 3CO2
Từ 2 PTHH => ${n_{CO}} = {n_{C{O_2}}}$
Cho khí X vào dung dịch Ca(OH)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
${n_{CaC{{\text{O}}_3}}} = \frac{4}{{100}} = 0,04\,mol$
Theo PTHH: ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}} = 0,04\,mol$
=> nCO = 0,04 mol
=> V = 0,04.22,4 = 0,896 lít
Hoà tan hoàn toàn 20 gam một oxit kim loại bằng dung dịch H2SO4 loãng thu được 50 gam muối. Khử hoàn toàn lượng oxit đó thành kim loại ở nhiệt độ cao cần V lít khí CO (đktc). Giá trị của V là
-
A.
2,80
-
B.
5,60
-
C.
6,72
-
D.
8,40
Đáp án : D
R2On + nH2SO4 → R2(SO4)n + nH2O
+) ${n_{{R_2}{O_n}}} = {n_{{R_2}{{(S{O_4})}_n}}} = > \frac{{20}}{{2{\text{R}} + 16n}} = \frac{{50}}{{2{\text{R}} + 96n}}$ => lập bảng xét R và n
+) Tìm công thức của oxit => tính theo PT tìm số mol CO phản ứng
+) Xét trường hợp oxit là Fe3O4
Gọi oxit kim loại cần tìm là R2On
R2On + nH2SO4 → R2(SO4)n + nH2O
Theo PTHH ta có: ${n_{{R_2}{O_n}}} = {n_{{R_2}{{(S{O_4})}_n}}} = > \frac{{20}}{{2{\text{R}} + 16n}} = \frac{{50}}{{2{\text{R}} + 96n}} = > R = \frac{{56}}{3}n$
Ta có bảng sau:

=> oxit cần tìm là Fe2O3
${n_{F{{\text{e}}_2}{O_3}}} = \frac{{20}}{{160}} = 0,125\,mol$
Fe2O3 + 3CO $\xrightarrow{{{t^o}}}$ 2Fe + 3CO2
0,125 → 0,375
=> VCO = 0,375.22,4 = 8,4 lít
* Trường hợp oxit kim loại là Fe3O4
${{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}=\frac{20}{232}=\frac{5}{58}\,mol$
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
$\frac{5}{58}$ mol → $\frac{5}{58}$ mol → $\frac{5}{58}$ mol
=> Khối lượng muối thu được là:
mmuối = ${{m}_{F\text{e}S{{O}_{4}}}}+{{m}_{F{{\text{e}}_{2}}{{(S{{O}_{4}})}_{3}}}}=\frac{5}{58}.152+\frac{5}{58}.400\approx 47,58\ne 50$
=> loại trường hợp này
Cho H2 dư qua 8,14 gam hỗn hợp A gồm CuO, Al2O3 và FexOy nung nóng. Sau khi phản ứng xong, thu được 1,44 gam H2O và a gam chất rắn. Giá trị của a là :
-
A.
6,70
-
B.
6,86
-
C.
6,78
-
D.
6,80
Đáp án : B
H2 + CuO $\xrightarrow{{{t^o}}}$ Cu + H2O
yH2 + FexOy $\xrightarrow{{{t^o}}}$ xFe + yH2O
+) ${n_{{H_2}}} = {n_{{H_2}O}}$
+) Bảo toàn khối lượng: ${m_{{H_2}}} + {m_{hh\,A}} = {m_{c{\text{r}}an}} + {m_{{H_2}O}}$
${n_{{H_2}O}} = \frac{{1,44}}{{18}} = 0,08\,mol$
H2 + CuO $\xrightarrow{{{t^o}}}$ Cu + H2O
yH2 + FexOy $\xrightarrow{{{t^o}}}$ xFe + yH2O
Từ PTHH ta có: ${n_{{H_2}}} = {n_{{H_2}O}} = 0,08\,mol$
Bảo toàn khối lượng: ${m_{{H_2}}} + {m_{hh\,A}} = {m_{c{\text{r}}an}} + {m_{{H_2}O}}$
=> 0,08.2 + 8,14 = a + 1,44 => a = 6,86 gam
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
-
A.
Fe3O4.
-
B.
Fe2O3.
-
C.
FeO.
-
D.
ZnO.
Đáp án : A
TH1: M không phải là Fe3O4
M2On + nH2 $\xrightarrow{{{t^o}}}$ 2M + nH2O
+) Tính số mol M2On theo số mol H2
$ = > {M_{{M_2}{O_n}}} = \dfrac{{m}}{n} = 58n$
+) lập bảng, biện luận
TH2: M là Fe3O4 $ = > {n_{F{{\text{e}}_3}{O_4}}}$
Fe3O4 + 4H2 $\xrightarrow{{{t^o}}}$ 3Fe + 4H2O
+) Tính số mol Fe theo số mol Fe3O4
Fe + 2HCl → FeCl2 + H2
+) Tính số mol H2 theo số mol Fe
${n_{{H_2}}} = \frac{{1,344}}{{22,4}} = 0,06\,mol$
TH1: M không phải là Fe3O4
M2On + nH2 $\xrightarrow{{{t^o}}}$ 2M + nH2O
$\frac{{0,06}}{n}$ ←0,06 → $\frac{{0,12}}{n}$
$ = > {M_{{M_2}{O_n}}} = \dfrac{{3,48}}{{\dfrac{{0,06}}{n}}} = 58n$
=> 2M + 16n = 58n => M = 21n
Ta có bảng sau:
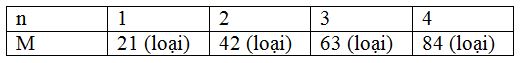
=> loại trường hợp này
TH2: M là Fe3O4 $ = > {n_{F{{\text{e}}_3}{O_4}}} = \dfrac{{3,48}}{{232}} = 0,015\,mol$
Fe3O4 + 4H2 $\xrightarrow{{{t^o}}}$ 3Fe + 4H2O
0,015 → 0,06 → 0,045 mol
Fe + 2HCl → FeCl2 + H2
0,045 mol → 0,045 mol
$ = > {V_{{H_2}}} = 0,045.22,4 = 1,008$ lít (phù hợp đầu bài)
Vậy oxit cần tìm là Fe3O4
Cho khí CO qua ống chứa 15,2 gam hỗn hợp A gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6 gam chất rắn C. Cho B tác dụng với dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là :
-
A.
15
-
B.
10
-
C.
20
-
D.
25
Đáp án : B
CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2
CO + FeO $\xrightarrow{{{t^o}}}$ Fe + CO2
+) ${n_{CO}} = {n_{C{O_2}}}$
+) Bảo toàn khối lượng: ${m_{CO}} + {m_{hh\,A}} = {m_{C{O_2}}} + {m_{hh\,{\mathbf{B}}}}$ => tính số mol CO2
B tác dụng với dung dịch Ca(OH)2 dư:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2
CO + FeO $\xrightarrow{{{t^o}}}$ Fe + CO2
Từ PTHH ta có: ${n_{CO}} = {n_{C{O_2}}} = a\,mol$
Bảo toàn khối lượng: ${m_{CO}} + {m_{hh\,A}} = {m_{C{O_2}}} + {m_{hh\,{\mathbf{B}}}}$
=> 28a + 15,2 = 44a + 13,6 => a = 0,1 mol
B tác dụng với dung dịch Ca(OH)2 dư:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,1 mol → 0,1 mol
=> mkết tủa = 0,1.100 = 10 gam
Dẫn một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của m là :
-
A.
6,24
-
B.
5,32
-
C.
3,12
-
D.
4,56
Đáp án : C
4CO + Fe3O4 $\xrightarrow{{{t^o}}}$ 3Fe + 4CO2
CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2
+) ${n_{CO}} = {n_{C{O_2}}} = a\,mol$
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,05 mol ← 0,05 mol
Bảo toàn khối lượng: ${m_{CO}} + {m_{hh\,F{{\text{e}}_3}{O_4},CuO}} = {m_{C{O_2}}} + {m_{hh\,kl}}$ => tính m
4CO + Fe3O4 $\xrightarrow{{{t^o}}}$ 3Fe + 4CO2
CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2
Từ PTHH ta có: ${n_{CO}} = {n_{C{O_2}}} = a\,mol$
Khí thoát ra khỏi bình dẫn qua dung dịch Ca(OH)2 thu được 5 gam kết tủa CaCO3
$ = > {n_{CaC{{\text{O}}_3}}} = \frac{5}{{100}} = 0,05\,mol$
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,05 mol ← 0,05 mol
Bảo toàn khối lượng: ${m_{CO}} + {m_{hh\,F{{\text{e}}_3}{O_4},CuO}} = {m_{C{O_2}}} + {m_{hh\,kl}}$
=> 0,05.28 + m = 0,05.44 + 2,32 => m = 3,12 gam
Luyện tập và củng cố kiến thức Bài 29. Axit cacbonic và muối cacbonat Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập muối cacbonat tác dụng với axit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 30. Silic và công nghiệp silicat Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 31. Sơ lược về bảng tuần hoàn các nguyên tố hóa học Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 28. Các oxit của cacbon Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 27. Cacbon Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 26. Clo Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 25. Tính chất của phi kim Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận