Trắc nghiệm Bài 9. Tính chất hóa học của muối - Hóa học 9
Đề bài
Cho dung dịch axit sunfuric loãng tác dụng với muối natrisunfit (Na2SO3). Chất khí nào sinh ra ?
-
A.
Khí hiđro
-
B.
Khí oxi
-
C.
Khí lưu huỳnh đioxit
-
D.
Khí hiđro sunfua
Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
-
A.
Có kết tủa trắng xanh.
-
B.
Có khí thoát ra.
-
C.
Có kết tủa đỏ nâu.
-
D.
Kết tủa màu trắng.
Dãy muối tác dụng với dung dịch axit sunfuric loãng là:
-
A.
Na2CO3, Na2SO3, NaCl
-
B.
CaCO3, Na2SO3, BaCl2
-
C.
CaCO3, BaCl2, MgCl2
-
D.
BaCl2, Na2CO3, Cu(NO3)2
Phản ứng biểu diễn đúng sự nhiệt phân của muối canxi cacbonat:
-
A.
2CaCO3 $\xrightarrow{{{t^o}}}$ 2CaO + CO + O2
-
B.
2CaCO3 $\xrightarrow{{{t^o}}}$ 3CaO + CO2
-
C.
CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
-
D.
2CaCO3 $\xrightarrow{{{t^o}}}$ 2Ca + CO2 + O2
Có thể dùng dung dịch HCl để nhận biết các dung dịch không màu sau đây:
-
A.
NaOH, Na2CO3, AgNO3
-
B.
Na2CO3, Na2SO4, KNO3
-
C.
KOH, AgNO3, NaCl
-
D.
NaOH, Na2CO3, NaCl
Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
-
A.
NaOH, MgSO4
-
B.
KCl, Na2SO4
-
C.
CaCl2, NaNO3
-
D.
ZnSO4, H2SO4
Các cặp chất nào cùng tồn tại trong một dung dịch?
1. CuSO4và HCl 2. H2SO4 và Na2SO3
3. KOH và NaCl 4. MgSO4và BaCl2
-
A.
(1; 2)
-
B.
(3; 4)
-
C.
(2; 4)
-
D.
(1; 3)
Dung dịch chất X có pH > 7 và khi cho tác dụng với dung dịch kali sunfat (K2SO4) tạo ra kết tủa. Chất X là:
-
A.
BaCl2
-
B.
NaOH
-
C.
Ba(OH)2
-
D.
H2SO4
Dung dịch tác dụng được với các dung dịch Fe(NO3)2, CuCl2 là:
-
A.
dung dịch NaOH
-
B.
dung dịch HCl
-
C.
dung dịch AgNO3
-
D.
dung dịch BaCl2
Để làm sạch dung dịch đồng (II) nitrat Cu(NO3)2 có lẫn tạp chất bạc nitrat AgNO3. Ta dùng kim loại:
-
A.
Mg
-
B.
Cu
-
C.
Fe
-
D.
Au
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng:
-
A.
Quỳ tím
-
B.
Dung dịch Ba(NO3)2
-
C.
Dung dịch AgNO3
-
D.
Dung dịch KOH
Cho 50 gam CaCO3 vào dung dịch HCl dư thu được bao nhiêu lít khí CO2 ở đktc ?
-
A.
11,2 lít
-
B.
1,12 lít
-
C.
2,24 lít
-
D.
22,4 lít
Khi cho 200 gam dung dịch Na2CO3 10,6% vào dung dịch HCl dư, khối lượng khí sinh ra là
-
A.
4,6 gam
-
B.
8 gam
-
C.
8,8 gam
-
D.
10 gam
Dung dịch muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
-
A.
CO2, NaOH, H2SO4, Fe
-
B.
H2SO4, AgNO3, Ca(OH)2, Al
-
C.
NaOH, BaCl2, Fe, H2SO4
-
D.
NaOH, BaCl2, Fe, Al
Cho a gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở đktc. Giá trị của a là
-
A.
15,9 gam
-
B.
10,5 gam
-
C.
34,8 gam
-
D.
18,2 gam
Trộn dung dịch có chứa 0,1 mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
-
A.
8 gam
-
B.
4 gam
-
C.
6 gam
-
D.
12 gam
Khi phân hủy bằng nhiệt 14,2 gam CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là:
-
A.
29,58% và 70,42%
-
B.
70,42% và 29,58%
-
C.
65% và 35%
-
D.
35% và 65%
Cho các muối A, B, C, D là các muối (không theo tự) CaCO3, CaSO4, Pb(NO3)2, NaCl. Biết
rằng A không được phép có trong nước ăn vì tính độc hại của nó, B không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó; C không tan trong nước nhưng bị phân hủy ở nhiệt ; D rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao. A, B, C và D lần lượt là
-
A.
Pb(NO3)2, NaCl, CaCO3, CaSO4.
-
B.
NaCl, CaSO4, CaCO3, Pb(NO3)2.
-
C.
CaSO4, NaCl, Pb(NO3)2, CaCO3.
-
D.
CaCO3, Pb(NO3)2, NaCl, CaSO4.
Cho dãy các dung dịch: MgCl2, NaOH, H2SO4, CuSO4, Fe(NO3)3. Khi cho dung dịch trên tác dụng với nhau từng đôi một thì số phản ứng không xảy ra là
-
A.
6.
-
B.
4.
-
C.
5
-
D.
7
Trong các dung dịch sau, chất nào phản ứng được với dung dịch BaCl2 ?
-
A.
AgNO3.
-
B.
NaCl.
-
C.
HNO3.
-
D.
HCl.
Cho 1,84g hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít CO2 ở đktc và dung dịch X. Khối lượng muối trong dung dịch X là:
-
A.
1,17(g)
-
B.
3,17(g)
-
C.
2,17(g)
-
D.
4,17(g)
Cho dãy chuyển hóa sau: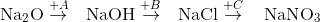 . Các chất A, B, C trong dãy trên lần lượt là:
. Các chất A, B, C trong dãy trên lần lượt là:
-
A.
H2O, HCl, KNO3
-
B.
H2O, HCl, HNO3
-
C.
H2O, HCl, AgNO3
-
D.
H2O, HCl, Ba(NO3)2
Cho dung dịch chứa 0,3 mol NaOH vào lượng dư dung dịch MgCl2, sau khi phản ứng hoàn toàn thu được a gam kết tủa. Giá trị của a là
-
A.
3,60.
-
B.
8,70.
-
C.
17,40.
-
D.
4,53.
Nhiệt phân một lượng MgCO3 sau một thời gian thu được chất rắn A và khí B. Hấp thụ hết khí B bằng dung dịch NaOH thu được dung dịch C. Dung dịch C vừa tác dụng được với BaCl2, vừa tác dụng với KOH. Hòa tan chất rắn A bằng dung dịch H2SO4 loãng dư thu được khí B và dung dịch D.
Xác định thành phần của D
-
A.
MgSO4, H2SO4 dư
-
B.
MgSO4
-
C.
H2SO4 dư
-
D.
NaHCO3 và Na2CO3
Cô cạn từ từ 200ml dung dịch CuSO4 0,2M thu được 10 gam tinh thể CuSO4.xH2O. Tìm x ?
-
A.
5
-
B.
4
-
C.
6
-
D.
3
Cho từ từ đến hết 100 ml dung dịch FeCl2 0,5M vào 100 ml dung dịch AgNO3 1,2M. Sau phản ứng hoàn toàn được m gam kết tủa và dung dịch chứa các muối. Gía trị của m là?
-
A.
7,6 gam
-
B.
15,8 gam
-
C.
24,7 gam
-
D.
15,6 gam
Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
-
A.
12 g
-
B.
4 g
-
C.
6 g
-
D.
8 g
Hòa tan 25,9g hỗn hợp hai muối khan gồm NaCl và Na2SO4 vào nước thì thu được 200g dung dịch A. Cho dung dịch A vào dung dịch Ba(OH)2 20% vừa đủ, thấy xuất hiện 23,3g kết tủa, lọc bỏ kết tủa thu được dung dịch B. Tính khối lượng muối khan trong hỗn hợp ban đầu.
-
A.
25,9
-
B.
25
-
C.
29,5
-
D.
27
Để hòa tan hết 5,1 g M2O3 phải dùng 43,8 g dung dịch HCl 25%. Phân tử khối của M2O3 là:
-
A.
160
-
B.
102
-
C.
103
-
D.
106
Công thức hóa học của muối natri hidrosunfat là:
-
A.
NaCl.
-
B.
Na2SO4.
-
C.
NaHSO4.
-
D.
NaHSO3
Cho Na2O vào dung dịch muối X, thu được kết tủa màu trắng. Muối X là chất nào sau đây?
-
A.
NaCl.
-
B.
FeCl3.
-
C.
CuCl2.
-
D.
MgCl2.
Muối nào sau đây không bị nhiệt phân hủy?
-
A.
CaCO3.
-
B.
Na2CO3.
-
C.
KNO3.
-
D.
KClO3.
Dãy muối cacbonat bị nhiệt phân ở nhiệt độ cao
-
A.
Na2CO3, Ca(HCO3)2.
-
B.
K2CO3, KHCO3.
-
C.
CaCO3, Ca(HCO3)2.
-
D.
MgCO3, K2CO3.
Lời giải và đáp án
Cho dung dịch axit sunfuric loãng tác dụng với muối natrisunfit (Na2SO3). Chất khí nào sinh ra ?
-
A.
Khí hiđro
-
B.
Khí oxi
-
C.
Khí lưu huỳnh đioxit
-
D.
Khí hiđro sunfua
Đáp án : C
H2SO4 + Na2SO3 → Na2SO4 + SO2 ↑ + H2O
=> chất khí sinh ra là SO2: lưu huỳnh đioxit
Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
-
A.
Có kết tủa trắng xanh.
-
B.
Có khí thoát ra.
-
C.
Có kết tủa đỏ nâu.
-
D.
Kết tủa màu trắng.
Đáp án : C
Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, xảy ra phản ứng:
3NaOH + FeCl3 → Fe(OH)3 ↓ + 3NaCl
Fe(OH)3 kết tủa màu đỏ nâu
Dãy muối tác dụng với dung dịch axit sunfuric loãng là:
-
A.
Na2CO3, Na2SO3, NaCl
-
B.
CaCO3, Na2SO3, BaCl2
-
C.
CaCO3, BaCl2, MgCl2
-
D.
BaCl2, Na2CO3, Cu(NO3)2
Đáp án : B
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
Loại A vì NaCl không phản ứng
Loại C vì MgCl2 không phản ứng
Loại D vì Cu(NO3)2 không phản ứng
Phản ứng biểu diễn đúng sự nhiệt phân của muối canxi cacbonat:
-
A.
2CaCO3 $\xrightarrow{{{t^o}}}$ 2CaO + CO + O2
-
B.
2CaCO3 $\xrightarrow{{{t^o}}}$ 3CaO + CO2
-
C.
CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
-
D.
2CaCO3 $\xrightarrow{{{t^o}}}$ 2Ca + CO2 + O2
Đáp án : C
Phản ứng nhiệt phân CaCO3 là: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Có thể dùng dung dịch HCl để nhận biết các dung dịch không màu sau đây:
-
A.
NaOH, Na2CO3, AgNO3
-
B.
Na2CO3, Na2SO4, KNO3
-
C.
KOH, AgNO3, NaCl
-
D.
NaOH, Na2CO3, NaCl
Đáp án : A
Dùng dung dịch HCl có thể nhận biết được: NaOH, Na2CO3, AgNO3. Cho dung dịch HCl vào mỗi lọ.
- dung dịch NaOH không hiện tượng
- dung dịch Na2CO3 xuất hiện bọt khí
- dung dịch AgNO3 xuất hiện kết tủa.
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
-
A.
NaOH, MgSO4
-
B.
KCl, Na2SO4
-
C.
CaCl2, NaNO3
-
D.
ZnSO4, H2SO4
Đáp án : A
Cặp chất không thể cùng tồn tại trong một dung dịch là cặp chất xảy ra phản ứng với nhau
Cặp chất không thể cùng tồn tại trong một dung dịch là cặp chất xảy ra phản ứng với nhau
=> cặp NaOH và MgSO4 không thể cùng tồn tại trong một dung dịch vì xảy ra phản ứng:
2NaOH + MgSO4 → Mg(OH)2 + Na2SO4
Các cặp chất nào cùng tồn tại trong một dung dịch?
1. CuSO4và HCl 2. H2SO4 và Na2SO3
3. KOH và NaCl 4. MgSO4và BaCl2
-
A.
(1; 2)
-
B.
(3; 4)
-
C.
(2; 4)
-
D.
(1; 3)
Đáp án : D
Dựa vào tính chất hóa học của muối => xét các cặp chất không phản ứng với nhau thì cùng tồn tại trong một dung dịch
Các cặp chất cùng tồn tại trong một dung dịch là cặp chất không phản ứng với nhau
=> cặp 1. CuSO4 và HCl và cặp 3. KOH và NaCl
Dung dịch chất X có pH > 7 và khi cho tác dụng với dung dịch kali sunfat (K2SO4) tạo ra kết tủa. Chất X là:
-
A.
BaCl2
-
B.
NaOH
-
C.
Ba(OH)2
-
D.
H2SO4
Đáp án : C
Cần nắm được tính chất hóa học của muối và tính chất hóa học của bazơ
Dung dịch chất X có pH > 7 => X là dung dịch bazơ => loại A và D
Dung dịch X tác dụng với dung dịch K2SO4 tạo kết tủa => X là Ba(OH)2
Ba(OH)2 + K2SO4 → BaSO4 ↓ + 2KOH
Dung dịch tác dụng được với các dung dịch Fe(NO3)2, CuCl2 là:
-
A.
dung dịch NaOH
-
B.
dung dịch HCl
-
C.
dung dịch AgNO3
-
D.
dung dịch BaCl2
Đáp án : A
Cần nắm được tính chất hóa học của muối tác dụng với axit và với bazơ
Dung dịch tác dụng được với các dung dịch Fe(NO3)2, CuCl2 là dung dịch NaOH vì tạo kết tủa
Fe(NO3)2 + 2NaOH → Fe(OH)2 ↓ + 2NaNO3
CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
Để làm sạch dung dịch đồng (II) nitrat Cu(NO3)2 có lẫn tạp chất bạc nitrat AgNO3. Ta dùng kim loại:
-
A.
Mg
-
B.
Cu
-
C.
Fe
-
D.
Au
Đáp án : B
Để làm sạch dung dịch đồng (II) nitrat Cu(NO3)2 có lẫn tạp chất bạc nitrat AgNO3 ta dùng Cu vì Cu phản ứng được với AgNO3 tạo ra Cu(NO3)2
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng:
-
A.
Quỳ tím
-
B.
Dung dịch Ba(NO3)2
-
C.
Dung dịch AgNO3
-
D.
Dung dịch KOH
Đáp án : D
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng dung dịch KOH vì tạo các kết tủa có màu khác nhau:
- dung dịch CuCl2 tạo kết tủa xanh: CuCl2 + 2NaOH → Cu(OH)2 ↓xanh + 2NaCl
- dung dịch FeCl3 tạo kết tủa đỏ nâu: FeCl3 + 3NaOH → Fe(OH)3 ↓đỏ nâu + 3NaCl
- dung dịch MgCl2 tạo kết tủa trắng: MgCl2 + 2NaOH → Mg(OH)2 ↓trắng + 3NaCl
Cho 50 gam CaCO3 vào dung dịch HCl dư thu được bao nhiêu lít khí CO2 ở đktc ?
-
A.
11,2 lít
-
B.
1,12 lít
-
C.
2,24 lít
-
D.
22,4 lít
Đáp án : A
Tính theo phương trình
CaCO3 + 2HCl → CaCl2 + CO2 ↑+ H2O
0,5 mol → 0,5 mol
${n_{CaC{{\text{O}}_3}}} = \frac{{50}}{{100}} = 0,5\,\,mol$
CaCO3 + 2HCl → CaCl2 + CO2 ↑+ H2O
0,5 mol → 0,5 mol
$ = > {V_{C{O_2}}} = 0,5.22,4 = 11,2$ lít
Khi cho 200 gam dung dịch Na2CO3 10,6% vào dung dịch HCl dư, khối lượng khí sinh ra là
-
A.
4,6 gam
-
B.
8 gam
-
C.
8,8 gam
-
D.
10 gam
Đáp án : C
Tính theo phương trình:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
0,2 mol → 0,2 mol
${m_{N{a_2}C{O_3}}} = \frac{{200.10,6}}{{100}} = 21,2\,\,gam\,\, = > \,\,{n_{N{a_2}C{O_3}}} = 0,2\,\,mol$
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
0,2 mol → 0,2 mol
$ = > {m_{C{O_2}}} = 0,2.44 = 8,8\,gam$
Dung dịch muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
-
A.
CO2, NaOH, H2SO4, Fe
-
B.
H2SO4, AgNO3, Ca(OH)2, Al
-
C.
NaOH, BaCl2, Fe, H2SO4
-
D.
NaOH, BaCl2, Fe, Al
Đáp án : D
Xem lại tính chất hóa học của muối
Dung dịch CuSO4 phản ứng được với: NaOH, BaCl2, Fe, Al
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓
CuSO4 + Fe → FeSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Cho a gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở đktc. Giá trị của a là
-
A.
15,9 gam
-
B.
10,5 gam
-
C.
34,8 gam
-
D.
18,2 gam
Đáp án : A
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
+) ${n_{N{a_2}C{O_3}}} = n{_{C{O_2}}} = > a$
Phương trình hóa học: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
${n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15\,\,mol$
Theo phương trình hóa học: ${n_{N{a_2}C{O_3}}} = n{_{C{O_2}}} = 0,15\,\,mol$
$ = > a = {m_{N{a_2}C{O_3}}} = 0,15\,.106 = 15,9\,gam$
Trộn dung dịch có chứa 0,1 mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
-
A.
8 gam
-
B.
4 gam
-
C.
6 gam
-
D.
12 gam
Đáp án : A
+) CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
+)Xét tỉ lệ: $\frac{{{n_{CuS{O_4}}}}}{1}$ và $\frac{{{n_{NaOH}}}}{2}$ => chất dư, chất hết
+) ${n_{Cu{{(OH)}_2}}} = {n_{CuS{O_4}}}$
+) Cu(OH)2 $\xrightarrow{{{t^o}}}$ CuO + H2O
0,1 mol → 0,1 mol
Phương trình hóa học: CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
Xét tỉ lệ: $\frac{{{n_{CuS{O_4}}}}}{1} = \frac{{0,1}}{1}\,\, < \,\,\frac{{{n_{NaOH}}}}{2} = \frac{{0,3}}{2} = 0,15$
=> CuSO4 phản ứng hết, NaOH còn dư => phản ứng tính theo CuSO4
Ta có: ${n_{Cu{{(OH)}_2}}} = {n_{CuS{O_4}}} = 0,1\,\,mol$
Nung chất rắn đến khối lượng không đổi:
Cu(OH)2 $\xrightarrow{{{t^o}}}$ CuO + H2O
0,1 mol → 0,1 mol
=> mCuO = 0,1.80 = 8 gam
Khi phân hủy bằng nhiệt 14,2 gam CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là:
-
A.
29,58% và 70,42%
-
B.
70,42% và 29,58%
-
C.
65% và 35%
-
D.
35% và 65%
Đáp án : B
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y => mhỗn hợp = PT(1)
Phương trình hóa học:
CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
x mol → x mol
MgCO3 $\xrightarrow{{{t^o}}}$ MgO + CO2
y mol → y mol
$ = > {n_{C{O_2}}} = PT(2)$
${n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15\,\,mol$
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y mol
=> mhỗn hợp = 100x + 84y = 14,2 (1)
Phương trình hóa học:
CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
x mol → x mol
MgCO3 $\xrightarrow{{{t^o}}}$ MgO + CO2
y mol → y mol
$ = > {n_{C{O_2}}} = x + y = 0,15\,\,mol\,\,(2)$
Từ (1) và (2) => x = 0,1 mol; y = 0,05 mol
$ = > \% {m_{CaC{{\text{O}}_3}}} = \frac{{100.0,1}}{{14,2}}.100\% = 70,42\% ;\,\,\% {m_{MgC{O_3}}} = 29,58\% $
Cho các muối A, B, C, D là các muối (không theo tự) CaCO3, CaSO4, Pb(NO3)2, NaCl. Biết
rằng A không được phép có trong nước ăn vì tính độc hại của nó, B không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó; C không tan trong nước nhưng bị phân hủy ở nhiệt ; D rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao. A, B, C và D lần lượt là
-
A.
Pb(NO3)2, NaCl, CaCO3, CaSO4.
-
B.
NaCl, CaSO4, CaCO3, Pb(NO3)2.
-
C.
CaSO4, NaCl, Pb(NO3)2, CaCO3.
-
D.
CaCO3, Pb(NO3)2, NaCl, CaSO4.
Đáp án : A
Dựa vào hiểu biết về các chất đã cho, từ đó xác định được A,B,C,D tương ứng
A là Pb(NO3)2 vì kim loại Pb rất độc
B là NaCl vì NaCl là muối ăn, nên có vị mặn
C là CaCO3. CaCO3 là muối không tan và dễ bị nhiệt phân hủy
CaCO3 \(\buildrel {{t^0}} \over\longrightarrow \) CaO + CO2↑
D là CaSO4. Muối CaSO4 ít tan trong nước và không bị nhiệt phân hủy.
Cho dãy các dung dịch: MgCl2, NaOH, H2SO4, CuSO4, Fe(NO3)3. Khi cho dung dịch trên tác dụng với nhau từng đôi một thì số phản ứng không xảy ra là
-
A.
6.
-
B.
4.
-
C.
5
-
D.
7
Đáp án : A
Kẻ bảng sau đó đổ lần lượt các chất từng đôi một vào với nhau, chất nào có phản ứng thì kí hiệu bằng dấu “X” ; chất nào không có phản ứng thì kí hiệu bằng dấu “-“ \( \to\) từ đó đếm được số cặp chất không có phản ứng xảy ra.
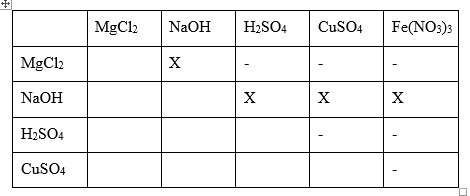
Dấu X là có phản ứng xảy ra
Dấu – là không có phản ứng xảy ra
\( \to\) có 6 cặp chất đổ vào nhau không có phản ứng xảy ra.
Trong các dung dịch sau, chất nào phản ứng được với dung dịch BaCl2 ?
-
A.
AgNO3.
-
B.
NaCl.
-
C.
HNO3.
-
D.
HCl.
Đáp án : A
Điều kiện để muối phản ứng được với dd axit hay muối khác là: sản phẩm tạo thành có chất kết tủa hoặc bay hơi ; hoặc axit tạo thành yếu hơn axit tham gia phản ứng.
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
Cho 1,84g hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít CO2 ở đktc và dung dịch X. Khối lượng muối trong dung dịch X là:
-
A.
1,17(g)
-
B.
3,17(g)
-
C.
2,17(g)
-
D.
4,17(g)
Đáp án : C
Gọi số mol của ACO3 và BCO3 lần lượt là x và y
Lập hệ phương trình với khối lượng hỗn hợp muối và số mol CO2 sẽ tìm ra được x, y. Từ đó tính được phần trăm mỗi muối.
nCO2 = VCO2 : 22,4 = 0,672 : 22,4 = 0,03 mol
Gọi số mol của ACO3 và BCO3 lần lượt là x và y
ACO3 + 2HCl→ ACl2 + H2O + CO2↑ (1)
x →2x → x → x
BCO3 + 2HCl→ BCl2 + H2O + CO2↑ (2)
y →2y → y → y
Từ pt dễ dàng thấy nH2O (1) + nH2O (2) = nCO2 (1) + n CO2 (2) = x + y = nCO2 = 0,03 mol
nHCl (1) + nHCl (2) = 2nCO2 (1) + 2n CO2 (2) = 2 (x + y) = 2nCO2 = 0,06 mol
Áp dụng định luật bảo toàn khối lượng ta có
m ACO3 + mBCO3 + mHCl = mACl2 + mBCl2 + mH2O + mCO2
=> mACl2 + mBCl2 = m ACO3 + mBCO3 + mHCl – (mH2O + mCO2)
= 1,84 + 0,06 . 36,5 – (0,03 . 18 + 0,03 . 44) = 2,17g
Cho dãy chuyển hóa sau: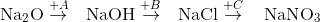 . Các chất A, B, C trong dãy trên lần lượt là:
. Các chất A, B, C trong dãy trên lần lượt là:
-
A.
H2O, HCl, KNO3
-
B.
H2O, HCl, HNO3
-
C.
H2O, HCl, AgNO3
-
D.
H2O, HCl, Ba(NO3)2
Đáp án : C
Cho dung dịch chứa 0,3 mol NaOH vào lượng dư dung dịch MgCl2, sau khi phản ứng hoàn toàn thu được a gam kết tủa. Giá trị của a là
-
A.
3,60.
-
B.
8,70.
-
C.
17,40.
-
D.
4,53.
Đáp án : B
Kết tủa thu được là Mg(OH)2.
Viết PTHH xảy ra, tính số mol Mg(OH)2 theo số mol NaOH.
PTHH: 2NaOH + MgCl2 → Mg(OH)2↓ + 2NaCl
Kết tủa thu được là Mg(OH)2
Theo PTHH: nMg(OH)2 = 1/2 nNaOH = 1/2 .0,3 = 0,15 (mol)
⟹ mMg(OH)2 = nMg(OH)2×MMg(OH)2 = 0,15×(24+17.2)= 8,7 (g)
Nhiệt phân một lượng MgCO3 sau một thời gian thu được chất rắn A và khí B. Hấp thụ hết khí B bằng dung dịch NaOH thu được dung dịch C. Dung dịch C vừa tác dụng được với BaCl2, vừa tác dụng với KOH. Hòa tan chất rắn A bằng dung dịch H2SO4 loãng dư thu được khí B và dung dịch D.
Xác định thành phần của D
-
A.
MgSO4, H2SO4 dư
-
B.
MgSO4
-
C.
H2SO4 dư
-
D.
NaHCO3 và Na2CO3
Đáp án : A
Nhiệt phân muối cacbonat thu được oxit kim loại + CO2
Cho CO2 hấp thụ vào dd NaOH có thể tạo muối trung hòa hoặc muối axit hoặc cả hai
Từ đó tìm được các chất thỏa mãn
A: MgCO3 và MgO
B: CO2
C: NaHCO3 và Na2CO3
D: MgSO4, H2SO4 dư
PTHH:
MgCO3 \(\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{}^{{t^0}}} \) MgO + CO2
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
2NaHCO3 + 2KOH → Na2CO3 +2H2O + K2CO3
MgCO3 + H2SO4 → MgSO4 + H2O + CO2↑
MgO + H2SO4 → MgSO4 + H2O
Cô cạn từ từ 200ml dung dịch CuSO4 0,2M thu được 10 gam tinh thể CuSO4.xH2O. Tìm x ?
-
A.
5
-
B.
4
-
C.
6
-
D.
3
Đáp án : A
200 ml = 0,2 (lít)
nCuSO4 = CM. V = 0,2. 0,2 = 0,04 (mol)
Vì cô cạn chỉ là quá trình làm bay hơi nước, khối lượng CuSO4 trước và sau khi cô cạn không thay đổi.
Số mol CuSO4 trước và sau cô cạn bằng nhau.
nCuSO4.xH2O = nCuSO4 = 0,04 (mol)
=> khối lượng phân tử của CuSO4.xH2O là: \({M_{CuSO4.xH2O}} = \frac{{10}}{{0,04}} = 250\,(g/mol)\)
Ta có: 160 + 18x = 250
=> x = ?
200 ml = 0,2 (lít)
nCuSO4 = CM. V = 0,2. 0,2 = 0,04 (mol)
Vì cô cạn chỉ là quá trình làm bay hơi nước, khối lượng CuSO4 trước và sau khi cô cạn không thay đổi.
Số mol CuSO4 trước và sau cô cạn bằng nhau.
nCuSO4.xH2O = nCuSO4 = 0,04 (mol)
=> khối lượng phân tử của CuSO4.xH2O là: \({M_{CuSO4.xH2O}} = \frac{{10}}{{0,04}} = 250\,(g/mol)\)
Ta có: 160 + 18x = 250
=> 18x = 90
=> x = 90: 18
=> x = 5
Cho từ từ đến hết 100 ml dung dịch FeCl2 0,5M vào 100 ml dung dịch AgNO3 1,2M. Sau phản ứng hoàn toàn được m gam kết tủa và dung dịch chứa các muối. Gía trị của m là?
-
A.
7,6 gam
-
B.
15,8 gam
-
C.
24,7 gam
-
D.
15,6 gam
Đáp án : B
Áp dụng định luật bảo toàn khối lượng để giải quyết bài toán.
FeCl2 + 3AgNO3 → 2AgCl↓ + Ag↓ + Fe(NO3)3
0,04 ←0,12 → 0,08 0,04 0,04
Vậy: m(kết tủa) = mAgCl + mAg = 143,5 . 0,08 + 108 . 0,04 → m = 15,8(g)
Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
-
A.
12 g
-
B.
4 g
-
C.
6 g
-
D.
8 g
Đáp án : D
Viết phương trình hóa học xảy ra, tính toán theo phương trình hóa học
Phương trình hóa học
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
0,1 0,2 0,1 (mol)
Cu(OH)2 → CuO + H2O
0,1 0,1 (mol)
m = mCuO = 0,1 . 80 = 8g
Hòa tan 25,9g hỗn hợp hai muối khan gồm NaCl và Na2SO4 vào nước thì thu được 200g dung dịch A. Cho dung dịch A vào dung dịch Ba(OH)2 20% vừa đủ, thấy xuất hiện 23,3g kết tủa, lọc bỏ kết tủa thu được dung dịch B. Tính khối lượng muối khan trong hỗn hợp ban đầu.
-
A.
25,9
-
B.
25
-
C.
29,5
-
D.
27
Đáp án : A
muối + bazo → muối mới + bazo mới ( điều kiện có chất kết tủa hoặc bay hơi). Tính toán theo phương trình hóa học
Khi cho hh muối khan gồm NaCl và Na2SO4 vào nước ta thu được dd A chứa chất tan là NaCl và Na2SO4.
Cho dd A tác dụng với dd Ba(OH)2 chỉ có dd Na2SO4 pư còn dd NaCl không phản ứng.
PTHH: Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH (1)
Ta có: Kết tủa thu được là BaSO4 có khối lượng 23,3 gam
\({n_{BaS{O_4}}} = \frac{{{m_{BaS{O_4}}}}}{{{M_{BaS{O_4}}}}} = \frac{{23,3}}{{137 + 32 + 16.4}} = 0,1\,(mol)\)
Theo PTHH (1): nNa2SO4 = nBaSO4 = 0,1 (mol)
→ mNa2SO4 = nNa2SO4×MNa2SO4 = 0,1×142 = 14,2 (g)
→ mNaCl = mhh – mNa2SO4 = 25,9 – 14,2 = 11,7 (g)
=> Khối lượng muối thu được sau phản ứng là: 14,2 + 11,7 = 25,9 gam.
Để hòa tan hết 5,1 g M2O3 phải dùng 43,8 g dung dịch HCl 25%. Phân tử khối của M2O3 là:
-
A.
160
-
B.
102
-
C.
103
-
D.
106
Đáp án : B
Viết PTHH xảy ra. Tính số mol M2O3 theo số mol HCl. Có số mol M2O3 và khối lượng sẽ tìm ra được phân tử khối của M2O3 theo công thức: M = m : n
\(\eqalign{
& {m_{HCl}} = {{{m_{ddHCl}}} \over {100\% }}.C\% = {{43,8} \over {100\% }}.25\% = 10,95\,(g) \cr
& \Rightarrow {n_{HCl}} = {{{m_{HCl}}} \over {{M_{HCl}}}} = {{10,95} \over {36,5}} = 0,3\,(mol) \cr} \)
PTHH: M2O3 + 6HCl → 2MCl3 + 3H2O
0,05 ← 0,3 (mol)
Theo PTHH: nM2O3 = 1/6. nHCl = 0,3/6 = 0,05 (mol)
\( \Rightarrow {M_{{M_2}O}}_{_3} = {{{m_{{M_2}O}}_{_3}} \over {{n_{{M_2}O}}_{_3}}} = {{5,1} \over {0,05}} = 102\,(g/mol)\)
Công thức hóa học của muối natri hidrosunfat là:
-
A.
NaCl.
-
B.
Na2SO4.
-
C.
NaHSO4.
-
D.
NaHSO3
Đáp án : C
Công thức hóa học của muối natri hidrosunfat là: NaHSO4
Cho Na2O vào dung dịch muối X, thu được kết tủa màu trắng. Muối X là chất nào sau đây?
-
A.
NaCl.
-
B.
FeCl3.
-
C.
CuCl2.
-
D.
MgCl2.
Đáp án : D
Khi cho Na2O vào nước có phản ứng sau: Na2O + H2O → NaOH
A. NaCl không phản ứng với NaOH
B. FeCl3 tác dụng với NaOH sinh ta kết tủa màu nâu đỏ: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
C. CuCl2 tác dụng với NaOH sinh ra kết tủa màu xanh lam: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
D. MgCl2 tác dụng với NaOH sinh ra kết tủa màu trắng: MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Muối nào sau đây không bị nhiệt phân hủy?
-
A.
CaCO3.
-
B.
Na2CO3.
-
C.
KNO3.
-
D.
KClO3.
Đáp án : B
Muối cacbonat của kim loại kiềm bền nên không bị nhiệt phân hủy.
Muối cacbonat của kim loại kiềm bền nên không bị nhiệt phân hủy. Do đó, Na2CO3 không bị nhiệt phân.
Dãy muối cacbonat bị nhiệt phân ở nhiệt độ cao
-
A.
Na2CO3, Ca(HCO3)2.
-
B.
K2CO3, KHCO3.
-
C.
CaCO3, Ca(HCO3)2.
-
D.
MgCO3, K2CO3.
Đáp án : C
Ghi nhớ: Na2CO3 và K2CO3 không bị nhiệt phân hủy
=> loại A, B, D => Chọn C
CaCO3 \(\xrightarrow{{{t^0}}}\) CaO + CO2↑
Ca(HCO3)2 \(\xrightarrow{{{t^0}}}\) CaCO3 + CO2 + H2O
Luyện tập và củng cố kiến thức Bài 10. Một số muối quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 11. Phân bón hóa học Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 8. Một số bazơ quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7. Tính chất hóa học của bazơ Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 4. Một số axit quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3. Tính chất hóa học của axit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập oxit axit tác dụng với dung dịch kiềm Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2. Một số oxit quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận