Trắc nghiệm Bài 8. Một số bazơ quan trọng - Hóa học 9
Đề bài
Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
-
A.
Na2CO3
-
B.
KCl
-
C.
NaOH
-
D.
NaNO3
Dung dịch có độ bazơ mạnh nhất trong các dung dịch có giá trị pH sau:
-
A.
pH = 8
-
B.
pH = 12
-
C.
pH = 10
-
D.
pH = 14
Nhóm các dung dịch có pH > 7 là:
-
A.
HCl, NaOH
-
B.
H2SO4, HNO3
-
C.
NaOH, Ca(OH)2
-
D.
BaCl2, NaNO3
Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
-
A.
Quỳ tím
-
B.
HCl
-
C.
NaCl
-
D.
H2SO4
NaOH có tính chất vật lý nào sau đây ?
-
A.
Natri hiđroxit là chất rắn không màu, ít tan trong nước.
-
B.
Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
-
C.
Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt.
-
D.
Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
-
A.
Ca(OH)2, Na2CO3
-
B.
Ca(OH)2, NaCl
-
C.
Ca(OH)2, NaNO3
-
D.
NaOH, KNO3
Nếu rót 200 ml dung dịch NaOH 1M vào ống nghiệm đựng 100 ml dung dịch H2SO4 1M thì dung dịch tạo thành sau phản ứng sẽ:
-
A.
Làm quỳ tím chuyển đỏ
-
B.
Làm quỳ tím chuyển xanh
-
C.
Làm dung dịch phenolphtalein không màu chuyển đỏ.
-
D.
Không làm thay đổi màu quỳ tím.
Dung dịch NaOH và dung dịch KOH không có tính chất nào sau đây?
-
A.
Làm đổi màu quỳ tím và phenophtalein
-
B.
Bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước
-
C.
Tác dụng với oxit axit tạo thành muối và nước
-
D.
Tác dụng với axit tạo thành muối và nước
Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là:
-
A.
K2O, Fe2O3.
-
B.
Al2O3, CuO.
-
C.
Na2O, K2O.
-
D.
ZnO, MgO.
Dãy các bazơ bị phân hủy ở nhiệt độ cao:
-
A.
Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3.
-
B.
Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2.
-
C.
Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
-
D.
Zn(OH)2, Ca(OH)2, KOH, NaOH.
Dung dịch NaOH phản ứng với tất cả các chất trong dãy:
-
A.
Fe(OH)3, BaCl2, CuO, HNO3
-
B.
H2SO4, SO2, CO2, FeCl2
-
C.
HNO3, HCl, CuSO4, KNO3
-
D.
Al, MgO, H3PO4, BaCl2
Dung dịch Ca(OH)2 phản ứng với tất cả các chất trong dãy chất nào sau đây?
-
A.
NaCl, HCl, Na2CO3, KOH
-
B.
H2SO4, NaCl, KNO3, CO2
-
C.
KNO3, HCl, KOH, H2SO4
-
D.
HCl, CO2, Na2CO3, H2SO4
Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
-
A.
Muối NaCl
-
B.
Nước vôi trong
-
C.
Dung dịch HCl
-
D.
Dung dịch NaNO3
Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
-
A.
Quỳ tím và dung dịch HCl
-
B.
Phenolphtalein và dung dịch BaCl2
-
C.
Quỳ tím và dung dịch K2CO3
-
D.
Quỳ tím và dung dịch NaCl
Thành phần phần trăm của Na và Ca trong hợp chất NaOH và Ca(OH)2 lần lượt là:
-
A.
50% và 54%
-
B.
52% và 56%
-
C.
54,1% và 57,5%
-
D.
57,5% và 54,1%
NaOH rắn có khả năng hút nước rất mạnh nên có thể dùng làm khô một số chất. NaOH dùng để làm khô khí ẩm nào sau đây?
-
A.
H2S.
-
B.
H2.
-
C.
CO2.
-
D.
SO2.
Cho 0,224 lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 2 lít dung dịch Ca(OH)2 , chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
-
A.
0,5M
-
B.
0,005M
-
C.
0,1M
-
D.
0,05M
Trung hòa 200 gam dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là
-
A.
200 gam
-
B.
300 gam
-
C.
400 gam
-
D.
500 gam
Dẫn từ từ 1,568 lít khí CO2 (đktc) vào một dung dịch có hòa tan 6,4 gam NaOH.
Khối lượng muối thu được sau phản ứng là
-
A.
5,88 gam.
-
B.
7,42 gam.
-
C.
8,48 gam.
-
D.
6,36 gam.
Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
-
A.
dư 0,112 lít CO2.
-
B.
dư 8 gam NaOH.
-
C.
dư 0,224 lít CO2.
-
D.
dư 0,8 gam NaOH.
Cho dãy các chất sau: Al, P2O5, Na2O, Fe3O4, ZnO, MgO, CuO, Al2O3, BaO, FeO. Trong các chất trên, số chất tan được trong nước là a; số chất tác dụng được với dung dịch H2SO4 loãng là b ; số chất vừa tan được trong dung dịch HCl, vừa tan được trong dung dịch NaOH là c. Giá trị 15a + 7b +8c bằng
-
A.
156.
-
B.
148.
-
C.
141.
-
D.
163
Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
-
A.
Quỳ tím và dung dịch HCl
-
B.
Phenolphtalein và dung dịch BaCl2
-
C.
Quỳ tím và dung dịch K2CO3
-
D.
Quỳ tím và dung dịch NaCl
Cho các chất dưới đây, dãy chất nào toàn là dung dịch kiềm?
-
A.
KOH, Mg(OH)2, Ba(OH)2, NaOH.
-
B.
KOH, Ca(OH)2, Ba(OH)2, NaOH.
-
C.
KOH, Mg(OH)2, Ba(OH)2, Fe(OH)2.
-
D.
Cu(OH)2, Mg(OH)2, Ba(OH)2, NaOH.
Nhỏ dd natri hidroxit vào ống nghiệm chứa dd đồng(II) clorua. Xuất hiện:
-
A.
Kết tủa nâu đỏ;
-
B.
Kết tủa trắng.
-
C.
Kết tủa xanh.
-
D.
Kết tủa nâu vàng.
Trong nước thải của nhà máy có một số chất có công thức: H2SO3, HCl, KCl, NaNO3, MgSO4. Người ta cho nước thải trên chảy vào bể chứa dung dịch nước vôi trong. Số chất có trong nước thải tác dụng với nước vôi trong là:
-
A.
5
-
B.
4
-
C.
3
-
D.
2
Để trung hòa V ml dung dịch NaOH nồng độ 1,0M cần 200 ml dung dịch H2SO4 nồng độ 1,5M. Giá trị của V là
-
A.
600.
-
B.
900
-
C.
300
-
D.
200
Biết 2,24 lít khí CO2 (đktc) tác dụng vừa hết với dung dịch Ba(OH)2 0,5M, sản phẩm là BaCO3 và H2O. Tính khối lượng kết tủa thu được.
-
A.
19,7g
-
B.
39,4 g
-
C.
0,197 g
-
D.
0,394g
Cho 200 ml dung dịch CuCl2 0,15M với dung dịch NaOH vừa đủ, sau phản ứng lọc kết tủa, nung đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
-
A.
1,2 gam
-
B.
2,4 gam
-
C.
4 gam
-
D.
8 gam
Dẫn từ từ 4,48 lít khí CO2 (đktc) tác dụng vào một dung dịch có hòa tan 28 g KOH, sản phẩm là muối K2CO3. Hãy xác định khối lượng muối thu được sau phản ứng.
-
A.
13,8 gam
-
B.
27,8 gam
-
C.
45,2 gam
-
D.
27,6g
Trộn 200ml dung dịch NaOH 1M với 300ml dung dịch NaOH 0,5M thì thu được dung dịch mới có nồng độ mol là?
-
A.
0,5M
-
B.
1,5M
-
C.
1M
-
D.
0,7M
Cho 200ml dung dịch NaOH 3M tác dụng với 100ml dung dịch FeCl3 1M thu được a gam kết tủa. Giá trị của a là :
-
A.
5,35g
-
B.
9,0g
-
C.
10,7g
-
D.
21,4g
Thêm 250 ml dung dịch NaOH 2M vào 200 ml dung dịch H3PO4 1,5M. Muối tạo thành và khối lượng tương ứng là:
-
A.
14,2 gam Na2HPO4; 32,8 gam Na3PO4
-
B.
28,4 gam Na2HPO4; 16,4 gam Na3PO4
-
C.
12,0 gam NaH2PO4; 28,4 gam Na2HPO4
-
D.
24,0 gam NaH2PO4; 14,2 gam Na2HPO4
Hòa tan 80 g NaOH vào nước thu được dung dịch có nồng độ 1M. Thể tích dung dịch NaOH là:
-
A.
1 lít
-
B.
2 lít
-
C.
1,5 lít
-
D.
3 lít
Dẫn 22,4 lít khí CO2 ( đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau:
-
A.
Muối natricacbonat và nước.
-
B.
Muối natri hidrocacbonat.
-
C.
Muối natricacbonat.
-
D.
Muối natrihiđrocacbonat và natricacbonat.
Hòa tan 30 g NaOH vào 170 g nước thì thu được dung dịch NaOH có nồng độ là:
-
A.
18%
-
B.
16 %
-
C.
15 %
-
D.
17 %
Cặp chất khi phản ứng với nhau tạo thành chất kết tủa trắng:
-
A.
Ca(OH)2 và Na2SO3
-
B.
NaOH và Na2SO3
-
C.
KOH và NaNO3.
-
D.
KOH và NaNO3.
Cặp chất đều làm đục nước vôi trong Ca(OH)2
-
A.
CO2 , Na2O
-
B.
CO2, SO2
-
C.
SO2, K2O
-
D.
SO2, BaO
Phương trình nào sau đây là sai?
-
A.
Fe(OH)3 \(\xrightarrow{{{t^0}}}\) Fe3O4 + H2O
-
B.
H2SO4 + 2NaOH→ Na2SO4 + 2H2O
-
C.
H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O
-
D.
NaOH + HCl → NaCl + H2O
Dung dịch Ca(OH)2 và dung dịch NaOH có những tính chất hóa học của bazơ tan vì:
-
A.
Làm đổi màu chất chỉ thị, tác dụng với oxit axit.
-
B.
Làm đổi màu chất chỉ thị, tác dụng với axit.
-
C.
Làm đổi màu chất chỉ thị, tác dụng với oxit axit và axit.
-
D.
Tác dụng với oxit axit và axit.
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
-
A.
Ca(OH)2, Na2CO3
-
B.
Ca(OH)2, NaCl
-
C.
Ca(OH)2, NaNO3
-
D.
NaOH, KNO3
Dãy các bazơ bị phân hủy ở nhiệt độ cao:
-
A.
Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3
-
B.
Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2.
-
C.
Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
-
D.
Zn(OH)2, Ca(OH)2, KOH, NaOH.
Lời giải và đáp án
Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
-
A.
Na2CO3
-
B.
KCl
-
C.
NaOH
-
D.
NaNO3
Đáp án : A
Thuốc thử để nhận biết dung dịch Ca(OH)2 là Na2CO3 vì Na2CO3 tạo kết tủa trắng với Ca(OH)2
Na2CO3 + Ca(OH)2 → CacO3 ↓ + 2NaOH
Dung dịch có độ bazơ mạnh nhất trong các dung dịch có giá trị pH sau:
-
A.
pH = 8
-
B.
pH = 12
-
C.
pH = 10
-
D.
pH = 14
Đáp án : D
pH > 7: dung dịch có tính bazơ, pH càng lớn độ bazơ càng lớn
=> pH = 14 có độ bazơ mạnh nhất
Nhóm các dung dịch có pH > 7 là:
-
A.
HCl, NaOH
-
B.
H2SO4, HNO3
-
C.
NaOH, Ca(OH)2
-
D.
BaCl2, NaNO3
Đáp án : C
Nhóm các dung dịch có pH > 7 là các dung dịch bazơ: NaOH, Ca(OH)2
Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
-
A.
Quỳ tím
-
B.
HCl
-
C.
NaCl
-
D.
H2SO4
Đáp án : D
Cần nắm được tính chất hóa học của NaOH và Ba(OH)2
Để phân biệt NaOH và Ba(OH)2 ta dùng dung dịch H2SO4
NaOH không có hiện tượng gì còn Ba(OH)2 tạo kết tủa màu trắng
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
NaOH có tính chất vật lý nào sau đây ?
-
A.
Natri hiđroxit là chất rắn không màu, ít tan trong nước.
-
B.
Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
-
C.
Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt.
-
D.
Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Đáp án : B
NaOH có tính chất vật lí là: NaOH là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
-
A.
Ca(OH)2, Na2CO3
-
B.
Ca(OH)2, NaCl
-
C.
Ca(OH)2, NaNO3
-
D.
NaOH, KNO3
Đáp án : A
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là: Ca(OH)2, Na2CO3 vì xảy ra phản ứng:
Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
Nếu rót 200 ml dung dịch NaOH 1M vào ống nghiệm đựng 100 ml dung dịch H2SO4 1M thì dung dịch tạo thành sau phản ứng sẽ:
-
A.
Làm quỳ tím chuyển đỏ
-
B.
Làm quỳ tím chuyển xanh
-
C.
Làm dung dịch phenolphtalein không màu chuyển đỏ.
-
D.
Không làm thay đổi màu quỳ tím.
Đáp án : D
Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{2}$ và $\frac{{{n_{{H_2}S{O_4}}}}}{1}$ => NaOH và H2SO4 phản ứng vừa đủ với nhau
+) dung dịch thu được có môi trường trung tính => không làm thay đổi màu quỳ tím.
${n_{NaOH}} = 0,2.1 = 0,2\,\,mol;\,\,{n_{{H_2}S{O_4}}} = 0,1.1 = 0,1\,\,mol$
Phương trình hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{2} = \frac{{0,2}}{2} = \frac{{{n_{{H_2}S{O_4}}}}}{1} = 0,1$ => NaOH và H2SO4 phản ứng vừa đủ với nhau
=> dung dịch thu được có môi trường trung tính => không làm thay đổi màu quỳ tím.
Dung dịch NaOH và dung dịch KOH không có tính chất nào sau đây?
-
A.
Làm đổi màu quỳ tím và phenophtalein
-
B.
Bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước
-
C.
Tác dụng với oxit axit tạo thành muối và nước
-
D.
Tác dụng với axit tạo thành muối và nước
Đáp án : B
Dung dịch NaOH và dung dịch KOH không có tính chất : bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước.
Vì NaOH và KOH đều là bazơ tan.
Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là:
-
A.
K2O, Fe2O3.
-
B.
Al2O3, CuO.
-
C.
Na2O, K2O.
-
D.
ZnO, MgO.
Đáp án : C
Xem lại tính chất hóa học của oxit bazơ tan trong nước
Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là: Na2O, K2O.
Dãy các bazơ bị phân hủy ở nhiệt độ cao:
-
A.
Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3.
-
B.
Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2.
-
C.
Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
-
D.
Zn(OH)2, Ca(OH)2, KOH, NaOH.
Đáp án : C
Xem lại tính chất hóa học của bazơ không tan bị nhiệt phân hủy
Dãy các bazơ bị phân hủy ở nhiệt độ cao là: Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2
Dung dịch NaOH phản ứng với tất cả các chất trong dãy:
-
A.
Fe(OH)3, BaCl2, CuO, HNO3
-
B.
H2SO4, SO2, CO2, FeCl2
-
C.
HNO3, HCl, CuSO4, KNO3
-
D.
Al, MgO, H3PO4, BaCl2
Đáp án : B
Dung dịch NaOH phản ứng với : H2SO4, SO2, CO2, FeCl2
Phương trình hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
2NaOH + SO2 → Na2SO3 + H2O
2NaOH + CO2 → Na2CO3 + H2O
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Loại A vì CuO không phản ứng
Loại C vì KNO3 không phản ứng
Loại D vì MgO không phản ứng
Dung dịch Ca(OH)2 phản ứng với tất cả các chất trong dãy chất nào sau đây?
-
A.
NaCl, HCl, Na2CO3, KOH
-
B.
H2SO4, NaCl, KNO3, CO2
-
C.
KNO3, HCl, KOH, H2SO4
-
D.
HCl, CO2, Na2CO3, H2SO4
Đáp án : D
Dung dịch Ca(OH)2 phản ứng được với : HCl, CO2, Na2CO3, H2SO4
Phương trình phản ứng:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
-
A.
Muối NaCl
-
B.
Nước vôi trong
-
C.
Dung dịch HCl
-
D.
Dung dịch NaNO3
Đáp án : B
Dùng dung dịch nước vôi trong (Ca(OH)2) để loại bỏ các khí trên vì đều xảy ra phản ứng
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2S → CaS + 2H2O
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
-
A.
Quỳ tím và dung dịch HCl
-
B.
Phenolphtalein và dung dịch BaCl2
-
C.
Quỳ tím và dung dịch K2CO3
-
D.
Quỳ tím và dung dịch NaCl
Đáp án : C
Cần nắm được tính chất hóa học của NaOH và Ba(OH)2
- Dùng quỳ tím: Dung dịch NaOH và Ba(OH)2 làm quỳ chuyển xanh, NaCl không làm đổi màu quỳ => nhận biết được NaCl
- Dùng dung dịch K2CO3 : dung dịch NaOH không hiện tượng, dung dịch Ba(OH)2 tạo kết tủa trắng
Ba(OH)2 + K2CO3 → BaCO3 + 2KOH
Thành phần phần trăm của Na và Ca trong hợp chất NaOH và Ca(OH)2 lần lượt là:
-
A.
50% và 54%
-
B.
52% và 56%
-
C.
54,1% và 57,5%
-
D.
57,5% và 54,1%
Đáp án : D
Công thức tính phần trăm khối lượng của nguyên tố trong hợp chất:
$\% {m_R} = \frac{{n.{M_R}}}{{{M_{hop\,\,chat}}}}.100\% $ với n là số nguyên tử R có trong 1 phân tử hợp chất đó
Công thức tính phần trăm khối lượng của nguyên tố trong hợp chất:
$\% {m_R} = \frac{{n.{M_R}}}{{{M_{hop\,\,chat}}}}.100\% $ với n là số nguyên tử R có trong 1 phân tử hợp chất đó
Ta có: $\% {m_{Na}} = \frac{{{M_{Na}}}}{{{M_{NaOH}}}}.100\% = \frac{{23}}{{40}}.100\% = 57,5\% $
$\% {m_{Ca}} = \frac{{{M_{Ca}}}}{{{M_{Ca{{(OH)}_2}}}}}.100\% = \frac{{40}}{{74}}.100\% = 54,1\% $
NaOH rắn có khả năng hút nước rất mạnh nên có thể dùng làm khô một số chất. NaOH dùng để làm khô khí ẩm nào sau đây?
-
A.
H2S.
-
B.
H2.
-
C.
CO2.
-
D.
SO2.
Đáp án : B
NaOH dùng để làm khô chất không có khả năng phản ứng với nó
NaOH dùng để làm khô chất không có khả năng phản ứng với nó => H2 không phản ứng được với NaOH
Cho 0,224 lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 2 lít dung dịch Ca(OH)2 , chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
-
A.
0,5M
-
B.
0,005M
-
C.
0,1M
-
D.
0,05M
Đáp án : B
$ + ){n_{Ca{{(OH)}_2}}} = {n_{C{O_2}}}$
$ + ){C_{M\,\,Ca{{(OH)}_2}}} = \frac{n}{V}$
Phương trình phản ứng: CO2 + Ca(OH)2 → CaCO3 + H2O
Từ phương trình $ = > {n_{Ca{{(OH)}_2}}} = {n_{C{O_2}}} = 0,01\,\,mol$
$ = > {C_{M\,\,Ca{{(OH)}_2}}} = \frac{{0,01}}{2} = 0,005M$
Trung hòa 200 gam dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là
-
A.
200 gam
-
B.
300 gam
-
C.
400 gam
-
D.
500 gam
Đáp án : D
NaOH + HCl → NaCl + H2O
0,5 → 0,5 mol
+) tính mHCl $ = > {m_{dd\,\,HCl}}$
${m_{NaOH}} = \frac{{200.10\% }}{{100\% }} = 20\,\,gam\,\, = > \,\,{n_{NaOH}} = 0,5\,\,mol$
NaOH + HCl → NaCl + H2O
0,5 → 0,5 mol
=> mHCl = 0,5.36,5 = 18,25 gam $ = > {m_{dd\,\,HCl}} = \frac{{18,25.100\% }}{{3,65\% }} = 500\,\,gam$
Dẫn từ từ 1,568 lít khí CO2 (đktc) vào một dung dịch có hòa tan 6,4 gam NaOH.
Khối lượng muối thu được sau phản ứng là
-
A.
5,88 gam.
-
B.
7,42 gam.
-
C.
8,48 gam.
-
D.
6,36 gam.
Đáp án: B
Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}} > 2$ => muối sau phản ứng là Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
+) ${n_{N{a_2}}}_{C{O_3}}\, = > {m_{N{a_2}C{O_3}}}$
Khối lượng muối thu được: Trước tiên ta phải xem muối nào được tạo thành (NaHCO3 hay Na2CO3).
${n_{CO2}} = \frac{{1,568}}{{22,4}} = 0,07{\text{ }}mol;\,\,{n_{NaOH}} = \frac{{6,4}}{{40}} = 0,16{\text{ }}mol$
Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}} > 2$ => muối sau phản ứng là Na2CO3
Phương trình hóa học của phản ứng: 2NaOH + CO2 → Na2CO3 + H2O
${n_{N{a_2}}}_{C{O_3}} = 0,07{\text{ }}mol\,\, = > {m_{N{a_2}C{O_3}}} = 0,07.106 = 7,42\,\,gam$
Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
-
A.
dư 0,112 lít CO2.
-
B.
dư 8 gam NaOH.
-
C.
dư 0,224 lít CO2.
-
D.
dư 0,8 gam NaOH.
Đáp án: D
Khối lượng chất dư sau phản ứng: mNaOH = 40.(0,16 – 0,14)
Khối lượng chất dư sau phản ứng: mNaOH = 40.(0,16 – 0,14) = 0,8 gam
Cho dãy các chất sau: Al, P2O5, Na2O, Fe3O4, ZnO, MgO, CuO, Al2O3, BaO, FeO. Trong các chất trên, số chất tan được trong nước là a; số chất tác dụng được với dung dịch H2SO4 loãng là b ; số chất vừa tan được trong dung dịch HCl, vừa tan được trong dung dịch NaOH là c. Giá trị 15a + 7b +8c bằng
-
A.
156.
-
B.
148.
-
C.
141.
-
D.
163
Đáp án : A
Dựa vào tính chất hóa học của Al và oxit để xác định
+ chất tan được trong nước: oxit axit và oxit bazơ của các kim loại tan trong trong nước
+ dung dịch H2SO4 loãng: Al và các oxit bazơ
+ tan trong dung dịch HCl và NaOH: Al, oxit lưỡng tính, một số oxit axit và các oxit bazơ của kim loại tan trong nước.
Các chất tan được trong nước là: P2O5, Na2O, BaO \( \to\) a = 3
Các chất tan được trong dd H2SO4 loãng là: Al, Na2O, Fe3O4, ZnO, MgO, CuO, Al2O3, BaO, FeO \( \to\) b =9
Các chất vừa tan trong dung dịch HCl, vừa tan được trong dd NaOH là: Al, P2O5, Na2O, ZnO, Al2O3, BaO \( \to\) c = 6
Vậy giá trị 15a + 7b + 8c = 15.3 + 7.9 + 8.6 = 156 \( \to\) chọn A
Các phương trình hóa học minh họa
P2O5 + 3H2O → 2H3PO4
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
2Al + 6HCl → 2AlCl3 + 3H2↑
Na2O + 2HCl → 2NaCl + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
BaO + 2HCl → BaCl2 + H2O
FeO + 2HCl → FeCl2 + H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
ZnO + 2NaOH → Na2ZnO2 + H2O
Al2O3 + NaOH → 2NaAlO2 + 3H2O
Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
-
A.
Quỳ tím và dung dịch HCl
-
B.
Phenolphtalein và dung dịch BaCl2
-
C.
Quỳ tím và dung dịch K2CO3
-
D.
Quỳ tím và dung dịch NaCl
Đáp án : C
Cần nắm được tính chất hóa học của NaOH và Ba(OH)2
- Dùng quỳ tím: Dung dịch NaOH và Ba(OH)2 làm quỳ chuyển xanh, NaCl không làm đổi màu quỳ ⟹ nhận biết được NaCl
- Dùng dung dịch K2CO3: dung dịch NaOH không hiện tượng, dung dịch Ba(OH)2 tạo kết tủa trắng
PTHH: Ba(OH)2 + K2CO3 → BaCO3 + 2KOH
Cho các chất dưới đây, dãy chất nào toàn là dung dịch kiềm?
-
A.
KOH, Mg(OH)2, Ba(OH)2, NaOH.
-
B.
KOH, Ca(OH)2, Ba(OH)2, NaOH.
-
C.
KOH, Mg(OH)2, Ba(OH)2, Fe(OH)2.
-
D.
Cu(OH)2, Mg(OH)2, Ba(OH)2, NaOH.
Đáp án : B
Dd kiềm là các bazo tan trong nước bao gồm các bazo của kim loại kiềm và kiềm thổ
A. Loại Mg(OH)2 là bazo không tan
B. Thỏa mãn
C. Loại Fe(OH)2 là bazo không tan.
D. Loại Cu(OH)2, Mg(OH)2 là bazo không tan
Nhỏ dd natri hidroxit vào ống nghiệm chứa dd đồng(II) clorua. Xuất hiện:
-
A.
Kết tủa nâu đỏ;
-
B.
Kết tủa trắng.
-
C.
Kết tủa xanh.
-
D.
Kết tủa nâu vàng.
Đáp án : C
Hiện tượng: xuất hiện kết tủa xanh của Cu(OH)2
PTHH: 2NaOH + CuCl2 → 2NaCl + Cu(OH)2↓
Trong nước thải của nhà máy có một số chất có công thức: H2SO3, HCl, KCl, NaNO3, MgSO4. Người ta cho nước thải trên chảy vào bể chứa dung dịch nước vôi trong. Số chất có trong nước thải tác dụng với nước vôi trong là:
-
A.
5
-
B.
4
-
C.
3
-
D.
2
Đáp án : C
Chất có trong nước thải tác dụng với nước vôi trong là H2SO3, HCl, MgSO4
Để trung hòa V ml dung dịch NaOH nồng độ 1,0M cần 200 ml dung dịch H2SO4 nồng độ 1,5M. Giá trị của V là
-
A.
600.
-
B.
900
-
C.
300
-
D.
200
Đáp án : A
Bước 1: Đổi số mol H2SO4 theo công thức: nH2SO4 = VH2SO4 × CM H2SO4
Bước 2: Viết PTHH xảy ra, tính số mol NaOH theo số mol H2SO4
Bước 3: Tính VNaOH = nNaOH : CM NaOH = ?
200 ml = 0,2 (lít) ⟹ nH2SO4 = VH2SO4 × CM H2SO4 = 0,2 × 1,5 = 0,3 (mol)
PTHH: 2NaOH + H2SO4 → Na2SO4 + 2H2O
Theo PTHH: nNaOH = 2nH2SO4 = 2.0,3 = 0,6 (mol)
⟹ VNaOH = nNaOH : CM NaOH = 0,6 : 1,0 = 0,6 (lít) = 600 (ml)
⟹ V = 600 ml
Biết 2,24 lít khí CO2 (đktc) tác dụng vừa hết với dung dịch Ba(OH)2 0,5M, sản phẩm là BaCO3 và H2O. Tính khối lượng kết tủa thu được.
-
A.
19,7g
-
B.
39,4 g
-
C.
0,197 g
-
D.
0,394g
Đáp án : A
Đổi số mol CO2, dựa vào PTHH tính toán BaCO3 theo CO2
\({n_{C{O_2}}}_{(dktc)} = \frac{{2,24}}{{22,4}} = 0,1\,(mol)\)
PTHH: CO2 + Ba(OH)2 → BaCO3↓ + H2O
Theo PTHH: nBaCO3 = nCO2 = 0,1 (mol)
Khối lượng kết tủa:
mBaCO3 = nBaCO3×MBaCO3 = 0,1×197 = 19,7 (mol)
Cho 200 ml dung dịch CuCl2 0,15M với dung dịch NaOH vừa đủ, sau phản ứng lọc kết tủa, nung đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
-
A.
1,2 gam
-
B.
2,4 gam
-
C.
4 gam
-
D.
8 gam
Đáp án : B
PTHH : CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Cu(OH)2 → CuO + H2O
nCuCl2 =0,2.0,15 =0,03 mol → nCu(OH)2 = 0,03 mol
→ nCuO =0,03 mol→ m=2,4 g
Dẫn từ từ 4,48 lít khí CO2 (đktc) tác dụng vào một dung dịch có hòa tan 28 g KOH, sản phẩm là muối K2CO3. Hãy xác định khối lượng muối thu được sau phản ứng.
-
A.
13,8 gam
-
B.
27,8 gam
-
C.
45,2 gam
-
D.
27,6g
Đáp án : D
PTHH xảy ra: CO2 + 2KOH → K2CO3 + H2O
Dựa vào phương trình hóa học. Tính số mol K2CO3 theo số mol chất phản ứng hết.
({n_{CO2}} = {{4,48} \over {22,4}} = 0,2mol\)
\({n_{KOH}} = {{28} \over {56}} = 0,5mol \Rightarrow {n_{KOH}} > 2{n_{CO2}}\)
=> CO2 phản ứng hết. KOH dư. Mọi tính toán theo CO2
CO2 + 2KOH → K2CO3 + H2O
Bđ 0,2 0,5 (mol)
Pư 0,2 0,4 0,2 (mol)
Sau - 0,1 0,2 (mol)
mK2CO3 =0,2 . 138 = 27,6(gam)
Trộn 200ml dung dịch NaOH 1M với 300ml dung dịch NaOH 0,5M thì thu được dung dịch mới có nồng độ mol là?
-
A.
0,5M
-
B.
1,5M
-
C.
1M
-
D.
0,7M
Đáp án : D
Công thức nồng độ mol: CM NaOH = nNaOH : VNaOH
Tống số mol NaOH có trong cả 2 dung dịch là
nNaOH = 0,2.1+ 0,3.0,5= 0,35 mol
Nồng độ mol của dung dịch thu được là
\({C_M}NaOH = \frac{{0,35}}{{0,5}} = 0,7\,(M)\)
Cho 200ml dung dịch NaOH 3M tác dụng với 100ml dung dịch FeCl3 1M thu được a gam kết tủa. Giá trị của a là :
-
A.
5,35g
-
B.
9,0g
-
C.
10,7g
-
D.
21,4g
Đáp án : C
Đổi số mol NaOH; FeCl3
Viết PTHH xảy ra: 3NaOH + FeCl3 → 3NaCl + Fe(OH)3
Dựa vào PTHH so sánh NaOH và FeCl3 chất nào phản ứng hết, chất nào dư. Mọi tính toán theo số mol của chất phản ứng hết.
Số mol của NaOH là 0,2.3=0,6 mol
số mol của FeCl3 là 0,1.1=0,1mol
Ta có PTHH : 3NaOH + FeCl3 → 3NaCl + Fe(OH)3
Trước PƯ 0,6 mol 0,1 mol
PƯ 0,3 mol 0,1 mol
Sau PƯ 0,3 mol 0 0,1 mol
Kết tủa là 0,1 mol Fe(OH)3 => a= 0,1.107=10,7(g)
Thêm 250 ml dung dịch NaOH 2M vào 200 ml dung dịch H3PO4 1,5M. Muối tạo thành và khối lượng tương ứng là:
-
A.
14,2 gam Na2HPO4; 32,8 gam Na3PO4
-
B.
28,4 gam Na2HPO4; 16,4 gam Na3PO4
-
C.
12,0 gam NaH2PO4; 28,4 gam Na2HPO4
-
D.
24,0 gam NaH2PO4; 14,2 gam Na2HPO4
Đáp án : C
Lập tỉ lệ \(k = \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\)
PTHH có thể xảy ra:
NaOH + H3PO4 → NaH2PO4 + H2O (1)
2NaOH + H3PO4 → Na2HPO4 + 2H2O (2)
3NaOH + H3PO4 → Na3PO4 + 3H2O (3)
Nếu k ≤ 1 chỉ xảy ra (1)
Nếu 1 < k < 2 xảy ra cả (1); (2)
Nếu 2 < k < 3 xảy ra của (2); (3)
Nếu k ≥ 3 xảy ra (3)
Nếu k = 2 thì chỉ xảy ra (2)
Sau khi xác định được phản ứng xảy ra theo phương trình nào thì dựa vào phương trình đó để giải bài toán.
nNaOH = VNaOH. CM = 0,25 . 2 = 0,5 (mol)
nH3PO4 = VH3PO4. CM = 0,2 . 1,5 = 0,3 (mol)
Xét tỉ lệ:
\(1 < \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,5}}{{0,3}} \approx 1,67 < 2\)
→ Phản ứng tạo 2 muối NaHPO4 và Na2HPO4
Đặt số mol NaH2PO4 = a (mol) ; số mol Na2HPO4 = b (mol)
PTHH: NaOH + H3PO4 → NaH2PO4 + H2O (1)
(mol) a ← a ← a
2NaOH + H3PO4 → Na2HPO4 + 2H2O (2)
(mol) 2b ← b ← b
Theo PTHH (1): nNaOH(1) = nH3PO4(1) = nNaH2PO4 = a (mol)
Theo PTHH (2): nNaOH(2) = 2nNa2HPO4 = 2b (mol)
nH3PO4(2) = nNa2HO4 = b (mol)
Ta có hệ phương trình: \(\left\{ \begin{array}{l}\sum {{n_{NaOH(1) + (2)}} = a + 2b = 0,5} \\\sum {{n_{{H_3}P{O_4}(1) + (2)}} = a + b = 0,3} \end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,1\\b = 0,2\end{array} \right.\)
Suy ra \(\left\{ \begin{array}{l}{n_{Na{H_2}P{O_4}}} = 0,1\\{n_{N{a_2}HP{O_4}}} = 0,2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_{Na{H_2}P{O_4}}} = {n_{Na{H_2}P{O_4}}} \times {M_{Na{H_2}P{O_4}}}\\{m_{N{a_2}HP{O_4}}} = {n_{N{a_2}HP{O_4}}} \times {M_{N{a_2}HP{O_4}}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_{Na{H_2}P{O_4}}} = 0,1.120 = 12\,\,\,\,\,\,\,(g)\\{m_{N{a_2}HP{O_4}}} = 0,2.142 = 28,4\,(g)\end{array} \right.\)
Hòa tan 80 g NaOH vào nước thu được dung dịch có nồng độ 1M. Thể tích dung dịch NaOH là:
-
A.
1 lít
-
B.
2 lít
-
C.
1,5 lít
-
D.
3 lít
Đáp án : B
Ghi nhớ công thức tính nồng độ mol:\({C_M} = \frac{{{n_{NaOH}}}}{V} \to V = ?\)
nNaOH = mNaOH : MNaOH = 80 : (23 + 16 + 1) = 2 mol
VNaOH = nNaOH : CM NaOH = 2 : 1 = 2 lít
Dẫn 22,4 lít khí CO2 ( đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau:
-
A.
Muối natricacbonat và nước.
-
B.
Muối natri hidrocacbonat.
-
C.
Muối natricacbonat.
-
D.
Muối natrihiđrocacbonat và natricacbonat.
Đáp án : B
Lập tỉ lệ: \(k = \frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}}\)
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Nếu k ≤ 1 thì xảy ra phương trình (1)
Nếu 1 < k < 2 thì xảy ra cả phương trình (1) và (2)
Nếu k ≥ 2 chỉ xảy ra phản ứng (2)
m chất tan NaOH = (m dd . C%):100% = 200 . 20%:100% = 40g
=> nNaOH = m NaOH : MNaOH = 40 : (23 + 16 + 1) = 1 mol
nCO2 = VCO2 : 22,4 = 22,4 : 22,4 = 1 mol
Ta có: n NaOH : n CO2 = 1 : 1 = 1
=> Phản ứng tạo muối axit: CO2 + NaOH → NaHCO3
Hòa tan 30 g NaOH vào 170 g nước thì thu được dung dịch NaOH có nồng độ là:
-
A.
18%
-
B.
16 %
-
C.
15 %
-
D.
17 %
Đáp án : C
Ghi nhớ công thức tính nồng độ phần trăm: \(C\% = \frac{{mc\tan }}{{m\,dd}}.100\% \)
mdd = m nước + mNaOH = 170 + 30 = 200g
![]()
Cặp chất khi phản ứng với nhau tạo thành chất kết tủa trắng:
-
A.
Ca(OH)2 và Na2SO3
-
B.
NaOH và Na2SO3
-
C.
KOH và NaNO3.
-
D.
KOH và NaNO3.
Đáp án : A
Chọn cặp chất có tác dụng với nhau sinh ra sản phẩm muối kết tủa trắng.
A. Thỏa mãn vì phản ứng được với nhau sinh ra kết tủa trắng.
PTHH: Ca(OH)2 + Na2SO3 → CaSO3↓ + 2NaOH
B,C,D loại vì không xảy ra phản ứng
Cặp chất đều làm đục nước vôi trong Ca(OH)2
-
A.
CO2 , Na2O
-
B.
CO2, SO2
-
C.
SO2, K2O
-
D.
SO2, BaO
Đáp án : B
Dựa vào tính chất hóa học của dd Ca(OH)2
CO2 và SO2 làm đục dung dịch Ca(OH)2 do sinh ra CaCO3, CaSO3 kết tủa.
PTHH: Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3↓ + H2O
Phương trình nào sau đây là sai?
-
A.
Fe(OH)3 \(\xrightarrow{{{t^0}}}\) Fe3O4 + H2O
-
B.
H2SO4 + 2NaOH→ Na2SO4 + 2H2O
-
C.
H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O
-
D.
NaOH + HCl → NaCl + H2O
Đáp án : A
Dựa vào tính chất hóa học của bazơ tan và không tan.
A. Sai, sửa: 2Fe(OH)3 \(\xrightarrow{{{t^0}}}\) Fe2O3 + 3H2O
B,C,D đúng
Dung dịch Ca(OH)2 và dung dịch NaOH có những tính chất hóa học của bazơ tan vì:
-
A.
Làm đổi màu chất chỉ thị, tác dụng với oxit axit.
-
B.
Làm đổi màu chất chỉ thị, tác dụng với axit.
-
C.
Làm đổi màu chất chỉ thị, tác dụng với oxit axit và axit.
-
D.
Tác dụng với oxit axit và axit.
Đáp án : C
Dựa vào tính chất hóa học của bazơ tan.
Dung dịch Ca(OH)2 và dung dịch NaOH có những tính chất hóa học của bazơ tan vì: làm đổi màu chất chỉ thị, tác dụng với oxit axit và axit.
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
-
A.
Ca(OH)2, Na2CO3
-
B.
Ca(OH)2, NaCl
-
C.
Ca(OH)2, NaNO3
-
D.
NaOH, KNO3
Đáp án : A
Cặp chất có tác dụng với nhau sinh ra chất mới thì không thể cùng tồn tại được với nhau trong một dung dịch.
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là: Ca(OH)2, Na2CO3 vì xảy ra phản ứng:
Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
Dãy các bazơ bị phân hủy ở nhiệt độ cao:
-
A.
Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3
-
B.
Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2.
-
C.
Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
-
D.
Zn(OH)2, Ca(OH)2, KOH, NaOH.
Đáp án : C
Xem lại tính chất hóa học của bazơ không tan bị nhiệt phân hủy.
A,B Loại Ca(OH)2 và NaOH là bazơ tan nên không bị nhiệt phân hủy.
C. Thỏa mãn vì tất cả đều là ba zơ không tan nên bị nhiệt phân hủy.
PTHH: Cu(OH)2 \(\xrightarrow{{{t^0}}}\) CuO + H2O
Mg(OH)2 \(\xrightarrow{{{t^0}}}\) MgO + H2O
2Fe(OH)3 \(\xrightarrow{{{t^0}}}\) Fe2O3 + 3H2O
Zn(OH)2 \(\xrightarrow{{{t^0}}}\) ZnO + H2O
D. Loại Ca(OH)2, KOH, NaOH là bazơ tan nên không bị nhiệt phân hủy.
Luyện tập và củng cố kiến thức Bài 9. Tính chất hóa học của muối Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Một số muối quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 11. Phân bón hóa học Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7. Tính chất hóa học của bazơ Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 4. Một số axit quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3. Tính chất hóa học của axit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập oxit axit tác dụng với dung dịch kiềm Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2. Một số oxit quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết




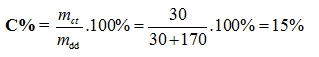






Danh sách bình luận