Trắc nghiệm Bài 10. Một số muối quan trọng - Hóa học 9
Đề bài
Trong tự nhiên muối natri clorua có nhiều trong:
-
A.
Nước biển.
-
B.
Nước mưa.
-
C.
Nước sông.
-
D.
Nước giếng.
Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
Không được phép có trong nước ăn vì tính độc hại của nó?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Nung kali nitrat (KNO3) ở nhiệt độ cao, ta thu được chất khí là:
-
A.
NO
-
B.
N2O
-
C.
N2O5
-
D.
O2
Muối kali nitrat (KNO3):
-
A.
không tan trong trong nước.
-
B.
tan rất ít trong nước.
-
C.
tan nhiều trong nước.
-
D.
không bị phân huỷ ở nhiệt độ cao.
Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
-
A.
Dung dịch AgNO3.
-
B.
Dung dịch HCl.
-
C.
Dung dịch BaCl2.
-
D.
Dung dịch Pb(NO3)2.
Trộn những cặp chất nào sau đây ta thu được NaCl ?
-
A.
dung dịch Na2CO3 và dung dịch BaCl2
-
B.
dung dịch NaNO3 và CaCl2
-
C.
dung dịch KCl và dung dịch NaNO3
-
D.
dung dịch Na2SO4 và dung dịch KCl
Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai cặp dung dịch các chất đã dùng ban đầu là
-
A.
BaCl2 và NaOH.
-
B.
MgCl2 và NaOH.
-
C.
Na2SO4 và HCl.
-
D.
NaNO3 và KCl.
Điện phân dung dịch NaCl bão hoà, có màng ngăn giữa hai điện cực, sản phẩm thu được là:
-
A.
NaOH, H2, Cl2
-
B.
NaCl, NaClO, H2, Cl2
-
C.
NaCl, NaClO, Cl2
-
D.
NaClO, H2 và Cl2
Trường hợp nào tạo ra chất kết tủa khi trộn hai dung dịch sau ?
-
A.
NaCl và AgNO3
-
B.
NaCl và Ba(NO3)2
-
C.
KNO3 và BaCl2
-
D.
CaCl2 và NaNO3
Cho phương trình phản ứng: Na2CO3 + 2HCl → 2NaCl + X + H2O. X là:
-
A.
CO
-
B.
CO2
-
C.
H2
-
D.
Cl2
Hoà tan 50 gam muối ăn vào 200 gam nước thu được dung dịch có nồng độ là:
-
A.
15%
-
B.
20%
-
C.
18%
-
D.
25%
Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là:
-
A.
90 gam.
-
B.
94,12 gam.
-
C.
100 gam.
-
D.
141,18 gam.
Hoà tan 10,95 gam KNO3 vào 150 gam nước thì được dung dịch bão hoà ở 200C, độ tan của KNO3 ở nhiệt độ này là
-
A.
6,3 gam.
-
B.
7,0 gam
-
C.
7,3 gam
-
D.
7,5 gam
Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
-
A.
143,5 gam
-
B.
14,35 gam
-
C.
157,85 gam
-
D.
15,785 gam
Trong phòng thí nghiệm, người ta thường dùng muối KNO3 để điều chế khí oxi bằng phản ứng phân hủy. Để điều chế 1,12 lít khí O2 (đktc) thì khối lượng muối cần dùng là
-
A.
20,2 gam.
-
B.
10,1 gam.
-
C.
5,05 gam.
-
D.
7,07 gam
Có thể phân biệt BaCl2 và NaCl bằng dung dịch:
-
A.
H2SO4.
-
B.
KOH.
-
C.
NaOH.
-
D.
KNO3.
Có những muối sau: NaCl, Pb(NO3)2, KNO3, CaCO3. Muối nào trong các muối trên dùng làm thuốc nổ đen
-
A.
NaCl.
-
B.
KNO3
-
C.
Pb(NO3)2
-
D.
CaCO3
Dung dịch muối NaHSO4 phản ứng được với tất cả các chất nào trong dãy sau:
-
A.
Na2O, NaOH, Fe, Ca(HCO3)2.
-
B.
Na2O, NaOH, Cu, Ca(HCO3)2.
-
C.
Na2O, NaCl, Fe, Ca(HCO3)2.
-
D.
Na2O, NaCl, Cu, Ca(HCO3)2.
Có 2 dung dịch muối mất nhãn là dung dịch NaCl và KNO3. Thuốc thử để nhận biết hai dung dịch trên là
-
A.
quỳ tím
-
B.
dd phenolphtalein
-
C.
dd HCl.
-
D.
dd AgNO3.
Muối nào sau đây dễ bị nhiệt phân hủy sinh ra khí CO2
-
A.
NaCl.
-
B.
Ca(HCO3)2.
-
C.
NaHSO4.
-
D.
KNO3.
Dung dịch NaOH có thể dùng để phân biệt cặp muối nào sau đây
-
A.
NaCl và BaCl2.
-
B.
NaHSO4 và Ba(HCO3)2.
-
C.
NaCl và Na2SO4
-
D.
NaCl và NaNO3.
Cặp chất nào sau đây phản ứng với nhau thu được sản phẩm là NaCl
-
A.
NaNO3 và HCl
-
B.
NaOH và HCl
-
C.
Na2SO4 và HCl
-
D.
NaHSO4 và HCl
Điện phân nóng chảy NaCl thu được sản phẩm gồm:
-
A.
NaOH và Cl2.
-
B.
Na, H2 và Cl2.
-
C.
Na và Cl2.
-
D.
Na và H2.
Dung dịch muối nào sau đây làm quỳ tím chuyển sang màu đỏ
-
A.
NaCl.
-
B.
NaHSO4.
-
C.
Ca(HCO3)2.
-
D.
KNO3.
Cho dung dịch Na2SO4 vào dung dịch BaCl2 thấy
-
A.
dung dịch chuyển đỏ.
-
B.
có kết tủa trắng.
-
C.
không có hiện tượng.
-
D.
có bọt khí thoát ra.
Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
-
A.
Xuất hiện kết tủa hồng.
-
B.
Xuất hiện kết tủa trắng.
-
C.
Xuất hiện kết tủa xanh lam.
-
D.
Xuất hiện kết tủa nâu đỏ.
Dãy hợp chất nào sau đây gồm các muối?
-
A.
Mg(HCO3)2, Ba(OH)2, CuSO4, HCl.
-
B.
Mg(HCO3)2, NH4NO3, CuSO4, Fe(NO3)2
-
C.
H2SO4, Na2CO3, NaOH, CaSO4.
-
D.
CaO, Ba(OH)2, MgSO4, BaSO4
CaCO3 có thể tham gia phản ứng với
-
A.
HCl.
-
B.
NaOH.
-
C.
KNO3.
-
D.
Mg.
Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất có công thức
-
A.
CaCO3
-
B.
HCl
-
C.
Mg(OH)2
-
D.
CuO
Để phân biệt các chất đựng trong lọ riêng biệt sau: NaNO3, Cu(NO3)2, Fe(NO3)3, Ba(NO3)2 người ta cần sử dụng hóa chất nào?
-
A.
NaOH, H2SO4
-
B.
NaCl, HCl
-
C.
Ca(OH)2
-
D.
BaCl2
Dung dịch muối FeCl2 tác dụng được với tất cả các chất nào trong dãy chất sau:
-
A.
Mg;NaOH; H2SO4; AgNO3
-
B.
Mg; NaOH; Mg(OH)2; AgNO3
-
C.
Mg; KOH; NaOH; NaNO3
-
D.
Mg; KOH; NaOH; AgNO3
Nung sắt(II)nitorat (Fe(NO3)2) ở nhiệt độ cao, ta thu được sản phẩm là:
-
A.
Fe(NO2)2; O2
-
B.
Fe;NO2;O2
-
C.
FeO;NO2;O2
-
D.
Fe2O3;NO2;O2
Để nhận biết 3 dung dịch bị mất nhãn : Na2SO4 , HCl , H2SO4 loãng , người ta dùng :
-
A.
Qùi tím
-
B.
Qùi tím và dd BaCl2
-
C.
Qùi tím và Fe
-
D.
dd BaCl2 và dd AgNO3
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M. Tính thể tích dung dịch MgSO4 2M cần dùng
-
A.
0,05 lít
-
B.
0,1 lít
-
C.
0,2 lít
-
D.
0,5 lít
Cho V (lít) CO2 (đktc) hấp thụ hết vào 200 ml dung dịch Ca(OH)2 1M thu được 15 gam kết tủa. Giá trị của V là
-
A.
5,6 lít.
-
B.
3,36 lít.
-
C.
4,48 lít.
-
D.
5,6 lít hoặc 3,36 lít.
Nung nóng muối A (công thức tổng quát nCaX2.H2O) trong điều kiện không có không khí ở 5000C thu được CaCO3 và hỗn hợp hơi B. Khối lượng CaCO3 thu được chỉ bằng 59,9% so với khối lượng muối A đem nung ban đầu. Tỷ khối hơi của B so với CO2 là 1,015. Toàn bộ B được cho vào CaO(rắn, dư) và làm lạnh để ngưng tụ toàn bộ hệ, thu được hỗn hợp C. Phân tích C cho thấy ngoài CaO dư còn có một chất vô cơ D và một chất hữu cơ E có tỷ lệ mol D:E là 1:2. Đốt cháy hoàn toàn 5,8 g E, cho toàn bộ sản phẩm vào dung dịch nước vôi trong dư, thu được 30 gam kết tủa. Xác định n và X trong công thức của A.
-
A.
X là CH3COO-; n = 2
-
B.
X là CH3COO-; n = 3
-
C.
X là HCOO-; n = 3
-
D.
X là HCOO-, n = 1
Nhiệt phân hoàn toàn 25 g hỗn hợp MgCO3, CaCO3 , BaCO3 thu được khí B. Cho khí B hấp thụ hết vào nước vôi trong thu được 15 gam kết tủa và dung dịch C. Đun nóng dung dịch C tới phản ứng hoàn toàn thấy tạo thành thêm 6 gam kết tủa. Hỏi % khối lượng của MgCO3 nằm trong khoảng nào?
-
A.
\( 42\% < \% {m_{MgC{O_3}}} < 82,83\% \)
-
B.
\( 24\% < \% {m_{MgC{O_3}}} < 28,83\% \)
-
C.
\( 46\% < \% {m_{MgC{O_3}}} < 86,83\% \)
-
D.
Đáp án khác
Hoà tan hoàn toàn 25,2 g một muối cacbonat của kim loại hóa trị II bằng dung dịch HCl 7,3% (D = 1,038 g/ml). Cho toàn bộ khí CO2 thu được vào 500 ml dung dịch NaOH 2M, sau phản ứng đem cô cạn thì thu được 47,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. a/ Xác định CTHH của muối cacbonat
-
A.
MgCO3
-
B.
BaCO3
-
C.
Na2CO3
-
D.
CaCO3
Trộn 30ml dd có chứa 1,04 g BaCl2 với 170ml dd có chứa 3,4g AgNO3. Tính CM của chất còn lại trong dd sau phản ứng. Biết thể tích dd thay đổi không đáng kể.
-
A.
CM AgNO3 = 0,05M; CM Ba(NO3)2 = 0,025M
-
B.
CM AgNO3 = 0,025M; CM Ba(NO3)2 = 0,05M
-
C.
CM AgNO3 = 0,025M; CM Ba(NO3)2 = 0,025M
-
D.
CM AgNO3 = 0,05M; CM Ba(NO3)2 = 0,05M
Hòa tan 10 gam hỗn hợp muối XCO3 và Y2(CO3)3 bằng dd HCl dư thư được dd A và 0,672 lít khí ở đktc.Khối lượng muối khan thu được sau phản ứng là
-
A.
10,3 gam
-
B.
10,33 gam
-
C.
30 gam
-
D.
13 gam
Cho dung dịch AgNO3 dư tác dụng với hỗn hợp có hòa tan 12,5 gam hai muối KCl và KBr thu được 20,78 gam hỗn hợp AgCl và AgBr. Thành phần % của muối AgCl trong hỗn hợp thu được sau phản ứng là.
-
A.
76,22%
-
B.
67,26%
-
C.
22,67%
-
D.
27,62%
Cho 8,4 gam Fe vào dung dịch chứa 0,4 mol AgNO3. Kết thúc phản ứng khối lượng muối thu được là.
-
A.
32,4 g
-
B.
33,2 g
-
C.
34,2 g
-
D.
42,3 g
Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
-
A.
2,24 lít
-
B.
4,48 lít
-
C.
22,4 lít
-
D.
44,8 lít
Lời giải và đáp án
Trong tự nhiên muối natri clorua có nhiều trong:
-
A.
Nước biển.
-
B.
Nước mưa.
-
C.
Nước sông.
-
D.
Nước giếng.
Đáp án : A
Trong tự nhiên muối natri clorua có nhiều trong: nước biển
Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
Không được phép có trong nước ăn vì tính độc hại của nó?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Đáp án: C
Xem lại lí thuyết một số muối quan trọng
Muối không được phép có trong nước ăn vì tính độc hại của nó là Pb(NO3)2.
Không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Đáp án: D
Xem lại lí thuyết một số muối quan trọng
Muối không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó là NaCl.
Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Đáp án: A
Xem lại lí thuyết một số muối quan trọng
Muối không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao là CaCO3.
Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
-
A.
CaCO3.
-
B.
CaSO4.
-
C.
Pb(NO3)2.
-
D.
NaCl.
Đáp án: B
Xem lại lí thuyết một số muối quan trọng
Muối rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao là CaSO4.
Nung kali nitrat (KNO3) ở nhiệt độ cao, ta thu được chất khí là:
-
A.
NO
-
B.
N2O
-
C.
N2O5
-
D.
O2
Đáp án : D
KNO3 bị nhiệt phân: 2KNO3 $\xrightarrow{{{t^o}}}$2KNO2 + O2
=> chất khí thu được là O2
Muối kali nitrat (KNO3):
-
A.
không tan trong trong nước.
-
B.
tan rất ít trong nước.
-
C.
tan nhiều trong nước.
-
D.
không bị phân huỷ ở nhiệt độ cao.
Đáp án : C
Muối kali nitrat (KNO3) là chất rắn, tan nhiều trong nước, khi tan thu nhiệt.
Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
-
A.
Dung dịch AgNO3.
-
B.
Dung dịch HCl.
-
C.
Dung dịch BaCl2.
-
D.
Dung dịch Pb(NO3)2.
Đáp án : C
Cần nắm được tính chất hóa học của muối Na2SO4 và NaCl
Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng dung dịch BaCl2 vì tạo kết tủa với Na2SO4 và chỉ còn lại dung dịch NaCl
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Trộn những cặp chất nào sau đây ta thu được NaCl ?
-
A.
dung dịch Na2CO3 và dung dịch BaCl2
-
B.
dung dịch NaNO3 và CaCl2
-
C.
dung dịch KCl và dung dịch NaNO3
-
D.
dung dịch Na2SO4 và dung dịch KCl
Đáp án : A
Cần nắm được tính chất hóa học của muối tác dụng với muối
Thu được NaCl bằng cách trộn dung dich Na2CO3 và dung dịch BaCl2 vì xảy ra phản ứng:
Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl
Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai cặp dung dịch các chất đã dùng ban đầu là
-
A.
BaCl2 và NaOH.
-
B.
MgCl2 và NaOH.
-
C.
Na2SO4 và HCl.
-
D.
NaNO3 và KCl.
Đáp án : B
Để thu được sản phẩm là NaCl => 2 chất ban đầu tác dụng với nhau, ngoài sản phẩm là NaCl thì chất còn lại là kết tủa hoặc chất khí hoặc H2O
Để thu được sản phẩm là NaCl => 2 chất ban đầu tác dụng với nhau, ngoài sản phẩm là NaCl thì chất còn lại là kết tủa hoặc chất khí hoặc H2O
=> 2 chất là MgCl2 và NaOH
PTHH: MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
Điện phân dung dịch NaCl bão hoà, có màng ngăn giữa hai điện cực, sản phẩm thu được là:
-
A.
NaOH, H2, Cl2
-
B.
NaCl, NaClO, H2, Cl2
-
C.
NaCl, NaClO, Cl2
-
D.
NaClO, H2 và Cl2
Đáp án : A
Xem lại phản ứng điện phân NaCl
PT điện phân: 2NaCl + 2H2O $\xrightarrow[{có\,\,màng\,\,ngăn}]{{đpdd}}$ 2NaOH + H2 + Cl2
Trường hợp nào tạo ra chất kết tủa khi trộn hai dung dịch sau ?
-
A.
NaCl và AgNO3
-
B.
NaCl và Ba(NO3)2
-
C.
KNO3 và BaCl2
-
D.
CaCl2 và NaNO3
Đáp án : A
Cần nắm được tính chất hóa học của muối tác dụng với muối
Trường hợp tạo ra chất kết tủa là : NaCl phản ứng với AgNO3
NaCl + AgNO3 → AgCl↓ + NaNO3
Cho phương trình phản ứng: Na2CO3 + 2HCl → 2NaCl + X + H2O. X là:
-
A.
CO
-
B.
CO2
-
C.
H2
-
D.
Cl2
Đáp án : B
Cần nắm được tính chất của muối tác dụng với dung dịch axit
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
=> khí X là CO2
Hoà tan 50 gam muối ăn vào 200 gam nước thu được dung dịch có nồng độ là:
-
A.
15%
-
B.
20%
-
C.
18%
-
D.
25%
Đáp án : B
Áp dụng công thức: $C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% $
$C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% = \frac{{50}}{{50 + 200}}.100\% = 20\% $
Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là:
-
A.
90 gam.
-
B.
94,12 gam.
-
C.
100 gam.
-
D.
141,18 gam.
Đáp án : B
Áp dụng công thức: $C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% $
Gọi khối lượng NaCl cần dùng là m (gam)
=> mdung dịch = mNaCl + mH2O = m + 200
$C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% = > \frac{m}{{m + 200}}.100\% = 32\% = > m = 94,12\,\,gam$
Hoà tan 10,95 gam KNO3 vào 150 gam nước thì được dung dịch bão hoà ở 200C, độ tan của KNO3 ở nhiệt độ này là
-
A.
6,3 gam.
-
B.
7,0 gam
-
C.
7,3 gam
-
D.
7,5 gam
Đáp án : C
150 gam nước hòa tan được 10,95 gam KNO3
100 gam nước hòa tan được S gam KNO3
=> áp dung tích chéo
- Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
150 gam nước hòa tan được 10,95 gam KNO3
100 gam nước hòa tan được S gam KNO3
=> độ tan $S = \frac{{100.10,95}}{{150}} = 7,3\,\,gam$
Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
-
A.
143,5 gam
-
B.
14,35 gam
-
C.
157,85 gam
-
D.
15,785 gam
Đáp án : A
Xét dư thừa => tính số mol AgCl theo chất hết
${n_{NaCl}} = 0,5.2 = 1\,\,mol;\,\,{n_{AgN{O_3}}} = 0,6.2 = 1,2\,\,mol$
NaCl + AgNO3 → AgCl↓ + NaNO3
Xét tỉ lệ: $\frac{{{n_{NaCl}}}}{1} = 1\,\, < \,\,\frac{{{n_{AgN{O_3}}}}}{1} = 1,2$ => NaCl hết, AgNO3 dư
=> phản ứng tính theo NaCl
Theo phương trình: ${n_{AgCl}} = {n_{NaCl}} = 1\,\,mol\,\, = > \,\,{m_{AgCl}} = 143,5\,\,gam$
Trong phòng thí nghiệm, người ta thường dùng muối KNO3 để điều chế khí oxi bằng phản ứng phân hủy. Để điều chế 1,12 lít khí O2 (đktc) thì khối lượng muối cần dùng là
-
A.
20,2 gam.
-
B.
10,1 gam.
-
C.
5,05 gam.
-
D.
7,07 gam
Đáp án : B
+) 2KNO3 $\xrightarrow{{{t^o}}}$ 2KNO2 + O2
+) ${n_{KN{O_3}}} = 2.{n_{{O_2}}}\, = > {m_{KN{O_3}}}$
${n_{{O_2}}} = \frac{{1,12}}{{22,4}} = 0,05\,\,mol$
PTHH: 2KNO3 $\xrightarrow{{{t^o}}}$ 2KNO2 + O2
Theo phương trình: ${n_{KN{O_3}}} = 2.{n_{{O_2}}} = 0,1\,\,mol\, = > {m_{KN{O_3}}} = 0,1.101 = 10,1\,\,gam$
Có thể phân biệt BaCl2 và NaCl bằng dung dịch:
-
A.
H2SO4.
-
B.
KOH.
-
C.
NaOH.
-
D.
KNO3.
Đáp án : A
Ta thấy đây là 2 muối của Cl- => chọn thuốc thử dựa vào dấu hiệu nhận biết cation Ba2+ và Na+.
Mà ion Na+ thì không có thuốc thử đặc trưng để nhận biết => chọn thuốc thử đặc trưng nhận biết Ba2+
Dùng H2SO4 để phân biệt BaCl2 và NaCl
+ BaCl2 tạo kết tủa trắng, còn NaCl thì không có hiện tượng gì
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Có những muối sau: NaCl, Pb(NO3)2, KNO3, CaCO3. Muối nào trong các muối trên dùng làm thuốc nổ đen
-
A.
NaCl.
-
B.
KNO3
-
C.
Pb(NO3)2
-
D.
CaCO3
Đáp án : B
Dựa vào ứng dụng của một số muối trong sgk hóa 9 - trang 35.
KNO3 là muối dùng làm thuốc nổ đen
Dung dịch muối NaHSO4 phản ứng được với tất cả các chất nào trong dãy sau:
-
A.
Na2O, NaOH, Fe, Ca(HCO3)2.
-
B.
Na2O, NaOH, Cu, Ca(HCO3)2.
-
C.
Na2O, NaCl, Fe, Ca(HCO3)2.
-
D.
Na2O, NaCl, Cu, Ca(HCO3)2.
Đáp án : A
A. Thỏa mãn pư được với tất cả các chất.
PTHH:
Na2O + 2NaHSO4 → 2Na2SO4 + H2O
NaOH + NaHSO4 → Na2SO4 + H2O
Fe + 2NaHSO4 → Na2SO4 + Fe2SO4 + H2↑
Ca(HCO3)2 + 2NaHSO4 → CaSO4 + Na2SO4 + 2CO2↑ + 2H2O
B. Loại Cu không phản ứng vì là kim loại đứng sau H trong dãy điện hóa học của kim loại.
C. Loại NaCl không phản ứng do không thỏa mãn điều kiện sản phẩm sinh ra chất kết tủa hoặc bay hơi.
D. Loại NaCl và Cu không phản ứng
Có 2 dung dịch muối mất nhãn là dung dịch NaCl và KNO3. Thuốc thử để nhận biết hai dung dịch trên là
-
A.
quỳ tím
-
B.
dd phenolphtalein
-
C.
dd HCl.
-
D.
dd AgNO3.
Đáp án : D
Dùng dung dịch AgNO3 để phân biệt 2 dd trên vì khi cho vào ta thấy:
+ Xuất hiện kết tủa trắng là dd NaCl
PTHH: NaCl + AgNO3 → AgCl↓(trắng) + NaNO3
+ Không có hiện tượng gì là KNO3
Muối nào sau đây dễ bị nhiệt phân hủy sinh ra khí CO2
-
A.
NaCl.
-
B.
Ca(HCO3)2.
-
C.
NaHSO4.
-
D.
KNO3.
Đáp án : B
A,C không bị phân hủy
B. PTHH: Ca(HCO3)2\(\xrightarrow{{{t^0}}}\) CaCO3↓ + CO2↑ + H2O ⟹ thỏa mãn thu được CO2
D. PTHH: KNO3 \(\xrightarrow{{{t^0}}}\) KNO2 + 1/2O2↑ ⟹ loại vì không thu được O2
Dung dịch NaOH có thể dùng để phân biệt cặp muối nào sau đây
-
A.
NaCl và BaCl2.
-
B.
NaHSO4 và Ba(HCO3)2.
-
C.
NaCl và Na2SO4
-
D.
NaCl và NaNO3.
Đáp án : B
A,C,D Loại vì NaOH không có phản ứng với cả 2 chất
B. Thỏa mãn vì khi cho dd NaOH vào ta có hiện tượng:
+ không có hiện tượng gì là dd NaHSO4
PTHH: NaHSO4 + NaOH → Na2SO4 + H2O
+ xuất hiện kết tủa trắng là Ba(HCO3)2
PTHH: Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Cặp chất nào sau đây phản ứng với nhau thu được sản phẩm là NaCl
-
A.
NaNO3 và HCl
-
B.
NaOH và HCl
-
C.
Na2SO4 và HCl
-
D.
NaHSO4 và HCl
Đáp án : B
A,C,D không có phản ứng hóa học xảy ra
B. PTHH: NaOH + HCl → NaCl + H2O
Điện phân nóng chảy NaCl thu được sản phẩm gồm:
-
A.
NaOH và Cl2.
-
B.
Na, H2 và Cl2.
-
C.
Na và Cl2.
-
D.
Na và H2.
Đáp án : C
PTHH: \(2NaCl\xrightarrow{{dpnc}}2Na + C{l_2}\)
Dung dịch muối nào sau đây làm quỳ tím chuyển sang màu đỏ
-
A.
NaCl.
-
B.
NaHSO4.
-
C.
Ca(HCO3)2.
-
D.
KNO3.
Đáp án : B
NaHSO4 là muối axit, có tính chất như một axit mạnh nên làm quỳ tím chuyển sang màu đỏ
Cho dung dịch Na2SO4 vào dung dịch BaCl2 thấy
-
A.
dung dịch chuyển đỏ.
-
B.
có kết tủa trắng.
-
C.
không có hiện tượng.
-
D.
có bọt khí thoát ra.
Đáp án : B
Phản ứng sinh ra kết tủa trắng BaSO4. PTHH: Na2SO4 + BaCl2 → BaSO4↓ + 2HCl
Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
-
A.
Xuất hiện kết tủa hồng.
-
B.
Xuất hiện kết tủa trắng.
-
C.
Xuất hiện kết tủa xanh lam.
-
D.
Xuất hiện kết tủa nâu đỏ.
Đáp án : B
Hiện tượng: xuất hiện kết tủa trắng
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Dãy hợp chất nào sau đây gồm các muối?
-
A.
Mg(HCO3)2, Ba(OH)2, CuSO4, HCl.
-
B.
Mg(HCO3)2, NH4NO3, CuSO4, Fe(NO3)2
-
C.
H2SO4, Na2CO3, NaOH, CaSO4.
-
D.
CaO, Ba(OH)2, MgSO4, BaSO4
Đáp án : B
Dựa vào khái niệm về muối: Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit
A. Loại HCl là axit
B. Thỏa mãn tất cả đều là muối
C. Loại H2SO4 là axit còn NaOH là bazo
D. Loại CaO là oxit bazo, Ba(OH)2 là bazo
CaCO3 có thể tham gia phản ứng với
-
A.
HCl.
-
B.
NaOH.
-
C.
KNO3.
-
D.
Mg.
Đáp án : A
CaCO3 có thể phản ứng với HCl
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất có công thức
-
A.
CaCO3
-
B.
HCl
-
C.
Mg(OH)2
-
D.
CuO
Đáp án : B
Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất HCl vì
Na2CO3 + 2HCl → 2NaCl + H2O + CO2 còn NaCl không tác dụng nên không có hiện tượng
Để phân biệt các chất đựng trong lọ riêng biệt sau: NaNO3, Cu(NO3)2, Fe(NO3)3, Ba(NO3)2 người ta cần sử dụng hóa chất nào?
-
A.
NaOH, H2SO4
-
B.
NaCl, HCl
-
C.
Ca(OH)2
-
D.
BaCl2
Đáp án : A
Trích mẫu thử của từng chất vào các ống nghiệm riêng biệt và đánh dấu tương ứng
- Cho dung dịch NaOH dư vào 4 ống nghiệm trên
+ống nghiệm nào xuất hiện kết tủa màu xanh thì ống nghiệm đó chứ Cu(NO3)2
3NaOH + Cu(NO3)2 → Cu(OH)2↓ + 2NaNO3
+ ống nghiệm nào xuất hiện kết tủa màu nâu đỏ thì ống nghiệm đó chứa Fe(NO3)3
3NaOH + Fe(NO3)3 → Fe(OH)3↓ + 3NaNO3
+ ống nghiệm nào không có hiện tượng hig chứa NaNO3 và Ba(NO3)2
- Cho H2SO4 dư vào 2 dung dịch chưa phân biệt được NaNO3 và Ba(NO3)2
+ ống nghiệm xuất hiện kết tủa màu trắng là Ba(NO3)2
H2SO4 + Ba(NO3)2 → BaSO4↓ + 2HNO3
Dung dịch muối FeCl2 tác dụng được với tất cả các chất nào trong dãy chất sau:
-
A.
Mg;NaOH; H2SO4; AgNO3
-
B.
Mg; NaOH; Mg(OH)2; AgNO3
-
C.
Mg; KOH; NaOH; NaNO3
-
D.
Mg; KOH; NaOH; AgNO3
Đáp án : D
FeCl2 + Mg → MgCl2 + Fe↓
FeCl2 + KOH → Fe(OH)2↓ + 2KCl
FeCl2 + NaOH → Fe(OH)2↓ + 2NaCl
FeCl2 + 2AgNO3 → 2AgCl↓ + Fe(NO3)2
Nung sắt(II)nitorat (Fe(NO3)2) ở nhiệt độ cao, ta thu được sản phẩm là:
-
A.
Fe(NO2)2; O2
-
B.
Fe;NO2;O2
-
C.
FeO;NO2;O2
-
D.
Fe2O3;NO2;O2
Đáp án : D
Đây là trường hợp đặc biệt: 4Fe(NO3)2 → 2Fe2O3 + 4NO2 + 5O2
Để nhận biết 3 dung dịch bị mất nhãn : Na2SO4 , HCl , H2SO4 loãng , người ta dùng :
-
A.
Qùi tím
-
B.
Qùi tím và dd BaCl2
-
C.
Qùi tím và Fe
-
D.
dd BaCl2 và dd AgNO3
Đáp án : B
Lấy mẫu thử của 3 dung dịch
Dùng quì tím
+ Na2SO4 không làm quì đổi màu
+ HCl và H2SO4 làm quì hóa đỏ
Dùng BaCl2 nhận biết HCl và H2SO4
+ không có hiện tượng là HCl
+ Xuất hiện kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4+ 2HCl
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M. Tính thể tích dung dịch MgSO4 2M cần dùng
-
A.
0,05 lít
-
B.
0,1 lít
-
C.
0,2 lít
-
D.
0,5 lít
Đáp án : A
Đổi 200 ml = 0,2 (lít)
nKOH = VKOH. CM KOH = 0,2.1 = 0,2 (mol)
PTHH: 2KOH + MgSO4→ Mg(OH)2↓ + K2SO4
Theo PTHH: nMgSO4 = 1/2 nKOH = 1/2. 0,2 = 0,1 (mol)
→ VMgSO4 = 0,1 : 2 = 0,05 lít
Cho V (lít) CO2 (đktc) hấp thụ hết vào 200 ml dung dịch Ca(OH)2 1M thu được 15 gam kết tủa. Giá trị của V là
-
A.
5,6 lít.
-
B.
3,36 lít.
-
C.
4,48 lít.
-
D.
5,6 lít hoặc 3,36 lít.
Đáp án : D
Ta thấy nCaCO3 < nCa(OH)2 nên có 2 trường hợp xảy ra
TH1: Phản ứng chỉ tạo ra muối CaCO3. Khi đó CO2 pư hết, dd Ca(OH)2 dư. Mọi tính toán theo số mol CO2 và CaCO3
TH2: Phản ứng tạo cả muối CaCO3 và Ca(HCO3)2. Khi đó cả CO2 và Ca(OH)2 cùng phản ứng hết. Mọi tính toán theo số mol của Ca(OH)2, CO2 và CaCO3.
200 ml = 0,2 (lít)
nCa(OH)2 = V. CM = 0,2.1 = 0,2 (mol)
nCaCO3 = mCaCO3 : MCaCO3 = 15 : 100 = 0,15 (mol)
Ta thấy nCaCO3 < nCa(OH)2 nên có 2 trường hợp xảy ra
TH1: Phản ứng chỉ tạo ra muối CaCO3. Khi đó CO2 pư hết, dd Ca(OH)2 dư. Mọi tính toán theo số mol CO2 và CaCO3
PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
(mol) 0,15 ← 0,15
Theo PTHH (1): nCO2 = nCaCO3 = 0,15 (mol) ⟹ VCO2(đktc) = 0,15.22,4 = 3,36 (lít)
TH2: Phản ứng tạo cả muối CaCO3 và Ca(HCO3)2. Khi đó cả CO2 và Ca(OH)2 cùng phản ứng hết. Mọi tính toán theo số mol của Ca(OH)2, CO2 và CaCO3.
PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O (2)
(mol) 0,15 0,15 ← 0,15
2CO2 + 2Ca(OH)2 → Ca(HCO3)2 (3)
Theo PTHH (2): nCa(OH)2(2) = nCaCO3 =0,15 (mol)
⟹ nCa(OH)2(3) = nCa(OH)2 ban đầu - nCa(OH)2(2) = 0,2 - 0,15 = 0,05 (mol)
Theo PTHH (3): nCO2 = 2nCa(OH)2(3) = 2.0,05 = 0,1 (mol)
Theo PTHH (2): nCO2(2) = nCaCO3 = 0,15 (mol)
⟹ ∑nCO2 (2)+(3) = 0,15 + 0,1 = 0,25 (mol) ⟹ VCO2(đktc) = 0,25.22,4 = 5,6 (lít)
Nung nóng muối A (công thức tổng quát nCaX2.H2O) trong điều kiện không có không khí ở 5000C thu được CaCO3 và hỗn hợp hơi B. Khối lượng CaCO3 thu được chỉ bằng 59,9% so với khối lượng muối A đem nung ban đầu. Tỷ khối hơi của B so với CO2 là 1,015. Toàn bộ B được cho vào CaO(rắn, dư) và làm lạnh để ngưng tụ toàn bộ hệ, thu được hỗn hợp C. Phân tích C cho thấy ngoài CaO dư còn có một chất vô cơ D và một chất hữu cơ E có tỷ lệ mol D:E là 1:2. Đốt cháy hoàn toàn 5,8 g E, cho toàn bộ sản phẩm vào dung dịch nước vôi trong dư, thu được 30 gam kết tủa. Xác định n và X trong công thức của A.
-
A.
X là CH3COO-; n = 2
-
B.
X là CH3COO-; n = 3
-
C.
X là HCOO-; n = 3
-
D.
X là HCOO-, n = 1
Đáp án : A
Nhiệt phân A tạo ra chất hữu cơ E => A là muối ngậm nước của axit hữu cơ
Khi nhiệt phân muối canxi của axit hữu cơ ta thu được anđehit/xeton (E) và CaCO3
Như vậy B gồm: H2O và anđehit/xeton (E)
Khi cho hỗn hợp B qua CaO thì chỉ có H2O bị hấp thụ: CaO + H2O → Ca(OH)2 (D)
Giả sử nCa(OH)2 = 1 mol; nE = 2 mol => nH2O = nCa(OH)2 = 1 mol
- Xét hỗn hợp B: MB = 1,015.44 = 44,66
Áp dụng phương pháp đường chéo ta có:
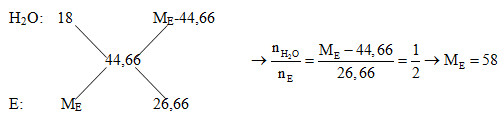
- Xét phản ứng đốt cháy 5,8 gam E: nE = 5,8 : 58 = 0,1 mol; nCO2 = nCaCO3 = 30 : 100 = 0,3 mol
=> Số C trong E = nCO2 : nE = 0,3 : 0,1 = 3
Vậy suy ra E có CTPT là C3H6O
- Xét phản ứng nhiệt phân 1mol muối A: nCaX2.H2O \(\xrightarrow{{{t^o}}}\) nCaCO3 + 2C3H6O + H2O
BTKL: mA = m sản phẩm = 100n + 2.58 + 18 = 100n + 134 (g)
Mà CaCO3 bằng 59,9% khối lượng của A nên ta có phương trình: \(\frac{{100n}}{{100n + 134}}.100\% = 59,9\% \) => n = 2
=> A có dạng là 2CaX2.H2O
Ta thấy 1 mol muối A nặng 100.2 + 134 = 334 gam => MA = 334 (g/mol) => 2(40 + 2MX) + 18 = 334 => MX = 59
=> X là CH3COO-
Vậy suy ra A là 2(CH3COO)2Ca.H2O; E là CH3-CO-CH3 (axeton)
Nhiệt phân hoàn toàn 25 g hỗn hợp MgCO3, CaCO3 , BaCO3 thu được khí B. Cho khí B hấp thụ hết vào nước vôi trong thu được 15 gam kết tủa và dung dịch C. Đun nóng dung dịch C tới phản ứng hoàn toàn thấy tạo thành thêm 6 gam kết tủa. Hỏi % khối lượng của MgCO3 nằm trong khoảng nào?
-
A.
\( 42\% < \% {m_{MgC{O_3}}} < 82,83\% \)
-
B.
\( 24\% < \% {m_{MgC{O_3}}} < 28,83\% \)
-
C.
\( 46\% < \% {m_{MgC{O_3}}} < 86,83\% \)
-
D.
Đáp án khác
Đáp án : A
\(\begin{array}{l}\overline M C{O_3} \to MO + C{O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(1)\\C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O\,\,\,(2)\\0,15\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \leftarrow 0,15\\2CO2 + Ca{(OH)_2} \to Ca{(HC{O_3})_2} + {H_2}O\,(3)\end{array}\)
Ca(HCO3)2 \(\xrightarrow{{{t^0}}}\) CaCO3↓ + CO2↑ + H2O (4)
0,06 ← 0,06
\({n_{CaC{O_3}(2)}} = \frac{{15}}{{100}} = 0,15\,(mol);\,{n_{CaC{O_3}\,(4)}} = \frac{6}{{100}} = 0,06\,(mol)\)
Ta có: \(\sum {{n_{C{O_2}(1)}} = {n_{C{O_2}(2)}} + {n_{C{O_2}(3)}} = {n_{C{O_2}(2)}} + 2{n_{CaC{O_3}(4)}} = 0,15 + 2.0,06 = 0,27\,(mol)} \)
\( \Rightarrow {n_{MC{O_3}}} = {n_{C{O_2}(1)}} = 0,27\,(mol)\)
Gọi x, y, z lần lượt là số mol của MgCO3; CaCO3; BaCO3 trong 100 g hỗn hợp
\( \Rightarrow x + y + z = \frac{{100.0,27}}{{25}} = 1,08 \Rightarrow y + z = 108 - x\,\,(*)\)
Có: 84x + 100x + 197z = 100 → 100y + 197z = 100 – 84x (**)
\({M_{CaC{O_3}}} < {\overline M _{CaC{O_3},BaC{O_3}}} < {M_{BaC{O_3}}}\)
\( \Rightarrow 100 < \frac{{100y + 197z}}{{y + z}} < 197\)
Thế (*) và (**) vào ta có: \( \Rightarrow 100 < \frac{{100 - 84x}}{{1,08 - x}} < 197\)
\( \Rightarrow \left\{ \begin{array}{l}100.(1,08 - x) < 100 - 84x\\100 - 84x < 197.(1,08 - x)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}108 - 100x < 100 - 84x\\100 - 84x < 212,76 - 197x\end{array} \right. \Rightarrow \left\{ \begin{array}{l}8 < 16x\\113x < 112,76\end{array} \right. \Rightarrow \left\{ \begin{array}{l}0,5 < x\\x < 0,9979\end{array} \right.\)
→ 0,5 < x < 0,9979
Nhân cả các vế với 84
→ 42 < 84x < 83,82
Phần trăm khối lượng của MgCO3 trong hh là: \(\% {m_{MgC{O_3}}} = \frac{{{m_{MgC{O_3}}}}}{{{m_{hh}}}}.100\% \Rightarrow \frac{{42}}{{100}}.100\% < \frac{{84x}}{{100}}.100\% < \frac{{83,82}}{{100}}.100\% \)
\( \Rightarrow 42\% < \% {m_{MgC{O_3}}} < 82,83\% \)
Hoà tan hoàn toàn 25,2 g một muối cacbonat của kim loại hóa trị II bằng dung dịch HCl 7,3% (D = 1,038 g/ml). Cho toàn bộ khí CO2 thu được vào 500 ml dung dịch NaOH 2M, sau phản ứng đem cô cạn thì thu được 47,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. a/ Xác định CTHH của muối cacbonat
-
A.
MgCO3
-
B.
BaCO3
-
C.
Na2CO3
-
D.
CaCO3
Đáp án : A
Đặt công thức của muối cacbonat là MCO3.
Các PTHH:
MCO3 + 2 HCl →MCl2 + CO2↑ + H2O (1)
NaOH + CO2 → NaHCO3. (2)
a a a
2NaOH + CO2 → Na2CO3 + H2O. (3)
2b b b
Số mol NaOH: nNaOH = 0,5. 2 = 1 mol
Cho CO2 vào dung dịch NaOH có thể xảy ra các trường hợp sau:
TH1: chỉ xảy ra pư (2). NaOHPƯ hết, CO2 có thể hết hoặc dư. Mọi tính toán theo NaOH
Theo(3): nNaHCO3 = nNaOH = 1(mol) => mNaHCO3 = 1 . 84 = 84(g) ≠ 47,8(g)=> loại
TH2: xảy ra cả (2) và (3). CO2 và NaOH đều hết. rắn thu được là 2 muối
Gọi a, b lần lượt là số mol CO2 tham gia ở phản ứng (2) và (3).
Theo phương trình và bài ta có:
\(\left\{ \begin{array}{l}{n_{NaOH}} = a + 2b = 1\\{m_{muoi}} = 84a + 106b = 47,8\end{array} \right.\) => vô nghiệm => loại
TH3: xảy ra (3). CO2 hết, rắn sau pư là NaOHdư và Na2CO3
Gọi nCO2(3)= x(mol); nNaOHdư = y(mol)
Theo (3) nNaOHpư = 2nCO2(4)=2x(mol) ; nNa2CO3 = nCO2(4) = x(mol)
\(\left\{ \begin{array}{l}{n_{NaOH}} = 2x + y = 1\\\sum {m{\,_{ran}}\, = m{\,_{N{a_2}C{O_3}}} + {m_{NaO{H_{\,du}}}} = 106x + 40y = 47,8} \end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,3\\y = 0,4\end{array} \right.\)
→ nMCO3 = nCO2(3) = 0,3 (mol)
\({M_{MC{O_3}}} = \frac{{{m_{MC{O_3}}}}}{{{n_{MC{O_3}}}}} = \frac{{25,2}}{{0,3}} = 84 \Rightarrow {m_M} = 84 - 60 = 24\,(Mg)\)
→ Công thức muối: MgCO3
Trộn 30ml dd có chứa 1,04 g BaCl2 với 170ml dd có chứa 3,4g AgNO3. Tính CM của chất còn lại trong dd sau phản ứng. Biết thể tích dd thay đổi không đáng kể.
-
A.
CM AgNO3 = 0,05M; CM Ba(NO3)2 = 0,025M
-
B.
CM AgNO3 = 0,025M; CM Ba(NO3)2 = 0,05M
-
C.
CM AgNO3 = 0,025M; CM Ba(NO3)2 = 0,025M
-
D.
CM AgNO3 = 0,05M; CM Ba(NO3)2 = 0,05M
Đáp án : A
n BaCl2 = mBaCl2 : MBaCl2 = 1,04 : (137 + 35,5 . 2) = 0,005 mol
nAgNO3 = mAgNO3 : MAgNO3 = 3,4 : (108 + 14 + 3 . 16) = 0,02 mol
PTHH: BaCl2 + 2AgNO3 → 2AgCl↓ + Ba(NO3)2
Tỉ lệ: 1 2 2 1
Pứ: 0,005 0,02 ?mol ?mol
Ta có
=> BaCl2 phản ứng hết, AgNO3 dư
nAgNO3phản ứng = 2nBaCl2 = 0,01 mol
=> nAgNO3 dư = nAgNO3 – nAgNO3 phản ứng = 0,02 – 0,01 = 0,01 mol
nBa(NO3)2 = nBaCl2 = 0,005 mol
Vdd sau phản ứng = VBaCl2 + VAgNO3 = 30 + 170 = 200ml = 0,2 lít
=> CM AgNO3 = nAgNO3 : Vdd = 0,01 : 0,2 = 0,05M
CM Ba(NO3)2 = n Ba(NO3)2 : Vdd = 0,005 : 0,2 = 0,025M
Hòa tan 10 gam hỗn hợp muối XCO3 và Y2(CO3)3 bằng dd HCl dư thư được dd A và 0,672 lít khí ở đktc.Khối lượng muối khan thu được sau phản ứng là
-
A.
10,3 gam
-
B.
10,33 gam
-
C.
30 gam
-
D.
13 gam
Đáp án : B

=> m Muối = 10,33 gam
Cho dung dịch AgNO3 dư tác dụng với hỗn hợp có hòa tan 12,5 gam hai muối KCl và KBr thu được 20,78 gam hỗn hợp AgCl và AgBr. Thành phần % của muối AgCl trong hỗn hợp thu được sau phản ứng là.
-
A.
76,22%
-
B.
67,26%
-
C.
22,67%
-
D.
27,62%
Đáp án : D

Cho 8,4 gam Fe vào dung dịch chứa 0,4 mol AgNO3. Kết thúc phản ứng khối lượng muối thu được là.
-
A.
32,4 g
-
B.
33,2 g
-
C.
34,2 g
-
D.
42,3 g
Đáp án : B

Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
-
A.
2,24 lít
-
B.
4,48 lít
-
C.
22,4 lít
-
D.
44,8 lít
Đáp án : B
PTHH: Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
Tỉ lê: 1 2
Pứ: 0,1 ? mol
Từ PTHH ta có n NH3 = 2 n Ba(OH)2 = 0,2 mol
=> V NH3 = n NH3 . 22,4 = 0,2 . 22,4 = 44,8 lít
Luyện tập và củng cố kiến thức Bài 11. Phân bón hóa học Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Tính chất hóa học của muối Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 8. Một số bazơ quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7. Tính chất hóa học của bazơ Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 4. Một số axit quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3. Tính chất hóa học của axit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập oxit axit tác dụng với dung dịch kiềm Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2. Một số oxit quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết













Danh sách bình luận