Trắc nghiệm Bài 4. Một số axit quan trọng - Hóa học 9
Đề bài
Các dung dịch đều làm quỳ tím chuyển đỏ là
-
A.
NaCl, HCl.
-
B.
HCl, H2SO4.
-
C.
NaOH, KOH.
-
D.
NaCl, NaOH.
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
-
A.
rót từng giọt nước vào axit.
-
B.
rót từng giọt axit vào nước.
-
C.
cho cả nước và axit vào cùng một lúc.
-
D.
cả 3 cách trên đều được.
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
-
A.
Cu, Zn, Na.
-
B.
Au, Pt, Cu.
-
C.
Ag, Ba, Fe.
-
D.
Mg, Fe, Zn.
Để nhận biết dung dịch H2SO4, người ta thường dùng
-
A.
dung dịch NaOH.
-
B.
dung dịch KCl.
-
C.
dung dịch BaCl2.
-
D.
dung dịch CuSO4.
Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
-
A.
Fe
-
B.
Zn
-
C.
Mg
-
D.
Al
Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
-
A.
Zn
-
B.
Fe
-
C.
Mg
-
D.
Al
Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit H2SO4 thu được 5,6 lít H2 (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
-
A.
30%.
-
B.
50%.
-
C.
40%.
-
D.
60%.
Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
-
A.
100 ml.
-
B.
80 ml.
-
C.
90 ml.
-
D.
120 ml.
Hòa tan 50,54 gam hỗn hợp X gồm (Fe, Al) trong dung dịch H2SO4 loãng dư thu được V lít khí H2 (đktc) và dung dịch A, cô cạn dung dịch A thu được 178,22 gam hỗn hợp muối. Giá trị của V là
-
A.
30,240.
-
B.
29,568.
-
C.
29,792.
-
D.
27,328.
Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgCl2 = 11,787%. Tính C% của FeCl2 trong dung dịch A
-
A.
22,22%.
-
B.
14,45%.
-
C.
24,13%.
-
D.
15,76%.
Cho 69,75 gam hỗn hợp A gồm CaCO3 và Na2CO3 tác dụng vừa đủ với 337,5 gam dung dịch HCl 14,6% thu được dung dịch X và V lit CO2 (đktc). Giá trị của V là
-
A.
15,12.
-
B.
8,40.
-
C.
6,72.
-
D.
8,96.
Cho 50,9 gam hỗn hợp rắn A gồm BaCl2 và BaCO3 tác dụng vừa đủ với dung dịch H2SO4 thu được V lít CO2 (đktc), 58,25 gam kết tủa và dung dịch X. Giá trị của V là
-
A.
3,36.
-
B.
4,48.
-
C.
2,24.
-
D.
1,12.
Cho các dãy chất dưới đây, dãy chất nào tác dụng được với dung dịch axit sunfuric loãng?
-
A.
CuO, Cu, K2O, CO.
-
B.
SO2, CuO, Fe, CO2.
-
C.
KOH, CuO, Fe, BaCl2.
-
D.
CuO, CO2, MgO, K2O.
Dung dịch HCl không tác dụng với chất nào sau đây?
-
A.
CuO.
-
B.
Ag.
-
C.
NaOH.
-
D.
AgNO3.
Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Công thức hóa học của axit sunfuric là:
-
A.
HCl.
-
B.
H2SO3.
-
C.
H2SO4.
-
D.
HClO.
Dung dịch axit loãng H2SO4 khi phản ứng với chất nào dưới đây mà khí H2 không giải phóng ra (không được sinh ra)?
-
A.
Fe
-
B.
Cu.
-
C.
Mg.
-
D.
Al
Sự khác biệt nhất trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
-
A.
Tác dụng được với oxit bazơ
-
B.
Tác dụng được với bazơ
-
C.
Tác dụng được với muối
-
D.
Khả năng hút nước mạnh (tính háo nước)
Khả năng tan của H2SO4 trong nước là
-
A.
rất ít
-
B.
ít
-
C.
bình thường
-
D.
nhiều
Chất tác dụng được với dung dịch axit HCl là
-
A.
Ag.
-
B.
Cu.
-
C.
Fe.
-
D.
Au.
Cho các chất sau: KOH, Cu, CaO, Mg, NaCl. Chất nào phản ứng được với dung dịch axit clohiđric ?
-
A.
KOH, CaO, Mg
-
B.
KOH
-
C.
Mg
-
D.
NaCl.
Chất nào sau đây có thể dùng làm thuốc thử để phân biệt dung dịch Na2SO4 và Na2CO3?
-
A.
BaCl2.
-
B.
HCl.
-
C.
NaOH.
-
D.
Ba(OH)2.
Nhóm chất tác dụng với nước và với dung dịch HCl là:
-
A.
K2O, P2O5, CaO
-
B.
CaO, BaO, Na2O.
-
C.
BaO, SO3, P2O5.
-
D.
Na2O, SO3, CO2.
Chất nào dùng làm thuốc thử để phân biệt hai dung dịch axit clohidric và axit sunfuric?
-
A.
AlCl3.
-
B.
BaCl2.
-
C.
NaCl.
-
D.
MgCl2
Khi cho kim loại Fe tác dụng với axit H2SO4 đặc, nóng, dư không tạo thành sản phẩm nào trong các sản phẩm sau đây?
-
A.
FeSO4
-
B.
H2O
-
C.
SO2
-
D.
Fe2(SO4)3
Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường là:
-
A.
Không xảy ra hiện tượng gì
-
B.
Đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
-
C.
Đường tan trong axit tạo dung dịch trong suốt, không có bọt khí thoát ra
-
D.
Đường tan trong axit tạo dung dịch trong suốt, có bọt khí thoát ra.
Axit clohiđric có công thức hóa học là:
-
A.
H2SO4
-
B.
HCl
-
C.
H3PO4
-
D.
H2CO3
Chất tác dụng với dung dịch HCl loãng tạo thành chất khí nặng hơn không khí là:
-
A.
Mg
-
B.
CaO
-
C.
Zn
-
D.
Na2SO3
Để phân biệt ba dung dịch HCl, H2SO4, HNO3 , nên dùng
-
A.
quỳ tím, dd AgNO3
-
B.
dd Na2CO3 , dd AgNO3
-
C.
dd NaOH, dd AgNO3
-
D.
dd BaCl2, dd AgNO3
Dãy các oxit nào dưới đây tác dụng được với H2SO4 loãng?
-
A.
FeO, Na2O, NO2
-
B.
CaO,MgO,P2O5
-
C.
K2O, FeO, CaO
-
D.
SO2,BaO, Al2O3
Cặp chất nào sau đây tác dụng với nhau sinh ra chất khí cháy trong không khí với ngọn lửa màu xanh?
-
A.
Zn + HCl
-
B.
ZnO + HCl
-
C.
Zn(OH)2+ HCl
-
D.
NaOH + HCl
Chất nào có thể dùng để nhận biết axit sunfuric và muối sunfat ?
-
A.
NaCl
-
B.
BaCl2
-
C.
BaCO3
-
D.
Không nhận biết được
Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí:
-
A.
Bari oxit và axit sunfuric loãng
-
B.
Bari hiđroxit và axit sunfuric loãng
-
C.
Bari cacbonat và axit sunfuric loãng
-
D.
Bari clorua và axit sunfuric loãng
Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit clohidric. Thể tích khí Hiđro thu được ở đktc là:
-
A.
44,8 lít
-
B.
4,48 lít
-
C.
2,24 lít
-
D.
22,4 lít
Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
-
A.
13,6 g
-
B.
1,36 g
-
C.
20,4 g
-
D.
27,2 g
Khi cho 500ml dung dịch NaOH 1M tác dụng vừa đủ với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là:
-
A.
250 ml
-
B.
400 ml
-
C.
500 ml
-
D.
125 ml
Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
-
A.
61,9% và 38,1%
-
B.
63% và 37%
-
C.
61,5% và 38,5%
-
D.
65% và 35%
Hòa tan vừa hết 20 gam hỗn hợp CuO và Fe2O3 trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp là:
-
A.
4 g và 16 g
-
B.
10 g và 10 g
-
C.
8 g và 12 g
-
D.
14 g và 6 g.
Hòa tan 7,74 gam hỗn hợp 2 kim loại Mg, Al trong 500ml dung dịch hỗn hợp chứa HCl 1M và H2SO4 0,38M loãng. Thu được dung dịch A và 8,736 lít khí H2 (đktc). Khối lượng muối có trong dung dịch A là
-
A.
38 gam
-
B.
40 gam
-
C.
42 gam
-
D.
36 gam
Thể tích khí sinh ra ở đktc khi cho hỗn hợp gồm 9 (g) Al và 6,5 (g) Zn vào 100 ml dung dịch HCl 1M và H2SO4 1M là:
-
A.
1,12 (lít).
-
B.
3,36 (lít).
-
C.
26,88 (lít).
-
D.
4,48 (lít).
Cho 8 gam Mg, Fe vào dung dịch HCl vừa đủ. Sau phản ứng thu được m gam muối. Hỏi m nằm trong khoảng nào?
-
A.
18,14 (g) < m < 31, 67 (g)
-
B.
21,14 (g) < m < 31, 67 (g)
-
C.
16,18 (g) < m < 20,67 (g)
-
D.
15,14 (g) < m < 31, 67 (g)
Cho 8,4 gam Mg, Zn vào dung dịch H2SO4 vừa đủ. Sau phản ứng thu được dung dịch X, 3,6 (g) chất rắn và 4,48 (l) khí ở đktc. Phần trăm khối lượng kim loại Zn có trong hỗn hợp là:
-
A.
30%
-
B.
50%
-
C.
60%
-
D.
65%
Cho 8 gam Mg, Al vào dung dịch \(HCl\) vừa đủ. Sau phản ứng thu được dung dịch X, 2,36 (g) chất rắn và 6,272 (l) khí ở đktc. Phần trăm khối lượng mỗi kim loại có trong hỗn hợp lần lượt là.
-
A.
40% và 60%.
-
B.
60% và 40%.
-
C.
30% và 70%.
-
D.
70% và 30%.
Hòa tan hoàn toàn hỗn hợp gồm 16 gam CuO và 4 gam MgO trong dung dịch H2SO4 20% vừa đủ. Tính khối lượng dung dịch H2SO4 đã dùng.
-
A.
29,4 gam
-
B.
147 gam
-
C.
98 gam
-
D.
49 gam
Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là:
-
A.
10,2 gam.
-
B.
8,3 gam.
-
C.
2,7 gam
-
D.
16,6 gam.
Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là:
-
A.
100.
-
B.
200.
-
C.
300.
-
D.
400
Hòa tan m gam oxit sắt cần 150 ml dd HCl 3M . Mặt khác, khử toàn bộ m gam oxit sắt bằng CO nóng, dư thu được 8,4 gam sắt. Công thức oxit sắt là
-
A.
FeO
-
B.
Fe2O3
-
C.
Fe3O4
-
D.
cả A,B,C đều đúng
Cho hỗn hợp Al và 1 kim loại hóa trị II tan trong dung dịch H2SO4 loãng vừa đủ thu được dung dịch A và có H2 thoát ra. Cho A tác dụng với dung dịch BaCl2 vừa đủ thấy tách ra 93,2 gam kết tủa trắng. Lọc kết tủa rồi cô cạn nước lọc thu được 36,2 gam muối khan. Khối lượng kim loại ban đầu là
-
A.
7,8
-
B.
7,9
-
C.
8
-
D.
8,6
Cho hỗn hợp A gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí X ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần phần trăm theo khối lượng của hỗn hợp Fe và FeS ban đầu lần lượt là
-
A.
38,89% và 61,11%.
-
B.
50% và 50%.
-
C.
35% và 65%.
-
D.
61,11% và 38,89%.
Hòa tan hết muối cacbonat trung hòa của kim loại A bằng dung dịch H2SO4 vừa đủ nồng độ 19,6% thì thu được dung dịch chứa muối sunfat nồng độ 26,57%. Xác định kim loại A
-
A.
Zn
-
B.
Al
-
C.
Fe
-
D.
Mg
Một hỗn hợp kim loại gồm Al, Cu, Fe . Nếu cho hỗn hợp này tác dụng với dung dịch HCl dư thì thu được 8,96 lít khí (đktc) và 9 gam chất rắn. Nếu cho hỗn hợp này tác dụng vừa đủ với dung dịch NaOH thì phải dùng 100 ml dung dịch NaOH 2M. % khối lượng của Fe trong hỗn hợp là
-
A.
27%
-
B.
50%
-
C.
28%
-
D.
45%
Cho 122,4g hỗn hợp X gồm Cu, Fe3O4 vào dung dịch H2SO4 đặc, nóng thu được 10,08 lít SO2 (đktc), dung dịch Y và còn lại 4,8g kim loại. Cô cạn dung dịch Y thu được m gam muối khan. Tính m.
-
A.
215,6 (g)
-
B.
267,8 (g)
-
C.
256,8 (g)
-
D.
207,8 (g)
Lời giải và đáp án
Các dung dịch đều làm quỳ tím chuyển đỏ là
-
A.
NaCl, HCl.
-
B.
HCl, H2SO4.
-
C.
NaOH, KOH.
-
D.
NaCl, NaOH.
Đáp án : B
Xem lại tính chất hóa học của axit
Các dung dịch đều làm quỳ tím chuyển đỏ là HCl, H2SO4.
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
-
A.
rót từng giọt nước vào axit.
-
B.
rót từng giọt axit vào nước.
-
C.
cho cả nước và axit vào cùng một lúc.
-
D.
cả 3 cách trên đều được.
Đáp án : B
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách: rót từng giọt axit vào nước.
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
-
A.
Cu, Zn, Na.
-
B.
Au, Pt, Cu.
-
C.
Ag, Ba, Fe.
-
D.
Mg, Fe, Zn.
Đáp án : D
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là Mg, Fe, Zn.
H2SO4 không phản ứng với Cu, Ag, Pt.
Để nhận biết dung dịch H2SO4, người ta thường dùng
-
A.
dung dịch NaOH.
-
B.
dung dịch KCl.
-
C.
dung dịch BaCl2.
-
D.
dung dịch CuSO4.
Đáp án : C
Để nhận biết dung dịch H2SO4, người ta thường dùng dung dịch BaCl2 vì tạo kết tủa trắng BaSO4
Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
-
A.
Fe
-
B.
Zn
-
C.
Mg
-
D.
Al
Đáp án : A
+) Gọi hóa trị của kim loại R là a (a = 1, 2, 3, 4)
+) Viết PTHH, tính số mol R theo số mol H2
+) Áp dụng công thức: $m = M.{\text{ }}n$
${n_{{H_2}}}$= 0,45 mol
Gọi hóa trị của kim loại R là a (a = 1, 2, 3, 4)
2R + 2aHCl → 2RCla + aH2
$\dfrac{{0,9}}{a}$ ← 0,45
Áp dụng công thức: $m = M.{\text{ }}n{\text{ }} = > {\text{ }}25,5 = \dfrac{{R.0,45.2}}{a} < = > R = 28a$

Vậy kim loại cần tìm là sắt (Fe)
Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
-
A.
Zn
-
B.
Fe
-
C.
Mg
-
D.
Al
Đáp án : A
+) Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4)
+) Từ PTHH, tính số mol A theo số mol H2
+) Áp dụng công thức: $m = M.n{\text{ }} = > A = \frac{m}{n}$
${n_{{H_2}}} = 0,1\,\,mol$
Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4)
2A + nH2SO4 → A2(SO4)n + nH2
$\frac{{0,2}}{n}$ ← 0,1 mol
Áp dụng công thức: $m = M.n{\text{ }} = > A = \frac{m}{n} = \frac{{6,5}}{{\frac{{0,2}}{n}}} = > A = 32,5n$
|
n |
1 |
2 |
3 |
4 |
|
A |
32,5 (loại) |
65 (Zn) |
97,5 (loại) |
130 (loại) |
Kim loại A là Zn
Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit H2SO4 thu được 5,6 lít H2 (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
-
A.
30%.
-
B.
50%.
-
C.
40%.
-
D.
60%.
Đáp án : C
+) Ag không phản ứng với H2SO4 => 3 gam chất rắn không tan là Ag
+) từ PTHH, tính số mol Al theo số mol H2
+) mhỗn hợp X = mAl + mAg $ = > \% {m_{Ag}} = \frac{{{m_{Ag}}}}{{{m_X}}}.100\% $
${n_{{H_2}}} = 0,25\,\,mol$
Ag không phản ứng với H2SO4 => 3 gam chất rắn không tan là Ag
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
$\frac{{0,5}}{3}$ mol ← 0,25 mol
$ = > {\text{ }}{m_{Al}} = 27.\frac{{0,5}}{3} = 4,5\,\,gam$
=> mhỗn hợp X = mAl + mAg = 4,5 + 3 = 7,5 gam
$ = > \% {m_{Ag}} = \frac{3}{{7,5}}.100\% = 40\% $
Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
-
A.
100 ml.
-
B.
80 ml.
-
C.
90 ml.
-
D.
120 ml.
Đáp án : B
Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít) $ = > {n_{HCl}} = 0,5V\,\,mol;\,\,n{_{{H_2}S{O_4}}} = 0,75V\,\,mol$
+) Từ số mol HCl và H2SO4 => lập PT tính số mol Fe theo V => tính V
nFe = 0,08 mol
Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít)
$ = > {n_{HCl}} = 0,5V\,\,mol;\,\,n{ _{{H_2}S{O_4}}} = 0,75V\,\,mol$
Fe + 2HCl → FeCl2 + H2
0,25V ← 0,5V
Fe + H2SO4 → FeSO4 + H2
0,75V ← 0,75V
=> nFe = 0,25V + 0,75V = 0,08 => V = 0,08 lít = 80 ml
Hòa tan 50,54 gam hỗn hợp X gồm (Fe, Al) trong dung dịch H2SO4 loãng dư thu được V lít khí H2 (đktc) và dung dịch A, cô cạn dung dịch A thu được 178,22 gam hỗn hợp muối. Giá trị của V là
-
A.
30,240.
-
B.
29,568.
-
C.
29,792.
-
D.
27,328.
Đáp án : C
Gọi số mol của Fe và Al lần lượt là x và y mol => mhỗn hợp X = PT(1)
+) Từ PTHH => muối trong dung dịch A gồm x mol FeSO4 và 0,5y mol Al2(SO4)3
=> mhỗn hợp muối = ${m_{F{\text{e}}S{O_4}}} + {m_{A{l_2}{{(S{O_4})}_3}}}$ => PT(2)
+) Từ PTHH => $\sum {{n_{{H_2}}}} = x + 1,5y$
Gọi số mol của Fe và Al lần lượt là x và y mol
=> mhỗn hợp X = 56x + 27y = 50,54 (1)
Fe + H2SO4 → FeSO4 + H2
x mol → x mol → x mol
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
y mol → 0,5y mol → 1,5y mol
Muối trong dung dịch A gồm x mol FeSO4 và 0,5y mol Al2(SO4)3
=> mhỗn hợp muối = ${m_{F{\text{e}}S{O_4}}} + {m_{A{l_2}{{(S{O_4})}_3}}}$ => 152x + 0,5y.342 = 178,22 (2)
Từ (1) và (2) ta có hệ phương trình: $\left\{ \begin{gathered}56{\text{x}} + 27y = 50,54 \hfill \\152{\text{x}} + 0,5y.342 = 178,22 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 0,7 \hfill \\y = 0,42 \hfill \\ \end{gathered} \right.$
=> $\sum {{n_{{H_2}}}} = x + 1,5y = 0,7 + 1,5.0,42 = 1,33\,\,mol$
=> V = 1,33.22,4 = 29,792 lít
Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgCl2 = 11,787%. Tính C% của FeCl2 trong dung dịch A
-
A.
22,22%.
-
B.
14,45%.
-
C.
24,13%.
-
D.
15,76%.
Đáp án : D
+) Tự chọn nMg = 1 mol và nFe = a mol => tính số mol MgCl2 và FeCl2
+) Tính ${m_{dd{\text{ }}HCl}} = \dfrac{{36,5.(2 + 2a)}}{{20\% }} $
+) mdd Y = mX + mdd HCl – mH2
+) Từ $ {\text{ }}C{\% _{MgC{l_2}}} = 11,787\% $ => tính a => tính số mol FeCl2 => C%
Tự chọn nMg = 1 mol và nFe = a mol
Mg + 2HCl → MgCl2 + H2
1 → 2 → 1 → 1
Fe + 2HCl → FeCl2 + H2
a → 2a → a → a
\( \to {n_{HCl}} = 2 + 2{\text{a}}\,\,(mol) \to {m_{HCl}} = 36,5.(2 + 2{\text{a}})\,\,gam\)
\( \to \) ${m_{dd{\text{ }}HCl}} = \dfrac{{36,5.(2 + 2a)}}{{20\% }} = 365a + 365$
Mà \({n_{{H_2}}} = 1 + a\,\,(mol) \to {m_{{H_2}}} = 2.(1 + a)\,\,gam\)
\( \to {m_{dd\,Y}} = {m_X} + {m_{dd\,\,HCl}} - {m_{{H_2}}} = {m_{Mg}} + {m_{F{\text{e}}}} + {m_{dd\,\,HCl}} - {m_{{H_2}}}\)
\( \to {m_{dd\,Y}} = 24.1 + 56.a + 365{\text{a}} + 365 - 2.(1 + a) = 419{\text{a}} + 387\) gam
$ = > {\text{ }}C{\% _{MgC{l_2}}} = \dfrac{{95}}{{419{\text{a}} + 387}}.100\% = 11,787\% \,\, = > \,\,a = 1$
\( \to C{\% _{F{\text{e}}C{l_2}}} = \dfrac{{127.1}}{{419.1 + 387}}.100 = 15,76\% \)
Cho 69,75 gam hỗn hợp A gồm CaCO3 và Na2CO3 tác dụng vừa đủ với 337,5 gam dung dịch HCl 14,6% thu được dung dịch X và V lit CO2 (đktc). Giá trị của V là
-
A.
15,12.
-
B.
8,40.
-
C.
6,72.
-
D.
8,96.
Đáp án : A
+) mhỗn hợp A = ${{m}_{CaC{{\text{O}}_{3}}}}+{{m}_{N{{a}_{2}}C{{O}_{3}}}}$ => PT (1)
+) từ PTHH => tính số mol HCl theo x và y => PT (2)
+) Từ PTHH $ = > \sum {{n_{C{O_2}}} = } x + y$
Gọi số mol của CaCO3 và Na2CO3 lần lượt là x và y mol
=> mhỗn hợp A = ${{m}_{CaC{{\text{O}}_{3}}}}+{{m}_{N{{a}_{2}}C{{O}_{3}}}}$ => 100x + 106y = 69,75 (1)
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
x → 2x → x
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
y → 2y → y
${m_{HCl}} = \frac{{337,5.14,6\% }}{{100\% }} = 49,275\,\,gam\,\, = > {n_{HCl}} = 1,35\,\,mol$
Từ 2 PT => nHCl = 2x + 2y = 1,35 (2)
Từ (1) và (2) ta có hệ : $\left\{ \begin{gathered}100{\text{x}} + 106y = 69,75 \hfill \\2{\text{x}} + 2y = 1,35 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 0,3 \hfill \\y = 0,375 \hfill \\ \end{gathered} \right.$
$ = > \sum {{n_{C{O_2}}} = } x + y = 0,3 + 0,375 = 0,675\,\,mol$
=> V = 0,675.22,4 = 15,12 lít
Cho 50,9 gam hỗn hợp rắn A gồm BaCl2 và BaCO3 tác dụng vừa đủ với dung dịch H2SO4 thu được V lít CO2 (đktc), 58,25 gam kết tủa và dung dịch X. Giá trị của V là
-
A.
3,36.
-
B.
4,48.
-
C.
2,24.
-
D.
1,12.
Đáp án : C
+) Gọi số mol BaCl2 và BaCO3 lần lượt là x và y => mhh A = PT(1)
+) Kết tủa thu được là BaSO4 $ = > {n_{BaS{O_4}}} => PT(4)$
+) Từ PTHH => nCO2 = y
Gọi số mol BaCl2 và BaCO3 lần lượt là x và y
=> mhh A = 208x + 197y = 50,9 (1)
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl (2)
x → x
BaCO3 + H2SO4 → BaSO4 ↓ + H2O + CO2 (3)
y → y → y
kết tủa thu được là BaSO4 $ = > {n_{BaS{O_4}}} = \frac{{58,25}}{{233}} = 0,25\,\,mol$
Từ PT (2) và (3) $ = > {n_{BaS{O_4}}} = x + y = 0,25\,\,\,(4)$
Từ (1) và (4) ta có hệ : $\left\{ \begin{gathered}208{\text{x}} + 197y = 50,9 \hfill \\x + y = 0,25 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 0,15 \hfill \\y = 0,1 \hfill \\ \end{gathered} \right.$
Theo PT (3) => nCO2 = y = 0,1 mol => V = 2,24 lít
Cho các dãy chất dưới đây, dãy chất nào tác dụng được với dung dịch axit sunfuric loãng?
-
A.
CuO, Cu, K2O, CO.
-
B.
SO2, CuO, Fe, CO2.
-
C.
KOH, CuO, Fe, BaCl2.
-
D.
CuO, CO2, MgO, K2O.
Đáp án : C
Dựa vào tính chất hóa học của axit H2SO4 loãng
+ Tác dụng với oxit bazo, bazo
+ Tác dụng với kim loại đứng trước H trong dãy điện hóa
+ Tác dụng với muối
A. Loại Cu và CO không phản ứng
B. Loại CO2 không phản ứng
C. Thỏa mãn
D. Loại CO2 không phản ứng
Dung dịch HCl không tác dụng với chất nào sau đây?
-
A.
CuO.
-
B.
Ag.
-
C.
NaOH.
-
D.
AgNO3.
Đáp án : B
Ag là kim loại đứng sau H trong dãy điện hóa nên không tác dụng được với HCl
Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Sản xuất axit sunfuric gồm 3 giai đoạn:
Giai đoạn 1: Đốt lưu huỳnh cháy trong không khí
S + O2 \(\xrightarrow{{{t^0}}}\) SO2
Giai đoạn 2: sản xuất SO3 bằng cách oxi hóa SO2
2SO2 + O2 \(\xrightarrow[{{{450}^0}C}]{{{V_2}{O_5}}}\) 2SO3
Giai đoạn 3: Cho SO3 tác dụng với nước để điều chế H2SO4
SO3 + H2O → H2SO4
Công thức hóa học của axit sunfuric là:
-
A.
HCl.
-
B.
H2SO3.
-
C.
H2SO4.
-
D.
HClO.
Đáp án : C
Học thuộc tên và kí hiệu hóa học tương ứng của axit
CTHH của axit sunfuric là: H2SO4
Dung dịch axit loãng H2SO4 khi phản ứng với chất nào dưới đây mà khí H2 không giải phóng ra (không được sinh ra)?
-
A.
Fe
-
B.
Cu.
-
C.
Mg.
-
D.
Al
Đáp án : B
Các kim loại đứng trước H trong dãy điện hóa mới phản ứng được với dd H2SO4
Cu là kim loại đứng sau H trong dãy điện hóa nên không phản ứng được với dd H2SO4 loãng, do vậy không sinh ra được khí H2
Sự khác biệt nhất trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
-
A.
Tác dụng được với oxit bazơ
-
B.
Tác dụng được với bazơ
-
C.
Tác dụng được với muối
-
D.
Khả năng hút nước mạnh (tính háo nước)
Đáp án : D
Axit sunfuric đặc có những tính chất hóa học riêng so với H2SO4 loãng
+ Tác dụng với hầu hết kim loại (trừ Au và Pt)
+ Tính háo nước
Khả năng tan của H2SO4 trong nước là
-
A.
rất ít
-
B.
ít
-
C.
bình thường
-
D.
nhiều
Đáp án : D
Axit sunfuric là chất lỏng sánh, không màu, nặng gấp đôi nước, không bay hơi, dễ tan trong nước, tỏa rất nhiều nhiệt.
Chất tác dụng được với dung dịch axit HCl là
-
A.
Ag.
-
B.
Cu.
-
C.
Fe.
-
D.
Au.
Đáp án : C
Kim loại đứng trước H trong dãy hoạt động hóa học của kim loại có pư với dd HCl.
Fe là kim loại đứng trước H trong dãy hoạt động hóa học của kim loại nên có pư với dd HCl
PTHH: Fe + 2HCl → FeCl2 + H2↑
Cho các chất sau: KOH, Cu, CaO, Mg, NaCl. Chất nào phản ứng được với dung dịch axit clohiđric ?
-
A.
KOH, CaO, Mg
-
B.
KOH
-
C.
Mg
-
D.
NaCl.
Đáp án : A
Tính chất hóa học của axit
+ Làm quỳ tím chuyển sang màu đỏ.
+ Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học, tạo ra muối và khí H2.
+ Tác dụng với oxit bazơ tạo ra muối và nước.
+ Tác dụng với bazơ tạo ra muối và nước.
+ Tác dụng với muối tạo ra muối mới và axit mới.
- Các chất tác dụng được với axit HCl là KOH, CaO, Mg.
- PTHH:
\(K{\rm{O}}H + HCl \to KCl + {H_2}O\)
\(CaO + 2HCl \to CaC{l_2} + {H_2}O\)
\(Mg + 2HCl \to MgC{l_2} + {H_2}\)
Chất nào sau đây có thể dùng làm thuốc thử để phân biệt dung dịch Na2SO4 và Na2CO3?
-
A.
BaCl2.
-
B.
HCl.
-
C.
NaOH.
-
D.
Ba(OH)2.
Đáp án : B
2 muối này có cùng gốc kim loại là Na khác gốc axit → chọn thuốc thử đặc trưng phân biệt ra 2 gốc axit
A. Loại vì cả 2 cùng có hiện tượng thu được kết tủa trắng
B. Chọn vì khi cho dd HCl lần lượt vào 2 dd trên, dd nào có khí thoát ra ngoài là Na2CO3 còn không có hiện tượng gì là Na2SO4
PTHH: 2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
C. Loại vì cho dd NaOH vào cả 2 dd đều không có hiện tượng gì
D. Loại vì cả 2 cùng có hiện tượng thu được kết tủa trắng
Nhóm chất tác dụng với nước và với dung dịch HCl là:
-
A.
K2O, P2O5, CaO
-
B.
CaO, BaO, Na2O.
-
C.
BaO, SO3, P2O5.
-
D.
Na2O, SO3, CO2.
Đáp án : B
Các oxit bazơ tan sẽ có phản ứng với nước và dd HCl
A. Loại P2O5 không tác dụng được với dd HCl
B. Thỏa mãn
PTHH: CaO + H2O → Ca(OH)2
BaO + H2O → Ba(OH)2
Na2O + H2O → 2NaOH
CaO + 2HCl → CaCl2 + H2O
BaO + 2HCl → BaCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
C. Loại SO3, P2O5 không tác dụng được với dd HCl
D. Loại SO3 không có pư với dd HCl
Chất nào dùng làm thuốc thử để phân biệt hai dung dịch axit clohidric và axit sunfuric?
-
A.
AlCl3.
-
B.
BaCl2.
-
C.
NaCl.
-
D.
MgCl2
Đáp án : B
Chọn thuốc thử đặc trưng để nhận ra gốc sunfat
Dùng BaCl2 để phân biệt dd HCl và dd H2SO4
Cho dd BaCl2 lần lượt vào 2 dung dịch trên
+ Dung dịch xuất hiện kết tủa trắng là H2SO4, còn lại không có hiện tượng gì là HCl
PTHH: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Khi cho kim loại Fe tác dụng với axit H2SO4 đặc, nóng, dư không tạo thành sản phẩm nào trong các sản phẩm sau đây?
-
A.
FeSO4
-
B.
H2O
-
C.
SO2
-
D.
Fe2(SO4)3
Đáp án : A
2Fe + 6H2SO4 (đặc) \(\xrightarrow{{{t^0}}}\) Fe2(SO4)3 + 3SO2↑ + 6H2O
→ pư không tạo FeSO4
Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường là:
-
A.
Không xảy ra hiện tượng gì
-
B.
Đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
-
C.
Đường tan trong axit tạo dung dịch trong suốt, không có bọt khí thoát ra
-
D.
Đường tan trong axit tạo dung dịch trong suốt, có bọt khí thoát ra.
Đáp án : B
Khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường thì đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
C6H12O6 \(\xrightarrow{{{H_2}S{O_{4\,}}dac}}\) 6C + 6H2O
Axit clohiđric có công thức hóa học là:
-
A.
H2SO4
-
B.
HCl
-
C.
H3PO4
-
D.
H2CO3
Đáp án : B
Axit clohiđric có công thức hóa học là: HCl
Chất tác dụng với dung dịch HCl loãng tạo thành chất khí nặng hơn không khí là:
-
A.
Mg
-
B.
CaO
-
C.
Zn
-
D.
Na2SO3
Đáp án : D
A. Tạo ra khí H2 nhẹ hơn không khí
B không tạo ra khí
C tạo ra khí H2 nhẹ hơn không khí
D tạo ra khí SO2 nặng hơn không khí
Để phân biệt ba dung dịch HCl, H2SO4, HNO3 , nên dùng
-
A.
quỳ tím, dd AgNO3
-
B.
dd Na2CO3 , dd AgNO3
-
C.
dd NaOH, dd AgNO3
-
D.
dd BaCl2, dd AgNO3
Đáp án : D
Để nhận biết 3 axit HCl, HNO3, H2SO4 ta dùng BaCl2 và AgNO3 vì
BaCl2 giúp nhận ra H2SO4 do chỉ tạo kết tủa trắng với chất này
AgNO3 nhận ra HCl sau khi nhận ra H2SO4 do tạo kết tủa trắng với HCl còn HNO3 thì không có hiện tượng
Dãy các oxit nào dưới đây tác dụng được với H2SO4 loãng?
-
A.
FeO, Na2O, NO2
-
B.
CaO,MgO,P2O5
-
C.
K2O, FeO, CaO
-
D.
SO2,BaO, Al2O3
Đáp án : C
A sai vì NO2 không tác dụng với H2SO4 loãng
B sai vì P2O5 không tác dụng với H2SO4 loãng
C đúng
D sai vì SO2 không phản ứng với H2SO4 loãng
Cặp chất nào sau đây tác dụng với nhau sinh ra chất khí cháy trong không khí với ngọn lửa màu xanh?
-
A.
Zn + HCl
-
B.
ZnO + HCl
-
C.
Zn(OH)2+ HCl
-
D.
NaOH + HCl
Đáp án : A
A đúng vì Zn + HCl → ZnCl2 + H2. H2 cháy dưới ngọn lửa màu xanh
B sai vì phản ứng không tạo ra khí
C sai vì phản ứng không tạo ra khí
D sai vì phản ứng không tạo ra khí
Chất nào có thể dùng để nhận biết axit sunfuric và muối sunfat ?
-
A.
NaCl
-
B.
BaCl2
-
C.
BaCO3
-
D.
Không nhận biết được
Đáp án : C
A sai vì NaCl không phản ứng với cả 2 chất nên không có hiện tượng
B sai vì BaCl2 tạo kết tủa trắng với cả 2 chất nên không phân biệt được
C đúng vì BaCO3 chỉ pư với H2SO4 tạo khí còn muối sunfat không pư
D sai vì có BaCO3 nhận biết được
Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí:
-
A.
Bari oxit và axit sunfuric loãng
-
B.
Bari hiđroxit và axit sunfuric loãng
-
C.
Bari cacbonat và axit sunfuric loãng
-
D.
Bari clorua và axit sunfuric loãng
Đáp án : C
PTHH: BaCO3 + H2SO4 → BaSO4↓ + H2O + CO2↑
Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit clohidric. Thể tích khí Hiđro thu được ở đktc là:
-
A.
44,8 lít
-
B.
4,48 lít
-
C.
2,24 lít
-
D.
22,4 lít
Đáp án : B
Đổi số mol của Mg: nMg = mMg : MMg = ? (mol)
Viết PTHH xảy ra: Mg + 2HCl → MgCl2 + H2
Tính số mol của H2 theo số mol của Mg: nH2 = nMg = ? (mol)
=> VH2(đktc) = nH2×22,4 = ? (lít)
nMg = mMg : MMg = 4,8 : 24 = 0,2mol
PTHH: Mg + 2HCl → MgCl2 + H2
1mol 2mol 1mol
0,2mol ? mol
VH2 = nH2 . 22,4 = 0,2 . 22,4 = 4,48l
Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
-
A.
13,6 g
-
B.
1,36 g
-
C.
20,4 g
-
D.
27,2 g
Đáp án : A
PTHH: Zn + 2HCl → ZnCl2 + H2
Theo PTHH: nZnCl2 = nZn = 0,1 (mol)
=> mZnCl2 = nZnCl2 . MZnCl2 = ? (g)
PTHH: Zn + 2HCl → ZnCl2 + H2
1mol 2mol 1mol
0,1mol ? mol
\({n_{ZnC{l_2}}} = \frac{{0,1.1}}{1} = 0,1mol.\)
m ZnCl2 = n ZnCl2 . M ZnCl2 = 0,1 . (65 + 35,5 . 2) = 13,6
Khi cho 500ml dung dịch NaOH 1M tác dụng vừa đủ với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là:
-
A.
250 ml
-
B.
400 ml
-
C.
500 ml
-
D.
125 ml
Đáp án : D
nNaOH = VNaOH . CM NaOH= 0,5 . 1 = 0,5mol
PTHH: 2NaOH + H2SO4 → Na2SO4 + H2O
2 mol 1 mol
0, 5mol ? mol
V H2SO4 = n H2SO4 : CM H2SO4 = 0,25 : 2 = 0,125l = 125ml
Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
-
A.
61,9% và 38,1%
-
B.
63% và 37%
-
C.
61,5% và 38,5%
-
D.
65% và 35%
Đáp án : A
Đối số mol: nH2 = VH2 : 22,4 = 2,24 : 22,4 = 0,1 mol
PTHH: Zn + H2SO4 → ZnSO4 + H2
Tính số mol Zn theo số mol H2: nZn = nH2 = ? (mol)
=> mZn = nZn . MZn = ? (mol)
%Zn = (mZn : mhh).100% = ?
%Cu = 100% - %Zn = ?
nH2 = VH2 : 22,4 = 2,24 : 22,4 = 0,1 mol
PTHH: Zn + H2SO4 → Zn SO4 + H2
1mol 1mol
? mol 0,1 mol
\({n_{Zn}} = \frac{{0,1.1}}{1} = 0,1mol.\)
=> mZn = MZn . nZn = 0,1 . 65 = 6,5g
=> %mZn = (6,5 : 10,5) . 100% = 61,90%
=> % mCu = 38,10%
Hòa tan vừa hết 20 gam hỗn hợp CuO và Fe2O3 trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp là:
-
A.
4 g và 16 g
-
B.
10 g và 10 g
-
C.
8 g và 12 g
-
D.
14 g và 6 g.
Đáp án : A
Gọi x, y lần lượt là số mol của CuO và Fe2O3
CuO + 2HCl → CuCl2 + H2O (1)
x → 2x
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
y → 6y
ta có mhh = mCuO + mFe2O3 = 80x + 160y = 20 (I)
nHCl = nHCl (1) + nHCl(2) = 2x + 6y = 0,7 (II)
Giải hệ (I) và (II) ta có x = ? và y = ?
=> mCuO = 80x = ? g
mFe2O3 =160y = ? g
gọi x, y lần lượt là số mol của CuO và Fe2O3
CuO + 2HCl → CuCl2 + H2O (1)
x → 2x
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
y → 6y
ta có mhh = mCuO + mFe2O3 = 80x + 160y = 20 (I)
nHCl = VHCl . CM HCl = 0,2 . 3,5 = 0,7 mol
nHCl = nHCl (1) + nHCl(2) = 2x + 6y = 0,7 (II)
Giải hệ (I) và (II) ta có x = 0,05 và y = 0,1
=> mCuO = 0,05 . 80 = 4g
mFe2O3 = 0,1 . 160 = 16g
Hòa tan 7,74 gam hỗn hợp 2 kim loại Mg, Al trong 500ml dung dịch hỗn hợp chứa HCl 1M và H2SO4 0,38M loãng. Thu được dung dịch A và 8,736 lít khí H2 (đktc). Khối lượng muối có trong dung dịch A là
-
A.
38 gam
-
B.
40 gam
-
C.
42 gam
-
D.
36 gam
Đáp án : B
So sánh số mol H có trong tổng HCl và H2SO4 với số mol H có trong H2 từ đó rút được axit pư dư, kim loại phản ứng hết
TH1: giả sử HCl phản ứng hết, H2SO4 dư
Tính được: mmuối 1 = mKL + mHCl + mH2SO4 pư - mH2 = ?
TH2: giả sử H2SO4 phản ứng hết, HCl dư
Tính được mmuối 2 = mKL + mHCl pư + mH2SO4 - mH2 = ?
Vì thực tế phản ứng xảy ra đồng thời nên cả 2 axit đều dư
Vì thực tế phản ứng xảy ra đồng thời nên 2 axit cùng dư sau phản ứng
⟹ mmuối 1 < mmuối A < mmuối 2
PTHH: Mg + 2HCl → MgCl2 + H2↑ (1)
2Al + 6HCl → 2AlCl3 + 3H2↑ (2)
Mg + H2SO4 → MgSO4 + H2↑ (3)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (4)
500 ml = 0,5 (lít)
\(\left. \begin{array}{l} \Rightarrow {n_{HCl}} = 0,5.1 = 0,5\,(mol)\\ \Rightarrow {n_{{H_2}S{O_4}}} = 0,5.0,38 = 0,19\,(mol)\end{array} \right\} \Rightarrow {n_H} = {n_{HCl}} + 2{n_{H2SO4}} = 0,5 + 2.0,19 = 0,88\,(mol)\)
nH2(đktc) = 8,736/22,4 = 0,39 (mol) ⟹ nH = 2nH2 = 2.0,39 = 0,78 (mol)
Ta thấy: 0,88 > 0,78 nên axit dư, kim loại phản ứng hết.
TH1: giả sử HCl phản ứng hết, H2SO4 dư
nHCl = 0,5 (mol) ⟹ nH2 (1)+(2) = 1/2nHCl = 1/2.0,5 = 0,25 (mol)
⟹ nH2 (3)+(4) = 0,39 - 0,25 = 0,14 (mol) ⟹ nH2SO4 pư = 0,14 (mol)
Theo ĐL BTKL ta có:
mmuối = mKL + mHCl + mH2SO4 pư - mH2 = 7,74 + 0,5.36,5 + 0,14.98 - 0,39.2 = 38,93 (g)
TH2: giả sử H2SO4 phản ứng hết, HCl dư
nH2SO4 = 0,19 (mol) ⟹ nH2(3)+(4) = 0,19 (mol)
⟹ nH2(1)+(2) = 0,39 - 0,19 = 0,2 (mol) ⟹ nHCl pư = 2.0,2 = 0,4 (mol)
Theo ĐLBTKL ta có: mmuối = mKL + mHCl pư + mH2SO4 - mH2 = 7,74 + 0,4.36,5 + 0,19.98 - 0,39.2 = 40,18 (g)
Vì thực tế phản ứng xảy ra đồng thời nên cả 2 axit đều dư
Suy ra tổng khối lượng muối A thu được là: 38,93 (g) < mmuối A < 40,18 (g)
Thể tích khí sinh ra ở đktc khi cho hỗn hợp gồm 9 (g) Al và 6,5 (g) Zn vào 100 ml dung dịch HCl 1M và H2SO4 1M là:
-
A.
1,12 (lít).
-
B.
3,36 (lít).
-
C.
26,88 (lít).
-
D.
4,48 (lít).
Đáp án : B
Bước 1: viết PTHH xảy ra
Bước 2: Nhận thấy:
∑nH2 = 3/2 nAl + nZn
⟹ Số mol nguyên tử H cần dùng để phản ứng hết với kim loại là:nH = 2nH2 = ?2a (mol)
Mặt khác, số mol nguyên tử H trong axit có: nH = nHCl + 2nH2SO4 = ?b (mol)
Bước 3: So sánh giá trị 2a với b từ đó rút ra kết luận axit hay kim loại phản ứng hết. Mọi tính toán theo chất pư hết.
\(\begin{array}{l}{n_{Al}} = \frac{9}{{27}} = \frac{1}{3}\,(mol)\\{n_{Zn}} = \frac{{6,5}}{{65}} = 0,1\,(mol)\\{n_{HCl}} = 0,1 \cdot 1 = 0,1(mol)\\{n_{{H_2}S{O_4}}} = 0,1 \cdot 1 = 0,1(mol)\end{array}\)
Các pthh xảy ra là:
2Al + 6HCl → 2AlCl3 + 3H2 (1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2)
Zn + 2HCl → ZnCl2 + H2 (3)
Zn + H2SO4 → ZnSO4 + H2 (4)
Nhận thấy:
∑nH2 = \(\frac{3}{2}{n_{Al}} + {n_{Zn}} = \frac{3}{2}.\frac{1}{3} + 0,1 = 0,6\,(mol)\)
⟹ Số mol nguyên tử H cần dùng để phản ứng hết với kim loại là: nH = 2nH2 = 2.0,6 = 1,2 (mol)
Mặt khác, số mol nguyên tử H trong axit có: nH = nHCl + 2nH2SO4 = 0,1 + 2.0,1 = 0,3 (mol)
Ta thấy 1,2 > 0,3 do đó kim loại phản ứng dư, axit hết. Mọi tính toán theo số mol của axit
⟹ nH2 = 1/2nH = 1/2. 0,3 = 0,15 (mol) ⟹ VH2(đktc) = 0,15.22,4 = 3,36 (lít)
Cho 8 gam Mg, Fe vào dung dịch HCl vừa đủ. Sau phản ứng thu được m gam muối. Hỏi m nằm trong khoảng nào?
-
A.
18,14 (g) < m < 31, 67 (g)
-
B.
21,14 (g) < m < 31, 67 (g)
-
C.
16,18 (g) < m < 20,67 (g)
-
D.
15,14 (g) < m < 31, 67 (g)
Đáp án : A
* Giả sử hỗn hợp chỉ có Mg
* Giả sử hỗn hợp chỉ có Fe
Tính lượng muối thu được mỗi trường hợp.
Vì hh ban đầu chứa cả Mg và Fe nên: lượng muối do Fe tạo ra < lượng muối thực tế < lượng muối do Mg tạo ra
PTHH: Mg + 2HCl → MgCl2 + H2 (1)
Fe + 2HCl → FeCl2 + H2 (2)
* Giả sử hỗn hợp chỉ có Mg ⟹ mMg = 8 (g) ⟹ \({n_{Mg}} = \frac{{{m_{Mg}}}}{{{M_{Mg}}}} = \frac{8}{{24}} = \frac{1}{3}\,\,(mol)\)
Theo PTHH (1): nMgCl2 = nMg = \(\frac{1}{3}\) (mol) ⟹ mMgCl2 = nMgCl2×MMgCl2 = \(\frac{1}{3} \times 95 \approx 31,67\,(g)\)
* Giả sử hỗn hợp chỉ có \(Fe\)\( \Rightarrow {n_{Fe}} = \frac{8}{{56}} = \frac{1}{7}(mol)\)
Theo PTHH (2): nFeCl2 = nFe = \(\frac{1}{7}(mol)\) ⟹ mFeCl2 = nFeCl2 × MFeCl2 = \(\frac{1}{7} \times 127 \approx 18,14\,(g)\)
Vì ban đầu chứa hỗn hợp kim loại nên: mFeCl2 < mmuối thu được < mMgCl2
⟹ 18,14 < mmuối thu được < 31, 67 (g)
Cho 8,4 gam Mg, Zn vào dung dịch H2SO4 vừa đủ. Sau phản ứng thu được dung dịch X, 3,6 (g) chất rắn và 4,48 (l) khí ở đktc. Phần trăm khối lượng kim loại Zn có trong hỗn hợp là:
-
A.
30%
-
B.
50%
-
C.
60%
-
D.
65%
Đáp án : A
TH1: Giả sử chỉ có phản ứng, Zn chưa phản ứng
TH2: Giả sử có cả Mg và Zn đều phản ứng.
Biện luận chất rắn thu được theo tính toán với theo đề bài cho mỗi trường hợp để xem trường hợp nào thỏa mãn.
- Khí tạo thành sau phản ứng là \({H_2}\)
\({n_{{H_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\)
- Giả sử chỉ có Mg phản ứng, Zn chưa phản ứng
PTHH: Mg + H2SO4 → MgSO4 + H2↑
⟹ nMg = nH2 = 0,2 (mol)
⟹ mMg = 0,2.24 = 4,8 (g)
⟹ Khối lượng kim loại còn lại là: mKL = 8,4 - 4,8 = 3,6 (g) = 3,6 (g) chất rắn đề bài cho
⟹ 3,6 gam chất rắn thu được sau phản ứng chứa Zn và có thể có Mg dư
Suy ra trong hh ban đầu: mMg ≥ mMg pư => mMg bđ ≥ 4,8 (g)
\(\begin{array}{l} \Rightarrow \% {m_{Mg}} \ge \frac{{4,8}}{{8,4}}.100\% \\ \Rightarrow \% {m_{Mg}} \ge 57,14\% \end{array}\)
⟹ Phần trăm khối lượng Zn ≤ 100% - 57,14
⟹ % mZn ≤ 42,86%
Dựa vào đáp án ta thấy chỉ có đáp án A thỏa mãn
Cho 8 gam Mg, Al vào dung dịch \(HCl\) vừa đủ. Sau phản ứng thu được dung dịch X, 2,36 (g) chất rắn và 6,272 (l) khí ở đktc. Phần trăm khối lượng mỗi kim loại có trong hỗn hợp lần lượt là.
-
A.
40% và 60%.
-
B.
60% và 40%.
-
C.
30% và 70%.
-
D.
70% và 30%.
Đáp án : C
TH1: Giả sử chỉ có phản ứng, Al chưa phản ứng
TH2: Giả sử có cả Mg và Al đều phản ứng.
Biện luận chất rắn thu được theo tính toán với theo đề bài cho mỗi trường hợp để xem trường hợp nào thỏa mãn.
- Khí tạo thành sau phản ứng là \({H_2}\)
\({n_{{H_2}}} = \frac{{6,272}}{{22,4}} = 0,28(mol)\)
- Giả sử chỉ có \(Mg\)phản ứng, Al chưa phản ứng
PTHH: Mg + 2HCl → MgCl2 + H2↑
⟹ nMg = nH2 = 0,28 (mol)
⟹ mMg = 0,28.24 = 6,72 (g)
⟹ Khối lượng kim loại còn lại là: mKL = 8 - 6,72 = 1,28 (g) # 2,36 (g) ⟹ loại.
- Giả sử có cả Mg và Al đều phản ứng. Do Mg là kim loại hoạt động mạnh hơn Al nên Mg pư hết trước, sau đó mới đến Al pư.
⟹ Chất rắn còn dư là Al
mMg + mAl pu = 8 - 2,36 = 5,64 (g)
Đặt nMg = x (mol); nAl pư = y (mol)
PTHH: Mg + 2HCl → MgCl2 + H2↑
(mol) x → x
2Al + 6HCl → AlCl3 + 3H2↑
(mol) y → 1,5y
Theo bài ra ta có hệ phương trình sau:
\(\left\{ \begin{array}{l}\sum {{n_{{H_2}}} = \,} x + 1,5y = 0,28\\\sum {m{\,_{hh}} = \,} 24x + 27y = 5,64\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}x = 0,1(mol) = {n_{Mg}}\\y = 0,12(mol) = {n_{Al\,pu}}\end{array} \right.\)
Phần trăm khối lượng mỗi kim loại có trong hỗn hợp là:
\(\left\{ \begin{array}{l}\% {m_{Mg}} = \frac{{{m_{Mg}}}}{{{m_{hh}}}}.100\% = \frac{{0,1.24}}{8}.100\% = 30\% \\\% {m_{Al}} = 100\% - 30\% = 70\% \end{array} \right.\)
Hòa tan hoàn toàn hỗn hợp gồm 16 gam CuO và 4 gam MgO trong dung dịch H2SO4 20% vừa đủ. Tính khối lượng dung dịch H2SO4 đã dùng.
-
A.
29,4 gam
-
B.
147 gam
-
C.
98 gam
-
D.
49 gam
Đáp án : B
- Tính số mol CuO và MgO.
- Viết các PTHH xảy ra, tính số mol H2SO4 theo CuO và MgO.
- Tính khối lượng H2SO4, tính khối lượng dung dịch H2SO4 dựa vào C%: \({m_{{\rm{dd}}}} = \frac{{{m_{ct}}.100}}{{C\% }}\)
PTHH: CuO + H2SO4 → CuSO4 + H2O
MgO + H2SO4 → MgSO4 + H2O
Ta có: \({n_{CuO}} = \frac{{16}}{{80}} = 0,2(mol);{n_{MgO}} = \frac{4}{{40}} = 0,1(mol)\)
CuO + H2SO4 → CuSO4 + H2O
(mol) 0,2 → 0,2
MgO + H2SO4 → MgSO4 + H2O
(mol) 0,1 → 0,1
\( \Rightarrow {\sum n _{{H_2}S{O_4}}} = 0,2 + 0,1 = 0,3(mol) \Rightarrow {m_{{H_2}S{O_4}}} = 0,3.98 = 29,4(g) \Rightarrow {m_{{\rm{dd}}}} = \frac{{29,4.100}}{{20}} = 147(g)\)
Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là:
-
A.
10,2 gam.
-
B.
8,3 gam.
-
C.
2,7 gam
-
D.
16,6 gam.
Đáp án : B
\({n_{{H_2}}}(dktc) = {{5,6} \over {22,4}} = 0,25\,\,(mol)\)
Đặt số mol Al = số mol Fe = x (mol)
PTHH:
2Al + 6HCl → 2AlCl3 + 3H2↑
x → 1,5x (mol)
Fe + 2HCl → FeCl2 + H2↑
x → x (mol)
Tổng số mol H2 là: 1,5x + x = 0,25 => x = ? (mol)
=> mhh = mAl + mFe = 27x + 56x = ? (g)
\({n_{{H_2}}}(dktc) = {{5,6} \over {22,4}} = 0,25\,\,(mol)\)
Đặt số mol Al = số mol Fe = x (mol)
PTHH:
2Al + 6HCl → 2AlCl3 + 3H2↑
x → 1,5x (mol)
Fe + 2HCl → FeCl2 + H2↑
x → x (mol)
Tổng số mol H2 là: 1,5x + x = 0,25 => x = 0,1 (mol)
=> mhh = mAl + mFe = 0,1.27 + 0,1.56 = 8,3
Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là:
-
A.
100.
-
B.
200.
-
C.
300.
-
D.
400
Đáp án : B
Bước 1: Đổi số mol Fe: \({n_{FeO}} = {{{m_{FeO}}} \over {{M_{FeO}}}} = ?\,\,(mol)\)
Bước 2: Viết phương trình phản ứng xảy ra, tính mol HCl theo mol FeO
Bước 3: Tính VHCl = nHCl : CM = ?
\({n_{Fe}} = {{14,4} \over {72}} = 0,2\,\,(mol)\)
PTPƯ: FeO + 2HCl → FeCl2 + H2O
0,2 → 0,4 (mol)
VHCl = nHCl : CM = 0,4 : 2 = 0,2 (lít) = 200 (ml)
Hòa tan m gam oxit sắt cần 150 ml dd HCl 3M . Mặt khác, khử toàn bộ m gam oxit sắt bằng CO nóng, dư thu được 8,4 gam sắt. Công thức oxit sắt là
-
A.
FeO
-
B.
Fe2O3
-
C.
Fe3O4
-
D.
cả A,B,C đều đúng
Đáp án : B
nFe = 8,4/56= 0,15 mol
nHCl = 0,15.3=0,45 mol
FexOy + 2yHCl→x FeCl2y/x +y H2O
nO(oxit) = nHCl/2 = 0,45/2= 0,225mol
=> Fe:O
nFe = 8,4/56= 0,15 mol
nHCl = 0,15.3=0,45 mol
FexOy + 2yHCl→x FeCl2y/x +y H2O
nO(oxit) = nHCl/2 = 0,45/2= 0,225mol
=> Fe:O = 2:3
=> Fe2O3
Cho hỗn hợp Al và 1 kim loại hóa trị II tan trong dung dịch H2SO4 loãng vừa đủ thu được dung dịch A và có H2 thoát ra. Cho A tác dụng với dung dịch BaCl2 vừa đủ thấy tách ra 93,2 gam kết tủa trắng. Lọc kết tủa rồi cô cạn nước lọc thu được 36,2 gam muối khan. Khối lượng kim loại ban đầu là
-
A.
7,8
-
B.
7,9
-
C.
8
-
D.
8,6
Đáp án : A
nBaSO4 = 93,2/233= 0,4 mol = nBaCl2
=> nCl (muối khan) = 2 nBaCl2 = 0,8 mol
m muối khan = mKl + mClo = mKl + 0,8.35,5 = 36,2
=> mKL
nBaSO4 = 93,2/233= 0,4 mol = nBaCl2
=> nCl (muối khan) = 2 nBaCl2 = 0,8 mol
m muối khan = mKl + mClo = mKl + 0,8.35,5 = 36,2
=> mKL= 7,8 g
Cho hỗn hợp A gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí X ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần phần trăm theo khối lượng của hỗn hợp Fe và FeS ban đầu lần lượt là
-
A.
38,89% và 61,11%.
-
B.
50% và 50%.
-
C.
35% và 65%.
-
D.
61,11% và 38,89%.
Đáp án : A
Mhh khí = 9.2=18 (g/mol)
nhh khí = V/22,4= 0,1 mol
Dùng quy tắc đường chéo, tính được từng mol H2, H2S
PTHH:
Fe + 2HCl→FeCl2 +H2
FeS +2HCl →FeCl2 + H2S
Tính số mol Fe, FeS theo số mol H2 ; H2S
=> mA = mFe + mFeS
=> %mFe, %mFeS
Mhh khí = 9.2=18 (g/mol)
nhh khí = V/22,4= 0,1 mol
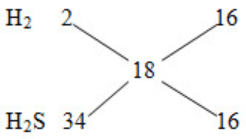
=> nH2= nH2S = 0,05 mol
Fe + 2HCl→FeCl2 +H2
0,05 0,05
FeS +2HCl →FeCl2 + H2S
0,05 0,05
=> mA = mFe + mFeS = 0,05.56 + 0,05.88=7,2 g
\(\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{{m_A}}}.100\% = \frac{{0,05.56}}{{7,2}}.100\% = 38,89\% \)
%mFeS = 100%- %mFe= 61,11%
Hòa tan hết muối cacbonat trung hòa của kim loại A bằng dung dịch H2SO4 vừa đủ nồng độ 19,6% thì thu được dung dịch chứa muối sunfat nồng độ 26,57%. Xác định kim loại A
-
A.
Zn
-
B.
Al
-
C.
Fe
-
D.
Mg
Đáp án : C
Giả sử dùng 1 mol A2 (CO3)n
A2 (CO3)n + nH2SO4 →A2(SO4)n + nH2O + nCO2
1 n 1 n
mdd = mA2(CO3)n + mdd H2SO4 -mCO2
\(\frac{{2{\text{A}} + 96n}}{{2{\text{A}} + 60n + \frac{{98n.100}}{{19,6}} - 44n}}.100 = 26,57\)
Giả sử dùng 1 mol A2 (CO3)n
A2 (CO3)n + nH2SO4 →A2(SO4)n + nH2O + nCO2
1 n 1 n
mdd = mA2(CO3)n + mdd H2SO4 -mCO2
\(\frac{{2{\text{A}} + 96n}}{{2{\text{A}} + 60n + \frac{{98n.100}}{{19,6}} - 44n}}.100 = 26,57\)
=> A= 28n
=> n=2, A=56 (Fe)
Một hỗn hợp kim loại gồm Al, Cu, Fe . Nếu cho hỗn hợp này tác dụng với dung dịch HCl dư thì thu được 8,96 lít khí (đktc) và 9 gam chất rắn. Nếu cho hỗn hợp này tác dụng vừa đủ với dung dịch NaOH thì phải dùng 100 ml dung dịch NaOH 2M. % khối lượng của Fe trong hỗn hợp là
-
A.
27%
-
B.
50%
-
C.
28%
-
D.
45%
Đáp án : C
mchất rắn = mCu = 9 gam
nNaOH= 0,1.2=0,2 mol
nH2= V/22,4= 0,4 mol
Al + NaOH +H2O →NaAlO2 + \(\frac{3}{2}\)H2
2Al +6HCl →2AlCl3 + 3H2
Fe + 2HCl→FeCl2 + H2
Đặt số mol các chất vào PTHH, tính toán theo PTHH
=> mhh = mAl + mFe + mCu
=> %mFe
mchất rắn = mCu = 9 gam
nNaOH= 0,1.2=0,2 mol
nH2= V/22,4= 0,4 mol
Al + NaOH +H2O →NaAlO2 + \(\frac{3}{2}\)H2
0,2 0,2
2Al +6HCl →2AlCl3 + 3H2
0,2 0,3
Fe + 2HCl→FeCl2 + H2
0,1 0,1
=> mhh = mAl + mFe + mCu = 0,2.27+0,1.56+ 9= 20 gam
=> \(\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{{m_{hh}}}}.100\% = \frac{{0,1.56}}{{20}}.100\% = 28\% \)
Cho 122,4g hỗn hợp X gồm Cu, Fe3O4 vào dung dịch H2SO4 đặc, nóng thu được 10,08 lít SO2 (đktc), dung dịch Y và còn lại 4,8g kim loại. Cô cạn dung dịch Y thu được m gam muối khan. Tính m.
-
A.
215,6 (g)
-
B.
267,8 (g)
-
C.
256,8 (g)
-
D.
207,8 (g)
Đáp án : C
2Fe3O4 + 10H2SO4(đ) \(\xrightarrow{{{t^0}}}\) 3Fe2(SO4)3 + SO2 + 10H2O (1)
x (mol) →
Cu + 2H2SO4 (đ) \(\xrightarrow{{{t^0}}}\) CuSO4 + SO2 + 2H2O (2)
y (mol) → y
Cu + Fe2(SO4)3 \(\xrightarrow{{}}\) CuSO4 + 2FeSO4 (3)
1,5x ←1,5x
Do sau phản ứng còn 4,8 gam kim loại dư nên dd Y là FeSO4, CuSO4. Kim loại dư là Cu.
2Fe3O4 + 10H2SO4(đ) \(\xrightarrow{{{t^0}}}\) 3Fe2(SO4)3 + SO2 + 10H2O (1)
x (mol) →
Cu + 2H2SO4 (đ) \(\xrightarrow{{{t^0}}}\) CuSO4 + SO2 + 2H2O (2)
y (mol) → y
Cu + Fe2(SO4)3 \(\xrightarrow{{}}\) CuSO4 + 2FeSO4 (3)
1,5x ←1,5x
Do sau phản ứng còn 4,8 gam kim loại dư nên dd Y là FeSO4, CuSO4. Kim loại dư là Cu.
Gọi số mol Fe3O4 là x; số mol Cu pư ở (2) là y (x, y>0)
Theo (1), (3): \({n_{Cu}} = \frac{3}{2}{n_{F{e_3}{O_4}}} = 1,5x\)
Khối lượng Fe3O4 và Cu phản ứng:
232x + 64(y+1,5x) = 122,4 - 4,8
→328x + 64y = 117,6 (I)
Theo (1), (2): \({n_{S{O_2}}} = \frac{x}{2} + y = \frac{{10,08}}{{22,4}} = 0,45\)
Giải hệ:
\(\left\{ \begin{gathered}
328x + 64y = 117,6 \hfill \\
x + 2y = 0,9 \hfill \\
\end{gathered} \right. \Leftrightarrow \left\{ \begin{gathered}
x = 0,3(mol) \hfill \\
y = 0,3(mol) \hfill \\
\end{gathered} \right.\)
Theo (2), (3): \({n_{C{\text{uS}}{O_4}}} = y + 1,5x = 0,75(mol)\)
Theo (1), (3): \0({n_{{\text{FeS}}{O_4}}} = 3x = 0,9(mol)\)
Khối lượng muối: m = 0,75.160 + 0,9.152=256,8(g)
Luyện tập và củng cố kiến thức Bài 7. Tính chất hóa học của bazơ Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 8. Một số bazơ quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Tính chất hóa học của muối Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Một số muối quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 11. Phân bón hóa học Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3. Tính chất hóa học của axit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập oxit axit tác dụng với dung dịch kiềm Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2. Một số oxit quan trọng Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận