Trắc nghiệm Bài 16.Tính chất hóa học của kim loại - Hóa học 9
Đề bài
Tính chất hóa học chung của kim loại gồm:
-
A.
Tác dụng với phi kim, tác dụng với axit.
-
B.
Tác dụng với phi kim, tác dụng với bazơ, tác dụng với muối.
-
C.
Tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
-
D.
Tác dụng với oxit bazơ, tác dụng với axit.
Kim loại nhôm bị hòa tan bởi H2SO4 loãng, thu được muối sunfat và khí hiđro. Phản ứng mô tả hiện tượng trên là
-
A.
2Al + H2SO4 → Al2(SO4)3 + H2
-
B.
2Al + H2SO4 → Al2SO4 + H2
-
C.
Al + 3H2SO4 → Al(SO4)3 + H2
-
D.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy nào dưới đây?
-
A.
FeCl3, MgO, Cu, Ca(OH)2
-
B.
NaOH, CuO, Ag, Zn
-
C.
Mg(OH)2, CaO, K2SO3, SO2
-
D.
Al, Al2O3, Fe(OH)3, BaCl2
Cho các kim loại Fe, Cu, Ag, Al, Mg. Trong các kết luận sau đây, kết luận nào sai ?
-
A.
Kim loại tác dụng với dung dịch HCl, H2SO4 loãng: Cu, Ag
-
B.
Kim loại tác dụng với dung dịch CuSO4 : Fe, Al, Mg
-
C.
Kim loại không tác dụng với H2SO4 đặc nguội: Al, Fe
-
D.
Kim loại không tan trong nước ở nhiệt độ thường: Tất cả các kim loại trên
Cho phản ứng: Zn + CuSO4 → muối X + kim loại Y. X là
-
A.
ZnSO4
-
B.
CuSO4
-
C.
Cu
-
D.
Zn
Một bạn học sinh đã đổ nhầm dung dịch sắt (II) sunfat vào lọ chứa sẵn dung dịch kẽm sunfat. Để thu được dung dịch chứa duy nhất muối kẽm sunfat, theo em dùng kim loại nào ?
-
A.
Đồng
-
B.
Sắt
-
C.
Kẽm
-
D.
Nhôm
Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng. Kim loại A là:
-
A.
Cu
-
B.
Zn
-
C.
K
-
D.
Na
Để oxi hóa hoàn toàn một kim loại R thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. R là kim loại nào sau đây ?
-
A.
Fe
-
B.
Al
-
C.
Mg
-
D.
Ca
Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây? (biết hóa trị của kim loại trong khoảng từ I đến III).
-
A.
Ca
-
B.
Mg
-
C.
Al
-
D.
Fe
Đốt cháy hoàn toàn 9,6 gam một kim loại M (chưa rõ hóa trị) trong bình chứa khí clo nguyên chất. Sau khi phản ứng kết thúc, để nguội thì thu được 20,25 gam muối clorua. Kim loại M là
-
A.
Fe
-
B.
Al
-
C.
Cu
-
D.
Zn
Cho 1,3 gam kẽm phản ứng với 14,7 gam dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng khí thoát ra là:
-
A.
0,03 gam
-
B.
0,06 gam
-
C.
0,04 gam
-
D.
0,02 gam
Hòa tan 2,7 gam kim loại A bằng dung dịch H2SO4 loãng dư. Sau phản ứng thu được 3,36 lít H2 (đktc). Kim loại A là:
-
A.
Fe
-
B.
Sn
-
C.
Zn
-
D.
Al
Cho 1,08 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
-
A.
Niken
-
B.
Canxi
-
C.
Nhôm
-
D.
Sắt
Cho 6,5 gam Zn vào dung dịch HCl dư. Hỏi thể tích khí thu được từ phản ứng ở đktc là bao nhiêu? (cho Zn = 65)
-
A.
1,12 lít
-
B.
2,24 lít
-
C.
3,36 lít
-
D.
22,4 lít.
Cho phản ứng hóa học: x… + H2SO4 -> FeSO4 + y…↑. Tổng (x + y) có thể là:
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
-
A.
Al.
-
B.
Fe.
-
C.
Mg.
-
D.
Cu.
Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
-
A.
0,1 mol.
-
B.
0,2 mol.
-
C.
0,3 mol.
-
D.
0,4 mol.
Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch H2SO4 9,8% (loãng) vừa đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là:
-
A.
Mg.
-
B.
Fe.
-
C.
Zn.
-
D.
Cu.
Chọn câu đúng nhất khi nói đến tính chất hóa học của kim loại
-
A.
Dãy gồm các kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thường) sẽ tạo thành các oxit bazơ tương ứng với nó.
-
B.
Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Mg, Ca) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
-
C.
Hầu hết tất cả các kim loại có thể phản ứng với dung dịch axit HCl hoặc H2SO4 loãng để giải phóng khí hiđro và sinh ra muối.
-
D.
Ở nhiệt độ cao, các kim loại như Cu, Mg, Fe…phản ứng với lưu huỳnh tạo thành sản phẩm là muối sunfua tương ứng là CuS, MgS, FeS.
Cho các phương trình hóa học sau:
(1) Cu + Fe(NO3)2 → Fe + Cu(NO3)2.
(2) Al + FeSO4 → Fe + Al2(SO4)3
(3) Mg + CuCl2 → MgCl2 + Cu
(4) Ba + Na2SO4 + 2H2O → BaSO4 + 2NaOH + H2.
Số phương trình hóa học viết chưa đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Nung hỗn hợp gồm 5,6 gam sắt và 1,6 gam lưu huỳnh trong điều kiện không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 0,5M phản ứng vừa đủ với chất rắn A thu được hỗn hợp khí B. Thể tích dung dịch HCl 0,5M đã dùng là
-
A.
100 ml
-
B.
200 ml.
-
C.
300 ml.
-
D.
400 ml.
Hòa tan 2,8 gam một kim loại R có hóa trị II bằng một hỗn hợp gồm 80 ml dung dịch H2SO4 0,5M và 200 ml dung dịch HCl 0,2M thu được dung dịch A và V lít khí H2(ở đktc). Để trung hòa dung dịch A thì cần 100 ml dung dịch KOH 0,2M. Phát biểu nào dưới đây về bài toán trên là chưa đúng?
-
A.
Kim loại R không tan được trong nước ở điều kiện thường.
-
B.
Kim loại R khi phản ứng với lưu huỳnh sẽ tạo ra chất rắn có màu đen.
-
C.
Giá trị của V là 1,12.
-
D.
Thành phần phần trăm về khối lượng của R (hóa trị II) trong hợp chất muối sunfat ứng với R là 28%.
Có các phản ứng sau:
a. HCl + (A) → MgCl2 + H2 b. AgNO3 + (B) → Cu(NO3)2 + Ag
c. S + (C) → K2S d. (D) + Cl2 → ZnCl2
(A), (B), (C), (D) lần lượt là:
-
A.
KCl, MgO, CuO,ZnO
-
B.
Zn, Mg, K,Cu
-
C.
Mg, Cu, K,Zn
-
D.
MgO, CuO, KCl,ZnO
Đốt cháy hoàn toàn 1,35g nhôm trong oxi. .Khối lượng nhôm oxit tạo thành và khối lượng oxi đã tham gia phản ứng là:
-
A.
2,25g và 1,2g
-
B.
2,55g và 1,28g
-
C.
2,55 và 1,2g
-
D.
2,7 và 3,2 g
Cho 1 gam Na phản ứng với 1 gam khí clo. Khối lượng muối NaCl thu được là:
-
A.
2 gam
-
B.
1 gam
-
C.
0,5 gam
-
D.
1,648 gam
Cho một lượng Fe tác dụng với 100 ml dung dịch H2SO4 aM loãng, vừa đủ. Sau phản ứng thu được dung dịch chứa 22,8 gam muối sunfat và V lít khí H2 ở đktc. Giá trị của a và V lần lượt là?
-
A.
1M và 2,24 lít.
-
B.
1,5M và 2,24 lít.
-
C.
1,5M và 3,36 lít.
-
D.
1M và 3,36 lít.
Đốt cháy hoàn toàn cùng một khối lượng các kim loại sau: Al, Mg, Zn, Cu ; kim loại nào cần dùng số mol khí O2 lớn nhất?
-
A.
Al.
-
B.
Mg.
-
C.
Zn.
-
D.
Cu.
Cho các kim loại sau: Fe, Ag, Hg, Zn. Số kim loại có thể dùng để điều chế Cu bằng phản ứng với dung dịch CuSO4 là?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Kim loại nào sau đây không thể điều chế bằng phương pháp nhiệt luyện?
-
A.
K.
-
B.
Zn.
-
C.
Fe.
-
D.
Cu.
Cho sơ đồ phản ứng sau (với R là kim loại):
R \(\xrightarrow{{ + ZnS{O_4}}}\)X.
R \(\xrightarrow{{ + {O_2},{t^o}}}\)A \(\xrightarrow{{ + {H_2}S{O_4}loang}}\)X.
R \(\xrightarrow{{ + {H_2}S{O_4}loang}}\)X.
R có thể là kim loại nào trong các kim loại sau: Cu, Fe, Mg, Ag?
-
A.
Cu.
-
B.
Fe.
-
C.
Mg.
-
D.
Ag.
Thực hiện các thí nghiệm sau:
(a) Cho Na tác dụng với dung dịch CuCl2 dư.
(b) Cho hỗn hợp Fe và Ag tác dụng với dung dịch CuSO4 dư.
(c) Cho Zn tác dụng với dung dịch AgNO3 dư.
(d) Cho hỗn hợp Fe, Mg tác dụng với dung dịch CuSO4 dư.
Sau khi phản ứng xảy ra hoàn toàn, số thí nghiệm thu được chất rắn chứa 1 kim loại là?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Cặp chất nào sau đây có thể tác dụng với nhau?
-
A.
Cu + ZnSO4.
-
B.
Fe + ZnCl2.
-
C.
Zn + Cu(NO3)2.
-
D.
Cu + CuCl2.
Lời giải và đáp án
Tính chất hóa học chung của kim loại gồm:
-
A.
Tác dụng với phi kim, tác dụng với axit.
-
B.
Tác dụng với phi kim, tác dụng với bazơ, tác dụng với muối.
-
C.
Tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
-
D.
Tác dụng với oxit bazơ, tác dụng với axit.
Đáp án : C
Xem lại lí thuyết tính chất hóa học chung của kim loại
Tính chất hóa học chung của kim loại gồm: tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
Kim loại nhôm bị hòa tan bởi H2SO4 loãng, thu được muối sunfat và khí hiđro. Phản ứng mô tả hiện tượng trên là
-
A.
2Al + H2SO4 → Al2(SO4)3 + H2
-
B.
2Al + H2SO4 → Al2SO4 + H2
-
C.
Al + 3H2SO4 → Al(SO4)3 + H2
-
D.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Đáp án : D
Phản ứng đúng là: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy nào dưới đây?
-
A.
FeCl3, MgO, Cu, Ca(OH)2
-
B.
NaOH, CuO, Ag, Zn
-
C.
Mg(OH)2, CaO, K2SO3, SO2
-
D.
Al, Al2O3, Fe(OH)3, BaCl2
Đáp án : D
Axit H2SO4 loãng phản ứng được với: Al, Al2O3, Fe(OH)3, BaCl2
Loại A vì Cu không phản ứng
Loại B vì Ag không phản ứng
Loại C vì SO2 không phản ứng
Cho các kim loại Fe, Cu, Ag, Al, Mg. Trong các kết luận sau đây, kết luận nào sai ?
-
A.
Kim loại tác dụng với dung dịch HCl, H2SO4 loãng: Cu, Ag
-
B.
Kim loại tác dụng với dung dịch CuSO4 : Fe, Al, Mg
-
C.
Kim loại không tác dụng với H2SO4 đặc nguội: Al, Fe
-
D.
Kim loại không tan trong nước ở nhiệt độ thường: Tất cả các kim loại trên
Đáp án : A
Cần nắm được lí thuyết kim loại tác dụng với axit, tác dụng với muối và với nước
Kết luận sai là: Kim loại tác dụng với dung dịch HCl, H2SO4 loãng: Cu, Ag
Cho phản ứng: Zn + CuSO4 → muối X + kim loại Y. X là
-
A.
ZnSO4
-
B.
CuSO4
-
C.
Cu
-
D.
Zn
Đáp án : A
Zn + CuSO4 → ZnSO4 + Cu
=> muối X là ZnSO4
Một bạn học sinh đã đổ nhầm dung dịch sắt (II) sunfat vào lọ chứa sẵn dung dịch kẽm sunfat. Để thu được dung dịch chứa duy nhất muối kẽm sunfat, theo em dùng kim loại nào ?
-
A.
Đồng
-
B.
Sắt
-
C.
Kẽm
-
D.
Nhôm
Đáp án : C
+) Dựa vào phản ứng kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối
Để thu được dung dịch chứa duy nhất muối ZnSO4 thì cần loại bỏ được dung dịch FeSO4 và không tạo ra muối nào khác
=> kim loại sử dụng được là Zn
PTHH: Zn + FeSO4 → ZnSO4 + Fe
Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng. Kim loại A là:
-
A.
Cu
-
B.
Zn
-
C.
K
-
D.
Na
Đáp án : C
+) công thức oxit của kim loại A là A2On
$ + )\% {m_O} = \frac{{16n}}{{2.{M_A} + 16n}}.100\% $ => lập x và R
Giả sử kim loại A có hóa trị n (n = 1, 2, 3, 4)
=> công thức oxit của kim loại A là A2On
Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng
$ = > \% {m_O} = \frac{{16n}}{{2.{M_A} + 16n}}.100\% = 17,02\% $
=> 16n = 0,1702.(2.MA + 16n) => MA = 39n
Ta có bảng sau:

Vậy A là Kali
Để oxi hóa hoàn toàn một kim loại R thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. R là kim loại nào sau đây ?
-
A.
Fe
-
B.
Al
-
C.
Mg
-
D.
Ca
Đáp án : D
+) Gọi nguyên tử khối của kim loại R là R và có hóa trị là x (x = 1, 2, 3, 4)
+) 4R + xO2 $\xrightarrow{{{t^o}}}$ 2R2Ox
+) $\frac{{32{\text{x}}}}{{4{\text{R}}}} = 0,4$=> lập bảng x và R
Gọi nguyên tử khối của kim loại R là R và có hóa trị là x (x = 1, 2, 3, 4)
4R + xO2 $\xrightarrow{{{t^o}}}$ 2R2Ox
Theo đề bài ta có: $\frac{{32{\text{x}}}}{{4{\text{R}}}} = 0,4\,\, = > R = 20{\text{x}}$
Ta có bảng sau:
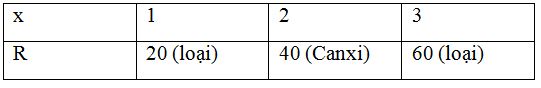
Vậy R là Canxi
Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây? (biết hóa trị của kim loại trong khoảng từ I đến III).
-
A.
Ca
-
B.
Mg
-
C.
Al
-
D.
Fe
Đáp án : C
2M + 2nHCl → 2MCln + nH2
$\dfrac{2}{n}$ ← 2 mol
$ + )M = \dfrac{{18}}{{\frac{2}{n}}} = 9n$
nHCl = 2 mol
Gọi kim loại M có hóa trị n (n = 1, 2, 3)
2M + 2nHCl → 2MCln + nH2
$\dfrac{2}{n}$ ← 2 mol
$ = > M = \dfrac{{18}}{{\dfrac{2}{n}}} = 9n$
Ta có bảng sau:
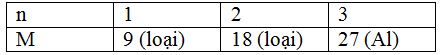
Đốt cháy hoàn toàn 9,6 gam một kim loại M (chưa rõ hóa trị) trong bình chứa khí clo nguyên chất. Sau khi phản ứng kết thúc, để nguội thì thu được 20,25 gam muối clorua. Kim loại M là
-
A.
Fe
-
B.
Al
-
C.
Cu
-
D.
Zn
Đáp án : C
2M + nCl2 → 2MCln
+) Bảo toàn khối lượng: mkim loại + mCl2 = mmuối => mCl2
+) ${n_M} = \frac{2}{n}.{n_{C{l_2}}} = > M = \frac{m}{n}$
Gọi kim loại M có hóa trị n (n = 1, 2, 3, 4)
2M + nCl2 → 2MCln
+) Bảo toàn khối lượng: mkim loại + mCl2 = mmuối => mCl2 = 20,25 – 9,6 = 10,65 gam
$ = > {n_{C{l_2}}} = 0,15\,\,mol\,\, = > {n_M} = \frac{2}{n}.{n_{C{l_2}}} = \frac{{0,3}}{n}mol = > M = \frac{m}{n} = \frac{{9,6}}{{\frac{{0,3}}{n}}} = 32n$
Ta có bảng sau:

Vậy M là kim loại Cu
Cho 1,3 gam kẽm phản ứng với 14,7 gam dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng khí thoát ra là:
-
A.
0,03 gam
-
B.
0,06 gam
-
C.
0,04 gam
-
D.
0,02 gam
Đáp án : C
+) Xét tỉ lệ: $\frac{{{n_{Zn}}}}{1}$ và $\frac{{{n_{{H_2}S{O_4}}}}}{1}$ => phản ứng tính theo chất hết
+) ${n_{{H_2}}} = {n_{Zn}}\,\, = > \,\,{m_{{H_2}}}$
${m_{{H_2}S{O_4}}} = \frac{{14,7.20}}{{100}} = 2,94\,gam\,\, = > {n_{{H_2}S{O_4}}} = 0,03\,\,mol$
nZn = 0,02 mol
Zn + H2SO4 → ZnSO4 + H2
Xét tỉ lệ: $\frac{{{n_{Zn}}}}{1} = \frac{{0,02}}{1} < \frac{{{n_{{H_2}S{O_4}}}}}{1} = \frac{{0,03}}{1}$ => Zn phản ứng hết, H2SO4 dư, tính số mol khí theo Zn
Ta có:
${n_{{H_2}}} = {n_{Zn}} = 0,02\,\,mol\,\, = > \,\,{m_{{H_2}}} = 0,02.2 = 0,04\,\,gam$
Hòa tan 2,7 gam kim loại A bằng dung dịch H2SO4 loãng dư. Sau phản ứng thu được 3,36 lít H2 (đktc). Kim loại A là:
-
A.
Fe
-
B.
Sn
-
C.
Zn
-
D.
Al
Đáp án : D
+) Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4)
+) Tính số mol A theo PTHH: 2A + nH2SO4 → A2(SO4)n + nH2
+) $ {M_A} = \frac{{m}}{n} $
+) Lập bảng xét giá trị M và n
${n_{{H_2}}} = \frac{{3,36}}{{22,4}} = 0,15mol$
Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4)
PTHH: 2A + nH2SO4 → A2(SO4)n + nH2
$\frac{{0,3}}{n}$ mol ← 0,15 mol
$ = > {M_A} = \frac{{2,7}}{{\frac{{0,3}}{n}}} = 9n$
Ta có bảng sau:

Vậy A là kim loại Al
Cho 1,08 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
-
A.
Niken
-
B.
Canxi
-
C.
Nhôm
-
D.
Sắt
Đáp án : C
+) 2R + nH2SO4 → R2(SO4)n + nH2
+) ${n_R} = 2.\,\,{n_{{R_2}{{(S{O_4})}_n}}} = > \frac{{1,08}}{R} = 2.\frac{{6,84}}{{2{\text{R}} + 96n}}\,$
Gọi kim loại R có hóa trị n (n = 1, 2, 3, 4)
2R + nH2SO4 → R2(SO4)n + nH2
Ta có: ${n_R} = \frac{{1,08}}{R}\,\,mol;\,\,{n_{{R_2}{{(S{O_4})}_n}}} = \frac{{6,84}}{{2{\text{R}} + 96n}}\,\,mol$
Theo phản ứng: ${n_R} = 2.\,\,{n_{{R_2}{{(S{O_4})}_n}}} = > \frac{{1,08}}{R} = 2.\frac{{6,84}}{{2{\text{R}} + 96n}}\,$
=> R = 9n
Ta có bảng sau:

Vậy R là kim loại Al
Cho 6,5 gam Zn vào dung dịch HCl dư. Hỏi thể tích khí thu được từ phản ứng ở đktc là bao nhiêu? (cho Zn = 65)
-
A.
1,12 lít
-
B.
2,24 lít
-
C.
3,36 lít
-
D.
22,4 lít.
Đáp án : B
- Đổi số mol Zn
- Viết PTPƯ: Zn + 2HCl → ZnCl2 + H2↑
- Tính số mol H2 theo số mol của Zn => VH2 (đktc) = nH2 . 22,4 = ? (lít)
\({n_{Zn}} = \dfrac{{6,5}}{{65}} = 0,1\,(mol)\)
PTPƯ: Zn + 2HCl → ZnCl2 + H2↑
0,1 → 0,1 (mol)
VH2(đktc) = 0,1 × 22,4 = 2,24 (lít)
Cho phản ứng hóa học: x… + H2SO4 -> FeSO4 + y…↑. Tổng (x + y) có thể là:
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Thấy sản phẩm có xuất hiện nguyên tố Fe => chất ban đầu có thể Fe hoặc các hợp chất của Fe
Nhưng chất phản ứng được với H2SO4 sinh ra khí thì chỉ có Fe
Từ đó viết PTHH và xác định được x, y =?
Fe + H2SO4 → FeSO4 + H2↑
=> Tổng (x+y) = 1+1 = 2
Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
-
A.
Al.
-
B.
Fe.
-
C.
Mg.
-
D.
Cu.
Đáp án : D
HCl chỉ tác dụng được với các kim loại đứng trước H trong dãy điện hóa của kim loại
Cu là kim loại đứng sau H trong dãy điện hóa nên không tan trong dd HCl => chất rắn T là Cu
Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
-
A.
0,1 mol.
-
B.
0,2 mol.
-
C.
0,3 mol.
-
D.
0,4 mol.
Đáp án : B
Sử dụng phương pháp tăng giảm khối lượng
Gọi số mol của CuSO4 phản ứng là x (mol)
PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
x ← x → x (mol)
Khối lượng tăng: mtăng = mCu - mFe => 1,6 = 64x – 56x => x = ?(mol)
Gọi số mol của CuSO4 phản ứng là x (mol)
PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
x ← x → x (mol)
Khối lượng tăng: mtăng = mCu - mFe
=> 1,6 = 64x – 56x
=> 1,6 = 8x
=> x = 0,2 (mol)
Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch H2SO4 9,8% (loãng) vừa đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là:
-
A.
Mg.
-
B.
Fe.
-
C.
Zn.
-
D.
Cu.
Đáp án : B
Đặt số mol R = 1 (mol)
PTPƯ: R + H2SO4 → RSO4 + H2↑
1 →1 →1 →1 (mol)
\({m_{{H_2}S{O_4}}} = {n_{{H_2}S{O_4}}}.{M_{{H_2}S{O_4}}} = 1.98 = 98\,\,gam\)
\({m_{dung\,\,dich\,\,{H_2}S{O_4}}} = \dfrac{{{m_{{H_2}S{O_4}}}}}{{C\% }}.100\% = ?\,\,(g)\)
Khối lượng dung dịch sau là:
\({m_{dung\,\,dich\,\,sau}} = {m_R} + {m_{dung\,\,dich\,\,{H_2}S{O_4}}} - {m_{{H_2}}} = ?\)
Muối Y là: RSO4: 1 (mol) \( \to\) mRSO4 = (R +96) g
Nồng độ phần trăm của muối Y là:
\(C{\% _{R{\text{S}}{O_4}}} = \dfrac{{{m_{R{\text{S}}{O_4}}}}}{{{m_{dung\,\,dich\,\,sau}}}}.100\% \to R = ?\)
Đặt số mol R = 1 (mol)
PTPƯ: R + H2SO4 → RSO4 + H2↑
1 →1 →1 →1 (mol)
\({m_{{H_2}S{O_4}}} = {n_{{H_2}S{O_4}}}.{M_{{H_2}S{O_4}}} = 1.98 = 98\,\,gam\)
\({m_{dung\,\,dich\,\,{H_2}S{O_4}}} = \dfrac{{{m_{{H_2}S{O_4}}}}}{{C\% }}.100\% = 1000\,\,(g)\)
Khối lượng dung dịch sau là:
\({m_{dung\,\,dich\,\,sau}} = {m_R} + {m_{dung\,\,dich\,\,{H_2}S{O_4}}} - {m_{{H_2}}} = R + 1000 - 1.2\)
\( \to {m_{dung\,\,dich\,\,sau}} = R + 998\) (g)
Muối Y là: RSO4: 1 (mol) \( \to\) mRSO4 = (R +96) g
Nồng độ phần trăm của muối Y là:
\(\eqalign{
& \% RS{O_4} = {{{m_{RS{O_4}}}} \over {{m_{dd\,sau}}}}.100\% \cr
& \Rightarrow 14,394\% = {{R + 96} \over {R + 998}}.100\% \cr
& \Rightarrow 14,394R + 14365,212 = 100R + 9600 \cr
& \Rightarrow 85,606R = 4765,212 \cr
& \Rightarrow R \approx 56(Fe) \cr} \)
Chọn câu đúng nhất khi nói đến tính chất hóa học của kim loại
-
A.
Dãy gồm các kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thường) sẽ tạo thành các oxit bazơ tương ứng với nó.
-
B.
Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Mg, Ca) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
-
C.
Hầu hết tất cả các kim loại có thể phản ứng với dung dịch axit HCl hoặc H2SO4 loãng để giải phóng khí hiđro và sinh ra muối.
-
D.
Ở nhiệt độ cao, các kim loại như Cu, Mg, Fe…phản ứng với lưu huỳnh tạo thành sản phẩm là muối sunfua tương ứng là CuS, MgS, FeS.
Đáp án : D
Dựa vào bài học về tính chất hóa học của kim loại SGK hóa 9 – trang 49
A. sai vì kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thích hợp) sẽ tạo thành các oxit bazơ tương ứng với nó.
B. Sai vì từ kim loại Mg trở về sau trong dãy điện hóa thì kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối
C. Sai vì phải là các kim loại đứng trước H trong dãy điện hóa mới phản ứng được với dd HCl và H2SO4 loãng sinh ra khí hiđro và muối.
D. đúng
Cho các phương trình hóa học sau:
(1) Cu + Fe(NO3)2 → Fe + Cu(NO3)2.
(2) Al + FeSO4 → Fe + Al2(SO4)3
(3) Mg + CuCl2 → MgCl2 + Cu
(4) Ba + Na2SO4 + 2H2O → BaSO4 + 2NaOH + H2.
Số phương trình hóa học viết chưa đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Dựa vào kiến thức đã được học về tính chất hóa học của kim loại SGK hóa 9 – trang 49
Từ đó nhận biết được phương trình nào không xảy ra, hoặc viết sai.
(1) sai vì phản ứng không xảy ra vì Cu là kim loại đứng sau Fe trong dãy điện hóa nên không đẩy được Fe ra khỏi dung dịch muối của nó.
(2) sai vì phương trình chưa được cân bằng
2Al + 3FeSO4 → 3Fe + Al2(SO4)3
(3) đúng
(4) đúng
Vậy có 2 phương trình chưa viết đúng
Nung hỗn hợp gồm 5,6 gam sắt và 1,6 gam lưu huỳnh trong điều kiện không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 0,5M phản ứng vừa đủ với chất rắn A thu được hỗn hợp khí B. Thể tích dung dịch HCl 0,5M đã dùng là
-
A.
100 ml
-
B.
200 ml.
-
C.
300 ml.
-
D.
400 ml.
Đáp án : D
Đổi số mol Fe, số mol S
Viết PTHH các phản ứng xảy ra, tính toán theo phương trình. (Tính toán theo số mol của chất phản ứng hết)
\({n_{F{\text{e}}}} = \dfrac{{5,6}}{{56}} = 0,1\,\,mol;{n_S} = \dfrac{{1,6}}{{32}} = 0,05\,\,mol\)
PTHH: Fe + S \(\buildrel {{t^0}} \over\longrightarrow \)FeS
Pư 0,05←0,05→0,05 (mol)
Vậy sau phản ứng rắn A thu được gồm: FeS: 0,05 (mol); Fe dư: 0,1 – 0,05 = 0,05 (mol)
Rắn A + dd HCl có phản ứng:
FeS + 2HCl → FeCl2 + H2S↑
0,05→ 0,1 (mol)
Fe + 2HCl → FeCl2 + H2↑
0,05→ 0,1 (mol)
\( \to\) tổng mol HCl = 0,1 + 0,1 =0,2 (mol)
\( \to\) \({V_{HCl}} = \dfrac{{{n_{HCl}}}}{{{C_M}}} = \dfrac{{0,2}}{{0,5}} = 0,4\,\,lít = 400\,\,ml\)
Hòa tan 2,8 gam một kim loại R có hóa trị II bằng một hỗn hợp gồm 80 ml dung dịch H2SO4 0,5M và 200 ml dung dịch HCl 0,2M thu được dung dịch A và V lít khí H2(ở đktc). Để trung hòa dung dịch A thì cần 100 ml dung dịch KOH 0,2M. Phát biểu nào dưới đây về bài toán trên là chưa đúng?
-
A.
Kim loại R không tan được trong nước ở điều kiện thường.
-
B.
Kim loại R khi phản ứng với lưu huỳnh sẽ tạo ra chất rắn có màu đen.
-
C.
Giá trị của V là 1,12.
-
D.
Thành phần phần trăm về khối lượng của R (hóa trị II) trong hợp chất muối sunfat ứng với R là 28%.
Đáp án : D
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
R + 2HCl → RCl2 + H2↑ (2)
Trong hỗn hợp ban đầu \({n_{{H_2}S{O_4}}}:{n_{HCl}} = 1:1 \to \) phản ứng với R theo tỉ lệ 1: 1
\( \to\) Tỉ lệ của H2SO4 dư và HCl dư cũng là 1: 1
Đặt số mol H2SO4 dư = số mol HCl dư = x (mol)
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
x →2x (mol)
HCl + KOH → KCl + H2O (4)
x → x (mol)
\( \to\) tổng số mol KOH là: 2x + x = 0,02 \( \to\) x = ? (mol)
Từ đó tính được số mol H2SO4; HCl pư ở (1), (2). Đặt vào phương trình (1), (2) tính toán được các dữ liệu mà đề bài yêu cầu.
\({n_{{H_2}S{O_4}}} = 0,5.0,08 = 0,04\,\,mol\) ; nHCl = 0,2.0,2 = 0,04 (mol); nKOH = 0,1.0,2 = 0,02 (mol)
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
R + 2HCl → RCl2+ H2↑ (2)
Trong hỗn hợp ban đầu \({n_{{H_2}S{O_4}}}:{n_{HCl}} = 0,04:0,04 = 1:1 \to \) phản ứng với R theo tỉ lệ 1: 1
\( \to\) Tỉ lệ của H2SO4 dư và HCl dư cũng là 1: 1
Đặt số mol H2SO4 dư = số mol HCl dư = x (mol)
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
x →2x (mol)
HCl + KOH → KCl + H2O (4)
x → x (mol)
\( \to\) tổng số mol KOH là: 2x + x = 0,02
\( \to\) x = \(\dfrac{1}{{150}}\) (mol)
\( \to\) \({n_{{H_2}S{O_4}(1)}} = 0,04 - \dfrac{1}{{150}} = \dfrac{1}{{30}}\) (mol)
nHCl(1) = 0,04 – \(\dfrac{1}{{150}}\) = \(\dfrac{1}{{30}}\) (mol)
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
\({1 \over {30}} \leftarrow {1 \over {30}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to {1 \over {30}}\)
R + 2HCl → RCl2 + H2↑ (2)
\({1 \over {60}} \leftarrow {1 \over {30}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to {1 \over {60}}\)
\( \Rightarrow \sum {{n_{{H_2}}} = {1 \over {30}}} + {1 \over {60}} = 0,05\,(mol) \Rightarrow {V_{{H_2}}}(dktc) = 0,05 \times 22,4 = 1,12(l)\) => C đúng
\( \Rightarrow \sum {{n_R} = {1 \over {30}}} + {1 \over {60}} = 0,05\,(mol) \Rightarrow {M_R} = {{{m_R}} \over {{n_R}}} = {{2,8} \over {0,05}} = 56\,(Fe)\) => A,B đúng
\(\% Fe = {{{m_{Fe}}} \over {{m_{FeS{O_4}}}}}.100\% = {{{1 \over {30}} \times 56} \over {{1 \over {30}} \times 152}}.100\% = 36,84\% \) => D sai
Có các phản ứng sau:
a. HCl + (A) → MgCl2 + H2 b. AgNO3 + (B) → Cu(NO3)2 + Ag
c. S + (C) → K2S d. (D) + Cl2 → ZnCl2
(A), (B), (C), (D) lần lượt là:
-
A.
KCl, MgO, CuO,ZnO
-
B.
Zn, Mg, K,Cu
-
C.
Mg, Cu, K,Zn
-
D.
MgO, CuO, KCl,ZnO
Đáp án : C
HCl + (A) → MgCl2 + H2 => A là Mg
AgNO3 + (B) → Cu(NO3)2 + Ag => B là Cu
S + (C) → K2S => C là K(D) + Cl2 → ZnCl2 => D là Zn
Đốt cháy hoàn toàn 1,35g nhôm trong oxi. .Khối lượng nhôm oxit tạo thành và khối lượng oxi đã tham gia phản ứng là:
-
A.
2,25g và 1,2g
-
B.
2,55g và 1,28g
-
C.
2,55 và 1,2g
-
D.
2,7 và 3,2 g
Đáp án : C
PTHH: 4Al + 3O2 → 2Al2O3
Tỉ lệ: 4 3 2
Pứ: 0,05 ? ?mol
Dùng quy tắc tam suất (nhân chéo chia đối diện) => nO2 = ? ; nAl2O3 = ?
=> mO2 = nO2.MO2 = ?
mAl2O3 = nAl2O3 . MAl2O3 = ?
nAl = mAl : MAl = 1,35 : 27 = 0,05 mol
PTHH: 4Al + 3O2 → 2Al2O3
Tỉ lệ: 4 3 2
Pứ: 0,05 ? ?mol
Theo pthh ta có nO2 = ¾ . nAl = 3/4 . 0,05 = 0,0375 mol => mO2 = nO2 . MO2 = 0,0375 . 32 = 1,2g
nAl2O3 = ½ nAl = 0,025 mol => mAl2O3 = nAl2O3 . MAl2O3 = 0,025 . (27 . 2 + 48) = 2,55g
Cho 1 gam Na phản ứng với 1 gam khí clo. Khối lượng muối NaCl thu được là:
-
A.
2 gam
-
B.
1 gam
-
C.
0,5 gam
-
D.
1,648 gam
Đáp án : D
Đổi số mol Na, Cl2 = ?
Viết PTHH xảy ra: 2Na + Cl2 → 2NaCl
Dựa vào phương trình so sánh xem Na ; Cl2 chất nào phản ứng hết, chất nào dư. Mọi tính toán theo số mol của chất phản ứng hết.
Cho một lượng Fe tác dụng với 100 ml dung dịch H2SO4 aM loãng, vừa đủ. Sau phản ứng thu được dung dịch chứa 22,8 gam muối sunfat và V lít khí H2 ở đktc. Giá trị của a và V lần lượt là?
-
A.
1M và 2,24 lít.
-
B.
1,5M và 2,24 lít.
-
C.
1,5M và 3,36 lít.
-
D.
1M và 3,36 lít.
Đáp án : C
Tính số mol FeSO4 rồi từ PTHH tính được số mol H2SO4, số mol H2 ⟹ a, V.
\({n_{FeS{O_4}}}\)= 22,8/152 = 0,15 mol
Fe + H2SO4 → FeSO4 + H2
0,15 ← 0,15 → 0,15 (mol)
a = 0,15/0,1 = 1,5M
V = 0,15.22,4 = 3,36 lít
Đốt cháy hoàn toàn cùng một khối lượng các kim loại sau: Al, Mg, Zn, Cu ; kim loại nào cần dùng số mol khí O2 lớn nhất?
-
A.
Al.
-
B.
Mg.
-
C.
Zn.
-
D.
Cu.
Đáp án : A
Đặt khối lượng 4 kim loại cùng là m gam, viết PTHH rồi tính số mol khí O2 cần dùng trong từng trường hợp theo m rồi so sánh.
Đặt khối lượng các kim loại là m gam.
4Al + 3O2 \(\xrightarrow{{{t^o}}}\)2Al2O3.
m/27 m/36 (mol)
2Mg + O2 \(\xrightarrow{{{t^o}}}\)2MgO.
m/24 m/48 (mol)
2Zn + O2 \(\xrightarrow{{{t^o}}}\)2ZnO.
m/65 m/130 (mol)
2Cu + O2 \(\xrightarrow{{{t^o}}}\)2CuO.
m/64 m/128 (mol)
Đốt Al cần dùng số mol khí O2 lớn nhất.
Cho các kim loại sau: Fe, Ag, Hg, Zn. Số kim loại có thể dùng để điều chế Cu bằng phản ứng với dung dịch CuSO4 là?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Chỉ có kim loại đứng trước Cu trong dãy hoạt động hóa học mới có thể đẩy Cu ra khỏi dung dịch muối.
Fe + CuSO4 → FeSO4 + Cu.
Zn + CuSO4 → ZnSO4 + Cu.
Có 2 kim loại Fe, Zn.
Kim loại nào sau đây không thể điều chế bằng phương pháp nhiệt luyện?
-
A.
K.
-
B.
Zn.
-
C.
Fe.
-
D.
Cu.
Đáp án : A
Dựa vào lý thuyết phần điều chế kim loại.
Phương pháp nhiệt luyện chỉ áp dụng với oxit kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (K đứng trước Al nên không thể điều chế bằng phương pháp nhiệt luyện).
Cho sơ đồ phản ứng sau (với R là kim loại):
R \(\xrightarrow{{ + ZnS{O_4}}}\)X.
R \(\xrightarrow{{ + {O_2},{t^o}}}\)A \(\xrightarrow{{ + {H_2}S{O_4}loang}}\)X.
R \(\xrightarrow{{ + {H_2}S{O_4}loang}}\)X.
R có thể là kim loại nào trong các kim loại sau: Cu, Fe, Mg, Ag?
-
A.
Cu.
-
B.
Fe.
-
C.
Mg.
-
D.
Ag.
Đáp án : C
Thử từng kim loại Cu, Fe, Mg, Ag xem có phù hợp với sơ đồ phản ứng hay không.
H2SO4 loãng tác dụng với hầu hết kim loại trừ (Cu, Ag, Hg, Au, Pt).
O2 tác dụng với hầu hết kim loại trừ (Ag, Au, Pt).
Mg + ZnSO4 → MgSO4 + Zn.
2Mg + O2 \(\xrightarrow{{{t^o}}}\)2MgO ; MgO + H2SO4 → MgSO4 + H2O.
Mg + H2SO4 → MgSO4 + H2.
R là Mg, A là MgO, X là MgSO4.
Thực hiện các thí nghiệm sau:
(a) Cho Na tác dụng với dung dịch CuCl2 dư.
(b) Cho hỗn hợp Fe và Ag tác dụng với dung dịch CuSO4 dư.
(c) Cho Zn tác dụng với dung dịch AgNO3 dư.
(d) Cho hỗn hợp Fe, Mg tác dụng với dung dịch CuSO4 dư.
Sau khi phản ứng xảy ra hoàn toàn, số thí nghiệm thu được chất rắn chứa 1 kim loại là?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Viết tất cả các PTHH xảy ra ở các thí nghiệm rồi xác định thành phần chất rắn thu được sau phản ứng.
Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối (trừ Li, Na, K, Ba, Ca).
(a) 2Na + 2H2O → 2NaOH + H2 ; 2NaOH + CuCl2 → 2NaCl + Cu(OH)2.
⟹ Chất rắn thu được là Cu(OH)2.
(b) Fe + CuSO4 → FeSO4 + Cu.
⟹ Chất rắn thu được gồm Cu, Ag không phản ứng.
(c) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag.
⟹ Chất rắn thu được là Ag.
(d) Fe + CuSO4 → FeSO4 + Cu ; Mg + CuSO4 → MgSO4 + Cu
⟹ Chất rắn thu được là Cu.
Vậy có 2 thí nghiệm sau phản ứng thu được chất rắn chứa 1 kim loại (c,d).
Cặp chất nào sau đây có thể tác dụng với nhau?
-
A.
Cu + ZnSO4.
-
B.
Fe + ZnCl2.
-
C.
Zn + Cu(NO3)2.
-
D.
Cu + CuCl2.
Đáp án : C
Kim loại đứng trước trong dãy điện hóa tác dụng với muối của kim loại đứng sau.
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu.
Luyện tập và củng cố kiến thức Bài 17. Dãy hoạt động hóa học của kim loại Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Nhôm Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch kiềm Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập phản ứng nhiệt nhôm Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 19. Sắt Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 20. Hợp kim của sắt: Gang - Thép Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 21. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 15. Tính chất vật lí của kim loại Hóa 9 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết




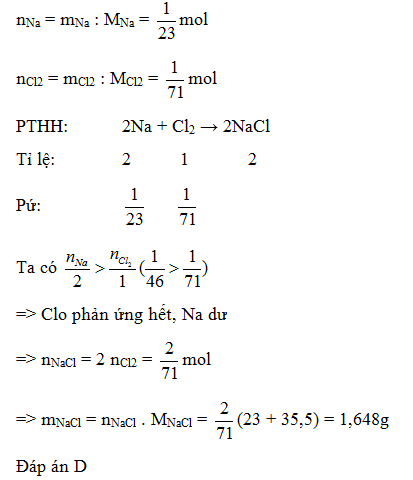






Danh sách bình luận