Đề thi học kì 1 Hóa 11 - Đề số 3
Đề bài
Câu nào sai khi nói về pH và pOH của dung dịch ?
-
A.
pH = -lg[H+].
-
B.
[H+] = 10a thì pH = a.
-
C.
pOH = -lg[OH-].
-
D.
pH + pOH = 14.
Phản ứng nào sau đây dùng để điều chế CO trong phòng thí nghiệm
-
A.
CO2 + C $\xrightarrow{{{t}^{0}}}$ 2CO
-
B.
C + H2O $\xrightarrow{{{t}^{0}}}$ CO + H2
-
C.
HCOOH$\xrightarrow{{{H}_{2}}S{{O}_{4}},{{t}^{0}}}$ CO + H2O
-
D.
CH3COOH$\xrightarrow{{{H}_{2}}S{{O}_{4}},{{t}^{0}}}$2CO + 2H2
Axit H3PO4 và HNO3 cùng phản ứng được với tất cả các chất trong dãy nào dưới đây ?
-
A.
CuCl2, KOH, NH3, Na2CO3.
-
B.
KOH, NaHCO3, NH3, ZnO.
-
C.
MgO, BaSO4, NH3, Ca(OH)2.
-
D.
NaOH, KCl, NaHCO3, H2S.
Hiện tượng xảy ra khi trộn dung dịch Na2CO3 với dung dịch FeCl3 là
-
A.
Xuất hiện kết tủa màu đỏ nâu.
-
B.
Có bọt khí thoát ra khỏi dung dịch.
-
C.
Xuất hiện kết tủa màu lục nhạt.
-
D.
cả A và B.
Phát biểu nào sau được dùng để định nghĩa công thức đơn giản nhất của hợp chất hữu cơ?
-
A.
Công thức đơn giản nhất là công thức biểu thị số nguyên tử của mỗi nguyên tố trong phân tử.
-
B.
Công thức đơn giản nhất là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
-
C.
Công thức đơn giản nhất là công thức biểu thị tỉ lệ phần trăm số mol của mỗi nguyên tố trong phân tử.
-
D.
Công thức đơn giản nhất là công thức biểu thị tỉ lệ số nguyên tử C và H có trong phân tử.
Chất điện li mạnh có độ điện li (α)
-
A.
α = 0
-
B.
α = 1
-
C.
0 < α <1
-
D.
α > 1
Trong các loại phân bón sau, phân bón hoá học kép là:
-
A.
(NH4)2SO4.
-
B.
Ca(H2PO4)2.
-
C.
KCl.
-
D.
KNO3
Phản ứng hóa học nào sau đây không đúng
-
A.
SiO2 + H2O → H2SiO3
-
B.
3CO + Fe2O3 $\xrightarrow{{{t}^{0}}}$ 2 Fe + 3CO2
-
C.
CO2 + 2Mg $\xrightarrow{{{t}^{0}}}$ C + 2MgO
-
D.
SiO2 + 4HF → SiF4 + 2H2O
Trong công nghiệp CO được điều chế bằng phương pháp nào?
-
A.
Đun nóng axit HCOOH có mặt H2SO4 đặc
-
B.
Cho SiO2 tác dụng với C
-
C.
Cho hơi nước đi qua than nóng đỏ ở 10500C
-
D.
Cho C tác dụng với oxi
Đốt cháy hổn hợp gồm 6,72 lít khí oxi và 7 lít khí amoniac (đo ở cùng điều kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là:
-
A.
Khí nitơ và nước
-
B.
Khí oxi, khí nitơ và nước
-
C.
Khí amoniac, khí nitơ và nước
-
D.
Khí nitơ oxit và nước
Phát biểu nào sau đây là sai ?
-
A.
Liên kết hóa học chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
-
B.
Các chất có cấu tạo và tính chất tương tự nhau nhưng về thành phần phân tử khác nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
-
C.
Các chất có cùng khối lượng phân tử là đồng phân của nhau.
-
D.
Liên kết ba gồm hai liên kết p và một liên kết s.
Công thức cấu tạo nào sau đây là sai?
-
A.
CH3 – CH2 – CH3
-
B.
CH3= CH3
-
C.
CH2=CH2
-
D.
CH ≡ CH
Cặp công thức của liti nitrua và nhôm nitrua là
-
A.
LiN3 và Al3N
-
B.
Li3N và AlN
-
C.
Li2N3 và Al2N3
-
D.
Li3N2 và Al3N2
Thành phần các nguyên tố trong hợp chất hữu cơ
-
A.
nhất thiết phải có cacbon, thường có H, hay gặp O, N sau đó đến halogen, S, P...
-
B.
gồm có C, H và các nguyên tố khác.
-
C.
bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
-
D.
thường có C, H hay gặp O, N, sau đó đến halogen, S, P.
Cho các phản ứng sau: (1) P + Cl2 (dư, to); (2) P + KClO3 (to); (3) P + H2SO4 (đặc, nóng); (4) P + O2 (thiếu, to). Những trường hợp P bị oxi hóa thành P+5 là
-
A.
(2), (3), (4).
-
B.
(1), (2), (4).
-
C.
(1), (2), (3).
-
D.
(1), (3), (4).
Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là
-
A.
đồng phân.
-
B.
đồng vị.
-
C.
đồng đẳng.
-
D.
đồng khối.
Hợp chất CH2=CH2 có tên thay thế là
-
A.
etan.
-
B.
eten.
-
C.
etin.
-
D.
etilen.
Khi bị nhiệt phân, dãy muối nitrat nào sau đây dều cho sản phẩm là kim loại , khí nitơ đioxit và khí Oxi
-
A.
Zn(NO3)2, KNO3, Pb(NO3)2
-
B.
Cu(NO3)2, LiNO3, KNO3
-
C.
Ca(NO3)2, LiNO3, KNO3
-
D.
Hg(NO3)2, AgNO3
Muối nào sau đây là muối trung hòa?
-
A.
NaHCO3.
-
B.
Na2HPO3.
-
C.
NaHSO4.
-
D.
NaH2PO4.
Chất nào sau đây là chất điện ly yếu
-
A.
KCl
-
B.
NaOH
-
C.
HNO3
-
D.
HF
Dung dịch muối nào có pH = 7?
-
A.
AlCl3.
-
B.
CuSO4.
-
C.
Na2CO3.
-
D.
KNO3.
Trong nhóm IVA, theo chiều tăng của điện tích hạt nhân, nhận định nào sau đây sai ?
-
A.
Độ âm điện giảm dần
-
B.
Tính phi kim giảm dần, tính kim loại tăng dần.
-
C.
Bán kính nguyên tử giảm dần.
-
D.
Số oxi hoá cao nhất là +4.
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với:
-
A.
H2SO4
-
B.
HCl
-
C.
HNO3
-
D.
HF
Khi bị đau dạ dày do lượng axit HCl trong đó quá cao thì người bệnh thường uống muối:
-
A.
NH4HCO3.
-
B.
Na2CO3.
-
C.
NaCl.
-
D.
NaHCO3.
Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
-
A.
0,2ml
-
B.
0,4ml
-
C.
0,6ml
-
D.
0,8ml
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
-
A.
0,01 và 0,03.
-
B.
0,01 và 0,01.
-
C.
0,03 và 0,02.
-
D.
0,02 và 0,01.
Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%.
-
A.
0,10 lít.
-
B.
0,52 lít.
-
C.
0,25 lít.
-
D.
0,35 lít.
Thể tích N2 thu được khi nhiệt phân hoàn toàn 16 gam NH4NO2 là
-
A.
1,12 lít
-
B.
11,2 lít
-
C.
0,56 lít
-
D.
5,6 lít
Tổng hệ số cân bằng của các chất tham gia trong phản ứng sau là:
Mg + HNO3 → Mg(NO3)2 + N2O↑ + H2O
-
A.
24
-
B.
38
-
C.
14
-
D.
10
Đốt 3,1 gam P trong oxi dư rồi hòa tan toàn bộ oxit vào 92,9 gam nước. Nồng độ phần trăm của dung dịch thu được là:
-
A.
14,2%.
-
B.
3,1%.
-
C.
7,1%.
-
D.
9,8%.
Đốt một mẩu than chì chứa tạp chất lưu huỳnh trong oxi. Cho hỗn hợp khí thoát ra tác dụng với lượng dư dung dịch brom, thấy dung dịch brom nhạt màu. Cho khí thoát ra khỏi dung dịch brom đi qua nước vôi trong dư thấy có vẩn đục. Hỗn hợp khí thoát ra là:
-
A.
CO2, SO2
-
B.
CO, CO2
-
C.
CO, SO2
-
D.
CO2, H2S
Cho hơi nước đi qua than nóng đỏ, thu được hỗn hợp khí X gồm CO, CO2 và H2. Cho toàn bộ X qua bình đựng dung dịch nước vôi dư thu được 10 gam kết tủa. Khí không bị hấp thụ thoát ra được dẫn qua ống đựng CuO (dư) nung nóng thu được hỗn hợp chất rắn Y. Hòa tan toàn bộ Y bằng dung dịch HNO3 (loãng, dư) thu được 8,96 lít khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO trong X là
-
A.
57,25%.
-
B.
28,57%.
-
C.
18,47%.
-
D.
14,29%.
Thể tích CO2 (đktc) lớn nhất cần cho vào 2,0 lít dung dịch Ba(OH)2 0,1M để thu được 15,76 gam kết tủa là
-
A.
7,616 lít
-
B.
6,272 lít
-
C.
5,824 lít
-
D.
7,168 lít
Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
-
A.
0,02
-
B.
0,03
-
C.
0,015
-
D.
0,01
Một chất có CTĐGN là CH3. CTPT chất đó là
-
A.
C3H8.
-
B.
C2H6.
-
C.
C3H6.
-
D.
C4H10.
Chất hữu cơ A chứa 7,86% H ; 15,73% N về khối lượng. Đốt cháy hoàn toàn 2,225 gam A thu được CO2, hơi nước và khí nitơ, trong đó thể tích khí CO2 là 1,68 lít (đktc). CTPT của A là (biết MA < 100) :
-
A.
C6H14O2N.
-
B.
C3H7O2N.
-
C.
C3H7ON.
-
D.
C3H7ON2.
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị của m gần nhất với giá trị nào dưới đây?
-
A.
23
-
B.
22
-
C.
24
-
D.
25
Dung dịch X gồm 0,1 mol H+, z mol Al3+, t mol NO3- và 0,02 mol SO42-. Cho 120ml dung dịch Y gồm KOH 1,2M và Ba(OH)2 0,1M vào X, sau khi các phản ứng kết thúc, thu được 3,732 gam kết tủa. Giá trị của z,t lần lượt là
-
A.
0,020 và 0,012
-
B.
0,020 và 0,120
-
C.
0,120 và 0,020
-
D.
0,012 và 0,096
Cho từ từ đến hết 250 ml dung dịch B gồm NaHCO3 1M và Na2CO3 1M vào 120 ml dung dịch A gồm H2SO4 1M và HCl 1M, thu được V lít khí CO2 (đktc) và dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X thì được m gam kết tủa. Giá trị của m và V là
-
A.
79,18 và 5,376
-
B.
53,57 và 5,376.
-
C.
79,18 và 3,360.
-
D.
53,57 và 3,360
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào lượng nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
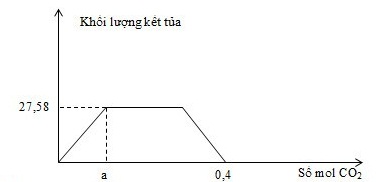
Giá trị của m là
-
A.
24,1 gam
-
B.
22,9 gam
-
C.
21,4 gam
-
D.
24,2 gam
Lời giải và đáp án
Câu nào sai khi nói về pH và pOH của dung dịch ?
-
A.
pH = -lg[H+].
-
B.
[H+] = 10a thì pH = a.
-
C.
pOH = -lg[OH-].
-
D.
pH + pOH = 14.
Đáp án : B
Công thức: pH = -log[H+]
B. SỬA [H+] = 10-a thì pH = a.
Phản ứng nào sau đây dùng để điều chế CO trong phòng thí nghiệm
-
A.
CO2 + C $\xrightarrow{{{t}^{0}}}$ 2CO
-
B.
C + H2O $\xrightarrow{{{t}^{0}}}$ CO + H2
-
C.
HCOOH$\xrightarrow{{{H}_{2}}S{{O}_{4}},{{t}^{0}}}$ CO + H2O
-
D.
CH3COOH$\xrightarrow{{{H}_{2}}S{{O}_{4}},{{t}^{0}}}$2CO + 2H2
Đáp án : C
Phản ứng dùng để điều chế CO trong phòng thí nghiệm là HCOOH$\xrightarrow{{{H}_{2}}S{{O}_{4}},{{t}^{0}}}$ CO + H2O
Axit H3PO4 và HNO3 cùng phản ứng được với tất cả các chất trong dãy nào dưới đây ?
-
A.
CuCl2, KOH, NH3, Na2CO3.
-
B.
KOH, NaHCO3, NH3, ZnO.
-
C.
MgO, BaSO4, NH3, Ca(OH)2.
-
D.
NaOH, KCl, NaHCO3, H2S.
Đáp án : B
- Dựa vào tính chất hóa học của axit H3PO4 và HNO3
- Các phản ứng giữa muối và axit cần xét điều kiện (sản phẩm tạo thành có chất kết tủa hoặc dễ bay hơi hoặc điện li yếu)
Axit H3PO4 và HNO3 cùng phản ứng được với KOH, NaHCO3, NH3, ZnO
A sai vì CuCl2 không tác dụng với HNO3
C sai vì BaSO4 không tác dụng với HNO3
D sai vì KCl không tác dụng với cả 2 axit
Hiện tượng xảy ra khi trộn dung dịch Na2CO3 với dung dịch FeCl3 là
-
A.
Xuất hiện kết tủa màu đỏ nâu.
-
B.
Có bọt khí thoát ra khỏi dung dịch.
-
C.
Xuất hiện kết tủa màu lục nhạt.
-
D.
cả A và B.
Đáp án : D
3Na2CO3 + 2FeCl3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Hiện tượng: xuất hiện kết tủa đỏ nâu và sủi bọt khí
Phát biểu nào sau được dùng để định nghĩa công thức đơn giản nhất của hợp chất hữu cơ?
-
A.
Công thức đơn giản nhất là công thức biểu thị số nguyên tử của mỗi nguyên tố trong phân tử.
-
B.
Công thức đơn giản nhất là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
-
C.
Công thức đơn giản nhất là công thức biểu thị tỉ lệ phần trăm số mol của mỗi nguyên tố trong phân tử.
-
D.
Công thức đơn giản nhất là công thức biểu thị tỉ lệ số nguyên tử C và H có trong phân tử.
Đáp án : B
Công thức đơn giản nhất là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
Chất điện li mạnh có độ điện li (α)
-
A.
α = 0
-
B.
α = 1
-
C.
0 < α <1
-
D.
α > 1
Đáp án : B
Dựa vào khái niệm chất điện li mạnh: Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion.
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion (tức α=1).
Trong các loại phân bón sau, phân bón hoá học kép là:
-
A.
(NH4)2SO4.
-
B.
Ca(H2PO4)2.
-
C.
KCl.
-
D.
KNO3
Đáp án : D
Phân bón hóa học kép là KNO3, vì chứa đồng thời 2 dinh dưỡng K và N
Phản ứng hóa học nào sau đây không đúng
-
A.
SiO2 + H2O → H2SiO3
-
B.
3CO + Fe2O3 $\xrightarrow{{{t}^{0}}}$ 2 Fe + 3CO2
-
C.
CO2 + 2Mg $\xrightarrow{{{t}^{0}}}$ C + 2MgO
-
D.
SiO2 + 4HF → SiF4 + 2H2O
Đáp án : A
Xem lại lí thuyết silic và hợp chất
Phản ứng hóa học không đúng là: SiO2 + H2O → H2SiO3
Trong công nghiệp CO được điều chế bằng phương pháp nào?
-
A.
Đun nóng axit HCOOH có mặt H2SO4 đặc
-
B.
Cho SiO2 tác dụng với C
-
C.
Cho hơi nước đi qua than nóng đỏ ở 10500C
-
D.
Cho C tác dụng với oxi
Đáp án : C
Trong công nghiệp CO được điều chế bằng phương pháp : cho hơi nước đi qua than nóng đỏ ở 10500C
C + H2O $\xrightarrow{{{t^o}}}$ CO + H2
Đốt cháy hổn hợp gồm 6,72 lít khí oxi và 7 lít khí amoniac (đo ở cùng điều kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là:
-
A.
Khí nitơ và nước
-
B.
Khí oxi, khí nitơ và nước
-
C.
Khí amoniac, khí nitơ và nước
-
D.
Khí nitơ oxit và nước
Đáp án : B
+) Xét tỉ lệ tìm ra chất dư, chất hết
+) Tính theo chất hết
Phản ứng: 4NH3 + 3O2 → 2N2 + 6H2O
Xét tỉ lệ thể tích: $\dfrac{{{n_{N{H_3}}}}}{4} = \dfrac{7}{4} < \dfrac{{{n_{{O_2}}}}}{3} = \dfrac{{6,72}}{3}$ => dư oxi.
Do đó, các chất thu được sau phản ứng là khí nitơ, nước được tạo thành và khí oxi dư.
Phát biểu nào sau đây là sai ?
-
A.
Liên kết hóa học chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
-
B.
Các chất có cấu tạo và tính chất tương tự nhau nhưng về thành phần phân tử khác nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
-
C.
Các chất có cùng khối lượng phân tử là đồng phân của nhau.
-
D.
Liên kết ba gồm hai liên kết p và một liên kết s.
Đáp án : C
Phát biểu sai là: Các chất có cùng khối lượng phân tử là đồng phân của nhau.
Vì cùng khối lượng phân tử nhưng có thể khác nhau về thành phần nguyên tử (ví dụ C5H10 và C3H5CHO)
Công thức cấu tạo nào sau đây là sai?
-
A.
CH3 – CH2 – CH3
-
B.
CH3= CH3
-
C.
CH2=CH2
-
D.
CH ≡ CH
Đáp án : B
Trong hợp chất hữu cơ C có hóa trị 4; H có hóa trị 1; O có hóa trị 2.
B sai vì khi đó C có hóa trị 5
Cặp công thức của liti nitrua và nhôm nitrua là
-
A.
LiN3 và Al3N
-
B.
Li3N và AlN
-
C.
Li2N3 và Al2N3
-
D.
Li3N2 và Al3N2
Đáp án : B
N2 tác dụng với kim loại thể hiện số oxi hóa -3 => N có hóa trị III
Liti nitrua: Li3N
Nhôm nitrua: AlN
Thành phần các nguyên tố trong hợp chất hữu cơ
-
A.
nhất thiết phải có cacbon, thường có H, hay gặp O, N sau đó đến halogen, S, P...
-
B.
gồm có C, H và các nguyên tố khác.
-
C.
bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
-
D.
thường có C, H hay gặp O, N, sau đó đến halogen, S, P.
Đáp án : A
Dựa vào đặc điểm thàn phân cấu tạo của hợp chất hữu cơ.
Thành phần các nguyên tố trong hợp chất hữu cơ nhất thiết phải có cacbon, thường có H, hay gặp O, N sau đó đến halogen, S, P...
Cho các phản ứng sau: (1) P + Cl2 (dư, to); (2) P + KClO3 (to); (3) P + H2SO4 (đặc, nóng); (4) P + O2 (thiếu, to). Những trường hợp P bị oxi hóa thành P+5 là
-
A.
(2), (3), (4).
-
B.
(1), (2), (4).
-
C.
(1), (2), (3).
-
D.
(1), (3), (4).
Đáp án : C
(1) 2P + 5Cl2dư → 2PCl5
(2) 6Pđỏ + 3KClO3 $\xrightarrow{{{t}^{0}}}$ 3P2O5 + 5KCl (phản ứng xảy ra khi quẹt diêm)
(3) 2P + 5H2SO4 đặc $\xrightarrow{{{t}^{0}}}$ 2H3PO4 + 3H2O + 5SO2
(4) 4P + 3O2 thiếu $\xrightarrow{{{t}^{0}}}$ 2P2O3
Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là
-
A.
đồng phân.
-
B.
đồng vị.
-
C.
đồng đẳng.
-
D.
đồng khối.
Đáp án : C
Hiện tượng các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhóm (-CH2-) được gọi là hiện tượng đồng đẳng.
Hợp chất CH2=CH2 có tên thay thế là
-
A.
etan.
-
B.
eten.
-
C.
etin.
-
D.
etilen.
Đáp án : B
Tên thay thế = Tên phần thế + tên mạch C chính + tên phần định chức
CH2 = CH2 : et + en = eten
Khi bị nhiệt phân, dãy muối nitrat nào sau đây dều cho sản phẩm là kim loại , khí nitơ đioxit và khí Oxi
-
A.
Zn(NO3)2, KNO3, Pb(NO3)2
-
B.
Cu(NO3)2, LiNO3, KNO3
-
C.
Ca(NO3)2, LiNO3, KNO3
-
D.
Hg(NO3)2, AgNO3
Đáp án : D
Đáp án D
Muối nào sau đây là muối trung hòa?
-
A.
NaHCO3.
-
B.
Na2HPO3.
-
C.
NaHSO4.
-
D.
NaH2PO4.
Đáp án : B
Muối trung hòa là muối không chứa H hoặc chứa H nhưng không có khả năng phân li ra H+.
Na2HPO3 có nguyên tử H nhưng không có khả năng phân li ra H+ nên là muối trung hòa.
Chất nào sau đây là chất điện ly yếu
-
A.
KCl
-
B.
NaOH
-
C.
HNO3
-
D.
HF
Đáp án : D
Chất điện yếu là các axit yếu, bazo yếu
chất điện ly yếu là HF
Dung dịch muối nào có pH = 7?
-
A.
AlCl3.
-
B.
CuSO4.
-
C.
Na2CO3.
-
D.
KNO3.
Đáp án : D
AlCl3, CuSO4 có pH < 7
Na2CO3 có pH > 7
KNO3 có pH = 7
Trong nhóm IVA, theo chiều tăng của điện tích hạt nhân, nhận định nào sau đây sai ?
-
A.
Độ âm điện giảm dần
-
B.
Tính phi kim giảm dần, tính kim loại tăng dần.
-
C.
Bán kính nguyên tử giảm dần.
-
D.
Số oxi hoá cao nhất là +4.
Đáp án : C
Xem lại lí thuyết cacbon
Nhận định sai là: bán kính nguyên tử giảm dần
Vì theo chiều tăng của điện tích hạt nhân, độ âm điện giảm và số lớp e tăng => bán kính nguyên tử tăng
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với:
-
A.
H2SO4
-
B.
HCl
-
C.
HNO3
-
D.
HF
Đáp án : D
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với HF
SiO2 + HF → SiF4 + 2H2O
Khi bị đau dạ dày do lượng axit HCl trong đó quá cao thì người bệnh thường uống muối:
-
A.
NH4HCO3.
-
B.
Na2CO3.
-
C.
NaCl.
-
D.
NaHCO3.
Đáp án : D
Thuốc muối có thành phần chính là NaHCO3, khi uống vào dạ dày thì NaHCO3 tác dụng với HCl có trong dạ dày theo PTHH sau:
NaHCO3 + HCl → NaCl + H2O + CO2
Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
-
A.
0,2ml
-
B.
0,4ml
-
C.
0,6ml
-
D.
0,8ml
Đáp án : C
\({m_{{\rm{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)\)
\( \to {V_{dd}} = m:d = 50:1,12 = \frac{{625}}{{14}}ml\)
\({n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)\)
\( \to {C_{MNaOH}} = n:{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)\)
NaOH → Na+ + OH−
Theo pt: nNaOH = nOH- = 2.10-3 (mol)
⟹ Thể tích dd A cần lấy là: V = n : CM = 2.10-3 : 3,36 = 6.10-4 (l) = 0,6 (ml)
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
-
A.
0,01 và 0,03.
-
B.
0,01 và 0,01.
-
C.
0,03 và 0,02.
-
D.
0,02 và 0,01.
Đáp án : D
+) Áp dụng định luật bảo toàn điện tích có PT(1)
+) Áp dụng định luật bảo toàn khối lượng ta có:
mmuối = ${\text{ }}\sum {{m_{ion}}} $ => PT (2)
Áp dụng định luật bảo toàn điện tích ta có:
0,01.2 + 0,03.1 = x.1 + y.3 (1)
Áp dụng định luật bảo toàn khối lượng ta có:
mmuối = ${\text{ }}\sum {{m_{ion}}} {\text{ = > 2,59 = 0,01}}{\text{.24 + 0,03}}{\text{.23 + x}}{\text{.35,5 + y}}{\text{.95 (2)}}$
- Giải hệ hai phương trình (1) và (2) ta được: x = 0,02; y = 0,01
Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%.
-
A.
0,10 lít.
-
B.
0,52 lít.
-
C.
0,25 lít.
-
D.
0,35 lít.
Đáp án : C
- Tính số mol NH3, CuO
- Xác định số mol các chất trong hỗn hợp A
2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ 3Cu + N2 + 3H2O (1)
- Tính số mol HCl phản ứng
CuO + 2HCl \( \to \) CuCl2 + H2O (2)
=> VHCl
\(-{n_{N{H_3}}} = 0,1\,\,mol,\,\,{n_{CuO}} = 0,4\,\,mol.\)
- Phương trình phản ứng :
2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ 3Cu + N2 + 3H2O (1)
mol: 0,1 0,4 \( \to \) 0,15
=>
nCuO dư = 0,4 - 0,15 = 0,25mol
A gồm Cu (0,15 mol) và CuO dư (0,25 mol)
- Phản ứng của A với dung dịch HCl :
CuO + 2HCl \( \to \) CuCl2 + H2O (2)
mol: 0,25 \( \to \) 0,5
Theo (2) và giả thiết ta suy ra : VHCl =\(\frac{{0,5}}{2} = 0,25\,lít.\)
Thể tích N2 thu được khi nhiệt phân hoàn toàn 16 gam NH4NO2 là
-
A.
1,12 lít
-
B.
11,2 lít
-
C.
0,56 lít
-
D.
5,6 lít
Đáp án : D
Đổi số mol NH4NO2 = ?
Tính số mol N2 thoát ra theo phương trình:
NH4NO2 → N2 + H2O
nNH4NO2 = 16 : 64 = 0,25 mol
\(\eqalign{
& N{H_4}N{O_2}\buildrel {{t^o}} \over
\longrightarrow {N_2} + 2{H_2}O \cr
& \,\,\,\,\,0,25\,\,\,\,\,\,\,\,\,\,\,\, \to 0,25 \cr} \)
=> V N2 = 0,25.22.4 = 5,6 lít
Tổng hệ số cân bằng của các chất tham gia trong phản ứng sau là:
Mg + HNO3 → Mg(NO3)2 + N2O↑ + H2O
-
A.
24
-
B.
38
-
C.
14
-
D.
10
Đáp án : C
Cân bằng phương trình bằng phương pháp thăng bằng eletron.
\(\begin{array}{l}
x4\,\,\,\,\,\,\,\,\,\,\mathop {Mg}\limits^0 - 2e \to \mathop {Mg}\limits^{ + 2} \\
x1\,\,\,\,\,\,\,\,\,\,\,2\mathop N\limits^{ + 5} + 8e \to 2\mathop N\limits^{ + 1}
\end{array}\)
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O↑ + 5H2O
Tổng hệ số các chất tham gia là: 4 + 10 = 14
Đốt 3,1 gam P trong oxi dư rồi hòa tan toàn bộ oxit vào 92,9 gam nước. Nồng độ phần trăm của dung dịch thu được là:
-
A.
14,2%.
-
B.
3,1%.
-
C.
7,1%.
-
D.
9,8%.
Đáp án : D
Bảo toàn nguyên tố.
nP = 0,1 mol
P → ½ P2O5 → H3PO4
0,1 → 0,1 mol
mdd sau phản ứng = mP2O5 + mH2O = 100 gam
=> C% dd H3PO4 = \(\frac{{0,1.98}}{{100}}.100\% \) = 9,8%
Đốt một mẩu than chì chứa tạp chất lưu huỳnh trong oxi. Cho hỗn hợp khí thoát ra tác dụng với lượng dư dung dịch brom, thấy dung dịch brom nhạt màu. Cho khí thoát ra khỏi dung dịch brom đi qua nước vôi trong dư thấy có vẩn đục. Hỗn hợp khí thoát ra là:
-
A.
CO2, SO2
-
B.
CO, CO2
-
C.
CO, SO2
-
D.
CO2, H2S
Đáp án : A
Cần nắm được tính chất của CO2 và SO2
$\begin{align}& C\text{ }+\text{ }{{O}_{2}}\text{ }\xrightarrow{{{t}^{0}}}\text{ }C{{O}_{2}} \\ & S\text{ }+\text{ }{{O}_{2}}\text{ }\xrightarrow{{{t}^{0}}}\text{ }S{{O}_{2}} \\ \end{align}$
Khí làm mất màu dung dịch brom là SO2
Khí làm vẩn đục nước vôi trong là CO2
Cho hơi nước đi qua than nóng đỏ, thu được hỗn hợp khí X gồm CO, CO2 và H2. Cho toàn bộ X qua bình đựng dung dịch nước vôi dư thu được 10 gam kết tủa. Khí không bị hấp thụ thoát ra được dẫn qua ống đựng CuO (dư) nung nóng thu được hỗn hợp chất rắn Y. Hòa tan toàn bộ Y bằng dung dịch HNO3 (loãng, dư) thu được 8,96 lít khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO trong X là
-
A.
57,25%.
-
B.
28,57%.
-
C.
18,47%.
-
D.
14,29%.
Đáp án : B
Cách 1: Tính theo PTHH
Cho hơi nước đi qua than nóng đỏ:
C + H2O → CO + H2
C + 2H2O → CO2 + 2H2
Hỗn hợp X chứa: CO; CO2 và H2
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
CO + CuO dư → Cu + CO2 (đun nóng)
H2 + CuO dư → Cu + H2O (đun nóng)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cách 2: Sử dụng bảo toàn electron
nCO2 = nCaCO3
Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol)
- Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → (1)
- Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol)
- Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → (2)
Cách 1: Tính theo PTHH
Cho hơi nước đi qua than nóng đỏ:
C + H2O → CO + H2
a → a
C + 2H2O → CO2 + 2H2
b → 2b
Hỗn hợp X chứa: CO (a mol); CO2 (b mol) và H2 (a + 2b mol)
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
b → b = 0,1 mol
CO + CuO dư → Cu + CO2 (đun nóng)
a → a
H2 + CuO dư → Cu + H2O (đun nóng)
(a+2b) → (a+2b)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
(2a+2b) → 2/3.(2a+2b)
Vậy ta có: \(\left\{ \begin{array}{l}b = 0,1\\{n_{NO}} = \frac{2}{3}\left( {2{\rm{a}} + 2b} \right) = 0,4\end{array} \right. \to \left\{ \begin{array}{l}a = 0,2\\b = 0,1\end{array} \right.\)
Hỗn hợp X chứa: CO (0,2 mol); CO2 (0,1 mol) và H2 (0,4 mol)
⟹ %VCO = 28,57%
Cách 2: Sử dụng bảo toàn electron
nCO2 = nCaCO3 = 0,1 mol
Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol)
- Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → 2y = 2x + 0,4 (1)
- Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol)
- Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → 2(x + y) = 3.0,4 (2)
Giải hệ trên được x = 0,2 và y = 0,4
Hỗn hợp X chứa: CO (0,2 mol); H2 (0,4 mol); CO2 (0,1 mol)
⟹ %VCO = 28,57%
Thể tích CO2 (đktc) lớn nhất cần cho vào 2,0 lít dung dịch Ba(OH)2 0,1M để thu được 15,76 gam kết tủa là
-
A.
7,616 lít
-
B.
6,272 lít
-
C.
5,824 lít
-
D.
7,168 lít
Đáp án : D
+) Thể tích khí CO2 cần dùng lớn nhất để thu được 15,76 gam kết tủa là khi tạo kết tủa tối đa sau đó hòa tan 1 phần
=> phản ứng thu được 2 muối BaCO3 và Ba(HCO3)2
+) Sử dụng công thức tính nhanh: nCO2 = nOH- - nBaCO3
nOH- = 0,4 mol; nBaCO3 = 0,08 mol
Thể tích khí CO2 cần dùng lớn nhất để thu được 15,76 gam kết tủa là khi tạo kết tủa tối đa sau đó hòa tan 1 phần
=> phản ứng thu được 2 muối BaCO3 và Ba(HCO3)2
Sử dụng công thức tính nhanh: nCO2 = nOH- - nBaCO3 = 0,4 – 0,08 = 0,32 mol
=> V = 7,168 lít
Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
-
A.
0,02
-
B.
0,03
-
C.
0,015
-
D.
0,01
Đáp án : D
Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có :
+) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là:
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O
+) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là:
2H+ + CO32- →CO2 + H2O
HCO3- + H+ → CO2 + H2O
Phản ứng xảy ra theo thứ tự sau:
CO32- + H+ → HCO3- (1)
0,02mol ← 0,02mol →0,02mol
HCO3- + H+ → CO2 + H2O(2)
0,01mol ← 0,01mol → 0,01mol
Sau phản ứng (2) HCO3- còn dư 0,01 mol
Vậy số mol CO2 là 0,01 mol.
Một chất có CTĐGN là CH3. CTPT chất đó là
-
A.
C3H8.
-
B.
C2H6.
-
C.
C3H6.
-
D.
C4H10.
Đáp án : B
Công thức phân tử của chất có dạng là CnH3n
Mặt khác trong hidrocacbon ta luôn có: H ≤ 2C + 2 và H là số chẵn.
Tìm điều kiện của n.
Công thức phân tử của chất có dạng là CnH3n
Mặt khác trong hidrocacbon ta luôn có: H ≤ 2C + 2
=> 3n ≤ 2n + 2 => n ≤ 2
Mà số H chẵn nên ta suy ra n = 2
=> CTPT C2H6
Chất hữu cơ A chứa 7,86% H ; 15,73% N về khối lượng. Đốt cháy hoàn toàn 2,225 gam A thu được CO2, hơi nước và khí nitơ, trong đó thể tích khí CO2 là 1,68 lít (đktc). CTPT của A là (biết MA < 100) :
-
A.
C6H14O2N.
-
B.
C3H7O2N.
-
C.
C3H7ON.
-
D.
C3H7ON2.
Đáp án : B
+) ${{n}_{C}}={{n}_{C{{O}_{2}}}}\Rightarrow {{m}_{C}}\Rightarrow \%C=\dfrac{0,9}{2,225}.100\%$
+) %O = 100% – %C – %H – %N
+) ${{n}_{C}}:{{n}_{H}}:{{n}_{O}}:{{n}_{N}}=\dfrac{40,45}{12}:\dfrac{7,86}{1}:\dfrac{35,96}{16}:\dfrac{15,73}{14}$
+) Đặt công thức phân tử của A là (C3H7O2N)n; MA < 100
Ta có : ${{n}_{C}}={{n}_{C{{O}_{2}}}}=\dfrac{1,68}{22,4}=0,075\,mol\Rightarrow {{m}_{C}}=0,9\,\,gam\Rightarrow %C=\dfrac{0,9}{2,225}.100=40,45%$
Do đó : %O = (100 – 40,45 – 15,73 – 7,86)% = 35,96%.
${{n}_{C}}:{{n}_{H}}:{{n}_{O}}:{{n}_{N}}=\dfrac{40,45}{12}:\dfrac{7,86}{1}:\dfrac{35,96}{16}:\dfrac{15,73}{14}=3,37:7,86:2,2475:1,124=3:7:2:1$
Công thức đơn giản nhất của A là C3H7O2N.
Đặt công thức phân tử của A là (C3H7O2N)n. Theo giả thiết ta có :
(12.3 + 7 + 16.2 + 14).n < 100 => n < 1,12 => n =1
Vậy công thức phân tử của A là C3H7O2N.
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị của m gần nhất với giá trị nào dưới đây?
-
A.
23
-
B.
22
-
C.
24
-
D.
25
Đáp án : A
Đặt số mol của FeCO3 là x mol, FeS2 : y mol
Đốt cháy X có CO2 : x mol và SO2 : 2y mol và hỗn hợp rắn X
Vì dY/H2 = MY : 2 = 27 → MY = 54 = \(\dfrac{{44x + 64.2y}}{{x + 2y}}\) → x = 2y
X + HCl + NaNO3: quy đổi X thành M ( M là kim loại) và O
Vì khí thu được có M = 13,2 (g/mol) mà một khí hóa nâu ngoài không khí là NO
→ khí còn lại có M < 13,2 → khí đó là H2
nNO < nNO3 nên xảy ra phản ứng tạo NH4+
4H+ + NO3- + 3e → H2O + NO
10H+ + NO3- + 9e → 3H2O + NH4+
O + 2e → O2-
O2- + 2H+ → H2O
2 H+ + 2e → H2
Bảo toàn nguyên tố
Đặt số mol của FeCO3 là x mol, FeS2 : y mol
Đốt cháy X có CO2 : x mol và SO2 : 2y mol và hỗn hợp rắn X
Vì dY/H2 = MY : 2 = 27 → MY = 54 = \(\dfrac{{44x + 64.2y}}{{x + 2y}}\) → x = 2y
X + HCl + NaNO3: quy đổi X thành M ( M là kim loại) và O
nkhí = 0,05 mol
Vì khí thu được có M = 0,66 : 0,05 = 13,2 (g/mol) mà một khí hóa nâu ngoài không khí là NO
→ khí còn lại có M < 13,2 → khí đó là H2
nNO = a mol và nH2 = b mol thì nkhí = a + b =0,05 mol và mkhí = 30a + 2b = 0,66
nên a = 0,02 mol và b = 0,03 mol
Vì khí sinh ra có H2 nên lượng NO3- phải phản ứng hết, mà nNO < nNO3 nên xảy ra phản ứng tạo NH4+
PTHH : 4H+ + NO3- + 3e → H2O + NO
0,08 0,02 0,06 0,02
10H+ + NO3- + 9e → 3H2O + NH4+
0,1 0,01 0,09 0,01
O + 2e → O2-
O2- + 2H+ → H2O
2 H+ + 2e → H2
Vì dung dịch thu được chỉ chứa muối clo nên H+ hết nên 0,08 + 0,1 + 2nO + 0,03.2= 0,72 mol→ nO = 0,24 mol
Bảo toàn O cho phản ứng đốt cháy X có nO(X) + 2nO2 = nO(Y) + 2nSO2 + 2nCO2
→ 3x + 2.0,16 = 0,24 + 2.2y + 2x
→ 3x + 0,32 = 0,24 + 2x + 2x → x = 0,08 mol
→ nO(X) = 0,08.3 = 0,24 mol → mO(X) = 3,84 gam
Vì trong X chiếm 16,71% O nên mX = 3,84 : 16,71 .100 =22,98 gam gần nhất với 23 gam
Dung dịch X gồm 0,1 mol H+, z mol Al3+, t mol NO3- và 0,02 mol SO42-. Cho 120ml dung dịch Y gồm KOH 1,2M và Ba(OH)2 0,1M vào X, sau khi các phản ứng kết thúc, thu được 3,732 gam kết tủa. Giá trị của z,t lần lượt là
-
A.
0,020 và 0,012
-
B.
0,020 và 0,120
-
C.
0,120 và 0,020
-
D.
0,012 và 0,096
Đáp án : B

Cho từ từ đến hết 250 ml dung dịch B gồm NaHCO3 1M và Na2CO3 1M vào 120 ml dung dịch A gồm H2SO4 1M và HCl 1M, thu được V lít khí CO2 (đktc) và dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X thì được m gam kết tủa. Giá trị của m và V là
-
A.
79,18 và 5,376
-
B.
53,57 và 5,376.
-
C.
79,18 và 3,360.
-
D.
53,57 và 3,360
Đáp án : A
Vì tỉ lệ số mol của HCO3- và CO32- ban đầu bằng nhau nên ta gọi nHCO3- phản ứng = nCO32- phản ứng = x mol
+) nH+ = nHCO3- + 2.nCO32-
+) Bảo toàn C: nCO2 = nHCO3- + nCO32-
Dung dịch X chứa HCO3- dư (0,13 mol), CO32- dư (0,13 mol), SO42- (0,12 mol) và các ion khác
+) ${n_{BaC{O_3}}} = {\rm{ }}{n_{HCO_3^ - }} + {\rm{ }}{n_{CO_3^{2 - }}}$ và ${n_{BaS{O_4}}} = {\rm{ }}{n_{SO_4^{2 - }}}$
Dung dịch A: nH+ = 0,36 mol và nSO42- = 0,12 mol
Dung dịch B: nHCO3- = nCO32- = 0,25 mol
Vì tỉ lệ số mol của HCO3- và CO32- ban đầu bằng nhau nên ta gọi nHCO3- phản ứng = nCO32- phản ứng = x mol
=> nH+ = x + 2x = 0,36 => x = 0,12
=> nCO2 = x + x = 0,24 mol => V = 5,376 lít
Dung dịch X chứa HCO3- dư (0,13 mol), CO32- dư (0,13 mol), SO42- (0,12 mol) và các ion khác
${n_{BaC{O_3}}} = {\rm{ }}{n_{HCO_3^ - }} + {\rm{ }}{n_{CO_3^{2 - }}} = {\rm{ }}0,13{\rm{ }} + {\rm{ }}0,13{\rm{ }} = {\rm{ }}0,26{\rm{ }}mol$
${n_{BaS{O_4}}} = {\rm{ }}{n_{SO_4^{2 - }}} = {\rm{ }}0,12{\rm{ }}mol$
=> mkết tủa = 79,18 gam
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào lượng nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:

Giá trị của m là
-
A.
24,1 gam
-
B.
22,9 gam
-
C.
21,4 gam
-
D.
24,2 gam
Đáp án : B
+ Tại thời điểm ${{n}_{C{{O}_{2}}}}~=a$ thì: ${{n}_{B{{a}^{2+}}}}~=\text{ }{{n}_{\downarrow \text{ }max}}~={{n}_{C{{O}_{2}}}}$
+ Tại thời điểm ${{n}_{C{{O}_{2}}}}~=0,4\text{ }mol$ thì ${{n}_{HC{{O}_{3}}^{-}}}~={{n}_{C{{O}_{2}}}}~=0,4\text{ }mol$
BTĐT => ${{n}_{N{{a}^{+}}}}~={{n}_{HC{{O}_{3}}^{-}~}}-2{{n}_{B{{a}^{2+}}}}$
BT e: 2nBa + nNa = 2nO + 2nH2 => nO
=> m = mBa + mNa + mO
${{n}_{B{{a}^{2+}}~}}={{n}_{\downarrow max}}~=\frac{27,58}{197}=0,14\text{ }mol$ (tại thời điểm ${{n}_{C{{O}_{2}}~}}=a=0,14$)
Khi ${{n}_{C{{O}_{2}}}}~=0,4\text{ }mol$ : dung dịch thu được gồm: Ba2+ (0,14 mol), HCO3- (0,4 mol) và Na+
BTĐT => ${{n}_{N{{a}^{+}}}}~={{n}_{HC{{O}_{3}}^{-}~}}-2{{n}_{B{{a}^{2+}}}}$ = 0,12 mol
BT e: 2nBa + nNa = 2nO + 2nH2 => nO = 0,06 mol
m = mBa + mNa + mO = 22,9 gam
Các bài khác cùng chuyên mục
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1

















