Đề số 8 - Đề kiểm tra học kì 1 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 8 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11
Đề bài
Câu 1 (3,5 điểm):
a) Viết phương trình điện li của các chất sau khi hòa tan trong nước:
HCl, NaOH, CH3COOH, AlCl3, Fe2(SO4)3.
b) Bằng phương pháp hóa học hãy nhận biết các dung dịch đựng trong các lọ riêng biệt mất nhãn sau: Na3PO4, NaNO3, Na2CO3, NH4NO3.
Câu 2 (2,5 điểm):
Hoàn thành các phương trình phản ứng giữa các cặp chất sau, ghi rõ điều kiện cần thiết nếu có?
a) P + Mg →
b) P + HNO3 (đặc) →
c) Si + NaOH + H2O →
d) C + O2 (dư) →
e) CO + CuO →
Câu 3 (3 điểm):
a) + Tính pH của dung dịch chứa 2,92 gam HCl trong 800 ml?
+ Tính pH của dung dịch chứa 0,8 gam NaOH trong 200 ml?
b) Hòa tan hoàn toàn 10,35 gam hỗn hợp X gồm 2 kim loại Mg và Al bằng dung dịch HNO3 (loãng) dư sau phản ứng thu được dung dịch A và 7,84 lít khí không màu hóa nâu trong không khí (ở đktc, là sản phẩm khử duy nhất).
- Tính % khối lượng mỗi kim loại trong hỗn hợp X?
- Tính tổng khối lượng muối khan thu được khi cô cạn dung dịch A?
Câu 4 (1 điểm):
Cho 0,448 lít khí CO2 (ở đktc) hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH và 0,06M và Ba(OH)2 0,12M, thu được m gam kết tủa. Xác định giá trị của m?
Lời giải chi tiết
Câu 1:
a)
HCl → H+ + Cl-
NaOH → Na+ + OH-
CH3COOH \( \rightleftarrows \) CH3COO- + H+
AlCl3 → Al3+ + 3Cl-
Fe2(SO4)3 → 2Fe3+ + 3SO42-
b)
|
Chất Thuốc thử |
Na3PO4 |
NaNO3 |
Na2CO3 |
NH4NO3 |
|
Dung dịch NaOH |
- |
- |
- |
Khí mùi khai |
|
Dung dịch HCl |
- |
- |
Khí không màu |
x |
|
Dung dịch AgNO3 |
Kết tủa vàng |
- |
x |
x |
PTHH:
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
Na2CO3 + HCl → NaCl + CO2↑ + H2O
Na3PO4 + AgNO3 → NaNO3 + Ag3PO4↓
Câu 2:
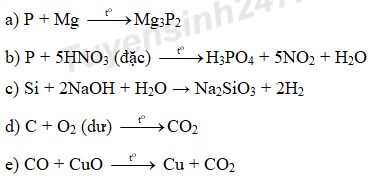
Câu 3:
a)
+ nHCl = 2,92 : 36,5 = 0,08 mol => nH+ = 0,08 mol
=> [H+] = 0,08 : 0,8 = 0,1 M
=> pH = -log[H+] = -log(0,1) = 1
+ nNaOH = 0,8 : 40 = 0,02 mol => nOH- = 0,02 mol
=> [OH-] = 0,02 : 0,2 = 0,1M
=> [H+] = 10-14 : [OH-] = 10-13 M
=> pH = -log[H+] = -log(10-13) = 13
b) nNO = 7,84 : 22,4 = 0,35 mol
Đặt nMg = x mol; nAl = y mol
- Khối lượng hỗn hợp X: 24x + 27y = 10,35 (1)
- Bảo toàn electron: 2nMg + 3nAl = 3nNO => 2x + 3y = 3.0,35 (2)
Từ (1) và (2) ta có:
\(\left\{ \begin{gathered}
24x + 27y = 10,25 \hfill \\
2x + 3y = 3.0,35 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,15 \hfill \\
y = 0,25 \hfill \\
\end{gathered} \right.\)
- Phần trăm mỗi kim loại:
\(\left\{ \begin{gathered}
\% {m_{Mg}} = \frac{{0,15.24}}{{10,35}}.100\% = 34,78\% \hfill \\
\% {m_{Al}} = \frac{{0,25.27}}{{10,35}}.100\% = 65,22\% \hfill \\
\end{gathered} \right.\)
- Khối lượng muối khan:
BTNT “Mg”: nMg(NO3)2 = nMg = 0,15 mol
BTNT “Al”: nAl(NO3)3 = nAl = 0,25 mol
=> m muối = 0,15.148 + 0,25.213 = 75,45 gam
Câu 4:
nNaOH = 0,006 mol; nBa(OH)2 = 0,012 mol
nCO2 = 0,448 : 22,4 = 0,02 mol
nOH- = nNaOH + 2nBa(OH)2 = 0,06.0,1 + 2.0,12.0,1 = 0,03 mol
Ta thấy: \(1 < \dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,03}}{{0,02}} = 1,5 < 2\)
=> tạo muối CO32-, HCO3-
Đặt \({n_{C{O_3}^{2 - }}}\) = a mol và \({n_{HC{O_3}^ - }}\) = b mol
PTHH:
CO2 + 2OH- → CO32- + H2O
a ← 2a ← a (mol)
CO2 + OH- → HCO3-
b ← 2b ← b (mol)
Theo đề bài ta có:
nCO2 = a + b = 0,02 (1)
nOH- = 2a + b = 0,03 (2)
\(\left\{ \begin{gathered}
a + b = 0,02 \hfill \\
2a + b = 0,03 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
a = 0,01 \hfill \\
b = 0,01 \hfill \\
\end{gathered} \right.\)
\({n_{B{a^{2 + }}}} = {n_{Ba{{\left( {OH} \right)}_2}}} = 0,012{\text{ }}mol\)
\({n_{C{O_3}^{2 - }}} = 0,01mol\)
=> CO32- hết, Ba2+ dư => \({n_{BaC{O_3}}} = {n_{C{O_3}^{2 - }}} = 0,01{\text{ }}mol\)
=> m = mBaCO3 = 0,01.197 = 1,97 gam
Xem lời giải chi tiết đề thi học kì 1 tại Tuyensinh247.com
Loigiaihay.com













Danh sách bình luận