Đề số 6 - Đề kiểm tra học kì 1 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 6 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11
Đề bài
PHẦN 1: TRẮC NGHIỆM KHÁCH QUAN (5,0 ĐIỂM)
Khoanh tròn đáp án đúng cho từng câu hỏi
Câu 1: Chọn phát biểu đúng.
A. Silic có tính oxi hóa mạnh hơn cacbon.
B. Cacbon có tính oxi hóa mạnh hơn silic.
C. Silic có tính khử yếu hơn cacbon.
D. Silic và cacbon có tính oxi hóa bằng nhau.
Câu 2: Chất có thể dùng làm khô khí NH3 là
A. P2O5. B. CuSO4 khan.
C. H2SO4 đặc. D. CaO.
Câu 3: Cho các hợp chất: CaC2, CO2, HCHO, CH3COOH, C2H5OH, NaCN, CaCO3. Số hợp chất hữu cơ trong các hợp chất đã cho là:
A. 1. B. 2.
C. 4. D. 3.
Câu 4: Trong các chất sau chất nào được gọi là hidrocacbon?
A. CH4. B. C2H6O.
C. CH3Cl. D. C12H22O11.
Câu 5: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3CH3CH2OH, C2H5OH.
D. C4H10, C6H6.
Câu 6: Khi đốt cháy chất hữu cơ X bằng oxi không khí thu được hỗn hợp khí và hơi gồm CO2, H2O, N2. Điều đó chứng tỏ phân tử chất X
A. chắc chắn phải có các nguyên tố C, H, O, N.
B. chắc chắn phải có các nguyên tố C, H, N có thể có nguyên tố O.
C. chỉ có các nguyên tố C, H.
D. chắc chắn phải có các nguyên tố C, O, N.
Câu 7: Thuốc nổ đen là hỗn hợp
A. KNO3, C và S.
B. KNO3 và S.
C. KClO3, C và S.
D. KClO3 và S.
Câu 8: Sự điện li là quá trình
A. hòa tan các chất vào nước.
B. phân li ra ion của các chất trong nước.
C. phân li thành các phân tử hòa tan.
D. phân li của axit trong nước.
Câu 9: Điều khẳng định đúng là:
A. dung dịch có môi trường bazo thì pH>7.
B. dung dịch có môi trường trung tính thì pH<7.
C. dung dịch có môi trường axit thì pH=7.
D. dung dịch có môi trường trung tính thì pH>7.
Câu 10: Trong các chất sau, chất có độ cứng lớn nhất là
A. silic. B. kim cương.
C. than chì. D. thạch anh.
Câu 11: Chất được dùng để chữa bệnh đau dạ dày là
A. CO. B. CO2 tinh thể
C. SiO2. D. NaHCO3.
Câu 12: Những ion có thể cùng tồn tại trong một dung dịch là
A. Na+, Ca2+, HSO4-, CO32-.
B. Na+, Mg2+, OH-, NO3-.
C. Na+, Ba2+, OH-, Cl-.
D. Ag+, H+, Cl-, SO42-.
Câu 13: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. các chất phản ứng phải là chất điện li mạnh.
B. một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
C. các chất phản ứng phải là những chất dễ tan.
D. phản ứng phải là thuận nghịch.
Câu 14: Khí N2 tương đối trơ ở nhiệt độ thường là do
A. Phân tử nito có liên kết ba bền vững.
B. Nito có bán kính nguyên tử nhỏ.
C. Nito có độ âm điện lớn.
D. Phân tử nito phân cực.
Câu 15: Cấu hình electron của nguyên tử photpho (Z = 15) là
A. 1s22s22p63s23p5.
B. 1s22s22p3.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p2.
Câu 16: Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là
A. đồng phân. B. đồng vị.
C. đồng đẳng. D. đồng khối.
Câu 17: Chất được dùng để khắc chữ lên thủy tinh là
A. dung dịch H2SO4.
B. dung dịch HNO3.
C. dung dịch HCl.
D. dung dịch HF.
Câu 18: Phản ứng nito thể hiện tính khử là
A. N2 + 6Li → 2Li3N.
B. N2 + 2Al → 2AlN.
C. N2 + O2 → 2NO.
D. N2 + 3H2 → 2NH3.
Câu 19: Trong phản ứng sau: HNO3 + C → CO2 + NO2 + H2O. Cacbon là
A. chất bị khử.
B. chất oxi hóa.
C. chất khử.
D. chất nhận electron.
Câu 20: Công thức phân tử của phân ure là
A. (NH4)2CO3. B. NH2CO.
C. (NH2)2CO3. D. (NH2)2CO.
PHẦN II: TỰ LUẬN (5,0 ĐIỂM)
Câu 1: (1,5 điểm) Viết các phương trình phản ứng hóa học hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện nếu có)

Câu 2: (1,5 điểm) Bằng phương pháp hóa học hãy nhận biết các dung dịch sau, viết các phương trình phản ứng xảy ra trong quá trình nhận biết: HNO3, NaNO3, Ba(OH)2, Na2SO4.
Câu 3: (1,0 điểm) Đốt cháy hoàn toàn 11,6 gam một chất hữu cơ A thu được 13,44 lít CO2 (đktc) và 10,8 gam H2O. Tỉ khối hơi A so với oxi là 1,8125. Lập công thức phân tử của A.
Câu 4: (1,0 điểm) Cho 13,5 gam Al tác dụng vừa đủ với 2,0 lít dung dịch HNO3 thu được hỗn hợp khí A gồm NO và N2 có tỉ khối với hidro là 14,75. Tính thể tích mỗi khí sinh ra (đktc)?
Cho biết: O = 16; H = 1; C = 12; N = 14; Al = 27
Lời giải chi tiết
|
1 |
2 |
3 |
4 |
5 |
|
B |
D |
D |
A |
A |
|
6 |
7 |
8 |
9 |
10 |
|
B |
A |
B |
A |
B |
|
11 |
12 |
13 |
14 |
15 |
|
D |
C |
B |
A |
C |
|
16 |
17 |
18 |
19 |
20 |
|
C |
D |
C |
C |
D |
PHẦN II: TỰ LUẬN (5,0 ĐIỂM)
Câu 1:
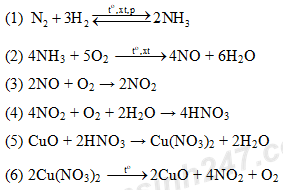
Câu 2:
|
Chất Thuốc thử |
HNO3 |
NaNO3 |
Ba(OH)2 |
Na2SO4 |
|
Quỳ tím |
Chuyển đỏ |
Không đổi màu |
Chuyển xanh |
Không đổi màu |
|
Ba(OH)2 |
- |
Không hiện tượng |
- |
Kết tủa trắng |
PTHH: Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
Câu 3:
nCO2 = 13,44 : 22,4 = 0,6 mol; nH2O = 10,8 : 18 = 0,6 mol
Do đốt cháy A thu được CO2 và H2O => A có chứa C, H có thể có O.
BTNT “C”: nC = nCO2 = 0,6 mol
BTNT “H”: nH = 2nH2O = 1,2 mol
BTKL: mO = mA – mC – mH = 11,6 – 0,6.12 – 1,2.1 = 3,2 (g)
=> nO = 3,2 : 16 = 0,2 mol
=> C : H : O = 0,6 : 1,2 : 0,2 = 3 : 6 : 1
Vậy A có dạng (C3H6O)n
Tỉ khối hơi A so với oxi là 1,8125 => MA = 1,8125.32 = 58 => 58n = 58 => n = 1
Vậy công thức phân tử của A là C3H6O
Câu 4:
nAl = 13,5 : 27 = 0,5 mol
Áp dụng phương pháp đường chéo cho hỗn hợp khí A ta có:
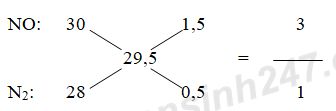
Đặt số mol của NO và N2 lần lượt là 3x và x (mol)
Theo định luật bảo toàn e ta có: 3nAl = 3nNO + 10nN2
=> 3.0,5 = 3.3x + 10x => x = 3/38 (mol)
VNO = 3x.22,4 = 3.(3/38).22,4 = 504/95 lít
VN2 = x.22,4 = (3/38).22,4 = 168/95 lít
Xem lời giải chi tiết đề thi học kì 1 tại Tuyensinh247.com
Loigiaihay.com













Danh sách bình luận