Đề số 7 - Đề kiểm tra học kì 1 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 7 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11
Đề bài
I. PHẦN CHUNG CHO TẤT CẢ CÁC HỌC SINH (6 điểm)
Câu 1: (2 điểm) Viết phương trình phản ứng theo sơ đồ chuyển hóa sau: (ghi rõ điều kiện, nếu có)
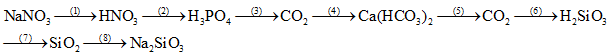
Câu 2: (2 điểm) Bằng phương pháp hóa học hãy phân biệt 4 dung dịch đựng trong các lọ mất nhãn sau: NH4Cl, Na3PO4, K2CO3, NaNO3.Viết phương trình hóa học xảy ra.
Câu 3: (2 điểm) Đốt cháy hoàn toàn 0,44g hợp chất hữu cơ A thu được 448ml khí CO2 (đktc) và 0,36g nước.
a/ Tìm công thức đơn giản nhất của A.
b/ Tìm công thức phân tử A biết tỉ khối của A so với hiđro là 44.
II. PHẦN RIÊNG (4 điểm) Học sinh học chương trình nào phải làm theo chương trình đó.
Câu 4: (2 điểm)
a/ Viết 1 phương trình hóa học chứng minh Silic có tính khử. Xác định số oxi hóa và chỉ rõ vai trò các chất tham gia phản ứng.
b/ Em hãy viết 01 phương trình điều chế cacbon monooxit (CO) bằng phương pháp khí than ướt.
Câu 5: (2 điểm) Hấp thụ hoàn toàn 3,36 lít khí CO2 (ở đktc) vào 100 ml dung dịch KOH 2M.
a/ Cho biết sau phản ứng thu được muối nào ?
b/ Tìm khối lượng muối thu được ?
Dành cho các lớp A
Câu 4: (2 điểm)
a/ Em hãy viết phương trình điều chế phân ure.
b/ Viết 01 phương trình chứng minh tính khử của Photpho, Xác định số oxi hóa và chỉ rõ vai trò các chất tham gia phản ứng.
Câu 5: (2 điểm) Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc) và dung dịch Y. Hãy:
a/ Tìm V.
b/ Cô cạn dd Y, Tính khối lượng muối khan trong Y.
Lời giải chi tiết
I. PHẦN CHUNG CHO TẤT CẢ HỌC SINH (6 điểm)
Câu 1:
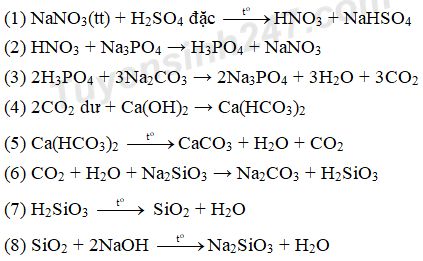
Câu 2:
|
|
NH4Cl |
Na3PO4 |
K2CO3 |
NaNO3 |
|
Dung dịch NaOH |
Khí mùi khai |
- |
- |
- |
|
Dung dịch HCl |
x |
- |
Khí không màu |
- |
|
Dung dịch AgNO3 |
x |
x |
Kết tủa vàng |
- |
NH4Cl + NaOH → NaCl + NH3↑ + H2O
K2CO3 + 2HCl → 2KCl + H2O + CO2↑
Na3PO4 + 3AgNO3 → Ag3PO4↓ + 3NaNO3
Câu 3:
nCO2 = 0,448 : 22,4 = 0,02 mol
=> nC = nCO2 = 0,02 mol => mC = 0,02.12 = 0,24 (g)
nH2O = 0,36 : 18 = 0,02 mol
=> nH = 2nH2O = 0,04 mol => mH = 0,04.1 = 0,04 (g)
mO = mA – mC – mH = 0,44 – 0,24 – 0,04 = 0,16 (g)
=> nO = 0,16 : 16 = 0,01 mol
a/ Gọi công thức phân tử của A là CxHyOz
Ta có: x : y : z = nC : nH : nO = 0,02 : 0,04 : 0,01 = 2 : 4 : 1
Vậy công thức đơn giản nhất của A là C2H4O
b/ Công thức đơn giản nhất của A là C2H4O nên công thức phân tử của A có dạng: (C2H4O)n
dA/H2 = 44 => MA = 44.2 = 88
=> 44n = 88 => n = 2
Vậy công thức phân tử của A là C4H8O2
II. PHẦN RIÊNG: (4 điểm) Học sinh học chương trình nào phải làm theo chương trình đó.
Dành cho các lớp D,T:
Câu 4:

Câu 5:
a/ nCO2 = 3,36 : 22,4 = 0,15 mol, nKOH = 0,1.2 = 0,2 mol
Ta thấy: => tạo 2 muối K2CO3 và KHCO3
b/ Đặt nK2CO3 = x mol; nKHCO3 = y mol
CO2 + 2KOH → K2CO3 + H2O
x 2x x (mol)
CO2 + KOH → KHCO3
y y y (mol)
nCO2 = x + y = 0,15 (1)
nKOH = 2x + y = 0,2 (2)
Giải hệ phương trình (1) và (2):
\(\left\{ \begin{gathered}
x + y = 0,15 \hfill \\
2x + y = 0,2 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,05 \hfill \\
y = 0,1 \hfill \\
\end{gathered} \right.\)
Khối lượng của các muối thu được là:
mK2CO3 = 0,05.138 = 6,9 gam
mKHCO3 = 0,1.100 = 10 gam
Tổng khối lượng 2 muối 6,9 + 10 = 16,9 gam
Dành cho các lớp A
Câu 4:

Câu 5:
a/ nCO3 2- = 0,1.1,5 = 0,15 mol, nHCO3- = 0,1.1 = 0,1 mol, nH+ = 0,2.1 = 0,2 mol
Khi nhỏ từ từ H+ vào dung dịch hỗn hợp CO32- và HCO3- thì thứ tự phản ứng là:
H+ + CO32- → HCO3-
0,15dư 0,05 ← 0,15 → 0,15 (mol)
H+ + HCO3- → H2O + CO2
0,05 → 0,05 → 0,05 (mol)
nHCO3- sau phản ứng = 0,1 + 0,15 – 0,05 = 0,2 mol
a/ VCO2 = 0,05.22,4 = 1,12 lít
b/ Dung dịch thu được chứa:
\(\left\{ \begin{gathered}
N{a^ + }:0,3mol \hfill \\
{K^ + }:0,1mol \hfill \\
HC{O_3}^ - :0,2mol \hfill \\
C{l^ - }:0,2mol \hfill \\
\end{gathered} \right.\)
Khi cô cạn HCO3- bị phân hủy:
\(\begin{gathered}
2HC{O_3}^ - \xrightarrow{{{t^o}}}C{O_3}^{2 - } + C{O_2} + {H_2}O \hfill \\
0,2mol\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1mol \hfill \\
\end{gathered} \)
Hỗn hợp muối sau khi cô cạn gồm:
\(\left\{ \begin{gathered}
N{a^ + }:0,3mol \hfill \\
{K^ + }:0,1mol \hfill \\
C{O_3}^{2 - }:0,1mol \hfill \\
C{l^ - }:0,2mol \hfill \\
\end{gathered} \right.\)
m muối = 0,3.23 + 0,1.39 + 0,1.60 + 0,2.35,5 = 23,9 gam
Xem lời giải chi tiết đề thi học kì 1 tại Tuyensinh247.com
Loigiaihay.com













Danh sách bình luận