Đề số 4 - Đề kiểm tra giữa học kì I - Hóa học 11 có lời giải
Đề số 4 - Đề kiểm tra giữa học kì I - Hóa học 11 có đáp án và lời giải chi tiết
Đề bài
Câu 1 : Chất không điện li là
A. CH3OH. B. CH3COOH.
C. NaF. D. HF.
Câu 2 : Phương trình ion thu gọn H+ + OH- → H2O biểu diễn bản chất của phản ứng hóa học nào sau đây ?
A. H2SO4 + BaCl2 → BaSO4 + 2HCl.
B. 3HCl + Fe(OH)3 → 3FeCl3 + 3H2O.
C. H2SO4 + 2NaOH → Na2SO4 + 2H2O.
D. NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 3 : Nhận định đúng về N2 là
A. Khí N2 hơi nặng hơn không khí.
B. Khí N2 không duy trì sự cháy.
C. Khí N2 tan tốt trong nước.
D. Khí N2 chiếm rất ít trong không khí.
|
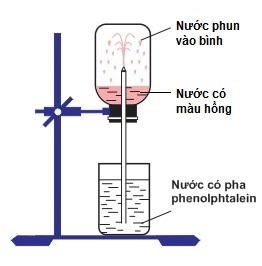
Câu 4 : Thực hiện thí nghiệm như hình vẽ dưới đây: Bên trong bình, lúc đầu có chứa khí X. Hiện tượng xảy ra khi tiến hành thí nghiệm: nước phun mạnh vào bình và chuyển thành màu hồng. Khí X là A. NH3. B. HCl. C. CO2. D. N2. |
 |
Câu 5 : Khi bón phân lân cho cây trồng thì không được trộn supephotphat với vôi bột vì:
A. Làm giảm hàm lượng P2O5 trong phân bón.
B. Làm tăng độ kiềm của đất.
C. Làm tăng độ chua của đất.
D. Tạo ra hợp chất ít tan làm cây trồng khó hấp thụ.
Câu 6 : Cho dãy chuyển hóa: HNO3 \(\xrightarrow{+X}\) NH4NO3 \(\xrightarrow{+Y}\) NH3 \(\xrightarrow{+Z}\) N2. Các chất X, Y, Z lần lượt có thể là:
A. Mg, BaCl2, Na2O. B. Cu, BaCl2, CuO.
C. Mg, NaOH, O2. D. Cu, NaOH, MgO.
Câu 7 : Cho phản ứng: aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Hệ số a, b, c, d, e là các số nguyên, tối giản. Tổng (a+b) bằng
A. 4. B. 6.
C. 7. D. 5.
Câu 8 : Cho các dung dịch sau: NaHSO4, AlCl3, K2SO4, K2S, Ba(NO3)2. Số dung dịch có pH < 7 là
A. 1. B. 2.
C. 3. D. 4.
Câu 9 : Cho các sơ đồ phản ứng sau:
1. NaOH + CuCl2 →
2. (NH4)2S + Ba(OH)2 →
3. NH4Cl + NaOH →
4. MgCO3 + HCl →
5. NH4NO3 + KOH →
6. NH4Cl + AgNO3 →
Phản ứng có cùng phương trình ion rút gọn:
A. 1, 3, 5. B. 2, 5, 6.
C. 2, 3, 5. D. 1, 5, 6.
Câu 10 : Cho các chất sau: FeO, Na2SO4, NH3, Cu(OH)2, MgO. Số chất tác dụng với dung dịch HNO3 là
A. 2. B. 3.
C. 4. D. 5.
Câu 11 : Cho 200 ml dung dịch chứa NaCl 0,1 M; Na2SO4 0,2M vào 300 ml dung dịch chứa H2SO4 0,1M; KCl 0,1M thu được 500 ml dung dịch A. Nồng độ ion SO42-, Na+ trong dung dịch A lần lượt là
A. 0,10M và 0,07M. B. 0,14M và 0,20M.
C. 0,14M và 0,07M. D. 0,10M và 0,20M.
Câu 12 : Hòa tan 50 ml dung dịch chứa HCl 0,01M, HNO3 0,01M vào 50 ml dung dịch H2SO4 0,005M thu được dung dịch B. Dung dịch B có pH bằng:
A. 1,60. B. 1,82.
C. 1,70. D. 2,00.
Câu 13 : Cho 100 ml dung dịch A chứa HCl 0,05M, H2SO4 0,025M vào 400 ml dung dịch B chứa NaOH 0,035M, Ba(OH)2 0,02M thu được dung dich có pH = x. Giá trị x là:
A. 1,4. B. 11,8.
C. 2,2. D. 12,6.
Câu 14 : Cho cốc (1) chứa 0,01 mol Mg2+, x mol NH4+, 0,03 mol NO3- vào cốc (2) chứa 0,025 mol Na+, y mol OH-, 0,01 mol CO32- nhận thấy khối lượng dung dịch thu được giảm bao nhiêu gam?
A. 1,010. B. 0,590.
C. 0,925. D. 1,850.
Câu 15 : Cho 17,92 lít hỗn hợp N2, H2 nung trong điều kiện thích hợp sau một thời gian thu được 13,888 lít hỗn hợp khí với hiệu suất 30% tính theo N2. Biết các khí đều được đo ở điều kiện tiêu chuẩn. Thể tích N2 trong hỗn hợp ban đầu là
A. 6,72. B. 8,96.
C. 5,60. D. 10,08.
Câu 16 : Hòa tan 12,9 gam hỗn hợp kim loại Mg, Al trong dung dịch HNO3 dư thu được dung dịch A chứa a gam muối và 8,96 lít (đktc) hỗn hợp khí N2, NO2 có tỉ lệ lần lượt là 1 : 3 (ngoài ra không còn sản phẩm khử khác). Khối lượng Mg trong hỗn hợp đầu là
A. 2,4. B. 4,8.
C. 7,2. D. 9,6.
Câu 17 : Nhiệt phân hoàn toàn 37,8 gam muối nitrat có hóa trị không đổi thu được oxit kim loại và 11,2 lít hỗn hợp khí (đktc) có khối lượng 21,6 gam. Công thức của muối nitrat là
A. Al(NO3)3. B. Cu(NO3)2.
C. Zn(NO3)2. D. AgNO3.
Câu 18 : Cho 19,6 gam axit photphoric tác dụng với 300 ml dung dịch NaOH 1M thu được dung dịch X. Khối lượng chất tan có trong dung dịch X là
A. 65,5. B. 52,4.
C. 39,3. D. 26,2.
Câu 19 : Hòa tan 8,4 gam Mg trong dung dịch HNO3 thu được 3,36 lít (đktc) hỗn hợp khí NO và khí X có tỉ lệ 2 : 1 (ngoài ra không còn sản phẩm khử nào khác). Khí X là
A. NO2. B. N2O.
C. N2. D. NO.
Câu 20 : Hòa tan kim loại hóa trị không đổi bằng dung dịch HNO3 thu được dung dịch chứa 113,4 gam muối và 2,688 lít (đktc) khí không màu và tương đối trơ ở điều kiện thường (sản phẩm khử duy nhất). Kim loại là
A. Mg. B. Zn.
C. Al. D. Fe.
Lời giải chi tiết
Câu 1
A: CH3OH là chất không điện li
B: CH3COOH là chất điện li yếu
C: NaF là chất điện li mạnh.
D: HF là chất điện li yếu.
Đáp án A
Câu 2
Phương pháp:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn.
Hướng dẫn giải:
A có PT ion thu gọn là SO42- + Ba2+ → BaSO4 → loại
B có PT ion thu gọn là 3H+ + Fe(OH)3 → Fe3++ 3H2O → loại
C có PT ion thu gọn là H+ + OH- → H2O → thỏa mãn
D có PT ion thu gọn là OH- + HCO3- → CO32- + H2O → loại
Đáp án C
Câu 3
A sai vì khí N2 nhẹ hơn không khí.
B đúng vì khí N2 không duy trì sự cháy.
C sai vì khí N2 ít tan trong nước.
D sai vì khí N2 chiếm thể tích lớn nhất trong không khí (≈80%).
Đáp án B
Câu 4
Phương pháp:
- Vì nước phun mạnh vào bình chứa khí X nên khí X tan tốt trong nước
- Nước chứa phenolphthalein chuyển màu hồng nên X tác dụng H2O tạo thành dung dịch có tính bazo
→ X
Hướng dẫn giải:
- Vì nước phun mạnh vào bình chứa khí X nên khí X tan tốt trong nước (khi bị hòa tan thì thể tích khí trong bình giảm nên nước phun vào bình).
- Nước chứa phenolphthalein chuyển màu hồng nên X tác dụng H2O tạo thành dung dịch có tính bazo
Vậy X là NH3
Đáp án A
Câu 5
Hướng dẫn giải:
Supephotphat đơn có thành phần là CaSO4 và Ca(H2PO4)2.
Supephotphat kép có thành phần là Ca(H2PO4)2.
Khi trộn supephotphat với vôi bột sẽ có phản ứng sau xảy ra:
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 ↓ + 4H2O
P trong phân bị kết tủa dưới dạng Ca3(PO4)2 nên làm giảm hàm lượng P2O5 trong phân bón
Đáp án A
Câu 6
Phương pháp:
Dựa vào tính chất hóa học của các chất xác định X, Y, Z.
Hướng dẫn giải:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
NH4NO3 + NaOH → NH3 + NaNO3.
2NH3 + 1,5O2 \(\xrightarrow{{{t}^{o}}}\) N2 + 3H2O.
Đáp án C
Câu 7
Phương pháp:
Cân bằng phương trình theo phương pháp thăng bằng electron
Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố, xác định chất khử, chất oxi hóa.
Bước 2: Viết quá trình oxi hóa, quá trình khử, cân bằng mỗi quá trình.
Bước 3: Đặt hệ số thích hợp trước chất khử, chất oxi hóa sao cho số electron quá trình oxi hóa bằng số electron quá trình khử.
Bước 4: Đặt hệ số thích hợp vào các chất trong phương trình và hoàn thành phương trình.
Hướng dẫn giải:
Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố trong phản ứng
\(a\overset{0}{\mathop{Al}}\,+bH\overset{+5}{\mathop{\text{ }N}}\,{{O}_{3}}\to \overset{+3}{\mathop{cAl}}\,{{(N{{O}_{3}})}_{3}}+\overset{+2}{\mathop{dN}}\,O+e{{H}_{2}}O\)
Bước 2,3: Viết quá trình oxi hóa, quá trình khử, cân bằng mỗi quá trình. Đặt hệ số trước chất khử, chất oxi hóa thích hợp sao cho số mol e nhường quá trình oxi hóa = số mol e nhận của quá trình khử
\(\begin{array}{*{20}{c}}{1 \times }\\{1 \times }\end{array}\left| {\begin{array}{*{20}{l}}{A{l^0} \to A{l^{ + 3{\kern 1pt} }} + 3e}\\{{N^{ + 5}} + 3e \to {N^{ + 2}}}\end{array}} \right.\)
Bước 3: Đặt hệ số vào chất khử, chất oxi hóa. Cân bằng phương trình
\(\mathop {Al}\limits^0 + H\mathop {{\rm{ }}N}\limits^{ + 5} {O_3} \to \mathop {Al}\limits^{ + 3} {(N{O_3})_3} + \mathop {{\rm{ }}N}\limits^{ + 2} O + {H_2}O\)
Kiểm tra nguyên tố N bên vế phải sau đó đặt hệ số HNO3 bên vế trái
Sau đó kiểm tra số H bên vế trái và đặt vào hệ số H2O bên vế phải
\(\mathop {Al}\limits^0 + 4H\mathop {{\rm{ }}N}\limits^{ + 5} {O_3} \to \mathop {Al}\limits^{ + 3} {(N{O_3})_3} + \mathop {{\rm{ }}N}\limits^{ + 2} O + 2{H_2}O\)
Kiểm tra cả 2 vế oxi đều đủ 12 nguyên tử O → phương trình trên được cân bằng
Vậy (a+b) = (1+4) = 5
Đáp án D
Câu 8
Phương pháp:
Xác định pH của dung dịch axit, bazo, muối:
- Dung dịch axit có MT axit (pH < 7)
- Dung dịch bazo có MT kiềm (pH > 7)
- Dung dịch muối:
+ Muối tạo bởi bazo mạnh và axit mạnh ⟹ MT trung tính (pH = 7)
+ Muối tạo bởi bazo mạnh và axit yếu ⟹ MT kiềm (pH > 7)
+ Muối tạo bởi bazo yếu và axit mạnh ⟹ MT axit (pH < 7)
Hướng dẫn giải:
NaHSO4 có khả năng phân li H+ ⟹ MT axit ⟹ pH < 7.
AlCl3 là muối của bazơ yếu Al(OH)3 và axit mạnh HCl ⟹ MT axit ⟹ pH < 7.
K2SO4 là muối của bazơ mạnh KOH và axit mạnh H2SO4 ⟹ MT trung tính ⟹ pH = 7.
K2S là muối của bazo mạnh KOH và axit yếu H2S ⟹ MT kiềm ⟹ pH > 7.
Ba(NO3)2 là muối của bazo mạnh Ba(OH)2 và axit mạnh HNO3 ⟹ MT trung tính ⟹ pH = 7.
Đáp án B
Câu 9
Phương pháp:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn.
Hướng dẫn giải:
1. 2NaOH + CuCl2 → 2NaCl + Cu(OH)2 ↓
⟹ Cu2+ + 2OH- → Cu(OH)2 ↓
2. (NH4)2S + Ba(OH)2 → BaS + 2NH3 ↑ + 2H2O
⟹ NH4+ + OH- → NH3 ↑ + H2O
3. NH4Cl + NaOH → NaCl + NH3 ↑ + H2O
⟹ NH4+ + OH- → NH3 ↑ + H2O
4. MgCO3 + 2HCl → MgCl2 + H2O + CO2 ↑
⟹ MgCO3 + 2H+ → Mg2+ + H2O + CO2 ↑
5. NH4NO3 + KOH → KNO3 + NH3 ↑ + H2O
⟹ NH4+ + OH- → NH3 ↑ + H2O
6. NH4Cl + AgNO3 → NH4NO3 + AgCl ↓
⟹ Ag+ + Cl- → AgCl ↓
Vậy các phản ứng 2, 3, 5 có cùng phương trình ion thu gọn là NH4+ + OH- → NH3 ↑ + H2O.
Đáp án C
Câu 10
Phương pháp:
Dựa vào tính chất hóa học của HNO3
Hướng dẫn giải:
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Na2SO4 không tác dụng HNO3
NH3 + HNO3 → NH4NO3
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O
MgO + 2HNO3 → Mg(NO3)2 + H2O
⟹ 4 chất
Đáp án C
Câu 11
Phương pháp:
Tính được số mol NaCl, Na2SO4, H2SO4, KCl.
Các chất đều là chất điện li mạnh nên điện li hoàn toàn thành ion.
Suy ra số mol các ion Na+ và SO42-
Tính nồng độ của các ion dựa vào công thức: CM = n : V
Hướng dẫn giải:
nNaCl = 0,2.0,1 = 0,02 mol; nNa2SO4 = 0,2.0,2 = 0,04 mol
nH2SO4 = 0,3.0,1 = 0,03 mol; nKCl = 0,3.0,1 = 0,03 mol
Các chất đều là chất điện li mạnh nên điện li hoàn toàn thành ion.
Vậy trong dung dịch A:
nNa+ = nNaCl + 2nNa2SO4 = 0,02 + 0,04.2 = 0,1 mol ⟹ CM Na+ = 0,1/0,5 = 0,2M
nSO42- = nNa2SO4 + nH2SO4 = 0,04 + 0,03 = 0,07 mol ⟹ CM SO42- = 0,07/0,5 = 0,14M
Đáp án B
Câu 12
Phương pháp:
Tính số mol của các axit ban đầu
Các axit đều là chất điện li mạnh nên điện li hoàn toàn thành ion
⟹ nH+ = nHCl + nHNO3 + nH2SO4 ⟹ [H+] ⟹ pH
Hướng dẫn giải:
nHCl = 0,05.0,01 = 5.10-4 mol.
nHNO3 = 0,05.0,01 = 5.10-4 mol.
nH2SO4 = 0,05.0,005 = 2,5.10-4 mol.
Các axit đều là chất điện li mạnh nên điện li hoàn toàn thành ion
⟹ nH+ = nHCl + nHNO3 + nH2SO4 = 5.10-4 + 5.10-4 + 2.2,5.10-4 = 1,5.10-3 mol
⟹ [H+] = (1,5.10-3)/0,1 = 0,015 M
⟹ pH = -log (0,015) = 1,82.
Đáp án B
Câu 13
Phương pháp:
Tính số mol H+, OH-
Tính theo PT ion suy ra số mol OH- dư sau phản ứng
Tính [OH-] dư ⟹ pOH ⟹ pH
Hướng dẫn giải:
Dung dịch A có: nHCl = 0,1.0,05 = 0,005 mol; nH2SO4 = 0,1.0,025 = 0,0025 mol
⟹ nH+ = nHCl + 2nH2SO4 = 0,005 + 0,0025.2 = 0,01 mol
Dung dịch A có: nNaOH = 0,4.0,035 = 0,014 mol; nBa(OH)2 = 0,4.0,02 = 0,008 mol
⟹ nOH- = nNaOH + 2nBa(OH)2 = 0,014 + 0,008.2 = 0,03 mol
H+ + OH- → H2O
Dựa vào tỉ lệ phản ứng H+ hết, OH- dư
H+ + OH- → H2O
Bđ: 0,01 0,03 (mol)
Pư: 0,01 → 0,01 (mol)
Sau: 0 0,02 (mol)
⟹ nOH-dư = 0,02 mol
⟹ [OH-]dư = 0,02/0,5 = 0,04 M
⟹ pOH = -log[OH-] = -log(0,04) ≈ 1,4
⟹ pH = 14 - pOH = 12,6
Đáp án D
Câu 14
Phương pháp:
- Dùng phương pháp bảo toàn điện tích tính số mol của các ion còn thiếu
- Viết phương trình ion tính khối lượng sản phẩm
- Khối lượng dung dịch giảm là tổng khối lượng của khí và kết tủa
Hướng dẫn giải:
Trong cốc 1: 2.nMg2+ + 1.nNH4+ = 1.nNO3- ⟹ 2.0,01 + x = 0,03 ⟹ x = 0,01 mol = nNH4+.
Trong cốc 2: 1.nNa+ = 1.nOH- + 2.nCO32- ⟹ 0,025 = y + 2.0,01 ⟹ y = 0,005 mol = nOH-.
Mg2+ + CO32- → MgCO3 ↓
0,01 → 0,01 0,01
NH4+ + OH- → NH3 ↑ + H2O
0,005 ← 0,005 → 0,005
Khí và kết tủa tách ra khỏi dung dịch nên làm cho khối lượng dung dịch giảm
⟹ mdd giảm = mNH3 + mMgCO3 = 0,005.17 + 0,01.84 = 0,925 gam.
Đáp án C
Câu 15
Phương pháp:
Ta có: ngiảm = nNH3
Tính theo PTHH ⟹ nN2 pư
Từ hiệu suất ⟹ nN2 ban đầu ⟹ VN2 ban đầu
Hướng dẫn giải:
nkhí ban đầu = 17,92/22,4 = 0,8 mol
nkhí sau = 13,888/22,4 = 0,62 mol
PTHH: N2 + 3H2 ⇄ 2NH3
ngiảm = nNH3 = nkhí bđ – nkhí sau = 0,8 – 0,62 = 0,18 mol
PTHH: N2 + 3H2 ⇄ 2NH3
0,09 ← 0,18
⟹ nN2 pu = 0,09 mol ⟹ nN2 bđ = nN2 pu.100/30 = 0,09.100/30 = 0,3 mol
⟹ VN2 = 0,3.22,4 = 6,72 lít
Đáp án A
Câu 16
Phương pháp:
Đặt ẩn là số mol mỗi kim loại
Từ khối lượng hỗn hợp ⟹ (1)
Áp dụng định luật bảo toàn electron ⟹ (2)
Giải hệ thu được nghiệm
Tính khối lượng của Mg trong hỗn hợp đầu
Hướng dẫn giải:
Gọi nMg = x, nAl = y (mol)
⟹ mhh = 24x + 27y = 12,9 (1)
Quá trình nhường e:
Mg → Mg2+ + 2e
x → 2x
Al → Al3+ + 3e
y → 3y
ne nhường = 2x + 3y (mol)
Ta có: nN2 + nNO2 = 0,4 và nN2 / nNO2 = 1/3 ⟹ nN2 = 0,1 mol và nNO2 = 0,3 mol.
Quá trình nhận e:
N+5 + 1e → N+4
0,3 ← 0,3
N+5 + 10e → N2
1 ← 0,1
⟹ ne nhận = 1,3 mol
Áp dụng bảo toàn e: 2x + 3y = 1,3 (2)
Từ (1) và (2) ⟹ x = 0,2; y = 0,3
⟹ mMg = 0,2.24 = 4,8 gam
Đáp án B
Câu 17
Phương pháp:
Từ thể tích và khối lượng của hỗn hợp khí tính được số mol mỗi khí
PTHH: 2M(NO3)n → M2On + 2nNO2 + 0,5nO2
Đặt mol khí vào phương trình suy ra số mol muối nitrat
Lập phương trình
Hướng dẫn giải:
Xét hỗn hợp khí gồm NO2 (a mol) và O2 (b mol):
⟹ nkhí = a + b = 0,5 (1)
⟹ mkhí = 46a + 32b = 21,6 (2)
Giải hệ trên được a = 0,4 và b = 0,1
2M(NO3)n → M2On + 2nNO2 + 0,5nO2
0,4/n ← 0,4
⟹ mmuối = 0,4/n.(M + 62n) = 37,8 ⟹ M = 32,5n
Biện luận với n = 1, 2, 3:
+ Nếu n = 1 ⟹ M = 32,5 (loại)
+ Nếu n = 2 ⟹ M = 65 (Zn)
+ Nếu n = 3 ⟹ M = 97,5 (loại)
Đáp án C
Câu 18
Phương pháp:
Xét tỉ lệ nNaOH : nH3PO4 = a
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Nếu a ≤ 1 thì phản ứng chỉ tạo ra NaH2PO4
Nếu 1 < a < 2 thì phản ứng tạo 2 muối NaH2PO4 và Na2HPO4
Nếu a = 2 thì phản ứng chỉ tạo Na2HPO4
Nếu 2 < a < 3 thỉ phản ứng tạo 2 muối Na2HPO4 và Na3PO4
Nếu a ≥ 3 nên phản ứng tạo muối Na3PO4
Ta có: nH3PO4 = 19,6/98 = 0,2 mol; nNaOH = 0,3.1 = 0,3 mol
Ta thấy: 1 < nNaOH/nH3PO4 = 0,3/0,2 = 1,5 < 2 ⟹ tạo muối NaH2PO4, Na2HPO4.
Hướng dẫn giải:
Gọi nNa2HPO4 = a mol; nNaH2PO4 = b mol
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
a 2a ← a
H3PO4 + NaOH → NaH2PO4 + H2O
b b ← b
nH3PO4 = a + b = 0,2 (1)
nNaOH = 2a + b = 0,3 (2)
Từ (1) và (2) ⟹ a = 0,1; b = 0,1
⟹ mchất tan = mNa2HPO4 + mNaH2PO4 = 0,1.142 + 0,1.120 = 26,2 gam
Đáp án D
Câu 19
Phương pháp:
Từ thể tích của hỗn hợp khí và tỉ lệ mol mỗi khí tính được số mol mỗi khí.
Giả sử 1 mol khí X trao đổi n mol electron.
Áp dụng bảo toàn e: 2nMg = 3nNO + n.nX
Suy ra giá trị của n.
+ Nếu n = 1 ⟹ X là NO2
+ Nếu n = 3 ⟹ X là NO
+ Nếu n = 8 ⟹ X là N2O
+ Nếu n = 10 ⟹ X là N2
Hướng dẫn giải:
Ta có nNO = 2nX ⟹ nNO = 0,1 mol và nX = 0,05 mol
Giả sử 1 mol khí X trao đổi n mol electron.
Áp dụng bảo toàn e: 2nMg = 3nNO + n.nX
⇔ 2.0,35 = 3.0,1 + 0,05n
⇔ n = 8
Vậy khí X là N2O (vì 2N+5 + 8e → 2N+1 (N2O)).
Đáp án B
Câu 20
Phương pháp:
Dựa vào phương pháp bảo toàn e, bảo toàn nguyên tố tìm kim loại.
Hướng dẫn giải:
Gọi kim loại hóa trị không đổi là M có hóa trị là n
2N+5 + 10e → N2
1,2 ← 0,12
M → Mn+ + ne
1,2/n ← 1,2
⟹ mmuối = (M + 62n).1,2/n = 113,4 ⟹ M = 32,5n
⟹ n = 2; M = 65 thỏa mãn
Vậy kim loại là Zn.
Đáp án B
Loigiaihay.com













Danh sách bình luận