 Giải bài tập hóa học 11, Hóa 11 - Để học tốt hóa học 11
Giải bài tập hóa học 11, Hóa 11 - Để học tốt hóa học 11
 Đề kiểm tra 45 phút (1 tiết) - Chương VIII - Hóa học 11
Đề kiểm tra 45 phút (1 tiết) - Chương VIII - Hóa học 11
Đề kiểm tra 1 tiết (45 phút) - Đề số 2 - Chương VIII - Hóa học 11
Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 2 - Chương VIII - Hóa học 11
Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Trong công thức sau đây, hãy cho biết công thức nào chỉ ứng với công thức của ancol bậc I?
A.R(OH)n. B.CnH2n-1OH.
C.R-CH2OH. D.CnH2n+1OH.
Câu 2. Cho 11 gam hỗn hợp gồm hai ancol đơn chức tác dụng hết với natri, thu được 3,36 lít H2 (đktc). Phân tử khối trung bình của hai ancol là:
A.40,8. B.71,3.
C.36,7. D.30,6.
Câu 3. Cho công thức cấu tạo của một hợp chất như sau:
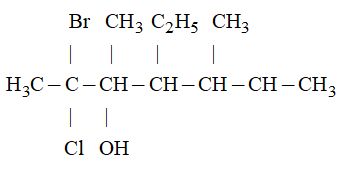
Tên gọi của hợp chất trên là:
A.2-brom-2-clo-5-etyl-4,6-đimetylheptan-3-ol.
B.2-clo-2-brom-4,6-đimetyl-5-etylheptan-3-ol.
C.2-brom-2-clo-4,6-đimetyl-5-etylheptan-3-ol.
D.Cả A, B và C đều đúng.
Câu 4. Công thức nào sau đây biểu diễn đúng công thức câu tạo thu gọn của ancol no, mạch hở?
A.CnH2+2Oa. B.CnH2n+2-x(OH)x.
C.CnH2n+2O. D.R(OH)a.
Câu 5. Cho công thức phân tử của C5H12O. Số đồng phân ứng với ancol bậc hai là:
A.3. B.4.
C.5. D.6.
Câu 6. Khi thực hiện phản ứng tách nước hợp chất 2,5-đimetylhexan-3-ol trong điều kiện \(170^\circ C\) và H2SO4 đặc thì sản phẩm chính thu được là:
A.2,5-đimetylhex-3-en.
B.2,5-đimetylhex-2-en.
C.2,5-đimetylhexen.
D.Cả A, B và C đều đúng.
Câu 7. Lấy 120 lít dung dịch ancol etylic \(96^\circ \) (D = 0,8 g/ml) cho qua ống chứa xúc tác ZnO/MgO ở \(500^\circ C\) thì thu được a gam buta-1,3-đien (hiệu suất H = 90%). Giá trị của a là:
A.3,36 lít. B.60,11 lít.
C.65,16 lít. D.64,18 lít.
II. PHẦN TỰ LUẬN
Câu 9. Dung dich A là hỗn hợp ancol và nước. Cho 20,2 gam A tác dụng với natri dư, thu được 5,6 lít H2 (đktc). Hãy tính độ rượu của dung dịch A, biết dancol = 0,8 g/ml và \({d_{{H_2}O}} = 1g/ml\).
Câu 10. Đốt cháy hết 0,05 mol ancol no Z mạch hở cần 3,92 lít O2 (đktc) thu được 6,6 gam CO2. Tìm công thức phân tử của Z.
Câu 11. Có 30,75 gam hỗn hợp A gồm hai ancol đồng đẳng với ancol metylic.
a) Lấy \(\dfrac{1}{{10}}\) hỗn hợp A đem oxi hóa hoàn toàn thành các axit hữu cơ tượng ứng. Để trung hòa các axit tạo thành cần dùng 300ml dung dịch NaOH 0,2M. Tính tổng số mol của 2 ancol có trong hỗn hợp A.
b) Lấy \(\dfrac{1}{{10}}\) hỗn hợp A đem đốt cháy hoàn toàn và cho các sản phẩm cháy lần lượt đi qua bình đựng axit sunfuric đặc và bình đựng dung dịch bari hiđoxit. Hỏi sau khi kết thúc thí nghiệm khối lượng các bình tăng hay giảm bao nhiêu gam?
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
C |
C |
A |
B |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
A |
B |
C |
D |
II. PHẦN TỰ LUẬN
Câu 9.
Ta có: \({n_{{H_2}}} = \dfrac{{5,6}}{{22,4}} = 0,25\left( {mol} \right)\)
Gọi a và b lần lượt là số mol của ancol và nước.
Phản ứng:
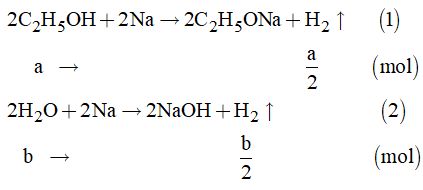
Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}{m_{{H_2}}} = \dfrac{a}{2} + \dfrac{b}{2} = 0,25\\{m_A} = 46a + 18b = 20,2\end{array} \right.\)
Giải hệ phương trình, ta được: \(\left\{ \begin{array}{l}a = 0,4\\b = 0,1\end{array} \right.\)
Vậy \({m_{{C_2}{H_5}OH}} = 0,4 \times 46 = 18,4\left( {gam} \right);\)
\({m_{{H_2}O}} = 0,1 \times 18 = 1,8\left( {gam} \right)\)
Vancol nguyên chất \( = \dfrac{m}{d} = \dfrac{{18,4}}{{0,8}} = 23\left( {ml} \right)\)
\( \Rightarrow {V_{{\rm{dd \;ancol}}}} = {V_{ancol}} + {V_{{H_2}O}} \)\(\,= 23 + 1,8 = 24,8\left( {ml} \right)\)
Độ ancol \( = \dfrac{{23}}{{24,8}} \times 100 = 92,74^\circ \)
Câu 10.
Gọi công thức tổng quát của ancol no mạch hở (Z) là: CxHy(OH)a
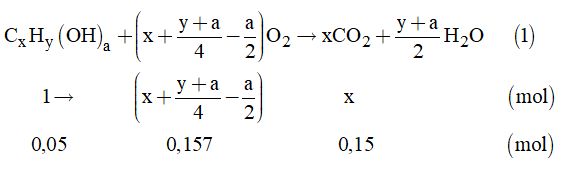
Từ (1) ta có: \(x = \dfrac{{0,15}}{{0,05}} = 3;\)
\(x + \dfrac{{y + a}}{2} - \dfrac{a}{2} = 3,5{\rm{ }}\left( 2 \right)\)
Vì Z là ancol no nên: \(y + a = 2x + 2 \) (3)
Thay (3) và (2) ta có: \(a = 3.\)
Vậy công thức phân tử của Z là: C3H5(OH)3.
Câu 11.
Gọi công thức phân tử của 2 ancol đồng đẳng với ancol metylic là: \({C_n}{H_{2n + 1}}OH;{C_m}{H_{2m + 1}}OH.\) a)Tính tổng số mol của 2 ancol:
Các phản ứng xảy ra:
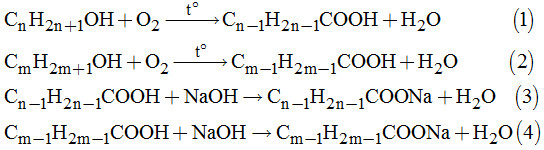
Ta có: \({n_{NaOH}} = 0,3 \times 0,2 = 0,06(mol)\)
Từ (1), (2), (3) và (4) ta thấy: cứ 1 mol ancol bị oxi hóa thành 1 mol axit để trung hòa 1 mol axit cần 1 mol NaOH.
Gọi a; b lần lượt là số mol của ancol thứ nhất và ancol thứ hai trong \(\dfrac{1}{{10}}\) hỗn hợp A,
Ta có: a + b = 0,06
Vậy tổng số mol của 2 ancol trong hỗn hợp A là: \(0,06 \times 10 = 0,6(mol)\)
b) Phản ứng đốt cháy các ancol trong hỗn hợp A:
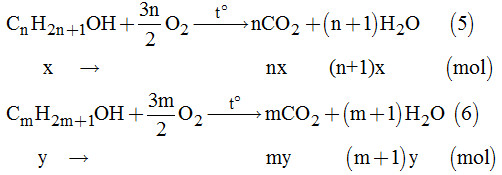
Hỗn hợp khí thu được gồm CO2 và H2O, khi qua bình đựng H2SO4 đặc thì nước bị giữ lại, còn CO2 khi qua bình đựng Ba(OH)2 sẽ bị giữ lại tạo kết tủa BaCO3.
\(C{O_2} + Ba{\left( {OH} \right)_2} \to BaC{O_3} \downarrow + {H_2}O\)
Theo câu a) \( \Rightarrow x + y = 0,06\) (I)
Theo phản ứng (5) và (6) \( \Rightarrow {n_{C{O_2}}} = t = nx + my\) (II)
Và \({n_{{H_2}O}} = \left( {n + 1} \right)x + \left( {m + 1} \right)y\) (III)
Khối lượng của 2 ancol trong hỗn hợp A là: \(\left( {14n + 18} \right)x + 14my + 18y = 3,075\)
\( \Leftrightarrow 14\left( {nx + my} \right) + 18\left( {x + y} \right) = 3,075\) (IV)
Từ (I) và (IV) ta suy ra số mol CO2:
\(t = nx + my = \dfrac{{3,075 - 18 \times 0,06}}{{14}}\)\(\, = 0,1425\left( {mol} \right)\)
Độ tăng của bình đựng Ba(OH)2 chính là khối lượng của CO2:
\( \Rightarrow {m_{C{O_2}}} = 0,1425 \times 44 = 6,27\left( {gam} \right).\)
Từ (III)
\( \Rightarrow {m_{{H_2}O}} = z = \left( {nx + my} \right) + \left( {x + y} \right)\)
\(= 0,1425 + 0,06 = 0,2025\left( {mol} \right)\)
Khối lượng bình đựng H2SO4 đặc tăng chính là khối lượng của H2O:
\( \Rightarrow {m_{{H_2}O}} = 0,2025 \times 18 = 3,645\left( {gam} \right).\)
Loigiaihay.com












Danh sách bình luận