Đề thi giữa kì 1 Hóa 11 - Đề số 3
Đề bài
Phát biểu không đúng là
-
A.
Môi trường kiềm có pH < 7.
-
B.
Môi trường kiềm có pH > 7.
-
C.
Môi trường trung tính có pH = 7.
-
D.
Môi trường axit có pH < 7.
Chất nào sau đây là chất điện li?
-
A.
Rượu etylic
-
B.
lưu huỳnh trioxit
-
C.
Axit sunfuric
-
D.
Glucozơ
Chất điện li yếu có độ điện li
-
A.
$\alpha $ = 1
-
B.
$\alpha $ = 0
-
C.
0<$\alpha $ < 1
-
D.
$\alpha $ <0
Câu nào sau đây nói không đúng về độ điện li $\alpha $ (anpha)?
-
A.
Là tỉ số giữa số phân tử phân li ra ion và tổng số phân tử hòa tan
-
B.
Độ điện li của các chất khác nhau là giống nhau
-
C.
Độ điện li thay đổi theo nhiệt độ
-
D.
Độ điện li của các chất điện li nằm trong khoảng 0 < $\alpha $ $ \leqslant $ 1.
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính acid là :
-
A.
CaCO3, Cu(OH)2, Fe(OH)2, FeO.
-
B.
CuO, NaOH, FeCO3, Fe2O3.
-
C.
Fe(OH)3, Na2CO3, Fe2O3, Cu(OH)2.
-
D.
KOH, FeS, K2CO3, Cu(OH)2
Muốn pha chế 300 ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là
-
A.
1,2.10$^{ - 3}$ gam
-
B.
2,1.10$^{ - 3}$ gam
-
C.
1,4.10$^{ - 3}$ gam
-
D.
1,3.10$^{ - 3}$ gam
NH3 thể hiện tính bazơ trong phản ứng
-
A.
2NH3 + H2SO4 → (NH4)2SO4.
-
B.
2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ 3Cu + N2 + 3H2O.
-
C.
4NH3 + 5O2 $\xrightarrow{{{t}^{o}},\,\,p}$ 4NO + 6H2O.
-
D.
2NH3 + 3Cl2 → N2 + 6HCl.
Dung dịch CH3COOH 0,1M có pH = a và dung dịch HCl 0,1M có pH = b. Phát biểu đúng là
-
A.
a < b = 1.
-
B.
a > b = 1.
-
C.
a = b = 1.
-
D.
a = b > 1.
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
-
A.
x=y
-
B.
x=2y
-
C.
2x=y
-
D.
x=3y
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
-
A.
10 atm.
-
B.
8 atm
-
C.
9 atm.
-
D.
8,5 atm
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
-
A.
NaCl < C2H5OH < CH3COOH < K2SO4
-
B.
C2H5OH < CH3COOH < NaCl < K2SO4
-
C.
C2H5OH < CH3COOH < K2SO4 < NaCl
-
D.
CH3COOH < NaCl < C2H5OH < K2SO4
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
-
A.
0,2 ml
-
B.
0,4 ml
-
C.
0,6 ml
-
D.
0,8 ml
Nhiệt phân hết 9,4 gam một muối nitrat của kim loại M được 4 gam chất rắn là oxit kim loại. Kim loại M là
-
A.
Fe
-
B.
Cu
-
C.
Zn
-
D.
Mg
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
-
A.
0,2 lít
-
B.
0,1 lít
-
C.
0,4 lít
-
D.
0,8 lít
Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
-
A.
Dung dịch NaCl.
-
B.
Dung dịch NaOH.
-
C.
Dung dịch ancol etylic
-
D.
Dung dịch Ba(OH)2.
Cho dung dịch X chứa các ion: Fe3+, SO4 2-, NH4+, NO3-. Chia dung dịch X thành 2 phần bằng nhau
- Phần 1 tác dụng với dung dịch NaOH dư, đun nóng, được 1,07 gam kết tủa và 0,672 lít khí (đktc).
- Phần 2 tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa.
Tổng khối lượng các chất tan trong dung dịch X là
-
A.
5,50 gam
-
B.
8,52 gam.
-
C.
4,26 gam.
-
D.
11,0 gam.
Dung dịch axit fomic 0,007M có pH = 3. Kết luận nào sau đây không đúng ?
-
A.
Khi pha loãng 10 lần dung dịch trên thì thu được dung dịch có pH = 4.
-
B.
Độ điện li của axit fomic sẽ giảm khi thêm dung dịch HCl.
-
C.
Khi pha loãng dung dịch trên thì độ điện li của axit fomic tăng.
-
D.
Độ điện li của axit fomic trong dung dịch trên là 14,29%.
Theo thuyết A-rê-ni-ut, kết luận nào sau đây là đúng ?
-
A.
Một hợp chất trong thành phần phân tử có hiđro là axit.
-
B.
Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
-
C.
Một hợp chất khi tan trong nước phân li ra cation H+ là axit.
-
D.
Một bazơ không nhất thiết phải có nhóm OH trong phân tử.
Dung dịch của chất X làm quỳ tím hóa đỏ, dung dịch của chất Y làm quỳ tím hóa xanh. Trộn lẫn dung dịch X của hai chất lại thì xuất hiện kết tủa. Vậy X và Y có thể lần lượt là
-
A.
H2SO4 và Ba(OH)2.
-
B.
H2SO4 và NaOH.
-
C.
NaHSO4 và BaCl2.
-
D.
HCl và Na2CO3.
Cho các phản ứng sau:
(a) NH4Cl + NaOH → NaCl + NH3 + H2O
(b) NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O
(c) NaHCO3 + NaOH → Na2CO3 + H2O
(d) Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
(e) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH
Số phản ứng có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O là
-
A.
4
-
B.
1
-
C.
2
-
D.
3
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
-
A.
34,09%.
-
B.
25,57%.
-
C.
38,35%.
-
D.
29,83%.
Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
-
A.
14,76.
-
B.
16,2.
-
C.
13,8.
-
D.
15,40.
Hòa tan 14,2 gam Na2SO4 trong nước thu được dung dịch A chứa số mol ion \(SO_4^{2 - }\) là:
-
A.
0,1 mol.
-
B.
0,2 mol.
-
C.
0,3 mol.
-
D.
0,05 mol.
Dãy chất nào sau đây là các chất điện li mạnh?
-
A.
NaCl, CuSO4, Fe(OH)3, HBr
-
B.
KNO3, H2SO4, CH3COOH, NaOH.
-
C.
CuSO4, HNO3, NaOH, MgCl2
-
D.
KNO3, NaOH, C2H5OH, HCl.
Phương trình ion rút gọn của phản ứng cho biết
-
A.
Những ion nào tồn tại trong dung dịch.
-
B.
Nồng độ những ion nào trong dung dịch lớn nhất.
-
C.
Bản chất của phản ứng trong dung dịch các chất điện li.
-
D.
Không tồn tại phân tử trong dung dịch các chất điện li.
Phản ứng nitơ thể hiện tính khử là
-
A.
N2 + 6Li → 2Li3N.
-
B.
N2 + 2Al → 2AlN.
-
C.
N2 + O2 → 2NO.
-
D.
N2 + 3H2 → 2NH3.
Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
-
A.
3,0M.
-
B.
1,0M.
-
C.
2,0M.
-
D.
2,5M.
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
-
A.
Mg, H2S, C, Fe3O4, Fe(OH)2.
-
B.
Na2SO3, P, CuO, CaCO3, Ag.
-
C.
Al, FeCO3, HI, CaO, FeO.
-
D.
Cu, C, Fe2O3, Fe(OH)2, SO2.
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
-
A.
(b).
-
B.
(a).
-
C.
(d).
-
D.
(c).
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
-
A.
19,2 gam
-
B.
20,1 gam
-
C.
27,0 gam
-
D.
20,7 gam
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
-
A.
3,0 mol.
-
B.
2,8 mol.
-
C.
3,2 mol.
-
D.
3,4 mol.
Muối amoni là chất điện li thuộc loại:
-
A.
Mạnh.
-
B.
Trung bình.
-
C.
Tùy gốc axit.
-
D.
Yếu.
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
-
A.
2,24 lít.
-
B.
11,2 lít.
-
C.
4,48 lít.
-
D.
6,72 lít.
Dung dịch có giá trị pH = 7 sẽ làm quỳ tím
-
A.
chuyển sang màu đỏ.
-
B.
chuyển sang màu xanh.
-
C.
quỳ không đổi màu.
-
D.
không xác định được.
Dung dịch X có chứa a mol Ba2+, b mol Mg2+, c mol NO3- và d mol Cl-. Biểu thức quan hệ giữa a, b, c, d là:
-
A.
2a + b = c + d
-
B.
a + b = c + d
-
C.
2a + 2b = c + d
-
D.
a + 2b = c + d
Cho phản ứng aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O
Các hệ số a,b,c,d,e là những số nguyên đơn giản nhất. Tổng (a+b) bằng
-
A.
3
-
B.
5
-
C.
4
-
D.
6
Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
-
A.
Fe(NO3)2, H2O
-
B.
Fe(NO3)2, AgNO3
-
C.
Fe(NO3)3, AgNO3
-
D.
Fe(NO3)2, Fe(NO3)3, AgNO3
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
-
A.
dd 1 : Fe2+ ; H+ ; SO42- ; Cl- và dd 2 : K+ ; NH4+ ; CO32- ; NO3-
-
B.
dd 1 : NH4+ ; H+ ; SO42- ; CO32- và dd 2 : K+ ; Fe2+ ; NO3- ; Cl-
-
C.
dd 1 : Fe2+ ; H+ ; NO3- ; SO42- và dd 2 : K+ ; NH4+ ; CO32- ; Cl-
-
D.
dd 1 : Fe2+ ; K+ ; SO42- ; NO3- và dd 2 : H+ ; NH4+ ; CO32- ; Cl-
Nhận xét đúng về muối amoni trong các nhận xét dưới đây là:
-
A.
Muối amoni là chất tinh thể ion, phân tử gồm cation amoni và anion hiđroxit.
-
B.
Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation amoni và anion gốc axit.
-
C.
Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hóa đỏ.
-
D.
Khi nhiệt phân muối amoni luôn luôn cho khí amoniac thoát ra.
Cho sơ đồ phản ứng sau:
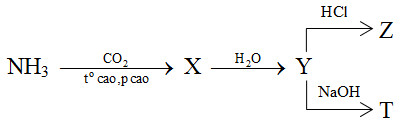
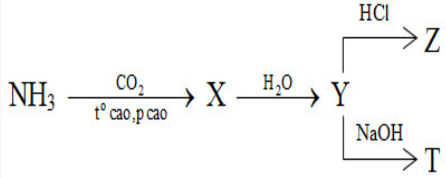
X, Y, Z, T tương ứng là
-
A.
(NH4)2CO3, NH4HCO3, CO2, NH3.
-
B.
(NH2)2CO, (NH4)2CO3, CO2, NH3.
-
C.
(NH4)2CO3, (NH2)2CO, CO2, NH3.
-
D.
(NH2)2CO, NH4HCO3, CO2, NH3.
Lời giải và đáp án
Phát biểu không đúng là
-
A.
Môi trường kiềm có pH < 7.
-
B.
Môi trường kiềm có pH > 7.
-
C.
Môi trường trung tính có pH = 7.
-
D.
Môi trường axit có pH < 7.
Đáp án : A
Phát biểu không đúng là: Môi trường kiềm có pH < 7. Do môi trường kiềm có pH > 7
Chất nào sau đây là chất điện li?
-
A.
Rượu etylic
-
B.
lưu huỳnh trioxit
-
C.
Axit sunfuric
-
D.
Glucozơ
Đáp án : C
- Chất điện li: Những chất tan trong nước phân li thành các ion
=> axit, bazơ, muối là các chất điện li.
Chỉ có axit, bazơ, muối là chất điện li
Chất điện li yếu có độ điện li
-
A.
$\alpha $ = 1
-
B.
$\alpha $ = 0
-
C.
0<$\alpha $ < 1
-
D.
$\alpha $ <0
Đáp án : C
Chất điện li yếu có độ điện li: 0 < $\alpha $< 1
Câu nào sau đây nói không đúng về độ điện li $\alpha $ (anpha)?
-
A.
Là tỉ số giữa số phân tử phân li ra ion và tổng số phân tử hòa tan
-
B.
Độ điện li của các chất khác nhau là giống nhau
-
C.
Độ điện li thay đổi theo nhiệt độ
-
D.
Độ điện li của các chất điện li nằm trong khoảng 0 < $\alpha $ $ \leqslant $ 1.
Đáp án : B
xem lại lí thuyết độ điện li $\alpha $
Câu không đúng là: Độ điện li của các chất khác nhau là giống nhau
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính acid là :
-
A.
CaCO3, Cu(OH)2, Fe(OH)2, FeO.
-
B.
CuO, NaOH, FeCO3, Fe2O3.
-
C.
Fe(OH)3, Na2CO3, Fe2O3, Cu(OH)2.
-
D.
KOH, FeS, K2CO3, Cu(OH)2
Đáp án : C
Dựa vào tính chất hoá học của HNO3
HNO3 chỉ thể hiện tính acid là không có phản ứng oxi hóa – khử => các chất đều đã đạt số oxi hóa tối đa
Muốn pha chế 300 ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là
-
A.
1,2.10$^{ - 3}$ gam
-
B.
2,1.10$^{ - 3}$ gam
-
C.
1,4.10$^{ - 3}$ gam
-
D.
1,3.10$^{ - 3}$ gam
Đáp án : A
+) Từ pH => pOH = 14 - pH => [OH−]
+) Tính số mol NaOH từ [OH−]
pH=10 => pOH = 14 – pH => [OH−] = 10−4 M
=> nNaOH = 0,3. 10−4 = 3. 10−5 ( mol)
=> mNaOH = 3. 10−5 . 40 = 1,2.10−3 (g)
NH3 thể hiện tính bazơ trong phản ứng
-
A.
2NH3 + H2SO4 → (NH4)2SO4.
-
B.
2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ 3Cu + N2 + 3H2O.
-
C.
4NH3 + 5O2 $\xrightarrow{{{t}^{o}},\,\,p}$ 4NO + 6H2O.
-
D.
2NH3 + 3Cl2 → N2 + 6HCl.
Đáp án : A
NH3 thể hiện tính bazơ trong phản ứng: 2NH3 + H2SO4 → (NH4)2SO4.
Dung dịch CH3COOH 0,1M có pH = a và dung dịch HCl 0,1M có pH = b. Phát biểu đúng là
-
A.
a < b = 1.
-
B.
a > b = 1.
-
C.
a = b = 1.
-
D.
a = b > 1.
Đáp án : B
Dễ thấy HCl là axit mạnh nên phân li hoàn toàn
CH3COOH là axit yếu nên phân li 1 phần
+) Sử dụng công thức: pH = -log[H+]
Dễ thấy HCl là axit mạnh nên phân li hoàn toàn => ${{\text{[}}{{\text{H}}^ + }{\text{]}}_{HCl}} = 0,1 = > b = - \log ({\text{[}}{{\text{H}}^ + }{\text{]) = 1}}$
CH3COOH là axit yếu nên phân li 1 phần
=> ${{\text{[}}{{\text{H}}^ + }{\text{]}}_{C{H_3}COOH}}{\text{ < }}0,1 = > a = - \log {\text{ }}({\text{[}}{{\text{H}}^ + }{\text{]) > 1}}$
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
-
A.
x=y
-
B.
x=2y
-
C.
2x=y
-
D.
x=3y
Đáp án : B
- Áp dụng bảo toàn nguyên tố
→ dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol
- Áp dụng định luật bảo toàn điện tích :
\(3{n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} = 2{n_{S{O_4}^{2 - }}}\)
=> Mối liên hệ giữa x và y
- Áp dụng bảo toàn nguyên tố
→ dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol
- Áp dụng định luật bảo toàn điện tích :
\(3{n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} = 2{n_{S{O_4}^{2 - }}}\)
=> 3x + 2.2y = 2.(2x + y) → x = 2y
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
-
A.
10 atm.
-
B.
8 atm
-
C.
9 atm.
-
D.
8,5 atm
Đáp án : B
+) Xét hiệu suất tính theo chất phản ứng thiếu
+) Tính thể tích các chất phản ứng => thể tích các chất sau phản ứng
+) Vì trước và sau phản ứng nhiệt độ không thay đổi nên : \(\frac{{{V_1}}}{{{V_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{p{}_2}}\)
Theo phương trình phản ứng tổng hợp NH3 ta thấy N2 và H2 phản ứng theo tỉ lệ là \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{3}{1}\).
Theo đề bài ta thấy \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{{{V_{{H_2}}}}}{{{V_{{N_2}}}}} = \frac{1}{1}\). Vậy H2 thiếu nên hiệu suất phản ứng tính theo H2.
Thể tích H2 phản ứng là 10.60% = 6 lít
VH2 phản ứng = 6 lít => VN2 phản ứng = 2 lít
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3
ban đầu: 10 10
phản ứng: 2 → 6 → 4
dư: 8 4 4
=> Vsau = 8 + 4 + 4 = 16
Vì trước và sau phản ứng nhiệt độ không thay đổi nên : \(\frac{{{V_1}}}{{{V_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{p{}_2}} \Rightarrow \frac{{20}}{{16}} = \frac{{10}}{{{p_2}}} \Rightarrow {p_2} = 8\,\,atm.\)
Độ giảm thể tích của hỗn hợp sau phản ứng bằng 1 nửa so với thể tích hỗn hợp phản ứng.
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
-
A.
NaCl < C2H5OH < CH3COOH < K2SO4
-
B.
C2H5OH < CH3COOH < NaCl < K2SO4
-
C.
C2H5OH < CH3COOH < K2SO4 < NaCl
-
D.
CH3COOH < NaCl < C2H5OH < K2SO4
Đáp án : B
- Xác định các chất điện li
- Viết phương trình điện li, so sánh độ dẫn điện của các chất điện li
Các dung dịch có cùng nồng độ, dung dịch nào phân li ra nhiều ion sẽ dẫn điện tốt hơn
- C2H5OH tan trong nước nhưng không phân li ra ion=>không có khả năng dẫn điện.
- CH3COOH là chất điện li yếu =>dẫn điện yếu hơn so với 2 muối
Cùng nồng độ 0,1 mol/l thì: NaCl →Na+ +Cl− ; K2SO4 →2K+ + SO42−
K2SO4 phân li ra nhiều ion hơn nên dẫn điện mạnh hơn NaCl.
=> C2H5OH < CH3COOH < NaCl < K2SO4
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
-
A.
0,2 ml
-
B.
0,4 ml
-
C.
0,6 ml
-
D.
0,8 ml
Đáp án : C
- Tính CM
+ Tính mdd: ${m_{{\text{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}}$
+ Tính CM
- Thể tích dd A cần lấy
NaOH → Na+ + OH−
Theo pt: nNaOH = nOH-
=> V = n: CM
$ - {m_{{\text{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)$
$ = > {\text{ }}{V_{dd}} = {\text{ }}m{\text{ }}:{\text{ }}d{\text{ }} = {\text{ }}50{\text{ }}:{\text{ }}1,12{\text{ }} = \frac{{625}}{{14}}ml$
${n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)$
$ = > {C_{MNaOH}}{\text{ }} = {\text{ }}n{\text{ }}:{\text{ }}{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)$
- NaOH → Na+ + OH−
Theo pt: nNaOH = nOH- = 2.10-3 (mol)
=> Thể tích dd A cần lấy là: V = n: CM = 2.10-3 : 3,36 = 6.10-4 lít = 0,6 ml
Nhiệt phân hết 9,4 gam một muối nitrat của kim loại M được 4 gam chất rắn là oxit kim loại. Kim loại M là
-
A.
Fe
-
B.
Cu
-
C.
Zn
-
D.
Mg
Đáp án : B
TH1: Nếu muối nitrat của M là Fe(NO3)2
Xét số mol Fe(NO3)2 và số mol Fe2O3 có phù hợp không => loại
TH2: Muối nitrat có hóa trị không đổi khi nhiệt phân
2M(NO3)n → M2On + 2nNO2 + n/2O2
$=>\,\,\frac{4,7}{M+62n}\,\,=\,\,\frac{4}{2M+16n}$
TH1: Nếu muối nitrat của M là Fe(NO3)2
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
47/900 mol 0,025 mol => loại
TH2: Muối nitrat có hóa trị không đổi khi nhiệt phân
2M(NO3)n → M2On + 2nNO2 + n/2O2
$\frac{9,4}{M+62n}$ → $\frac{4,7}{M+62n}$
$=>\,\,\frac{4,7}{M+62n}\,\,=\,\,\frac{4}{2M+16n}=>M=32n$
Với n = 2 => M = 64 => M là Cu
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
-
A.
0,2 lít
-
B.
0,1 lít
-
C.
0,4 lít
-
D.
0,8 lít
Đáp án : C
Dựa vào lý thuyết sự điện ly ta có:
\(\begin{gathered}
{H_2}S{O_4} \to 2{H^ + } + S{O_4}^{2 - } \hfill \\
{n_{O{H^ - }}} = {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} \hfill \\
Ba{(OH)_2} \to B{a^{2 + }} + 2O{H^ - } \hfill \\
{n_{Ba{{(OH)}_2}}} = \frac{1}{2}{n_{O{H^ - }}} \hfill \\
= > {V_{Ba{{(OH)}_2}}} \hfill \\
\end{gathered} \)
- nH2SO4 = 0,2(mol)
H2SO4 → 2H+ + SO42-
\({n_{O{H^ - }}} = {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} = 2.0,2 = 0,4(mol)\)
- Ba(OH)2 → Ba2+ + 2OH−
\({n_{Ba{{(OH)}_2}}} = \dfrac{1}{2}{n_{O{H^ - }}} = \dfrac{1}{2}.0,4 = 0,2(mol)\)
\( = > {V_{Ba{{(OH)}_2}}} = n:{C_M} = 0,2:0,5 = 0,4(l)\)
Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
-
A.
Dung dịch NaCl.
-
B.
Dung dịch NaOH.
-
C.
Dung dịch ancol etylic
-
D.
Dung dịch Ba(OH)2.
Đáp án : B
Ta dùng NaOH vì
|
|
NH4Cl |
Na2SO4 |
Ba(HCO3)2 |
|
NaOH |
Tạo khí mùi khai |
Không hiện tượng |
Kết tủa trắng |
Cho dung dịch X chứa các ion: Fe3+, SO4 2-, NH4+, NO3-. Chia dung dịch X thành 2 phần bằng nhau
- Phần 1 tác dụng với dung dịch NaOH dư, đun nóng, được 1,07 gam kết tủa và 0,672 lít khí (đktc).
- Phần 2 tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa.
Tổng khối lượng các chất tan trong dung dịch X là
-
A.
5,50 gam
-
B.
8,52 gam.
-
C.
4,26 gam.
-
D.
11,0 gam.
Đáp án : B
P1: ${{n}_{Fe{{\left( OH \right)}_{3}}}}\Rightarrow {{n}_{F{{e}^{3+}}}}$
${{n}_{N{{H}_{3}}}}\Rightarrow {{n}_{NH_{4}^{+}}}$
P2: ${{n}_{BaS{{O}_{4}}}}\Rightarrow {{n}_{SO_{4}^{2-}}}$
BTĐT $\Rightarrow {{n}_{NO_{3}^{-}}}$
P1: ${{n}_{Fe{{\left( OH \right)}_{3}}}}={{n}_{F{{e}^{3+}}}}=\frac{1,07}{107}=0,01\text{ }mol$
${{n}_{N{{H}_{3}}}}={{n}_{NH_{4}^{+}}}=\frac{0,672}{22,4}=0,03\text{ }mol$
P2: ${{n}_{BaS{{O}_{4}}}}={{n}_{SO_{4}^{2-}}}=\frac{4,66}{233}=0,02\text{ }mol$
BTĐT $\Rightarrow {{n}_{NO_{3}^{-}}}=3{{n}_{F{{e}^{3+}}}}+{{n}_{NH_{4}^{+}}}-2{{n}_{SO_{4}^{2-}}}=0,02\text{ }mol$
=> m chất tan (1 phần) = 0,01.56 + 0,03.18 + 0,02.96 + 0,02.62 = 4,26 gam
=> m chất tan trong X = 8,52 gam
Dung dịch axit fomic 0,007M có pH = 3. Kết luận nào sau đây không đúng ?
-
A.
Khi pha loãng 10 lần dung dịch trên thì thu được dung dịch có pH = 4.
-
B.
Độ điện li của axit fomic sẽ giảm khi thêm dung dịch HCl.
-
C.
Khi pha loãng dung dịch trên thì độ điện li của axit fomic tăng.
-
D.
Độ điện li của axit fomic trong dung dịch trên là 14,29%.
Đáp án : A
A sai vì HCOOH là axit yếu, phân li không hoàn toàn nên nồng độ $[{H^ + }{\text{]}}$ giảm, pH thay đổi tuy nhiên còn phụ thuộc cả vào độ điện li nên không tuân theo đúng tỉ lệ pha loãng.
B đúng vì HCOOH $\overset {} \leftrightarrows $ HCOO- + H+. Khi thêm dung dịch HCl, nghĩa là thêm H+, như vậy cân bằng hóa học chuyển dịch sang trái → độ điện li của axit giảm.
C đúng (SGK 11NC – trang 9)
D đúng vì HCOOH $\overset {} \leftrightarrows $ HCOO- + H+.
pH = 3 → $[{H^ + }{\text{]}}$ = 0,001M
$\alpha = \dfrac{{{C_{HCOOH\,phân\,li}}}}{{{C_{HCOOH\,b\,\,{\text{đ}}ầu}}}}.100\% = \dfrac{{0,001}}{{0,007}}.100\% = 14,29\% $
Theo thuyết A-rê-ni-ut, kết luận nào sau đây là đúng ?
-
A.
Một hợp chất trong thành phần phân tử có hiđro là axit.
-
B.
Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
-
C.
Một hợp chất khi tan trong nước phân li ra cation H+ là axit.
-
D.
Một bazơ không nhất thiết phải có nhóm OH trong phân tử.
Đáp án : C
Kết luận đúng là: Một hợp chất khi tan trong nước phân li ra cation H+ là axit.
Dung dịch của chất X làm quỳ tím hóa đỏ, dung dịch của chất Y làm quỳ tím hóa xanh. Trộn lẫn dung dịch X của hai chất lại thì xuất hiện kết tủa. Vậy X và Y có thể lần lượt là
-
A.
H2SO4 và Ba(OH)2.
-
B.
H2SO4 và NaOH.
-
C.
NaHSO4 và BaCl2.
-
D.
HCl và Na2CO3.
Đáp án : A
Chọn axit X và bazo Y tác dụng với nhau tạo ra kết tủa
Dung dịch chất X làm quỳ tím chuyển sang màu đỏ => dd X có môi trường axit
Dung dich chất Y làm quỳ tím hóa xanh => dd Y có môi trường bazo
Trộn X với Y có kết tủa
=> X là H2SO4 và Y là Ba(OH)2
H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
Cho các phản ứng sau:
(a) NH4Cl + NaOH → NaCl + NH3 + H2O
(b) NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O
(c) NaHCO3 + NaOH → Na2CO3 + H2O
(d) Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
(e) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH
Số phản ứng có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O là
-
A.
4
-
B.
1
-
C.
2
-
D.
3
Đáp án : B
Viết các phương trình ion rút gọn của các phản ứng ra, chọn các phản ứng có phương trình ion rút gọn như đề bào cho.
(a) NH4+ + OH- → NH3 + H2O
(b) NH4+ + HCO3 - → NH3 + CO32- + 2H2O
(c) HCO3- + OH- → CO32- + H2O
(d) Ba2+ + HCO3- + OH- → BaCO3↓ + CO32- + 2H2O
(d) Ba2+ + CO32- → BaCO3↓
Vậy chỉ có 1 phương trình (c) có có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
-
A.
34,09%.
-
B.
25,57%.
-
C.
38,35%.
-
D.
29,83%.
Đáp án : A
Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích.
Khi cho dung dịch Z tác dụng với BaCl2 dư thì kết tủa thu được là BaSO4
\( \to {n_{BaS{O_4}}} = \dfrac{{166,595}}{{233}} = 0,715\,\,mol\)
Bảo toàn gốc \(SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\)
Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3
\({n_{N{H_3}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\)
Bảo toàn điện tích cho dung dịch Z: \(2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\)
Mà \({n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\)
\( \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145\,\,mol\)
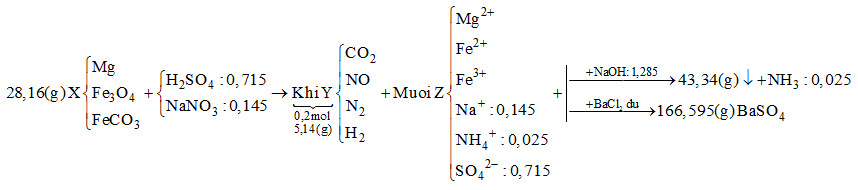
Ta có: \({n_{O{H^ - }\,\,(trong\,\,hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\)
Bảo toàn khối lượng: \({m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\)
\( \to {m_{Fe}} + {m_{Mg}} = 21,92g\)
Bảo toàn khối lượng cho dung dịch Z: \({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\)
Bảo toàn khối lượng cho phản ứng: \({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\)
\( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\)
\( \to \) \({m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\)
Bảo toàn nguyên tố H : \(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\)
\( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\)
Đặt số mol của CO2, NO và N2 lần lượt là x, y, z
\( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\) (*)
Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\)
\( \to 44x + 30y + 28z = 5,04\) (**)
Bảo toàn nguyên tố N : \({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\)
\( \to y + 2z = 0,12\) (***)
Từ (*), (**) và (***) \( \to \) x = 0,04; y = 0,01; z = 0,04
\( \to {n_{FeC{O_3}}} = 0,04\,\,mol\)
Gọi số mol của Mg và Fe3O4 lần lượt là a và b
\( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\) (1)
Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g
\( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\) (2)
Từ (1) và (2) \( \to \) a = 0,4; b = 0,06
\( \to \% {m_{Mg}} = \dfrac{{0.4.24}}{{28,16}}.100\% = 34,09\% \)
Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
-
A.
14,76.
-
B.
16,2.
-
C.
13,8.
-
D.
15,40.
Đáp án : A
X + HNO3 → Muối + NO + H2O
BTKL: mH2O = mX + mHNO3 - m muối - mNO = ? => nH2O
BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => nNH4+
BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => nNO3-
BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O => nO(X)
=> m = mKL = mX - mO(X)
X + HNO3 → Muối + NO + H2O
BTKL: mH2O = mX + mHNO3 - m muối - mNO = 18,6 + 0,98.63 - 68,88 - 0,1.30 = 8,46 gam
=> nH2O = 0,47 mol
BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => 0,98 = 4nNH4+ + 2.0,47 => nNH4+ = 0,01 mol
BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => 0,98 = nNO3- + 0,01 + 0,1 => nNO3- = 0,87 mol
BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O
=> nO(X) + 3.0,98 = 3.0,87 + 0,1 + 0,47 => nO(X) = 0,24 mol
=> m = mKL = mX - mO(X) = 18,6 - 0,24.16 = 14,76 gam
Hòa tan 14,2 gam Na2SO4 trong nước thu được dung dịch A chứa số mol ion \(SO_4^{2 - }\) là:
-
A.
0,1 mol.
-
B.
0,2 mol.
-
C.
0,3 mol.
-
D.
0,05 mol.
Đáp án : A
Tính số mol Na2SO4 sau đó dựa vào phương trình điện ly tính được số mol \(SO_4^{2 - }\)
\({n_{N{a_2}S{O_4}}} = \dfrac{{14,2}}{{142}} = 0,1\,\,mol\)
\(N{a_2}S{O_4} \to 2N{a^ + } + SO_4^{2 - }\)
Theo phương trình điện ly\( \to {n_{SO_4^{2 - }}} = {n_{N{a_2}S{O_4}}} = 0,1\,\,mol\)
Dãy chất nào sau đây là các chất điện li mạnh?
-
A.
NaCl, CuSO4, Fe(OH)3, HBr
-
B.
KNO3, H2SO4, CH3COOH, NaOH.
-
C.
CuSO4, HNO3, NaOH, MgCl2
-
D.
KNO3, NaOH, C2H5OH, HCl.
Đáp án : C
Chất điên li mạnh gồm có các axit mạnh, bazo mạnh và hầu hết các muối.
A loại Fe(OH)3 (bazơ yếu) và HBr (axit yếu)
B loại Loại CH3COOH (axit yếu)
D loại C2H5OH (không phải chất điện ly)
Phương trình ion rút gọn của phản ứng cho biết
-
A.
Những ion nào tồn tại trong dung dịch.
-
B.
Nồng độ những ion nào trong dung dịch lớn nhất.
-
C.
Bản chất của phản ứng trong dung dịch các chất điện li.
-
D.
Không tồn tại phân tử trong dung dịch các chất điện li.
Đáp án : C
Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch các chất điện ly
Phản ứng nitơ thể hiện tính khử là
-
A.
N2 + 6Li → 2Li3N.
-
B.
N2 + 2Al → 2AlN.
-
C.
N2 + O2 → 2NO.
-
D.
N2 + 3H2 → 2NH3.
Đáp án : C
Chất nhường electron thể hiện tính khử khi đó số oxi hóa của nguyên tố đó tăng.
A. \(N_2^0 + 6Li \to 2L{i_3}\mathop N\limits^{ - 3} \Rightarrow {N_2}\) thể hiện tính oxi hóa.
B. \(N_2^0 + 2Al \to 2Al\mathop N\limits^{ - 3} \Rightarrow {N_2}\) thể hiện tính oxi hóa.
C. \(N_2^0 + O_2 \to 2\mathop N\limits^{ +2}O \Rightarrow {N_2}\) thể hiện tính khử.
D. \(N_2^0 + 3H_2 \to 2\mathop N\limits^{ - 3} H_3 \Rightarrow {N_2}\) thể hiện tính oxi hóa.
Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
-
A.
3,0M.
-
B.
1,0M.
-
C.
2,0M.
-
D.
2,5M.
Đáp án : D
Viết và tính toán theo PTHH.
\(NH_4^ + + {\text{ }}O{H^ - } \to {\text{ }}N{H_3} + {\text{ }}{H_2}O\)
Theo PTHH: \({{\text{n}}_{{\text{O}}{{\text{H}}^{\text{ - }}}}}{\text{ = }}{{\text{n}}_{{\text{N}}{{\text{H}}_{\text{3}}}}}\)= 5,6 : 22,4 = 0,25 mol
=> CM = n : V = 0,25 : 0,1 = 2,5M
HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
-
A.
Mg, H2S, C, Fe3O4, Fe(OH)2.
-
B.
Na2SO3, P, CuO, CaCO3, Ag.
-
C.
Al, FeCO3, HI, CaO, FeO.
-
D.
Cu, C, Fe2O3, Fe(OH)2, SO2.
Đáp án : A
HNO3 thể hiện tính oxi hóa khi phản ứng với các chất khử (chất có khả năng tăng số oxi hóa)
A đúng
B loại CuO, CaCO3
C loại CaO
D loại Fe2O3
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
-
A.
(b).
-
B.
(a).
-
C.
(d).
-
D.
(c).
Đáp án : D
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc.
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm.
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
-
A.
19,2 gam
-
B.
20,1 gam
-
C.
27,0 gam
-
D.
20,7 gam
Đáp án : D
Trong phòng thí nghiệm người ta điều chế N2 bằng phản ứng:
NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O
- Tính toán theo PTHH.
NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O
Theo PTHH: nNaNO2 = nN2 = 6,72:22,4 = 0,3 mol
=> mNaNO2 = 0,3.69 = 20,7 gam
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
-
A.
3,0 mol.
-
B.
2,8 mol.
-
C.
3,2 mol.
-
D.
3,4 mol.
Đáp án : C
HS ghi nhớ công thức tính nhanh số mol HNO3 đã phản ứng:
nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O
= 12x + 2x + 4y + 10z = 14x + 4y +10z (*)
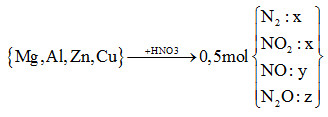
nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O
= 12x + 2x + 4y + 10z = 14x + 4y +10z (*)
*nZ = 2x + y + z = 0,5 mol (1)
*mZ = nZ.MZ => 28x + 44x + 30y + 44z = 0,5.8,9.4
=> 74x + 30y + 44z = 17,8 (2)
\(\xrightarrow{{\dfrac{3}{7}(2) - \dfrac{{62}}{7}(1)}}14x + 4y + 10z = 3,2\)(**)
(*) và (**) => nHNO3 = 3,2 mol
Muối amoni là chất điện li thuộc loại:
-
A.
Mạnh.
-
B.
Trung bình.
-
C.
Tùy gốc axit.
-
D.
Yếu.
Đáp án : A
Tất cả các muối amoni đều tan nhiều tronng nước và phân li hoàn toàn thành các ion.
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
-
A.
2,24 lít.
-
B.
11,2 lít.
-
C.
4,48 lít.
-
D.
6,72 lít.
Đáp án : C
Do Fe dư nên tạo thành muối Fe2+
Sử dụng định luật bảo toàn e: 2nFe = 3nNO => nNO = ?
Do Fe dư nên tạo thành muối Fe2+
nFe = (20 – 3,2)/56 = 0,3 mol
BTe ta có: 2nFe = 3nNO => nNO = 2.0,3/3 = 0,2 mol
=> V = 4,48 lít
Dung dịch có giá trị pH = 7 sẽ làm quỳ tím
-
A.
chuyển sang màu đỏ.
-
B.
chuyển sang màu xanh.
-
C.
quỳ không đổi màu.
-
D.
không xác định được.
Đáp án : C
Dung dịch pH = 7 không làm đổi màu quỳ tím.
Dung dịch X có chứa a mol Ba2+, b mol Mg2+, c mol NO3- và d mol Cl-. Biểu thức quan hệ giữa a, b, c, d là:
-
A.
2a + b = c + d
-
B.
a + b = c + d
-
C.
2a + 2b = c + d
-
D.
a + 2b = c + d
Đáp án : C
Bảo toàn điện tích.
Bảo toàn điện tích: n(+) = n(-) => 2nBa2+ + 2nMg2+ = nNO3- + nCl- => 2a + 2b = c + d
Cho phản ứng aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O
Các hệ số a,b,c,d,e là những số nguyên đơn giản nhất. Tổng (a+b) bằng
-
A.
3
-
B.
5
-
C.
4
-
D.
6
Đáp án : B
Fe + 4HNO3 → 2H2O + NO + Fe(NO3)3
Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
-
A.
Fe(NO3)2, H2O
-
B.
Fe(NO3)2, AgNO3
-
C.
Fe(NO3)3, AgNO3
-
D.
Fe(NO3)2, Fe(NO3)3, AgNO3
Đáp án : C
2AgNO3 + Fe → 2Ag + Fe(NO3)2
AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
-
A.
dd 1 : Fe2+ ; H+ ; SO42- ; Cl- và dd 2 : K+ ; NH4+ ; CO32- ; NO3-
-
B.
dd 1 : NH4+ ; H+ ; SO42- ; CO32- và dd 2 : K+ ; Fe2+ ; NO3- ; Cl-
-
C.
dd 1 : Fe2+ ; H+ ; NO3- ; SO42- và dd 2 : K+ ; NH4+ ; CO32- ; Cl-
-
D.
dd 1 : Fe2+ ; K+ ; SO42- ; NO3- và dd 2 : H+ ; NH4+ ; CO32- ; Cl-
Đáp án : A
H+ và CO32- không thể cùng tồn tại trong cùng một dung dịch
Tương tự với Fe2+ ; H+ ; NO3- cũng không thể cùng tồn tại trong một dung dịch
H+ + CO32- → HCO3-
3Fe2+ + 4H+ + NO3- → 3Fe3+ NO + 2H2O
Nhận xét đúng về muối amoni trong các nhận xét dưới đây là:
-
A.
Muối amoni là chất tinh thể ion, phân tử gồm cation amoni và anion hiđroxit.
-
B.
Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation amoni và anion gốc axit.
-
C.
Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hóa đỏ.
-
D.
Khi nhiệt phân muối amoni luôn luôn cho khí amoniac thoát ra.
Đáp án : B
Lý thuyết về muối amoni.
A sai muối amoni là chất tinh thể ion, phân tử gồm cation amoni và anion gốc axit.
B đúng.
C sai, chất khí thoát là NH3 làm quỳ tím hóa xanh.
D sai, tùy từng trường hợp mà thu được khí N2, NH3 hoặc N2O.
Cho sơ đồ phản ứng sau:
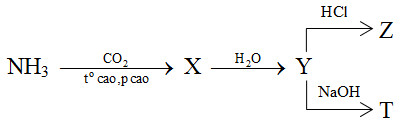

X, Y, Z, T tương ứng là
-
A.
(NH4)2CO3, NH4HCO3, CO2, NH3.
-
B.
(NH2)2CO, (NH4)2CO3, CO2, NH3.
-
C.
(NH4)2CO3, (NH2)2CO, CO2, NH3.
-
D.
(NH2)2CO, NH4HCO3, CO2, NH3.
Đáp án : B
Viết các PTHH từ đó xác định được các chất X, Y, Z, T tương ứng.
2NH3 + CO2 \(\xrightarrow{{{t^o}\,cao,\,p\,\,cao}}\) (NH2)2CO (X) + H2O
(NH2)2CO (X) + 2H2O → (NH4)2CO3 (Y)
(NH4)2CO3 (Y) + 2HCl → 2NH4Cl + H2O + CO2 (Z)
(NH4)2CO3 (Y) + 2NaOH → Na2CO3 + 2NH3 (T) + 2H2O
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1










Danh sách bình luận