Đề thi học kì 2 Hóa 10 - Đề số 3
Đề bài
Trong các chất dưới đây, dãy nào gồm các chất đều tác dụng được với dung dịch HCl?
-
A.
Fe2O3, KMnO4, Cu.
-
B.
Fe, CuO, Ba(OH)2.
-
C.
CaCO3, H2SO4, Mg(OH)2.
-
D.
AgNO3, MgCO3, BaSO4.
Cho phản ứng: Cl2 + Ca(OH)2 → CaOCl2 + H2O. Khẳng định nào đúng:
-
A.
Clo chỉ đóng vai trò là chất khử.
-
B.
Clo vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử.
-
C.
Clo chỉ đóng vai trò chất oxi hóa.
-
D.
Ca đóng vai trò chất khử, clo đóng vai trò chất oxi hóa.
Khi nhiệt phân hoàn toàn 100 gam mỗi chất KClO3 (xt MnO2), KMnO4, KNO3, AgNO3 thì chất tạo ra lượng oxi lớn nhất là
-
A.
KClO3.
-
B.
KMnO4.
-
C.
AgNO3.
-
D.
KNO3.
Tính chất hóa học đặc trưng của lưu huỳnh là gì ?
-
A.
Tính oxi hóa và tính khử.
-
B.
Tính oxi hóa.
-
C.
Tính khử.
-
D.
Tính khử mạnh.
Trường hợp nào sau đây không xảy ra phản ứng hóa học?
-
A.
3O2 + 2H2S → 2SO2 + 2H2O (to)
-
B.
FeCl2 + H2S → 2HCl + FeS
-
C.
O3 + 2KI + H2O → 2KOH + O2 + I2
-
D.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Hấp thụ hết 5,6 lít SO2 (đktc) trong 200 ml dung dịch chứa NaOH 1M và Na2SO3 xM thu được dung dịch có chứa 43,8 gam hỗn hợp muối. Giá trị của x là
-
A.
1,25.
-
B.
1,50.
-
C.
0,10.
-
D.
0,75.
Cho một lượng muối khan BaCl2 tác dụng vừa đủ với 300 gam dung dịch H2SO4 14,7% thu được dung dịch X và kết tủa. Phần trăm chất tan trong dung dịch X là
-
A.
11,38%.
-
B.
8,35%.
-
C.
12,15%.
-
D.
15,46%.
Cho hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 đặc, nóng đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y và một phần Fe không tan. Chất tan có trong dung dịch Y là
-
A.
MgSO4 và FeSO4.
-
B.
MgSO4.
-
C.
MgSO4 và Fe2(SO4)3.
-
D.
MgSO4, FeSO4 và Fe2(SO4)3.
Hòa tan 28,6 gam hỗn hợp X (gồm Fe, Cu, Ag) vào dung dịch H2SO4 đặc nóng dư, thu được 12,88 lít khí SO2 (đktc, sản phẩm khử duy nhất) và m gam muối. Giá trị của m là
-
A.
55,6.
-
B.
79,6.
-
C.
83,8.
-
D.
88,6.
Trong acquy chì chứa dung dịch axit sunfuric. Khi sử dụng acquy lâu ngày thường acquy bị “cạn nước”. Để bổ sung nước cho acquy, người ta cho thêm vào acquy chất nào sau đây?
-
A.
nước cất.
-
B.
nước mưa.
-
C.
dung dịch H2SO4 loãng.
-
D.
nước muối loãng.
Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M. Giá trị của V là
-
A.
10.
-
B.
40.
-
C.
20.
-
D.
30.
Cho 1 lít H2 (đktc) tác dụng với 0,672 lít Cl2 (đktc) rồi hòa tan sản phẩm vào nước để được 20 gam dung dịch A. Lấy 5 gam A tác dụng với dung dịch AgNO3 dư thu được 1,435 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2 (giả sử Cl2 và H2 không tan trong nước).
-
A.
50%
-
B.
33,33%
-
C.
60%
-
D.
66,67%
Nung một hỗn hợp rắn gồm a mol FeCO3 và b mol FeS2 trong bình kín chứa không khí dư. Sau khi các phản ứng xảy ra hoàn toàn, đưa bình về nhiệt độ ban đầu, thu được chất rắn duy nhất là Fe2O3 và hỗn hợp khí. Biết áp suất khí trong bình trước và sau phản ứng bằng nhau, mối liên hệ giữa a và b là (biết sau các phản ứng, lưu huỳnh ở mức oxi hoá +4, thể tích các chất rắn là không đáng kể)
-
A.
a = 0,5b.
-
B.
a = b.
-
C.
a = 4b.
-
D.
a = 2b
Cho dãy các chất: Ag, Fe3O4, Na2CO3 và Fe(OH)3. Số chất trong dãy tác dụng được với dung dịch H2SO4 loãng là
-
A.
1
-
B.
4
-
C.
2
-
D.
3
Cho a gam kim loại R phản ứng vừa đủ với 28,4 gam khí Clo thì thu được 43,52 gam muối clorua với hiệu suất 80%. Khối lượng a và tên của Kim loại R là:
-
A.
26 gam và Zn
-
B.
26 gam và Fe
-
C.
24 gam và Ca
-
D.
24 gam và Cu
Cấu hình electron lớp ngoài cùng của các nguyên tử halogen là
-
A.
ns2np4
-
B.
ns2np5
-
C.
ns2np6
-
D.
(n-1)d10ns2np5
Cho clo vào nước, thu được nước clo. Biết clo tác dụng không hoàn toàn với nước. Nước clo là hỗn hợp gồm các chất:
-
A.
HCl, HClO
-
B.
HClO, Cl2, H2O
-
C.
H2O, HCl, HClO
-
D.
H2O, HCl, HClO, Cl2
Chất nào có tính khử mạnh nhất ?
-
A.
HI
-
B.
HF
-
C.
HBr
-
D.
HCl
Nung nóng hỗn hợp gồm 15,8 gam KMnO4 và 24,5 gam KClO3 một thời gian thu được 36,3 gam hỗn hợp Y gồm 6 chất. Cho Y tác dụng với dung dịch HCl đặc, dư, đun nóng, lượng khí clo sinh ra cho hấp thụ vào 300 ml dung dịch NaOH 5M đun nóng thu được dung dịch Z. Cô cạn Z thu được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
-
A.
12 gam
-
B.
91,8 gam
-
C.
111 gam
-
D.
79,8 gam
Dẫn 8,96 lít (đktc) hỗn hợp khí X gồm H2S và CO2 vào lượng dư dung dịch Pb(NO3)2, thu được 23,9 gam kết tủa. Thành phần phần trăm thể tích của H2S trong X là
-
A.
25%
-
B.
50%
-
C.
60%
-
D.
75%
Nguyên tử nguyên tố X có tổng số electron trên các phân lớp s là 6 và có 6e lớp ngoài cùng. Nguyên tố X là
-
A.
Na.
-
B.
Cl.
-
C.
O.
-
D.
S.
Chất nào sau đây không phản ứng với O2 ?
-
A.
SO3
-
B.
P
-
C.
Ca
-
D.
C
Cho các chất tham gia phản ứng
a. S + F2 b. SO2+ Br2 + H2O
c. SO2+ O2 d. SO2 + H2SO4 đặc, nóng
e. SO2và H2O f. H2S + Cl2(dư) + H2O
Số phản ứng tạo ra lưu huỳnh ở mức oxi hóa +6 là:
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Tốc độ phản ứng phụ thuộc vào các yếu tố sau:
-
A.
Nhiệt độ
-
B.
Nồng độ, áp suất.
-
C.
Chất xúc tác, diện tích bề mặt.
-
D.
cả A, B, C.
Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng kẽm với dung dịch axit clohiđric:
• Nhóm thứ nhất: Cân 1 gam kẽm miếng và thả vào cốc đựng 200 ml dung dịch axit HCl 2M
• Nhóm thứ hai: Cân 1 gam kẽm bột và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
-
A.
Nhóm thứ hai dùng axit nhiều hơn.
-
B.
Diện tích bề mặt kẽm bột lớn hơn kẽm miếng.
-
C.
Nồng độ kẽm bột lớn hơn.
-
D.
Cả ba nguyên nhân đều sai.
Cho phản ứng: Br2 + HCOOH → 2HBr + CO2.Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol/(l.s). Giá trị của a là
-
A.
0,018.
-
B.
0,016.
-
C.
0,012.
-
D.
0,014.
Trong bình định mức 2,00 lít ban đầu chỉ chứa 0,777 mol SO3 (k) tại 1100K. Tính giá trị Kc của phản ứng dưới đây, biết tại trạng thái cân bằng có 0,52 mol SO3: 2SO3 (k) \(\rightleftarrows \) 2SO2 (k) + O2 (k)
-
A.
1,569.10-2.
-
B.
3,139.10-2.
-
C.
3,175.10-2.
-
D.
6,351.10-2.
Điền vào khoảng trống trong các câu sau bằng cụm từ thích hợp: “ Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận…………tốc độ phản ứng nghich.”
-
A.
lớn hơn
-
B.
bằng
-
C.
nhỏ hơn
-
D.
khác
X, Y là hai halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối của X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A cần dùng 150 ml dung dịch AgNO3 0,2M. Hai nguyên tố X, Y là
-
A.
Cl và Br.
-
B.
Cl và I
-
C.
I và Br.
-
D.
F và I
Cho cân bằng hóa học sau trong bình kín:
2NO2(k) ⇄ N2O4(k) ; ΔH < 0
(nâu đỏ) (không màu)
Phát biểu nào sau đây đúng?
-
A.
Phản ứng thuận tỏa nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ đậm dần.
-
B.
Phản ứng thuận tỏa nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ nhạt dần.
-
C.
Phản ứng thuận thu nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ đậm dần.
-
D.
Phản ứng thuận thu nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ nhạt dần.
Lời giải và đáp án
Trong các chất dưới đây, dãy nào gồm các chất đều tác dụng được với dung dịch HCl?
-
A.
Fe2O3, KMnO4, Cu.
-
B.
Fe, CuO, Ba(OH)2.
-
C.
CaCO3, H2SO4, Mg(OH)2.
-
D.
AgNO3, MgCO3, BaSO4.
Đáp án : B
Dãy gồm các chất đều tác dụng với dung dịch HCl là Fe, CuO, Ba(OH)2.
Loại A vì Cu không phản ứng
Loại C vì H2SO4 không phản ứng
Loại D vì BaSO4 không phản ứng
Cho phản ứng: Cl2 + Ca(OH)2 → CaOCl2 + H2O. Khẳng định nào đúng:
-
A.
Clo chỉ đóng vai trò là chất khử.
-
B.
Clo vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử.
-
C.
Clo chỉ đóng vai trò chất oxi hóa.
-
D.
Ca đóng vai trò chất khử, clo đóng vai trò chất oxi hóa.
Đáp án : B
$\mathop {Cl}\limits^0$$_2$ tạo thành $\mathop {Cl}\limits^{ - 1} $ và $\mathop {Cl}\limits^{ + 1} $ => clo vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử
Khi nhiệt phân hoàn toàn 100 gam mỗi chất KClO3 (xt MnO2), KMnO4, KNO3, AgNO3 thì chất tạo ra lượng oxi lớn nhất là
-
A.
KClO3.
-
B.
KMnO4.
-
C.
AgNO3.
-
D.
KNO3.
Đáp án : A
Viết PTHH mỗi phản ứng, tính số mol oxi sinh ra dựa vào số mol chất rắn nhiệt phân
2KClO3 → 2KCl + 3O2
$\frac{{100}}{{122,5}}$ → 1,224
2KMnO4 → K2MnO4 + MnO2 + O2
$\frac{{100}}{{158}}$ → 0,316
2KNO3 → 2KNO2 + O2
$\frac{{100}}{{101}}$ → 0,495
2AgNO3 → 2Ag + NO2 + 2O2
$\frac{{100}}{{170}}$ → 0,588
=> chất tạo lượng oxi lớn nhất là KClO3
Tính chất hóa học đặc trưng của lưu huỳnh là gì ?
-
A.
Tính oxi hóa và tính khử.
-
B.
Tính oxi hóa.
-
C.
Tính khử.
-
D.
Tính khử mạnh.
Đáp án : A
Tính chất hóa học đặc trưng của lưu huỳnh là tính oxi hóa và tính khử
Trường hợp nào sau đây không xảy ra phản ứng hóa học?
-
A.
3O2 + 2H2S → 2SO2 + 2H2O (to)
-
B.
FeCl2 + H2S → 2HCl + FeS
-
C.
O3 + 2KI + H2O → 2KOH + O2 + I2
-
D.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Đáp án : B
Trường hợp không xảy ra phản ứng là: FeCl2 + H2S vì nếu phản ứng sinh ra FeS sẽ bị hòa tan bởi HCl
Hấp thụ hết 5,6 lít SO2 (đktc) trong 200 ml dung dịch chứa NaOH 1M và Na2SO3 xM thu được dung dịch có chứa 43,8 gam hỗn hợp muối. Giá trị của x là
-
A.
1,25.
-
B.
1,50.
-
C.
0,10.
-
D.
0,75.
Đáp án : D
+) Hỗn hợp muối gồm NaHSO3 (a mol) và Na2SO3 (b mol) => mmuối = PT(1)
+) Bảo toàn nguyên tố S: ${n_{S{O_2}}} + {n_{Na{_2}S{O_3}trước phản ứng}} = {n_{NaHS{O_3}}} + {n_{N{a_2}S{O_3}sau phản ứng}}$ => PT (2)
+) Bảo toàn nguyên tố Na: ${n_{NaOH}} + 2.{n_{Na{ _2}S{O_3}trước phản ứng}} = {n_{NaHS{O_3}}} + 2.{n_{N{a_2}S{O_3}sau phản ứng}}$ => PT (3)
nSO2 = 0,25 mol; nNaOH = 0,2 mol
Hỗn hợp muối gồm NaHSO3 (a mol) và Na2SO3 (b mol) => mmuối = 104a + 126b = 43,8 (1)
+) Bảo toàn nguyên tố S: ${n_{S{O_2}}} + {n_{Na{_2}S{O_3}trước phản ứng}} = {n_{NaHS{O_3}}} + {n_{N{a_2}S{O_3}sau phản ứng}}$
=> 0,25 + 0,2x = a + b (2)
+) Bảo toàn nguyên tố Na: ${n_{NaOH}} + 2.{n_{Na{ _2}S{O_3}trước phản ứng}} = {n_{NaHS{O_3}}} + 2.{n_{N{a_2}S{O_3}sau phản ứng}}$
=> 0,2 + 2.0,2x = a + 2b (3)
Từ (1), (2) và (3) => a = 0,3 mol; b = 0,1 mol; x = 0,75 mol
Cho một lượng muối khan BaCl2 tác dụng vừa đủ với 300 gam dung dịch H2SO4 14,7% thu được dung dịch X và kết tủa. Phần trăm chất tan trong dung dịch X là
-
A.
11,38%.
-
B.
8,35%.
-
C.
12,15%.
-
D.
15,46%.
Đáp án : A
+) $C\% = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% $ → ${m_{{H_2}S{O_4}}}$ → ${n_{{H_2}S{O_4}}}$
PTHH: BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
=> tính số mol BaSO4, HCl và BaCl2 theo số mol H2SO4
+) mdung dịch spứ = ${m_{BaC{l_2}}} + {m_{{\text{dd}}\,\,{H_2}S{O_4}}} - {m_{BaS{O_4}}}$
+) $C{\% _{HCl}} = \frac{{{m_{HCl}}}}{{{m_{{\text{dd}}}}}} $
$C\% = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% $ → ${m_{{H_2}S{O_4}}} = \frac{{{m_{{\text{dd}}}}.C\% }}{{100\% }} = \frac{{300.14,7\% }}{{100\% }} = 44,1\,\,g$ → ${n_{{H_2}S{O_4}}}$ = $\frac{m}{M}$ = 0,45 mol
PTHH: BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
0,45 ← 0,45 → 0,45 → 0,9
Dung dịch X chứa chất tan HCl: mHCl = n.M = 32,85 g
mdung dịch spứ =${m_{BaC{l_2}}} + {m_{{\text{dd}}\,\,{H_2}S{O_4}}} - {m_{BaS{O_4}}}$ = 0,45.208 + 300 – 0,45.233 = 288,75 g
$C{\% _{HCl}} = \frac{{{m_{HCl}}}}{{{m_{{\text{dd}}}}}} = \frac{{32,85}}{{288,75}} \approx 11,38\% $
Cho hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 đặc, nóng đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y và một phần Fe không tan. Chất tan có trong dung dịch Y là
-
A.
MgSO4 và FeSO4.
-
B.
MgSO4.
-
C.
MgSO4 và Fe2(SO4)3.
-
D.
MgSO4, FeSO4 và Fe2(SO4)3.
Đáp án : A
H2SO4 đặc tác dụng với Fe tạo Fe3+, vì Fe còn dư nên 1 phần Fe tác dụng với Fe3+ sinh ra muối Fe2+
Vì có 1 phần Fe không tan => 1 phần Fe dư phản ứng với Fe2(SO4)3
=> muối thu được gồm MgSO4 và FeSO4
Hòa tan 28,6 gam hỗn hợp X (gồm Fe, Cu, Ag) vào dung dịch H2SO4 đặc nóng dư, thu được 12,88 lít khí SO2 (đktc, sản phẩm khử duy nhất) và m gam muối. Giá trị của m là
-
A.
55,6.
-
B.
79,6.
-
C.
83,8.
-
D.
88,6.
Đáp án : C
+) Xét quá trình nhận e: $\,\mathop S\limits^{ + 6} \,\, + \,\,2e\,\,\, \to \,\,\mathop {\,S}\limits^{ + 4} $ → ne nhận = 2${n_{S{O_2}}}$ → ne cho = ne nhận
+) ${n_{SO_4^{2 - }}}$ = $\frac{{{n_{e{\text{ }}cho}}}}{2}$ → mmuối = mkim loại + ${m_{SO_4^{2 - }}}$
${n_{S{O_2}}} = \,\,\frac{{12,88}}{{22,4}}\,\, = \,\,0,575\,\,mol$
Xét quá trình nhận e: $\,\mathop S\limits^{ + 6} \,\, + \,\,2e\,\,\, \to \,\,\mathop {\,S}\limits^{ + 4} $
→ ne nhận = 2${n_{S{O_2}}}$ = 2.0,575 = 1,15 mol → ne cho = ne nhận = 1,15 mol
→${n_{SO_4^{2 - }}}$ = $\frac{{{n_{e{\text{ }}cho}}}}{2}$ = 0,575 mol → mmuối = mkim loại + ${m_{SO_4^{2 - }}}$ = 28,6 + 0,575.96 = 83,8 gam
Trong acquy chì chứa dung dịch axit sunfuric. Khi sử dụng acquy lâu ngày thường acquy bị “cạn nước”. Để bổ sung nước cho acquy, người ta cho thêm vào acquy chất nào sau đây?
-
A.
nước cất.
-
B.
nước mưa.
-
C.
dung dịch H2SO4 loãng.
-
D.
nước muối loãng.
Đáp án : C
Để bổ sung nước cho acquy, người ta cho thêm vào acquy dung dịch H2SO4 loãng.
Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M. Giá trị của V là
-
A.
10.
-
B.
40.
-
C.
20.
-
D.
30.
Đáp án : B
+) Bảo toàn nguyên tố S: ${{n}_{{{H}_{2}}S{{O}_{4}}}}=4.{{n}_{{{H}_{2}}S{{O}_{4}}.3S{{O}_{3}}}}$
+) tính số mol KOH theo PT: 2KOH + H2SO4 → K2SO4 + H2O
Số mol oleum : ${{n}_{{{H}_{2}}S{{O}_{4}}.3\text{S}{{O}_{3}}}}=\frac{1,69}{338}=0,005\,mol$
Bảo toàn nguyên tố S: ${{n}_{{{H}_{2}}S{{O}_{4}}}}=4.{{n}_{{{H}_{2}}S{{O}_{4}}.3S{{O}_{3}}}}=4.0,005=0,02\,mol$
2KOH + H2SO4 → K2SO4 + H2O
0,04 mol ← 0,02mol
=> Thể tích dung dịch KOH cần dùng là: VKOH = 0,04 lít = 40 ml
Cho 1 lít H2 (đktc) tác dụng với 0,672 lít Cl2 (đktc) rồi hòa tan sản phẩm vào nước để được 20 gam dung dịch A. Lấy 5 gam A tác dụng với dung dịch AgNO3 dư thu được 1,435 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2 (giả sử Cl2 và H2 không tan trong nước).
-
A.
50%
-
B.
33,33%
-
C.
60%
-
D.
66,67%
Đáp án : D
Vì ${{n}_{{{H}_{2}}}}>{{n}_{C{{l}_{2}}}}$ => hiệu suất phản ứng tính theo Cl2
+) nHCl (trong 5g A) = nAgCl
+) nCl2 phản ứng = 0,5.nHCl
${{n}_{{{H}_{2}}}}=\frac{1}{22,4}=0,0446\,mol;\,\,{{n}_{C{{l}_{2}}}}=0,03\,mol$
H2 + Cl2 → 2HCl (1)
Vì ${{n}_{{{H}_{2}}}}>{{n}_{C{{l}_{2}}}}$ => hiệu suất phản ứng tính theo Cl2
AgNO3 + HCl → AgCl + HNO3
=> nHCl (trong 5g A) = nAgCl = 0,01 mol
=> nHCl (trong 20g A) = 0,01.4 = 0,04 mol
(1) => nCl2 phản ứng = 0,5.nHCl = 0,5.0,04 = 0,02 mol
=> H% = 0,02 / 0,03 .100% = 66,67%
Nung một hỗn hợp rắn gồm a mol FeCO3 và b mol FeS2 trong bình kín chứa không khí dư. Sau khi các phản ứng xảy ra hoàn toàn, đưa bình về nhiệt độ ban đầu, thu được chất rắn duy nhất là Fe2O3 và hỗn hợp khí. Biết áp suất khí trong bình trước và sau phản ứng bằng nhau, mối liên hệ giữa a và b là (biết sau các phản ứng, lưu huỳnh ở mức oxi hoá +4, thể tích các chất rắn là không đáng kể)
-
A.
a = 0,5b.
-
B.
a = b.
-
C.
a = 4b.
-
D.
a = 2b
Đáp án : B
+) Vì áp suất trc và sau phản ứng = nhau nên V khí trc và sau phản ứng bằng nhau
+) Viết PTHH và cho số mol các khí bằng nhau
4FeCO3 + O2 → 2Fe2O3 + 4CO2
a → 0,25a → a
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
b → 2,75b → 2b
=> 0,25a + 2,75b = a + 2b => a= b
Cho dãy các chất: Ag, Fe3O4, Na2CO3 và Fe(OH)3. Số chất trong dãy tác dụng được với dung dịch H2SO4 loãng là
-
A.
1
-
B.
4
-
C.
2
-
D.
3
Đáp án : D
Viết PTHH
Chất tác dụng được với dung dịch H2SO4 loãng là Fe3O4, Na2CO3, Fe(OH)3
Cho a gam kim loại R phản ứng vừa đủ với 28,4 gam khí Clo thì thu được 43,52 gam muối clorua với hiệu suất 80%. Khối lượng a và tên của Kim loại R là:
-
A.
26 gam và Zn
-
B.
26 gam và Fe
-
C.
24 gam và Ca
-
D.
24 gam và Cu
Đáp án : A
nCl2 bđ = 28,4/71 = 0,4 mol => n Cl2 thực tế phản ứng = 0,4.80% = 0,32 mol
Giả sử kim loại có hóa trị là n.
2R + nCl2 → 2RCln
0,32 → 0,64/n
=> m muối = 0,64/n.(R + 35,5n) = 43,52 => 0,64R = 20,8n => R = 32,5n
+ n = 1 => R = 32,5 (loại)
+ n = 2 => R = 65 (Zn)
=> m Zn bđ = nCl2 bđ = 0,4 mol => a = 0,4.65 = 26 gam
Cấu hình electron lớp ngoài cùng của các nguyên tử halogen là
-
A.
ns2np4
-
B.
ns2np5
-
C.
ns2np6
-
D.
(n-1)d10ns2np5
Đáp án : B
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VIIA (halogen) là ns2np5.
Cho clo vào nước, thu được nước clo. Biết clo tác dụng không hoàn toàn với nước. Nước clo là hỗn hợp gồm các chất:
-
A.
HCl, HClO
-
B.
HClO, Cl2, H2O
-
C.
H2O, HCl, HClO
-
D.
H2O, HCl, HClO, Cl2
Đáp án : D
Cl2 có phản ứng thuận nghịch với nước:
H2O + Cl2 HCl + HClO (axit clohiđric và axit hipoclorơ)
Ngoài ra clo tan trong nước theo kiểu vật lí
=> trong nước clo có chứa Cl2, HCl, HClO, H2O.
Chất nào có tính khử mạnh nhất ?
-
A.
HI
-
B.
HF
-
C.
HBr
-
D.
HCl
Đáp án : A
Xem lại lí thuyết hợp chất không có oxi của halogen
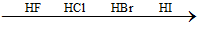
Tính axit tăng dần, tính khử tăng dần => Chất có tính khử mạnh nhất là HI
Nung nóng hỗn hợp gồm 15,8 gam KMnO4 và 24,5 gam KClO3 một thời gian thu được 36,3 gam hỗn hợp Y gồm 6 chất. Cho Y tác dụng với dung dịch HCl đặc, dư, đun nóng, lượng khí clo sinh ra cho hấp thụ vào 300 ml dung dịch NaOH 5M đun nóng thu được dung dịch Z. Cô cạn Z thu được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
-
A.
12 gam
-
B.
91,8 gam
-
C.
111 gam
-
D.
79,8 gam
Đáp án : B
Bảo toàn e
Bảo toàn e: nCl2 = (0,1. 5 + 0,2. 6 – 0,125. 4): 2 = 0,6 mol
xCl2 + 2xNaOH → NaClOx + (2x-1)NaCl + x H2O
=> 0,6 mol Cl2 + 1,5 mol NaOH → {NaCl; NaClOx; NaOH dư} + 0,6 mol H2O
=> mZ = 0,6. 71 + 1,5. 40 – 0,6. 18 = 91, 8 gam
Dẫn 8,96 lít (đktc) hỗn hợp khí X gồm H2S và CO2 vào lượng dư dung dịch Pb(NO3)2, thu được 23,9 gam kết tủa. Thành phần phần trăm thể tích của H2S trong X là
-
A.
25%
-
B.
50%
-
C.
60%
-
D.
75%
Đáp án : A
Xem lại tính chất hóa học của hiđro sunfua
nhh X = 0,4 mol
nPbS = 0,1 mol
H2S + Pb(NO3)2 → PbS + 2HNO3
0,1← 0,1
%VH2S = 25%
Nguyên tử nguyên tố X có tổng số electron trên các phân lớp s là 6 và có 6e lớp ngoài cùng. Nguyên tố X là
-
A.
Na.
-
B.
Cl.
-
C.
O.
-
D.
S.
Đáp án : D
Tổng số e ở phân lớp s là 6 và có 6e lớp ngoài cùng => cấu hình e của X là 1s22s22p63s23p4
=> nguyên tố X là S
Chất nào sau đây không phản ứng với O2 ?
-
A.
SO3
-
B.
P
-
C.
Ca
-
D.
C
Đáp án : A
Xem lại tính chất hóa học của oxi
Oxi không thể phản ứng được với SO3
Cho các chất tham gia phản ứng
a. S + F2 b. SO2+ Br2 + H2O
c. SO2+ O2 d. SO2 + H2SO4 đặc, nóng
e. SO2và H2O f. H2S + Cl2(dư) + H2O
Số phản ứng tạo ra lưu huỳnh ở mức oxi hóa +6 là:
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : C
Xem lại lí thuyết SO2
Các phản ứng tạo ra lưu huỳnh ở mức oxi hóa +6 là:
a. S+\(F_2\) → SF6
b. SO2 + Br2 + 2H2O → 2HBr + H2SO4
c. 2SO2 + O2 \(\xrightarrow{{{V_2}{O_5},{t^o}}}\) 2SO3
d. SO2 + H2O → H2SO3
e. H2S + 4Cl2(dư) + 4H2O → 8HCl + H2SO4
Tốc độ phản ứng phụ thuộc vào các yếu tố sau:
-
A.
Nhiệt độ
-
B.
Nồng độ, áp suất.
-
C.
Chất xúc tác, diện tích bề mặt.
-
D.
cả A, B, C.
Đáp án : D
Dựa vào kiến thức bài 36: Tốc độ phản ứng hóa học trong sgk hóa 10 – trang 150
Tốc độ phản ứng phụ thuộc vào các yếu tố: nồng độ, nhiệt độ, áp suất, chất xúc tác và bề mặt tiếp xúc.
Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng kẽm với dung dịch axit clohiđric:
• Nhóm thứ nhất: Cân 1 gam kẽm miếng và thả vào cốc đựng 200 ml dung dịch axit HCl 2M
• Nhóm thứ hai: Cân 1 gam kẽm bột và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
-
A.
Nhóm thứ hai dùng axit nhiều hơn.
-
B.
Diện tích bề mặt kẽm bột lớn hơn kẽm miếng.
-
C.
Nồng độ kẽm bột lớn hơn.
-
D.
Cả ba nguyên nhân đều sai.
Đáp án : B
Dựa vào ảnh hưởng của diện tích tiếp xúc và nồng độ đến tốc độ phản ứng để giải thích.
A. Sai vì cả hai nhóm dùng nồng độ HCl như nhau là 2M
B. Đúng
C. Sai, vì kẽm bột là chất rắn nên không có nồng độ
D. Sai
Cho phản ứng: Br2 + HCOOH → 2HBr + CO2.Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol/(l.s). Giá trị của a là
-
A.
0,018.
-
B.
0,016.
-
C.
0,012.
-
D.
0,014.
Đáp án : C
Dựa vào công thức tính tốc độ phản ứng: v = ∆C/∆t
∆CBr2 = a-0,01 = v.t = 50.4.10-5 => a = 0,012 mol/lít
Trong bình định mức 2,00 lít ban đầu chỉ chứa 0,777 mol SO3 (k) tại 1100K. Tính giá trị Kc của phản ứng dưới đây, biết tại trạng thái cân bằng có 0,52 mol SO3: 2SO3 (k) \(\rightleftarrows \) 2SO2 (k) + O2 (k)
-
A.
1,569.10-2.
-
B.
3,139.10-2.
-
C.
3,175.10-2.
-
D.
6,351.10-2.
Đáp án : A
nSO2 phản ứng = nSO2 bđ – nSO2 cb = ? (mol)
Hằng số cân bằng: \(Kc = \frac{{{{{\rm{[}}S{O_2}]}^2}{\rm{.[}}{O_2}]}}{{{{{\rm{[}}S{O_3}]}^2}}} = ?\)với nồng độ các chất trong biểu thức ở trạng thái cân bằng.
nSO2 phản ứng = 0,777 – 0,52 = 0,257 (mol)
2SO3 (k) \(\rightleftarrows \) 2SO2 (k) + O2 (k)
(mol) 0,257 → 0,257 0,1285
Hằng số cân bằng: \(Kc = \frac{{{{{\rm{[}}S{O_2}]}^2}{\rm{.[}}{O_2}]}}{{{{{\rm{[}}S{O_3}]}^2}}} = \frac{{{{\left[ {\frac{{0,257}}{2}} \right]}^2}.\left[ {\frac{{0,1285}}{2}} \right]}}{{{{\left[ {\frac{{0,52}}{2}} \right]}^2}}} = 1,{569.10^{ - 2}}\)
Điền vào khoảng trống trong các câu sau bằng cụm từ thích hợp: “ Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận…………tốc độ phản ứng nghich.”
-
A.
lớn hơn
-
B.
bằng
-
C.
nhỏ hơn
-
D.
khác
Đáp án : B
Dựa vào khái niệm cân bằng hóa học trong sgk hóa 10
Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghich
X, Y là hai halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối của X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A cần dùng 150 ml dung dịch AgNO3 0,2M. Hai nguyên tố X, Y là
-
A.
Cl và Br.
-
B.
Cl và I
-
C.
I và Br.
-
D.
F và I
Đáp án : A
Đặt công thức chung của hai muối là:\(Na\overline X \)
\(\eqalign{
& Na\overline X + AgN{O_3}\buildrel {} \over
\longrightarrow Ag\overline X + NaN{O_3} \cr
& 0,2 \leftarrow 0,2\,(mol) \cr
& Theo\,\,PTHH:\,{n_{Na\overline X }} = nAgN{O_3} = 0,2\,(mol) \cr
& \Rightarrow {M_{Na\overline X }} = {{{m_{Na\overline X }}} \over {{n_{Na\overline X }}}} = ? \Rightarrow \overline X = ? \cr} \)
nAgNO3 = 0,15×0,2 = 0,03 (mol)
Đặt công thức chung của hai muối là: \(Na\overline X \)
\(\eqalign{
& Na\overline X + AgN{O_3}\buildrel {} \over
\longrightarrow Ag\overline X + NaN{O_3} \cr
& 0,2 \leftarrow 0,2\,(mol) \cr
& Theo\,\,PTHH:\,{n_{Na\overline X }} = nAgN{O_3} = 0,2\,(mol) \cr
& \Rightarrow {M_{Na\overline X }} = {{{m_{Na\overline X }}} \over {{n_{Na\overline X }}}} = {{2,2} \over {0,03}} \approx 73,33\,(g/mol) \cr
& \Rightarrow 23 + {M_{\overline X }} = 73,33 \cr
& \Rightarrow {M_{\overline X }} = 50,33\,(g/mol) \cr} \)
Vì X, Y là 2 halogen thuộc 2 chu kì liên tiếp nhau trong dãy BTH → 2 nguyên tố là Cl và Br
Cho cân bằng hóa học sau trong bình kín:
2NO2(k) ⇄ N2O4(k) ; ΔH < 0
(nâu đỏ) (không màu)
Phát biểu nào sau đây đúng?
-
A.
Phản ứng thuận tỏa nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ đậm dần.
-
B.
Phản ứng thuận tỏa nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ nhạt dần.
-
C.
Phản ứng thuận thu nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ đậm dần.
-
D.
Phản ứng thuận thu nhiệt, khi tăng nhiệt độ của bình thì màu nâu đỏ nhạt dần.
Đáp án : A
Phản ứng có ∆H < 0 ⟹ phản ứng thuận là phản ứng tỏa nhiệt.
Nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Phản ứng có ∆H < 0 ⟹ phản ứng thuận là phản ứng tỏa nhiệt.
Khi tăng nhiệt độ của bình, theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê: cân bằng sẽ chuyển dịch theo chiều làm giảm nhiệt độ của hệ.
⟹ Cân bằng chuyển dịch theo chiều phản ứng thu nhiệt.
⟹ Cân bằng chuyển dịch theo chiều nghịch, tạo ra nhiều NO2 hơn
⟹ Màu nâu đỏ của bình đậm dần.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 1 tiết Hóa 10 chương 1: Nguyên tử - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 2










Danh sách bình luận