Đề kiểm tra 1 tiết Hóa 10 chương 2: Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn - Đề số 1
Đề bài
Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?
-
A.
Theo chiều tăng của điện tích hạt nhân.
-
B.
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
-
C.
Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành 1 cột.
-
D.
Cả A, B, C.
Nhóm nguyên tố mà nguyên tử của nó có cấu hình electron lớp ngoài cùng 4s1 là
-
A.
K, Ca, Cr.
-
B.
Na, Cr, Cu.
-
C.
K, Ca, Cu.
-
D.
K, Cr, Cu.
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do:
-
A.
Sự lặp lại tính chất kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
-
B.
Sự lặp lại tính chất phi kim của các nguyên tố ở chu kì sau so với chu kì truớc.
-
C.
Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước (ở ba chu kì đầu).
-
D.
Sự lặp lại tính chất hoá học của các nguyên tố ở chu kì sau so với chu kì trước.
Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
-
A.
tăng theo chiều tăng của điện tích hạt nhân.
-
B.
giảm theo chiều tăng của điện tích hạt nhân.
-
C.
không thay đổi.
-
D.
ban đầu tăng, sau đó giảm.
Trong một nhóm A, khi đi từ trên xuống thì
-
A.
độ âm điện tăng dần, tính kim loại tăng dần.
-
B.
độ âm điện tăng dần, tính phi kim tăng dần.
-
C.
độ âm điện giảm dần, tính phi kim tăng dần.
-
D.
độ âm điện giảm dần, tính kim loại tăng dần.
Dãy nguyên tố được sắp xếp theo chiều tăng dần tính kim loại từ trái sang phải
-
A.
Na < K < Mg < Al.
-
B.
Al < Mg < Na < K.
-
C.
Mg < Al < Na < K.
-
D.
K < Na < Al < Mg.
Trong bảng hệ thống tuần hoàn, khi đi từ trái sang phải trong 1 chu kì thì
-
A.
độ âm điện tăng dần.
-
B.
độ âm điện không thay đổi.
-
C.
độ âm điện giảm dần.
-
D.
độ âm điện tăng lên xong giảm xuống.
Cho các nguyên tố: X (Z = 12), Y (Z = 8), R (Z = 19), T (Z = 15). Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là
-
A.
X, Y, R, T.
-
B.
Y, X, T, R.
-
C.
Y, T, X, R.
-
D.
R, T, X, Y.
Các nguyên tố thuộc cùng một nhóm A có tính chất hoá học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có:
-
A.
Số electron thuộc lớp ngoài cùng như nhau.
-
B.
Số electron như nhau.
-
C.
Số lớp electron như nhau.
-
D.
Cùng số electron s hay p.
Oxit cao nhất của một nguyên tố R ứng với công thức RO2. Nguyên tố R đó là:
-
A.
Magie
-
B.
Cacbon
-
C.
Nitơ
-
D.
Photpho
Thứ tự tăng dần tính phi kim của các nguyên tố trong nhóm VIIA là
-
A.
Br, F, I, Cl.
-
B.
F, Cl, Br, I.
-
C.
I, Br, F, Cl.
-
D.
I, Br, Cl, F.
Trong một chu kì khi đi từ trái sang phải, hóa trị cao nhất của nguyên tố đối với oxi:
-
A.
Giảm dần
-
B.
Tăng dần
-
C.
Không đổi
-
D.
Tăng giảm không theo quy luật
Nhóm gồm những nguyên tố phi kim điển hình là:
-
A.
IA
-
B.
VIA
-
C.
VIIA
-
D.
VIIIA
Hiđroxit nào sau đây có tính axit mạnh nhất?
-
A.
H3PO4
-
B.
H2SiO3
-
C.
HClO4
-
D.
H2SO4
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit biến đổi như thế nào?
-
A.
Giảm dần
-
B.
Giảm dần sau đó tăng dần
-
C.
Tăng dần sau đó giảm dần
-
D.
Tăng dần
Cho các phát biểu sau:
(1) Nhóm IIIA là tập hợp những nguyên tố mà nguyên tử có 3e hóa trị.
(2) Trong phương trình hóa học: 2Fe + 3Cl2 2FeCl3. Fe là chất bị khử.
(3) Tất cả các nguyên tố nhóm IA đều là kim loại điển hình.
(4) Trong 1 nhóm A, độ âm điện của các nguyên tố tăng dần theo chiều tăng của điện tích hạt nhân.
(5) Số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm B có tối đa bằng 2.
Số phát biểu không đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Nguyên tố Y tạo hợp chất khí với hiđro có công thức YH3. Trong hợp chất oxit cao nhất Y chiếm 25,92% về khối lượng. Xác định Y?
-
A.
N (M= 14).
-
B.
P (M = 31).
-
C.
S (M = 32).
-
D.
O (M = 16).
Số nguyên tố thuộc chu kì 3 của bảng tuần hoàn là
-
A.
2
-
B.
32
-
C.
18
-
D.
8
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
-
A.
Mg > S > Cl > F
-
B.
F > Cl > S > Mg
-
C.
S > Mg > Cl > F
-
D.
Cl > F > S > Mg
Cho 3,9g một kim loại kiềm, tác dụng hết với dung dịch HCl dư thu được 1,12 lit khí hiđro (ở đktc). Kim loại đó là
-
A.
Mg
-
B.
Na
-
C.
K
-
D.
Li
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của chúng có cùng…
-
A.
số lớp electron
-
B.
số electron ở lớp ngoài cùng
-
C.
số electron
-
D.
số electron hóa trị
Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hidro và công thức oxit cao nhất là
-
A.
RH2, RO
-
B.
RH3, R2O5
-
C.
RH5, R2O3
-
D.
RH4, RO2
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
-
A.
Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
-
B.
Oxit cao nhất của R ở điều kiện thường là chất rắn.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3.
-
D.
Phân tử oxit cao nhất của R không có cực.
Độ âm điện là:
-
A.
Khả năng nhường electron của nguyên tử cho nguyên tử khác.
-
B.
Khả năng tham gia phản ứng mạnh hay yếu.
-
C.
Khả năng nhường protroncủa nguyên tử này cho nguyên tử khác.
-
D.
Khả năng hút electron của nguyên tử trong phân tử.
X và Y là hai kim loại thuộc cùng một nhóm A trong bảng tuần hoàn các nguyên tố hóa học. Biết ZX<ZY và ZX + ZY = 24. Phát biểu nào sau đây là không đúng?
-
A.
X, Y đều có 2 electron ở phân lớp ngoài cùng.
-
B.
Bán kính nguyên tử của Y lớn hơn bán kính nguyên tử của X.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học thì X, Y đều thuộc nhóm IIA.
-
D.
Hidroxit tương ứng với oxit cao nhất của X, Y đều có tính bazo mạnh.
Trong bảng tuần hoàn các nguyên tố, nguyên tố có tính phi kim mạnh nhất là
-
A.
flo.
-
B.
oxi.
-
C.
clo.
-
D.
nito.
Hòa tan hoàn toàn 7,30 gam hỗn hợp hai kim loại kiềm X, Y (MX < MY) thuộc hai chu kì liên tiếp vào 200 gam nước thu được dung dịch Z và 7,84 lít khí hidro (đktc). Nồng độ phần trăm của YOH trong dung dịch Z là
-
A.
2,904%.
-
B.
6,389%.
-
C.
2,894%.
-
D.
1,670%.
Nguyên tử R có cấu hình electron lớp ngoài cùng là ns2np3. Trong hợp chất khí với hidro thì hidro chiếm 17,647% về khối lượng. R là
-
A.
As.
-
B.
S.
-
C.
N.
-
D.
P.
Nguyên tố X thuộc chu kì 3, nhóm IIA có cấu hình electron là
-
A.
1s22s22p63s2.
-
B.
1s22s22p63s1.
-
C.
1s22s22p63p2.
-
D.
1s22s22p6.
Lời giải và đáp án
Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?
-
A.
Theo chiều tăng của điện tích hạt nhân.
-
B.
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
-
C.
Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành 1 cột.
-
D.
Cả A, B, C.
Đáp án : D
Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc:
- Theo chiều tăng của điện tích hạt nhân.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng (chu kì)
- Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành 1 cột (nhóm)
Nhóm nguyên tố mà nguyên tử của nó có cấu hình electron lớp ngoài cùng 4s1 là
-
A.
K, Ca, Cr.
-
B.
Na, Cr, Cu.
-
C.
K, Ca, Cu.
-
D.
K, Cr, Cu.
Đáp án : D
Viết cấu hình e có lớp ngoài cùng là 4s1 (chú ý các trường hợp bán bão hòa và bão hòa) => nguyên tố
Các nguyên tố có cấu hình e lớp ngoài cùng 4s1 là:
1s22s22p63s23p64s1 => nguyên tố K
1s22s22p63s23p63d54s1 => nguyên tố Cr
1s22s22p63s23p63d104s1 => nguyên tố Cu
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do:
-
A.
Sự lặp lại tính chất kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
-
B.
Sự lặp lại tính chất phi kim của các nguyên tố ở chu kì sau so với chu kì truớc.
-
C.
Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước (ở ba chu kì đầu).
-
D.
Sự lặp lại tính chất hoá học của các nguyên tố ở chu kì sau so với chu kì trước.
Đáp án : C
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do: Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước (ở ba chu kì đầu).
Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
-
A.
tăng theo chiều tăng của điện tích hạt nhân.
-
B.
giảm theo chiều tăng của điện tích hạt nhân.
-
C.
không thay đổi.
-
D.
ban đầu tăng, sau đó giảm.
Đáp án : A
Trong một nhóm A, bán kính nguyên tử của các nguyên tố: tăng theo chiều tăng của điện tích hạt nhân.
Trong một nhóm A, khi đi từ trên xuống thì
-
A.
độ âm điện tăng dần, tính kim loại tăng dần.
-
B.
độ âm điện tăng dần, tính phi kim tăng dần.
-
C.
độ âm điện giảm dần, tính phi kim tăng dần.
-
D.
độ âm điện giảm dần, tính kim loại tăng dần.
Đáp án : D
Trong một nhóm A, khi đi từ trên xuống thì độ âm điện giảm dần, tính kim loại tăng dần.
Dãy nguyên tố được sắp xếp theo chiều tăng dần tính kim loại từ trái sang phải
-
A.
Na < K < Mg < Al.
-
B.
Al < Mg < Na < K.
-
C.
Mg < Al < Na < K.
-
D.
K < Na < Al < Mg.
Đáp án : B
Na, Mg và Al là 3 kim loại thuộc cùng chu kì 2, vì ZNa < ZMg < ZAl => thứ tự tính kim loại tăng dần là: Al < Mg < Na
K thuộc chu kì 3 => bán kính nguyên tử của K lớn nhất
=> thứ tự tăng dần tính kim loại từ trái sang phải là: Al < Mg < Na < K.
Trong bảng hệ thống tuần hoàn, khi đi từ trái sang phải trong 1 chu kì thì
-
A.
độ âm điện tăng dần.
-
B.
độ âm điện không thay đổi.
-
C.
độ âm điện giảm dần.
-
D.
độ âm điện tăng lên xong giảm xuống.
Đáp án : A
Trong bảng hệ thống tuần hoàn, khi đi từ trái sang phải trong 1 chu kì thì độ âm điện tăng dần.
Cho các nguyên tố: X (Z = 12), Y (Z = 8), R (Z = 19), T (Z = 15). Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là
-
A.
X, Y, R, T.
-
B.
Y, X, T, R.
-
C.
Y, T, X, R.
-
D.
R, T, X, Y.
Đáp án : C
Y (Z = 8) là Oxi, thuộc chu kì 2 => có bán kính nguyên tử nhỏ nhất
X (Z = 12) là Mg và T (Z = 15) là P cùng thuộc chu kì 3 => P có độ âm điện lớn hơn Mg
=> bán kính Mg lớn hơn P (X > T)
R (Z = 19) là K thuộc chu kì 4 => R có bán kính nguyên tử lớn nhất
=> Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là : Y, T, X, R.
Các nguyên tố thuộc cùng một nhóm A có tính chất hoá học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có:
-
A.
Số electron thuộc lớp ngoài cùng như nhau.
-
B.
Số electron như nhau.
-
C.
Số lớp electron như nhau.
-
D.
Cùng số electron s hay p.
Đáp án : A
Những nguyên tố thuộc cùng 1 nhóm A có số e lớp ngoài cùng như nhau nên có tính chất tương tự nhau.
Oxit cao nhất của một nguyên tố R ứng với công thức RO2. Nguyên tố R đó là:
-
A.
Magie
-
B.
Cacbon
-
C.
Nitơ
-
D.
Photpho
Đáp án : B
Hóa trị của một nguyên tố nhóm A trong oxit cao nhất bằng số thứ tự nhóm của nguyên tố đó.
Trong RO2, R có hóa trị IV => R thuộc nhóm IVA => Cacbon
Thứ tự tăng dần tính phi kim của các nguyên tố trong nhóm VIIA là
-
A.
Br, F, I, Cl.
-
B.
F, Cl, Br, I.
-
C.
I, Br, F, Cl.
-
D.
I, Br, Cl, F.
Đáp án : D
Dựa vào quy luật biến đổi tính phi kim của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học:
- Trong cùng một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính phi kim của các nguyên tố tăng dần.
- Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính phi kim của các nguyên tố giảm dần.
Ta thấy các nguyên tố trên đều thuộc nhóm VIIA. Mà trong trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính phi kim của các nguyên tố giảm dần nên ta có sự sắp xếp tính phi kim của các nguyên tố như sau: I < Br < Cl < F
Trong một chu kì khi đi từ trái sang phải, hóa trị cao nhất của nguyên tố đối với oxi:
-
A.
Giảm dần
-
B.
Tăng dần
-
C.
Không đổi
-
D.
Tăng giảm không theo quy luật
Đáp án : B
Trong một chu kì khi đi từ trái sang phải, hóa trị cao nhất của nguyên tố đối với oxi tăng dần
Nhóm gồm những nguyên tố phi kim điển hình là:
-
A.
IA
-
B.
VIA
-
C.
VIIA
-
D.
VIIIA
Đáp án : C
Nhóm VIIA gồm những phi kim điển hình
Hiđroxit nào sau đây có tính axit mạnh nhất?
-
A.
H3PO4
-
B.
H2SiO3
-
C.
HClO4
-
D.
H2SO4
Đáp án : C
Xác định vị trí tương đối của các nguyên tố P, Si, Cl, S trong bảng tuần hoàn.
Dựa vào quy luật biến đổi tính axit để so sánh.
Các nguyên tố đều thuộc cùng 1 chu kì và được sắp xếp theo chiều tăng của điện tích hạt nhân là: Si, P, S, Cl
Quy luật biến đổi tính axit của các hidroxit: Trong cùng một chu kì, theo chiều tăng dần điện tích hạt nhân thì tính axit của hidroxit tăng dần
=> Axit mạnh nhất là HClO4
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit biến đổi như thế nào?
-
A.
Giảm dần
-
B.
Giảm dần sau đó tăng dần
-
C.
Tăng dần sau đó giảm dần
-
D.
Tăng dần
Đáp án : D
Các nguyên tố thuộc cùng 1 nhóm A có cùng số e lớp ngoài cùng (số e hóa trị) và:
Số thứ tự của nhóm = số e lớp ngoài cùng = số e hóa trị
Vậy theo thứ tự nhóm A từ IA đến VIIA ứng với cấu hình electron lớp ngoài cùng là ns1 và ns2np5 thì số e hóa trị tăng từ 1 đến 7.
=> Trong 1 chu kỳ, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố trong oxit tăng lần lượt từ 1 đến 7.
Cho các phát biểu sau:
(1) Nhóm IIIA là tập hợp những nguyên tố mà nguyên tử có 3e hóa trị.
(2) Trong phương trình hóa học: 2Fe + 3Cl2 2FeCl3. Fe là chất bị khử.
(3) Tất cả các nguyên tố nhóm IA đều là kim loại điển hình.
(4) Trong 1 nhóm A, độ âm điện của các nguyên tố tăng dần theo chiều tăng của điện tích hạt nhân.
(5) Số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm B có tối đa bằng 2.
Số phát biểu không đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Đáp án : B
(1) Đ
(2) S. Fe nhường e nên Fe là chất khử hay là chất bị oxi hóa
(3) S. trong nhóm IA có nguyên tố H không phải là kim loại
(4) S. Trong 1 nhóm A, độ âm điện của các nguyên tố giảm dần theo chiều tăng của điện tích hạt nhân .
(5) Đ
Nguyên tố Y tạo hợp chất khí với hiđro có công thức YH3. Trong hợp chất oxit cao nhất Y chiếm 25,92% về khối lượng. Xác định Y?
-
A.
N (M= 14).
-
B.
P (M = 31).
-
C.
S (M = 32).
-
D.
O (M = 16).
Đáp án : A
Tổng hóa trị của nguyên tố trong hợp chất với H và oxit cao nhất bằng 8
- Từ CT hợp chất khí với hiđro ta suy ra công thức oxit cao nhất
- Dựa vào phần trăm khối lượng để lập phương trình với ẩn là MY
=> MY
Nguyên tố Y tạo hợp chất khí với hiđro có công thức YH3 => CTHH của oxit cao nhất là Y2O5
\(\begin{gathered}
\% {m_Y} = \frac{{2{M_Y}}}{{2{M_Y} + 5.16}}.100\% = 25,92\% \hfill \\
\to {M_Y} = 14(Nitơ) \hfill \\
\end{gathered} \)
Số nguyên tố thuộc chu kì 3 của bảng tuần hoàn là
-
A.
2
-
B.
32
-
C.
18
-
D.
8
Đáp án : D
Nắm được cấu tạo chung của bảng tuần hoàn.
Chu kì 3 là chu kì nhỏ nên có 8 nguyên tố
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
-
A.
Mg > S > Cl > F
-
B.
F > Cl > S > Mg
-
C.
S > Mg > Cl > F
-
D.
Cl > F > S > Mg
Đáp án : A
1. Viết cấu hình e nguyên tử các nguyên tố
2. Từ cấu hình e suy ra vị trí của các nguyên tố trong bảng tuần hoàn
3. Dựa vào sự thay đổi của bán kính trong một nhóm và một chu kì để sắp xếp bán kính theo chiều giảm dần:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
- Cấu hình e và vị trí của các nguyên tố:
12Mg: 1s22s22p63s2=> Chu kì 3, nhóm IIA
16S: 1s22s22p63s23p4 => Chu kì 3, nhóm VIA
17Cl: 1s22s22p63s23p5 => Chu kì 3, nhóm VIIA
9F: 1s22s22p5 => Chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tử các nguyên tố trong bảng tuần hoàn:
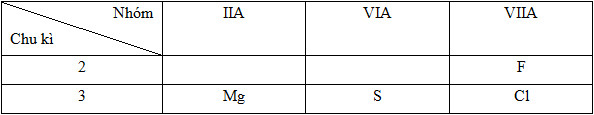
* Sự biến đổi bán kính trong bảng tuần hoàn:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Như vậy bán kính nguyên tử các nguyên tố được sắp xếp như sau: Mg > S > Cl > F
Cho 3,9g một kim loại kiềm, tác dụng hết với dung dịch HCl dư thu được 1,12 lit khí hiđro (ở đktc). Kim loại đó là
-
A.
Mg
-
B.
Na
-
C.
K
-
D.
Li
Đáp án : C
Viết PTHH ta thấy: nKL = 2nH2 => MKL => Tên KL
nH2 = 0,05 mol
nKL = 2nH2 = 0,1 mol
=> MKL = 3,9 : 0,1 = 39. Vậy kim loại đó là K
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của chúng có cùng…
-
A.
số lớp electron
-
B.
số electron ở lớp ngoài cùng
-
C.
số electron
-
D.
số electron hóa trị
Đáp án : D
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của chúng có cùng số electron hóa trị.
Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hidro và công thức oxit cao nhất là
-
A.
RH2, RO
-
B.
RH3, R2O5
-
C.
RH5, R2O3
-
D.
RH4, RO2
Đáp án : B
Tổng hóa trị của một nguyên tố trong oxit cao nhất và trong hợp chất khí với H bằng 8
R có cấu hình electron 1s22s22p3 => R có 5e ở lớp ngoài cùng => R ở nhóm VA
=> Oxit cao nhất: R2O5
=> Hợp chất khí với H: RH3
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
-
A.
Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
-
B.
Oxit cao nhất của R ở điều kiện thường là chất rắn.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3.
-
D.
Phân tử oxit cao nhất của R không có cực.
Đáp án : D
Đặt công thức:
+ Oxit cao nhất: R2On
+ Hợp chất khí với H là: RH8-n
Đặt công thức:
+ Oxit cao nhất: R2On
+ Hợp chất khí với H là: RH8-n
\(\begin{array}{l}
\left\{ \begin{array}{l}
a = \dfrac{R}{{R + 8 - n}}.100\\
b = \dfrac{{2R}}{{2R + 16n}}.100
\end{array} \right. \to \dfrac{a}{b} = \dfrac{{2R + 16n}}{{2(R + 8 - n)}} = \dfrac{{11}}{4}\\
\to R = \dfrac{{86n - 176}}{{14}}
\end{array}\)
Thay các giá trị n = 1, 2, …, 7 thấy n = 4, R = 12 thỏa mãn
=> R là Cacbon
Xét các phương án:
- Cấu hình e của R ở trạng thái cơ bản là 1s22s22p2 => R có 4 electron s => A sai
- Oxit cao nhất của R ở điều kiện thường là CO2 ở thể khí => B sai
- R có 2 lớp e nên thuộc chu kì 2 => C sai
- Phân tử CO2 không có cực => D đúng
Độ âm điện là:
-
A.
Khả năng nhường electron của nguyên tử cho nguyên tử khác.
-
B.
Khả năng tham gia phản ứng mạnh hay yếu.
-
C.
Khả năng nhường protroncủa nguyên tử này cho nguyên tử khác.
-
D.
Khả năng hút electron của nguyên tử trong phân tử.
Đáp án : D
Độ âm điện là khả năng hút e của nguyên tử khi hình thành liên kết hóa học
X và Y là hai kim loại thuộc cùng một nhóm A trong bảng tuần hoàn các nguyên tố hóa học. Biết ZX<ZY và ZX + ZY = 24. Phát biểu nào sau đây là không đúng?
-
A.
X, Y đều có 2 electron ở phân lớp ngoài cùng.
-
B.
Bán kính nguyên tử của Y lớn hơn bán kính nguyên tử của X.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học thì X, Y đều thuộc nhóm IIA.
-
D.
Hidroxit tương ứng với oxit cao nhất của X, Y đều có tính bazo mạnh.
Đáp án : D
TH1: X, Y cách nhau 1 chu kì nhỏ
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 8 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 8 \hfill \\
{Z_Y} = 16 \hfill \\
\end{gathered} \right.\) loại do X, Y không phải là kim loại
TH2: X, Y cách nhau 1 chu kì lớn
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 18 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 3 \hfill \\
{Z_Y} = 21 \hfill \\
\end{gathered} \right.\) loại
TH3: X, Y cách nhau 2 chu kì nhỏ
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 8.2 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 4(Be) \hfill \\
{Z_Y} = 20(Ca) \hfill \\
\end{gathered} \right.\)
Be: 1s22s2
Ca: 1s22s22p63s23p64s2
A, B, C đúng
D sai vì Be(OH)2 có tính bazơ yếu
Trong bảng tuần hoàn các nguyên tố, nguyên tố có tính phi kim mạnh nhất là
-
A.
flo.
-
B.
oxi.
-
C.
clo.
-
D.
nito.
Đáp án : A
Trong bảng tuần hoàn các nguyên tố, nguyên tố có tính phi kim mạnh nhất là flo
Hòa tan hoàn toàn 7,30 gam hỗn hợp hai kim loại kiềm X, Y (MX < MY) thuộc hai chu kì liên tiếp vào 200 gam nước thu được dung dịch Z và 7,84 lít khí hidro (đktc). Nồng độ phần trăm của YOH trong dung dịch Z là
-
A.
2,904%.
-
B.
6,389%.
-
C.
2,894%.
-
D.
1,670%.
Đáp án : A
Viết PTHH và tính toán theo PTHH.
Gọi công thức chung của 2 kim loại là M
M + H2O → MOH + 0,5 H2
0,7 ← 0,35 (mol)
M = 7,3/0,7 = 10,43 => Li và Na
Đặt nLi = x; nNa = y (mol)
\(\left\{ \begin{gathered}
7x + 23y = 7,3 \hfill \\
x + y = 0,7 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,55 \hfill \\
y = 0,15 \hfill \\
\end{gathered} \right.\)
mdd sau phản ứng = mKL + mH2O – mH2 = 7,3 + 200 – 0,35.2 = 206,6 (g)
\( \to C{\% _{NaOH}} = \dfrac{{0,15.40}}{{206,6}}.100\% = 2,904\% \)
Nguyên tử R có cấu hình electron lớp ngoài cùng là ns2np3. Trong hợp chất khí với hidro thì hidro chiếm 17,647% về khối lượng. R là
-
A.
As.
-
B.
S.
-
C.
N.
-
D.
P.
Đáp án : C
Hợp chất khí của R với H là: RH3
\(\begin{gathered}
\% {m_H} = \dfrac{3}{{R + 3}}.100\% = 17,647\% \hfill \\
\to R = 14(N) \hfill \\
\end{gathered} \)
Nguyên tố X thuộc chu kì 3, nhóm IIA có cấu hình electron là
-
A.
1s22s22p63s2.
-
B.
1s22s22p63s1.
-
C.
1s22s22p63p2.
-
D.
1s22s22p6.
Đáp án : A
Chu kì = số lớp e
Số thứ tự nhóm (đối với nhóm A) = số e lớp ngoài cùng
Chu kì 3 => 3 lớp electron
Nhóm IIA => có 2e lớp ngoài cùng
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 1 tiết Hóa 10 chương 1: Nguyên tử - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 2










Danh sách bình luận