Đề thi giữa kì 2 Hóa 10 - Đề số 3
Đề bài
Khi sục Cl2 vào nước thu được nước clo có màu vàng nhạt. Trong nước clo có chứa các chất
-
A.
Cl2, H2O.
-
B.
HCl, HClO.
-
C.
HCl, HClO, H2O.
-
D.
Cl2, HCl, HClO, H2O.
Cho 21,8 gam hỗn hợp X gồm Al, Fe và Zn đốt trong khí clo dư thu được 57,3 gam hỗn hợp muối Y. Cho Y vào dung dịch AgNO3 dư thu được kết tủa có khối lượng là
-
A.
114,8 gam.
-
B.
129,15 gam.
-
C.
143,5 gam.
-
D.
157,85 gam.
Trong các phản ứng hóa học, axit HCl có thể đóng vai trò là
-
A.
chất khử
-
B.
chất oxi hóa.
-
C.
chất trao đổi.
-
D.
chất khử, chất oxi hóa hoặc trao đổi.
Cho 1,03 gam muối natri halogenua A tác dụng với dung dịch AgNO3 dư thu được một kết tủa. Kết tủa này sau khi bị phân hủy hoàn toàn cho 1,08 gam Ag. Muối A là
-
A.
NaF
-
B.
NaCl
-
C.
NaBr
-
D.
NaI
Đun nóng một hỗn hợp gồm 6,4 gam bột lưu huỳnh và 15 gam bột kẽm trong môi trường kín không có không khí. Chất nào còn dư sau phản ứng và có khối lượng là bao nhiêu?
-
A.
Zn; 2g
-
B.
Zn; 8,45g
-
C.
S; 2g
-
D.
S; 3,2g
Trong công nghiệp, từ khí SO2 và oxi, phản ứng hóa học tạo thành SO3 xảy ra ở điều kiện nào sau đây?
-
A.
Nhiệt độ phòng.
-
B.
Đun nóng đến 500oC.
-
C.
Đun nóng đến 500oC và có mặt xúc tác V2O5.
-
D.
Nhiệt độ phòng và có mặt chất xúc tác V2O5.
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
-
A.
Mg
-
B.
Al
-
C.
Fe
-
D.
Cu
Từ 1,6 tấn quặng có chứa 60% FeS2, biết hiệu suất cả quá trình là 80%, người ta có thể sản xuất được lượng axit sunfuric là
-
A.
1558,0 kg.
-
B.
1254,4 kg.
-
C.
1548,0 kg.
-
D.
1568,0 kg.
Gây nổ hỗn hợp gồm 3 khí trong bình kín. Một khí được điều chế bằng cách cho HCl dư tác dụng với 307,68 gam Mg. Khí thứ 2 điều chế được khi phân hủy hoàn toàn 514,5 gam KClO3 có MnO2 xúc tác. Khí thứ 3 thu được do HCl dư tác dụng với 19,14 gam MnO2. Tính C% của chất trong dung dịch sau khi nổ.
-
A.
3,306%
-
B.
6,61%
-
C.
7,22%
-
D.
3,61%
Hấp thụ 2,24 lít Cl2 (đktc) vào 250 ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch A. Cô cạn dung dịch A thu được m gam rắn khan. Giá trị của m là:
-
A.
13,3 gam.
-
B.
15,3 gam.
-
C.
5,85 gam.
-
D.
7,45 gam.
Tính oxi hóa của lưu huỳnh thể hiện qua phản ứng nào sau đây
-
A.
Tác dụng với kim loại
-
B.
Tác dụng với hidro
-
C.
Tác dụng với phi kim
-
D.
Cả A và B đều đúng
Hòa tan hoàn toàn 19,2 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 trong 50 ml dung dịch H2SO4 18M (đặc, dư, đun nóng), thu được dung dịch Y và V lít khí SO2 (đktc và là sản phẩm khử duy nhất). Cho 450 ml dung dịch NaOH 2M vào dung dịch Y thu được 21,4 gam kết tủa. Giá trị của V là
-
A.
5,60 lít.
-
B.
4,48 lít.
-
C.
6,72 lít.
-
D.
3,36 lít.
Chất nào sau đây khi cho tác dụng với H2SO4 đặc, nóng không có khí thoát ra?
-
A.
FeO.
-
B.
Fe(OH)2.
-
C.
Fe2O3.
-
D.
Fe3O4.
Phản ứng trong đó HCl thể hiện tính khử là
-
A.
HCl + NaOH → NaCl + H2O
-
B.
2HCl + Mg → MgCl2 + H2
-
C.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
-
D.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chất nào có tính khử mạnh nhất ?
-
A.
HI
-
B.
HF
-
C.
HBr
-
D.
HCl
Oleum có công thức tổng quát là
-
A.
H2SO4.nSO2
-
B.
H2SO4.nH2O
-
C.
H2SO4.nSO3
-
D.
H2SO4 đặc
Nước Gia-ven và clorua vôi thường được dùng để
-
A.
sản xuất clo trong công nghiệp.
-
B.
tẩy trắng sợi, vải, giấy và tẩy uế.
-
C.
sản xuất HCl trong phòng thí nghiệm.
-
D.
sản xuất phân bón hóa học.
Nung m gam hỗn hợp X gồm KClO3 và KMnO4 thu được chất rắn Y và O2. Biết KClO3 phân hủy hoàn toàn, còn KMnO4 chỉ bị phân hủy một phần. Trong Y có 0,894 gam KCl chiếm 8,132% về khối lương. Trộn lượng O2 ở trên với không khí theo tỷ lệ thể tích 1:3 trong một bình kín ta thu được hỗn hợp khí Z. Cho vào bình 0,528 gam cacbon rồi đốt cháy hết cacbon, phản ứng hoàn toàn, thu được hỗn hợp khí T gồm 3 khí O2, N2, CO2, trong đó CO2 chiếm 22,92% thể tích. Giá trị m là
-
A.
12,59
-
B.
12,530
-
C.
11,384
-
D.
12,91
Cho phương trình phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Sau khi cân bằng với hệ số là các giá trị tối giản, hệ số của chất oxi hoá và chất khử là
-
A.
5 và 2.
-
B.
2 và 5.
-
C.
2 và 2.
-
D.
5 và 5.
Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây?
-
A.
Oxi
-
B.
Lưu huỳnh
-
C.
Clo
-
D.
Flo
Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây ?
-
A.
oxi
-
B.
lưu huỳnh
-
C.
clo
-
D.
flo
Phát biểu nào sau đây sai ?
-
A.
khí oxi không màu, không mùi, nặng hơn không khí
-
B.
khí ozon màu xanh nhạt, có mùi đặc trưng
-
C.
ozon là một dạng thù hình của oxi, có tính oxi hóa mạnh hơn oxi
-
D.
ozon và oxi đều được dùng để khử trùng nước sinh hoạt
Cho sơ đồ sau:
\({S^{ - 2}} \to S \to {S^{ + 4}} \to {S^{ + 6}} \to {S^{ - 2}}\)
Vậy S-2, S+4 và S+6 có thể tương ứng với dãy các chất nào sau đây ?
-
A.
FeS2, SO2, H2SO4
-
B.
H2S, SO2, H2SO4
-
C.
H2S, SO2, SO3
-
D.
FeS, SO2 và Na2SO4
Thực hiện thí nghiệm điều chế clo theo sơ đồ sau:
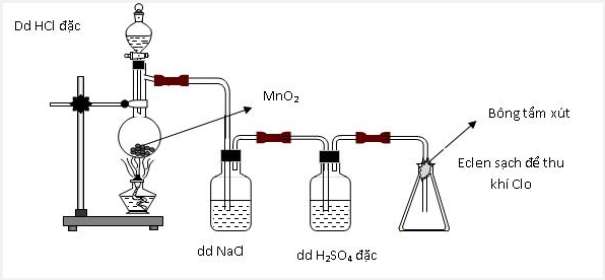
Cho các nhận định sau:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
Số nhận định chính xác là:
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Thể tích khí clo (đktc) và khối lượng natri cần dung để điều chế 4,68 gam NaCl, hiệu suất phản ứng 80% là (cho Na = 23 ; Cl = 35,5)
-
A.
22,4 lit và 23 gam
-
B.
2,24 lit và 2,3 gam
-
C.
11,2 lit và 2,3 gam
-
D.
1,12 lít và 2,3 gam
Dẫn 2 luồng khí clo đi qua 2 dung dịch KOH: dung dịch thứ nhất loãng và nguội, dung dịch thứ 2 đậm đặc và đun nóng ở 1000 C. Nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỷ lệ thể tích khí clo đi qua dung dịch KOH thứ nhất và dung dịch thứ 2 là:
-
A.
5/3.
-
B.
3/5.
-
C.
3/1.
-
D.
1/3.
Cho m gam hỗn hợp X gồm Fe và FeO tác dụng với dung dịch HCl dư, thu được 0,3 mol khí H2. Nếu cho m gam hỗn hợp X trên tác dụng với axit H2SO4 đặc, dư, đun nóng, thu được 11,2 lít khí SO2 (đktc). Biết các phản ứng xảy ra hoàn toàn, SO2 là sản phẩm khử duy nhất của S+6. Giá trị của m và khối lượng axit H2SO4 đã phản ứng lần lượt là
-
A.
54 và 58,8 gam.
-
B.
24 và 107,8 gam.
-
C.
24 và 58,8 gam.
-
D.
54 và 107,8 gam.
Hỗn hợp O2 và O3 có tỉ khối đồi với H2 bằng 20. Phần trăm số mol O2 và O3 lần lượt là (cho biết H = 1; O = 16)
-
A.
40 và 60
-
B.
75 và 25
-
C.
60 và 40
-
D.
50 và 50
Đốt cháy hoàn toàn 12,8g lưu huỳnh thu được khí A. Lượng khí A được hấp thu hết bởi 88,8 gam dung dịch Ca(OH)2 25%. Tìm C% của các chất trong dung dịch thu được sau phản ứng.
-
A.
CaSO3: 26,55% và Ca(HSO3)2: 22,35%.
-
B.
Ca(HSO3)2: 22,35%
-
C.
CaSO3: 22,35% và Ca(HSO3)2: 26,55%.
-
D.
Ca(HSO3)2: 26,55%
Dẫn 2,24 lít (đktc) khí hiđrosunfua vào 250 ml dung dịch NaOH 1M. Tính khối lượng các chất trong dung dịch sau phản ứng.
-
A.
Na2S: 7,8 gam
-
B.
Na2S: 7,8 gam và NaHS: 2 gam
-
C.
Na2S: 2 gam và NaOH: 7,8 gam
-
D.
Na2S: 7,8 gam và NaOH: 2 gam
Lời giải và đáp án
Khi sục Cl2 vào nước thu được nước clo có màu vàng nhạt. Trong nước clo có chứa các chất
-
A.
Cl2, H2O.
-
B.
HCl, HClO.
-
C.
HCl, HClO, H2O.
-
D.
Cl2, HCl, HClO, H2O.
Đáp án : D
Cl2 có phản ứng thuận nghịch với nước:
H2O + Cl2 $\overset {} \leftrightarrows $ HCl + HClO (axit clohiđric và axit hipoclorơ)
Ngoài ra clo tan trong nước theo kiểu vật lí
=> trong nước clo có chứa Cl2, HCl, HClO, H2O.
Cho 21,8 gam hỗn hợp X gồm Al, Fe và Zn đốt trong khí clo dư thu được 57,3 gam hỗn hợp muối Y. Cho Y vào dung dịch AgNO3 dư thu được kết tủa có khối lượng là
-
A.
114,8 gam.
-
B.
129,15 gam.
-
C.
143,5 gam.
-
D.
157,85 gam.
Đáp án : C
+) Bảo toàn khối lượng: mkim loại + mCl2 = mmuối Y
+) Bảo toàn nguyên tố Cl: nAgCl = ngốc Cl trong Y = 2.nCl2
+) Bảo toàn khối lượng: mkim loại + mCl2 = mmuối Y => mCl2 = 57,3 – 21,8 = 35,5 gam
=> nCl2 = 0,5 mol
+) Bảo toàn nguyên tố Cl: nAgCl = ngốc Cl trong Y = 2.nCl2 = 1 mol
=> mAgCl = 143,5 gam
Trong các phản ứng hóa học, axit HCl có thể đóng vai trò là
-
A.
chất khử
-
B.
chất oxi hóa.
-
C.
chất trao đổi.
-
D.
chất khử, chất oxi hóa hoặc trao đổi.
Đáp án : D
Trong các phản ứng hóa học, axit HCl có thể đóng vai trò là chất khử, chất oxi hóa hoặc trao đổi.
Cho 1,03 gam muối natri halogenua A tác dụng với dung dịch AgNO3 dư thu được một kết tủa. Kết tủa này sau khi bị phân hủy hoàn toàn cho 1,08 gam Ag. Muối A là
-
A.
NaF
-
B.
NaCl
-
C.
NaBr
-
D.
NaI
Đáp án : C
+) Phương trình phản ứng:
NaX + AgNO3 → AgX + NaNO3
2AgX → 2Ag + X2
+) nNaX = nAgX = nAg
Gọi công thức muối là NaX
Phương trình phản ứng: NaX + AgNO3 → AgX + NaNO3
2AgX → 2Ag + X2
nAg = 0,01 mol => nNaX = nAgX = nAg = 0,01 mol
MNaX = 1,03 / 0,01 = 103
=> MX = 103 – 23 = 80 => X là Br
Công thức muối A là NaBr
Đun nóng một hỗn hợp gồm 6,4 gam bột lưu huỳnh và 15 gam bột kẽm trong môi trường kín không có không khí. Chất nào còn dư sau phản ứng và có khối lượng là bao nhiêu?
-
A.
Zn; 2g
-
B.
Zn; 8,45g
-
C.
S; 2g
-
D.
S; 3,2g
Đáp án : A
+) Tính số mol Zn và S => xác định chất hết, chất dư
+) Tính số mol phản ứng theo chất hết => khối lượng dư
nS = 0,2 mol; nZn = $\frac{3}{13}$ mol
Zn + S $\xrightarrow{{{t^o}}}$ ZnS
Vì nS < nZn => S phản ứng hết và Zn còn dư
nZn phản ứng = nS = 0,2 mol => mZn dư = 15 – 0,2.65 = 2 gam
Trong công nghiệp, từ khí SO2 và oxi, phản ứng hóa học tạo thành SO3 xảy ra ở điều kiện nào sau đây?
-
A.
Nhiệt độ phòng.
-
B.
Đun nóng đến 500oC.
-
C.
Đun nóng đến 500oC và có mặt xúc tác V2O5.
-
D.
Nhiệt độ phòng và có mặt chất xúc tác V2O5.
Đáp án : C
- Trong công nghiệp người ta sản xuất lưu huỳnh trioxit bằng cách oxi hóa lưu huỳnh đioxit
4FeS2 + 11O2 $\xrightarrow{{{t^o}}}$ 2Fe2O3 + 8SO2
2SO2 + O2 $\overset{{{V}_{2}}{{O}_{5}},{{t}^{o}}}{\leftrightarrows}$ 2SO3
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
-
A.
Mg
-
B.
Al
-
C.
Fe
-
D.
Cu
Đáp án : D
Dung dịch H2SO4 loãng tác dụng được với kim loại hoạt động (đứng trước H trong dãy điện hóa).
Mg, Al, Fe đứng trước H trong dãy điện hóa → A, B, C sai
Cu đứng sau H trong dãy điện hóa → D đúng
Từ 1,6 tấn quặng có chứa 60% FeS2, biết hiệu suất cả quá trình là 80%, người ta có thể sản xuất được lượng axit sunfuric là
-
A.
1558,0 kg.
-
B.
1254,4 kg.
-
C.
1548,0 kg.
-
D.
1568,0 kg.
Đáp án : B
FeS2 → 2SO2 → 2SO3 → 2H2SO4
120 196
1,6.60% → m tấn
+) H = 80% => mttế = mlí thuyết . 80%
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
120 196
1,6.60% = 0,96 tấn → 1,568 tấn
=> khối lượng axit sunfuric thực tế thu được = 1,568.80% = 1,2544 tấn = 1254,4 kg
Gây nổ hỗn hợp gồm 3 khí trong bình kín. Một khí được điều chế bằng cách cho HCl dư tác dụng với 307,68 gam Mg. Khí thứ 2 điều chế được khi phân hủy hoàn toàn 514,5 gam KClO3 có MnO2 xúc tác. Khí thứ 3 thu được do HCl dư tác dụng với 19,14 gam MnO2. Tính C% của chất trong dung dịch sau khi nổ.
-
A.
3,306%
-
B.
6,61%
-
C.
7,22%
-
D.
3,61%
Đáp án : B
+) Viết các PTPƯ tạo ra hỗn hợp khí nổ, tính số mol mỗi khí
+) Xác định chất tan trong dung dịch thu được
Mg + 2HCl → MgCl2 + H2
12,82 mol → 12,82 mol
2KClO3 → 2KCl + 3O2
4,2 mol → 6,3 mol
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
0,22 → 0,22 → 0,44
2H2 + O2 → 2H2O
12,6 ← 6,3 → 12,6
H2 + Cl2 → 2HCl
0,22 → 0,22 → 0,44
=> chất tan sau phản ứng nổ là HCl (0,44 mol)
mdd sau pứ = mH2O + mHCl = 12,6.18 + 0,44.36,5 = 242,86 gam
=> $C{{\%}_{HCl}}=\frac{0,44.36,5}{242,86}.100\%=6,61\%$
Hấp thụ 2,24 lít Cl2 (đktc) vào 250 ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch A. Cô cạn dung dịch A thu được m gam rắn khan. Giá trị của m là:
-
A.
13,3 gam.
-
B.
15,3 gam.
-
C.
5,85 gam.
-
D.
7,45 gam.
Đáp án : B
+) Viết PTHH, bài toán chất thừa thiếu
=> Các chất thu được sau phản ứng
=> Khối lượng
2NaOH + Cl2 -> NaCl + NaClO + H2O
0,2 mol <- 0,1 mol
Vậy sau phản ứng có : 0,1 mol NaCl ; 0,1 mol NaClO ; 0,05 mol NaOH
=> m = 15,3g
Tính oxi hóa của lưu huỳnh thể hiện qua phản ứng nào sau đây
-
A.
Tác dụng với kim loại
-
B.
Tác dụng với hidro
-
C.
Tác dụng với phi kim
-
D.
Cả A và B đều đúng
Đáp án : D
S thể hiện tính oxi hóa thông qua các phản ứng với kim loại và hiđro
Hòa tan hoàn toàn 19,2 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 trong 50 ml dung dịch H2SO4 18M (đặc, dư, đun nóng), thu được dung dịch Y và V lít khí SO2 (đktc và là sản phẩm khử duy nhất). Cho 450 ml dung dịch NaOH 2M vào dung dịch Y thu được 21,4 gam kết tủa. Giá trị của V là
-
A.
5,60 lít.
-
B.
4,48 lít.
-
C.
6,72 lít.
-
D.
3,36 lít.
Đáp án : C
Quy đổi hỗn hợp ban đầu thành Fe và O
Sử dụng định luật bảo toàn nguyên tố và bảo toàn electron để tìm số mol Fe và O.
nH2SO4 = 0,05.18 = 0,9 mol; nFe(OH)3 = 21,4 : 107 = 0,2 mol
Quy đổi hỗn hợp ban đầu thành Fe (x mol) và O (y mol)
mX = 56x + 16y = 19,2 (1)
BTe: 3nFe = 2nO + 2nSO2 => 3x = 2y + 2nSO2 => nSO2 = 1,5x - y (mol)
BTNT "Fe": nFe2(SO4)3 = 0,5nFe = 0,5x (mol)
Khi cho NaOH phản ứng với dd Y:
- Nếu NaOH hết: nNaOH = nH+ + 3nFe3+ = 2.nHS2O4 dư + 3nFe(OH)3
=> 0,9 = 2.nH2SO4 dư + 3.0,2 => nH2SO4 dư = 0,15 mol => nH2SO4 pư = 0,9 - 0,15 = 0,75 mol
BTNT "S": nH2SO4 pư = 3nFe2(SO4)3 + nSO2 => 0,75 = 3.0,5x + 1,5x - y (2)
Giải hệ (1) và (2) được x = 0,3 và y = 0,15
=> nSO2 = 1,5x - y = 0,3 mol => V = 6,72 lít
- Nếu NaOH dư: HS tự xét
Chất nào sau đây khi cho tác dụng với H2SO4 đặc, nóng không có khí thoát ra?
-
A.
FeO.
-
B.
Fe(OH)2.
-
C.
Fe2O3.
-
D.
Fe3O4.
Đáp án : C
Chất nào chỉ xảy ra phản ứng trao đổi sẽ không có khí thoát ra
Fe2O3 + H2SO4 đặc, nóng chỉ xảy ra phản ứng trao đổi nên không có khí thoát ra
Fe2O3 + 3H2SO4 đặc, nóng → Fe2(SO4)3 + 3H2O
Phản ứng trong đó HCl thể hiện tính khử là
-
A.
HCl + NaOH → NaCl + H2O
-
B.
2HCl + Mg → MgCl2 + H2
-
C.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
-
D.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Đáp án : C
A, D: HCl đóng vai trò là chất trao đổi
B: HCl đóng vai trò chất oxi hóa \(2\mathop H\limits^{ + 1} + 2{\rm{e}} \to {\mathop H\limits^0 _2}\)
C:\({\rm{ }}\mathop {Cl}\limits^{ - 1} \to {\mathop {Cl}\limits^0 _2} + 2{\rm{e}}\) => HCl là chất khử
Chất nào có tính khử mạnh nhất ?
-
A.
HI
-
B.
HF
-
C.
HBr
-
D.
HCl
Đáp án : A
Xem lại lí thuyết hợp chất không có oxi của halogen
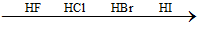
Tính axit tăng dần, tính khử tăng dần => Chất có tính khử mạnh nhất là HI
Oleum có công thức tổng quát là
-
A.
H2SO4.nSO2
-
B.
H2SO4.nH2O
-
C.
H2SO4.nSO3
-
D.
H2SO4 đặc
Đáp án : C
Xem lại lý thuyết sản xuất axit sunfuric
Oleum có công thức tổng quát là H2SO4.nSO3.
Nước Gia-ven và clorua vôi thường được dùng để
-
A.
sản xuất clo trong công nghiệp.
-
B.
tẩy trắng sợi, vải, giấy và tẩy uế.
-
C.
sản xuất HCl trong phòng thí nghiệm.
-
D.
sản xuất phân bón hóa học.
Đáp án : B
Xem lại lí thuyết hợp chất có oxi của clo
Nước Gia-ven và clorua vôi thường được dùng để tẩy trắng sợi, vải, giấy và tẩy uế.
Nung m gam hỗn hợp X gồm KClO3 và KMnO4 thu được chất rắn Y và O2. Biết KClO3 phân hủy hoàn toàn, còn KMnO4 chỉ bị phân hủy một phần. Trong Y có 0,894 gam KCl chiếm 8,132% về khối lương. Trộn lượng O2 ở trên với không khí theo tỷ lệ thể tích 1:3 trong một bình kín ta thu được hỗn hợp khí Z. Cho vào bình 0,528 gam cacbon rồi đốt cháy hết cacbon, phản ứng hoàn toàn, thu được hỗn hợp khí T gồm 3 khí O2, N2, CO2, trong đó CO2 chiếm 22,92% thể tích. Giá trị m là
-
A.
12,59
-
B.
12,530
-
C.
11,384
-
D.
12,91
Đáp án : B
C+ O2 →CO2
nC = nCO2 = 0,044 mol => nT
nZ = nT
VO2 : VKK= 1:3 => nO2
Tính mY
BTKL: mX = mY + mO2
C+ O2 →CO2
nC = nCO2 = 0,044 mol => nT = 0,044: 0,2292 = 0,192 mol
Ta thấy số mol O2 chuyển thành CO2 nên Vz = VT => nZ = nT = 0,192 mol
VO2 : VKK= 1:3 => nO2 = 0,192: 4 = 0,048 mol
mY = 0,894 : 0,08132 = 11 gam
mX = mY + mO2 = 11 + 0,048. 32 = 12,536 gam ≈ 12,530 gam
Cho phương trình phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Sau khi cân bằng với hệ số là các giá trị tối giản, hệ số của chất oxi hoá và chất khử là
-
A.
5 và 2.
-
B.
2 và 5.
-
C.
2 và 2.
-
D.
5 và 5.
Đáp án : B
cân bằng phương trình theo phương pháp thăng bằng e
S+4 → S+6 + 2e
Mn+7 + 5e → Mn+2
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Chất oxi hóa: KMnO4
Chất khử là SO2
Hệ số của chất oxi hoá và chất khử là 2 và 5
Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây?
-
A.
Oxi
-
B.
Lưu huỳnh
-
C.
Clo
-
D.
Flo
Đáp án : A
Xem lại lí thuyết phần II – khái quát về nhóm VIA
=> cấu hình e của anion X2- là 2s22p6 => Cấu hình electron của X là : 1s22s22p4
X là oxi
Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây ?
-
A.
oxi
-
B.
lưu huỳnh
-
C.
clo
-
D.
flo
Đáp án : A
Xem lại lí thuyết phần II – khái quát về nhóm VIA
=> cấu hình e của anion X2- là 2s22p6 => Cấu hình electron của X là : 1s22s22p4
X là oxi
Phát biểu nào sau đây sai ?
-
A.
khí oxi không màu, không mùi, nặng hơn không khí
-
B.
khí ozon màu xanh nhạt, có mùi đặc trưng
-
C.
ozon là một dạng thù hình của oxi, có tính oxi hóa mạnh hơn oxi
-
D.
ozon và oxi đều được dùng để khử trùng nước sinh hoạt
Đáp án : D
Xem lại tính chất hóa học của ozon và oxi
A, B, C đúng
D sai vì Chỉ có ozon dùng để khử trùng nước sinh hoạt
Cho sơ đồ sau:
\({S^{ - 2}} \to S \to {S^{ + 4}} \to {S^{ + 6}} \to {S^{ - 2}}\)
Vậy S-2, S+4 và S+6 có thể tương ứng với dãy các chất nào sau đây ?
-
A.
FeS2, SO2, H2SO4
-
B.
H2S, SO2, H2SO4
-
C.
H2S, SO2, SO3
-
D.
FeS, SO2 và Na2SO4
Đáp án : B
Xem lại tính chất hóa học của H2SO4 loãng
S-2, S+4 và S+6 có thể tương ứng với dãy các chất: H2S, SO2, H2SO4
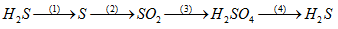
(1) 2H2S + SO2 → 3S +2 H2O
(2) S + O2 → SO2
(3) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
(4) 15H2SO4 đặc + 8Fe → 4Fe2(SO4)3 + 3H2S + 12H2O
Thực hiện thí nghiệm điều chế clo theo sơ đồ sau:

Cho các nhận định sau:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
Số nhận định chính xác là:
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
=> đúng
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
=> đúng
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
=> sai vì nước không giữ được khí clo vì nước phản ứng rất yếu với clo
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
=> đúng vì thuốc tím cũng là một chất oxi hóa mạnh tương tự như MnO2
Vậy có 3 phát biểu đúng.
Thể tích khí clo (đktc) và khối lượng natri cần dung để điều chế 4,68 gam NaCl, hiệu suất phản ứng 80% là (cho Na = 23 ; Cl = 35,5)
-
A.
22,4 lit và 23 gam
-
B.
2,24 lit và 2,3 gam
-
C.
11,2 lit và 2,3 gam
-
D.
1,12 lít và 2,3 gam
Đáp án : D
Đổi số mol NaCl
PTHH: 2Na + Cl2 \(\xrightarrow{{{t^0}}}\) 2NaCl
Tính số mol Na, Cl2 theo NaCl. Từ đó tính được khối lượng lí thuyết của Na, thể tích lí thuyết của Cl2
Vì %H = 80% và Na, Cl2 là chất tham gia pư nên áp dụng công thức: \(\% H = \frac{{luong\,li\,thuyet}}{{luong\,thuc\,te}}.100\% \)
Trong đó lượng lí thuyết là lượng tính theo PTHH.
\({n_{NaCl}} = \frac{{{m_{NaCl}}}}{{{M_{NaCl}}}} = \frac{{4,68}}{{58,5}} = 0,08\,(mol)\)
PTHH: 2Na + Cl2 \(\xrightarrow{{{t^0}}}\) 2NaCl
(mol) 0,08 0,04 ← 0,08
Theo PTHH: nNa = nNaCl = 0,08 (mol) → mNalí thuyết = 0,08.23 = 1,84 (g)
Theo PTHH: nCl2 = 1/2 nNaCl = 0,04 (mol) → VCl2 (đktc) lí thuyết = 0,04.22,4 = 0,896 (lít)
Vì %H = 80% nên khối lượng thực tế Na cần lấy là: \({m_{Na\,thuc\,te}} = \frac{{m{\,_{Na\,li\,thuyet}}}}{{\% H}}.100\% = \frac{{1,84}}{{80\% }}.100\% = 2,3\,(g)\)
Thể tích thực Cl2 cần lấy là: \(V{\,_{C{l_2}(dktc)\,thuc\,te}} = \frac{{V{\,_{C{l_2}(dktc)\,li\,thuyet}}}}{{\% H}}.100\% = \frac{{0,896}}{{80\% }}.100\% = 1,12\,(lit)\)
Dẫn 2 luồng khí clo đi qua 2 dung dịch KOH: dung dịch thứ nhất loãng và nguội, dung dịch thứ 2 đậm đặc và đun nóng ở 1000 C. Nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỷ lệ thể tích khí clo đi qua dung dịch KOH thứ nhất và dung dịch thứ 2 là:
-
A.
5/3.
-
B.
3/5.
-
C.
3/1.
-
D.
1/3.
Đáp án : A
PTHH khi qua dd KOH thứ nhất: Cl2 + 2KOH \(\xrightarrow{{}}\) KCl + KClO + H2O (1)
PTHH khi đi qua dd KOH thứ hai: 3Cl2 + 6KOH \(\xrightarrow{{{{100}^0}C}}\)5KCl + KClO3 + H2O (2)
Đặt \(\left\{ \begin{array}{l}{n_{Cl2\,(1)}}:a(mol)\\{n_{Cl2\,(2)}}:\,b(mol)\end{array} \right.\)
Sau đó đặt số mol muối KCl theo số mol Cl2 vào PTHH.
Lập phương trình khối lượng muối thu được ở 2 pư bằng nhau → từ đó ta ra được tỉ lệ a/b =?
PTHH khi qua dd KOH thứ nhất: Cl2 + 2KOH \(\xrightarrow{{}}\) KCl + KClO + H2O (1)
PTHH khi đi qua dd KOH thứ hai: 3Cl2 + 6KOH \(\xrightarrow{{{{100}^0}C}}\)5KCl + KClO3 + 3H2O (2)
Đặt \(\left\{ \begin{array}{l}{n_{Cl2\,(1)}}:a(mol)\\{n_{Cl2\,(2)}}:\,b(mol)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{n_{KCl(1)}} = a(mol)\\{n_{KCl(2)}} = \frac{5}{3}b(mol)\end{array} \right.\)
Theo bài khối lượng KCl sinh ra ở 2 PTHH bằng nhau 2 muối bằng nhau, tức số mol muối KCl ở 2 PTHH bằng nhau. \( \Rightarrow a = \frac{5}{3}b \Rightarrow \frac{a}{b} = \frac{5}{3}\)
Cho m gam hỗn hợp X gồm Fe và FeO tác dụng với dung dịch HCl dư, thu được 0,3 mol khí H2. Nếu cho m gam hỗn hợp X trên tác dụng với axit H2SO4 đặc, dư, đun nóng, thu được 11,2 lít khí SO2 (đktc). Biết các phản ứng xảy ra hoàn toàn, SO2 là sản phẩm khử duy nhất của S+6. Giá trị của m và khối lượng axit H2SO4 đã phản ứng lần lượt là
-
A.
54 và 58,8 gam.
-
B.
24 và 107,8 gam.
-
C.
24 và 58,8 gam.
-
D.
54 và 107,8 gam.
Đáp án : B
Sử dụng bảo toàn e
Đặt số mol Fe = a (mol); FeO = b (mol)
Cho hh X tác dụng với HCl dư chỉ có Fe tạo ra khí H2
BT e: 2nFe = 2nH2 ⟹ nFe = nH2 = 0,3 (mol) ⟹ a = 0,3 (mol)
Cho hh X tác dụng với H2SO4 đặc, nóng dư cả Fe và FeO cùng tạo khí
nSO2(đktc) = 11,2/22,4 = 0,5 (mol)
quá trình nhường e
Fe0 → Fe+3 + 3e
Fe+2 (FeO) →Fe+3 + 1e
quá trình nhận e
S+6 + 2e → S+4 (SO2)
bảo toàn e ta có: ne nhường = ne nhận
⟹ 3nFe + nFeO = 2nSO2
⟹ 3a + b = 2.0,5
Thay a = 0,3 vào ⟹ 3.0,3 + b = 2.0,5 ⟹ b = 0,1 (mol)
Vậy hh X gồm: Fe: 0,3 (mol) và FeO: 0,1 (mol)
⟹ m = mFe + mFeO = 0,3.56 + 0,1.72 = 24 (g)
BTNT “Fe”: nFe2(SO4)3 = 1/2(nFe + nFeO) = 1/2.(0,3 + 0,1) = 0,2 (mol)
nH2SO4 pư = nSO42-(muối) + nSO2 = 3.0,2 + 0,5 = 1,1 (mol) ⟹ mH2SO4 = 1,1.98 = 107,8 (g)
Hỗn hợp O2 và O3 có tỉ khối đồi với H2 bằng 20. Phần trăm số mol O2 và O3 lần lượt là (cho biết H = 1; O = 16)
-
A.
40 và 60
-
B.
75 và 25
-
C.
60 và 40
-
D.
50 và 50
Đáp án : D
Sử dụng phương pháp đường chéo hoặc công thức trung bình.
Mhh = 20. MH2 = 20.2 = 40 (g/mol)
Đặt số mol O2 = a(mol) ; số mol O3 = b (mol)
Áp dụng công thức tính phân tử khối trung bình ta có:
\(\begin{array}{l}{M_{hh}} = \frac{{{n_{{O_2}}}.{M_{{O_2}}} + {n_{{O_2}}}.{M_{{O_3}}}}}{{{n_{{O_2}}} + {n_{{O_3}}}}}\\ \Rightarrow 40 = \frac{{32a + 48b}}{{a + b}}\\ \Rightarrow 40a + 40b = 32a + 48b\\ \Rightarrow 8a = 8b\\ \Rightarrow a = b\end{array}\)
Vậy trong hh có nO2 = nO3 → Phần trăm số mol O2 = O3 = 50%
Đốt cháy hoàn toàn 12,8g lưu huỳnh thu được khí A. Lượng khí A được hấp thu hết bởi 88,8 gam dung dịch Ca(OH)2 25%. Tìm C% của các chất trong dung dịch thu được sau phản ứng.
-
A.
CaSO3: 26,55% và Ca(HSO3)2: 22,35%.
-
B.
Ca(HSO3)2: 22,35%
-
C.
CaSO3: 22,35% và Ca(HSO3)2: 26,55%.
-
D.
Ca(HSO3)2: 26,55%
Đáp án : B
- S cháy trong O2 tạo thành SO2, tính số mol của SO2 theo S.
- Lập tỉ lệ \(T = \frac{{{n_{S{O_2}}}}}{{{n_{Ca{{(OH)}_2}}}}}\)để xác định loại muối tạo thành.
- Dựa vào dữ kiện tính số mol và khối lượng cách chất sau phản ứng.
- Tính \({m_{ddsau}} = {m_{S{O_3}}} + {m_{ddCa{{(OH)}_2}}} - {m_{CaS{O_3}}}\)
\(\begin{array}{l}{n_S} = \frac{{12,8}}{{32}} = 0,4(mol)\\{m_{Ca{{(OH)}_2}}} = \frac{{88,8 \times 25\% }}{{100\% }} = 22,2\,(g) \Rightarrow {n_{Ca{{(OH)}_2}}} = \frac{{22,2}}{{74}} = 0,3\,(mol)\end{array}\)
S + O2 → SO2
(mol) 0,4 → 0,4
\({m_{Ca{{(OH)}_2}}} = \frac{{88,8.25}}{{100}} = 22,2(g)\)
\(1 < T = \frac{{{n_{S{O_2}}}}}{{{n_{Ca{{(OH)}_2}}}}} = \frac{{0,4}}{{0,3}} < 2\), phản ứng tạo thành hai muối
Đặt số mol của CaSO3 và Ca(HSO3)2 lần lượt là x và y
Ta có
\(\left\{ \begin{array}{l}x + y = 0,3\\x + 2y = 0,4\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,2\\y = 0,1\end{array} \right.\)
\({m_{CaS{O_3}}} = 0,2.120 = 24(g)\)
mdd sau= 0,4.64 + 88,8 – 24 = 90,4(g)
\(C{\% _{Ca{{(HS{O_3})}_2}}} = \frac{{0,1.202}}{{90,4}}.100\% = 22,35\% \)
Dẫn 2,24 lít (đktc) khí hiđrosunfua vào 250 ml dung dịch NaOH 1M. Tính khối lượng các chất trong dung dịch sau phản ứng.
-
A.
Na2S: 7,8 gam
-
B.
Na2S: 7,8 gam và NaHS: 2 gam
-
C.
Na2S: 2 gam và NaOH: 7,8 gam
-
D.
Na2S: 7,8 gam và NaOH: 2 gam
Đáp án : D
- Lập tỉ lệ \(T = \frac{{{n_{NaOH}}}}{{{n_{{H_2}S}}}}\)để xác định loại muối tạo thành.
- Dựa vào dữ kiện bài toán để xác định số mol và khối lương các chất trong dung dịch lúc sau.
\(\begin{array}{l}{n_{{H_2}S}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\\{n_{NaOH}} = {V_{NaOH \times }}{C_M} = 0,25 \times 1 = 0,25(mol)\end{array}\)
Xét tỉ lệ ta có
\(T = \frac{{{n_{NaOH}}}}{{{n_{{H_2}S}}}} = \frac{{0,25}}{{0,1}} = 2,5 > 2\), phản ứng tạo thành Na2S và NaOH dư. Mọi tính toán theo H2S
H2S + 2NaOH → Na2S + 2H2O
(mol) 0,1 → 0,2 → 0,1
Ta có: \({m_{NaOHdu}} = (0,25 - 0,2).40 = 2(g);{m_{N{a_2}S}} = 0,1.78 = 7,8(g)\)
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 1 tiết Hóa 10 chương 1: Nguyên tử - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 2










Danh sách bình luận