Đề kiểm tra 15 phút Hóa 10 chương 3: Liên kết hóa học - Đề số 1
Đề bài
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
-
A.
nhường đi 3e.
-
B.
nhận vào 5e.
-
C.
nhường đi 1e.
-
D.
nhận vào 7e.
Cho độ âm điện Ca (1,00), Cl (3,16). Liên kết trong phân tử CaCl2 thuộc loại
-
A.
liên kết cộng hóa trị có cực.
-
B.
liên kết ion.
-
C.
liên kết cho – nhận.
-
D.
liên kết cộng hóa trị không phân cực
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10e là:
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
Nhận định nào sau đây là đúng về điện hoá trị:
-
A.
Trong hợp chất ion, hoá trị của một nguyên tố bằng tích của điện tích và chỉ số của ion đó.
-
B.
Trong hợp chất ion, hoá trị của một nguyên tố bằng điện tích của ion đó.
-
C.
Điện hoá trị luôn là số dương và được viết số trước dấu sau.
-
D.
Điện hoá trị luôn là số âm và được viết số trước dấu sau.
Số oxi hóa của N, O, S, Cl, Br, Cr, Mn trong các chất và ion: NH4+, CH3COOH, SO42–, Cl2, KBrO3, K2Cr2O7, K2MnO4 lần lượt là:
-
A.
+3, –2, +4, 0, +5, +6, +7.
-
B.
–3, 0, +6, 0, +3, +7, +7.
-
C.
–3, –2, +6, 0, +5, +6, +6.
-
D.
–3, –2, +4, 0, +7, +6, +6.
Cho dãy các chất : N2, H2, NH3, CO2, HCl, H2O, C2H4. Số chất mà phân tử chỉ chứa liên kết đơn là :
-
A.
4
-
B.
3
-
C.
1
-
D.
2
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
-
A.
liên kết cộng hóa trị.
-
B.
liên kết ion.
-
C.
liên kết hidro.
-
D.
liên kết kim loại.
Ion nào là ion đơn nguyên tử?
-
A.
NH4+
-
B.
NO3-
-
C.
Cl-
-
D.
OH-
Liên kết ion là liên kết được hình thành bởi
-
A.
lực hút tĩnh điện giữa các ion trái dấu.
-
B.
các electron độc thân.
-
C.
các electron dùng chung.
-
D.
các electron tự do.
Cộng hoá trị của 1 nguyên tố là:
-
A.
Số e tham gia liên kết của nguyên tử của nguyên tố đó.
-
B.
Số thứ tự nhóm của nguyên tử.
-
C.
Hoá trị cao nhất của nguyên tố.
-
D.
Số liên kết của nguyên tử nguyên tố đó trong phân tử.
Lời giải và đáp án
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
-
A.
nhường đi 3e.
-
B.
nhận vào 5e.
-
C.
nhường đi 1e.
-
D.
nhận vào 7e.
Đáp án : A
Cấu hình e của Al: 1s22s22p63s23p1
=> nguyên tử Al cần cho 3e để đạt cấu hình bền vững của Ne (1s22s22p6)
Cho độ âm điện Ca (1,00), Cl (3,16). Liên kết trong phân tử CaCl2 thuộc loại
-
A.
liên kết cộng hóa trị có cực.
-
B.
liên kết ion.
-
C.
liên kết cho – nhận.
-
D.
liên kết cộng hóa trị không phân cực
Đáp án : B
∆x = 3,16 – 1 = 2,16 > 1,7 => liên kết ion
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10e là:
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
Đáp án : C
+) Xác định số e trong từng nguyên tố, sau đó xác định số e của ion
+) Số e của ion dương = số e nguyên tử - số đơn vị điện tích
+) Số e của ion âm = số e nguyên tử + số đơn vị điện tích
Na có Z = 11 => số e = 11 => ion Na+ có số e = 11 – 1 = 10
Mg có Z = 12 => số e = 12 => ion Mg2+ có số e = 12 – 2 = 10
Al có Z = 13 => số e = 13 => ion Al3+ có số e = 13 – 3 = 10
Ca có Z = 20 => số e = 20 => ion Ca2+ có số e = 20 – 2 = 18
S có Z = 16 => số e = 16 => ion S2- có số e = 16 + 2 = 18
Cl có Z = 17 => số e = 17 => ion Cl- có số e = 17 + 1 = 18
O có Z = 8 => số e = 8 => ion O2- có số e = 8 + 2 = 10
Vậy có 4 ion có 10e
Nhận định nào sau đây là đúng về điện hoá trị:
-
A.
Trong hợp chất ion, hoá trị của một nguyên tố bằng tích của điện tích và chỉ số của ion đó.
-
B.
Trong hợp chất ion, hoá trị của một nguyên tố bằng điện tích của ion đó.
-
C.
Điện hoá trị luôn là số dương và được viết số trước dấu sau.
-
D.
Điện hoá trị luôn là số âm và được viết số trước dấu sau.
Đáp án : B
Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
=> Nhận định đúng về điện hóa trị là: B
Số oxi hóa của N, O, S, Cl, Br, Cr, Mn trong các chất và ion: NH4+, CH3COOH, SO42–, Cl2, KBrO3, K2Cr2O7, K2MnO4 lần lượt là:
-
A.
+3, –2, +4, 0, +5, +6, +7.
-
B.
–3, 0, +6, 0, +3, +7, +7.
-
C.
–3, –2, +6, 0, +5, +6, +6.
-
D.
–3, –2, +4, 0, +7, +6, +6.
Đáp án : C
\(\overset{-3}{\mathop{N}}\,{{\overset{+1}{\mathop{H}}\,}_{4}}^{+},\text{ }{{\text{C}}_{2}}{{\overset{{}}{\mathop{H}}\,}_{4}}{{\overset{-2}{\mathop{O}}\,}_{2}},\text{ }\overset{+6}{\mathop{S}}\,{{\overset{-2}{\mathop{O}}\,}_{4}}^{2-},\text{ }{{\overset{0}{\mathop{Cl}}\,}_{2}},\text{ }\overset{+1}{\mathop{K}}\,\overset{+5}{\mathop{Br}}\,{{\overset{-2}{\mathop{O}}\,}_{3}},\text{ }{{\overset{+1}{\mathop{K}}\,}_{2}}{{\overset{+6}{\mathop{Cr}}\,}_{2}}{{\overset{-2}{\mathop{O}}\,}_{7}},\text{ }{{\overset{+1}{\mathop{K}}\,}_{2}}\overset{+6}{\mathop{Mn}}\,{{\overset{-2}{\mathop{O}}\,}_{4}}\)
=> Số oxi hóa của N, O, S, Cl, Br, Cr, Mn lần lượt là: -3 ; -2; +6 ; 0 ; +5; +6 ; +6
Cho dãy các chất : N2, H2, NH3, CO2, HCl, H2O, C2H4. Số chất mà phân tử chỉ chứa liên kết đơn là :
-
A.
4
-
B.
3
-
C.
1
-
D.
2
Đáp án : A
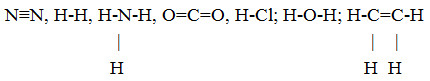
Các chất chỉ chứa liên kết đơn là: H2, NH3, HCl, H2O
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
-
A.
liên kết cộng hóa trị.
-
B.
liên kết ion.
-
C.
liên kết hidro.
-
D.
liên kết kim loại.
Đáp án : A
Liên kết cộng hóa trị được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Ion nào là ion đơn nguyên tử?
-
A.
NH4+
-
B.
NO3-
-
C.
Cl-
-
D.
OH-
Đáp án : C
Ion đơn nguyên tử là ion được cấu tạo từ 1 nguyên tử.
Cl- là ion đơn nguyên tử.
Liên kết ion là liên kết được hình thành bởi
-
A.
lực hút tĩnh điện giữa các ion trái dấu.
-
B.
các electron độc thân.
-
C.
các electron dùng chung.
-
D.
các electron tự do.
Đáp án : A
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Cộng hoá trị của 1 nguyên tố là:
-
A.
Số e tham gia liên kết của nguyên tử của nguyên tố đó.
-
B.
Số thứ tự nhóm của nguyên tử.
-
C.
Hoá trị cao nhất của nguyên tố.
-
D.
Số liên kết của nguyên tử nguyên tố đó trong phân tử.
Đáp án : D
Cộng hoá trị của 1 nguyên tố là số liên kết của nguyên tử nguyên tố đó trong phân tử.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 1 tiết Hóa 10 chương 1: Nguyên tử - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 2










Danh sách bình luận