Đề thi học kì 1 Hóa 10 - Đề số 3
Đề bài
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
-
A.
nhường đi 3e.
-
B.
nhận vào 5e.
-
C.
nhường đi 1e.
-
D.
nhận vào 7e.
Cho nguyên tố H (Z = 1) và nguyên tố S (Z = 16). Hợp chất tạo thành từ 2 nguyên tố là
-
A.
HS
-
B.
HS2.
-
C.
H2S.
-
D.
H2S3
Chỉ ra nội dung sai :
-
A.
Số oxi hoá của nguyên tố trong các hợp chất bằng hoá trị của nguyên tố đó.
-
B.
Trong một phân tử, tổng số oxi hoá của các nguyên tố bằng không.
-
C.
Số oxi hoá của ion đơn nguyên tử bằng điện tích của ion đó.
-
D.
Tổng số oxi hoá của các nguyên tố trong ion đa nguyên tử bằng điện tích của ion đó.
Một đơn vị khối lượng nguyên tử (u) được định nghĩa là?
-
A.
Khối lượng của 1 mol nguyên tử đồng vị cacbon 12.
-
B.
Khối lượng của 1 nguyên tử đồng vị cacbon 12.
-
C.
1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12.
-
D.
1/12 khối lượng của 1 nguyên tử cacbon.
Ion X có 18 electron và 16 proton, mang điện tích là
-
A.
18+
-
B.
2-
-
C.
18-
-
D.
2+
Nguyên tố ở chu kỳ 5, nhóm VIA có cấu hình electron hóa trị là
-
A.
4s24p4.
-
B.
4s24p5.
-
C.
5s25p5.
-
D.
5s25p4.
Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
-
A.
tăng theo chiều tăng của điện tích hạt nhân.
-
B.
giảm theo chiều tăng của điện tích hạt nhân.
-
C.
tăng theo chiều tăng của tính kim loại.
-
D.
A và C đều đúng.
A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Cấu hình electron A là
-
A.
1s22s22p63s2
-
B.
1s22s22p63s23p64s2
-
C.
1s22s22p3
-
D.
1s22s22p63s23p63d54s2
Trong bảng hệ thống tuần hoàn, trong 1 phân nhóm chính (nhóm A) theo chiều tăng dần điện tích hạt nhân thì
-
A.
độ âm điện tăng dần.
-
B.
độ âm điện không thay đổi.
-
C.
độ âm điện giảm dần.
-
D.
độ âm điện tăng lên xong giảm xuống.
Điện hoá trị của canxi (Ca) trong CaCl2 là:
-
A.
+1.
-
B.
+2.
-
C.
-1.
-
D.
-2.
Tổng số hạt cơ bản trong nguyên tử của nguyên tố X là 40. X là nguyên tố hóa học nào dưới đây?
-
A.
Na
-
B.
P
-
C.
Al
-
D.
Si
Hợp chất M được tạo thành từ cation X+ và anion Y3-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố phi kim tạo nên. Tổng số p trong X+ là 11, trong Y3- là 47. Hai nguyên tố trong Y3- thuộc 2 chu kì kế tiếp trong bảng tuần hoàn và cách nhau 7 đơn vị. Công thức hợp chất M là
-
A.
(NH4)2CrO4
-
B.
(CH4)2SO4
-
C.
(NH4)3PO4
-
D.
(NH4)2S2O3
Cho 16,3 gam hỗn hợp 2 kim loại thuộc nhóm IA và ở 2 chu kì kế tiếp vào nước dư thu được 5,6 lít H2 ở đktc và dung dịch X. Tên của 2 kim loại là:
-
A.
Li và Na
-
B.
Na và K
-
C.
K và Rb
-
D.
Li và K
Điều khẳng định nào sau đây là đúng ?
-
A.
Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
-
B.
Trong nguyên tử số hạt proton bằng số hạt electron.
-
C.
Số khối A bằng tổng số proton (Z) cộng tổng số electron (E).
-
D.
Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Điện tích hạt nhân của X là:
-
A.
11
-
B.
12
-
C.
13
-
D.
14
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
-
A.
Phân tử oxit cao nhất của R không có cực.
-
B.
Oxit cao nhất của R ở điều kiện thường là chất rắn.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3.
-
D.
Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
Hợp chất trong phân tử có liên kết ion là:
-
A.
NH4Cl.
-
B.
NH3
-
C.
HCl
-
D.
H2O
Thực hiện các thí nghiệm sau
a. Nung nóng KNO3
b. Cho Fe(OH)2 vào dung dịch H2SO4 đặc nóng dư
c. Sục khí Cl2 vào dung dịch FeCl2
d. Cho dung dịch KHSO4 vào dung dịch FeCl2
e. Cho Si vào dung dịch NaOH
Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
-
A.
3
-
B.
2
-
C.
4
-
D.
5
Các nguyên tố xếp chu kỳ 6 có số lớp electron trong nguyên tử là:
-
A.
3
-
B.
5
-
C.
6
-
D.
7
Độ âm điện của một nguyên tử đặc trưng cho:
-
A.
Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
-
B.
Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
-
C.
Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
-
D.
Khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
Cho X có cấu hình e: [Ne]3s23p4. Hỏi X thuộc nguyên tố nào?
-
A.
s
-
B.
p
-
C.
d
-
D.
f
Hoá trị trong hợp chất ion được gọi là :
-
A.
số oxi hoá.
-
B.
cộng hoá trị.
-
C.
điện hoá trị.
-
D.
điện tích ion.
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
-
A.
liên kết cộng hóa trị.
-
B.
liên kết ion.
-
C.
liên kết hidro.
-
D.
liên kết kim loại.
Cho 2 nguyên tố: X (Z = 14), Y (Z =17). Phát biểu nào sau đây đúng?
-
A.
Tính phi kim: X > Y.
-
B.
X, Y thuộc hai chu kì khác nhau trong bảng tuần hoàn.
-
C.
Độ âm điện: X > Y.
-
D.
Bán kính nguyên tử: X > Y.
Trong anion X─ có tổng số hạt cơ bản là 53, số hạt mang điện chiếm 66,04%. Cấu hình electron của X─ là
-
A.
1s22s22p6.
-
B.
1s22s22p63s23p4.
-
C.
1s22s22p63s23p5.
-
D.
1s22s22p63s23p6.
Phản ứng nào sau đây là phản ứng oxi hóa-khử?
-
A.
2HgO → 2Hg + O2.
-
B.
CaCO3 → CaO + CO2.
-
C.
2Al(OH)3 → Al2O3 + 3H2O.
-
D.
2NaHCO3 → Na2CO3 + CO2 + H2O.
Cho các nguyên tố: X (Z= 11), Y (Z= 17). Liên kết hoá học giữa X và Y thuộc loại...
-
A.
liên kết kim loại.
-
B.
iên kết ion.
-
C.
liên kết cộng hoá trị có cực.
-
D.
liên kết cộng hoá trị không có cực.
Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hidro và công thức oxit cao nhất là
-
A.
RH2, RO
-
B.
RH3, R2O5
-
C.
RH5, R2O3
-
D.
RH4, RO2
Nội dung của mô hình hiện đại về sự chuyển động của electron trong nguyên tử là:
-
A.
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân không theo quỹ đạo xác định.
-
B.
Trong nguyên tử, các lectron chuyển động xung quanh hạt nhân theo những quỹ đạo tròn.
-
C.
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân theo những quỹ đạo hình bầu dục.
-
D.
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định nhưng quỹ đạo có hình dạng bất kì.
Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
-
A.
180.
-
B.
90
-
C.
45
-
D.
135
Vỏ nguyên tử là một thành phần của nguyên tử:
-
A.
không mang điện
-
B.
mang điện tích âm
-
C.
mang điện tích dương
-
D.
có thể mang điện hoặc không mang điện
Cho các nhận xét sau:
(1) Một nguyên tử có điện tích hạt nhân là +1,6a.10-19 culong thì số proton trong hạt nhân là a.
(2) Trong một nguyên tử thì số proton luôn bằng số nơtron.
(3) Khi bắn phá hạt nhân người ta tìm thấy một loại hạt có khối lượng gần bằng khối lượng của proton, hạt đó là electron.
(4) Trong nguyên tử bất kì thì điện tích của lớp vỏ luôn bằng điện tích của hạt nhân nhưng ngược dấu.
Số nhận xét đúng là:
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Trong anion XY32- có 30 proton. Trong nguyên tử X cũng như Y có số proton bằng số notron. X và Y là nguyên tố nào sau đây?
-
A.
C và O
-
B.
S và O
-
C.
Si và O
-
D.
C và S
Trong tự nhiên, clo (Cl) có hai đồng vị bền là 35Cl và 37Cl. Mỗi đồng vị đó lần lượt chiếm 75% và 25%. Nguyên tử khối trung bình của clo là:
-
A.
35.
-
B.
35,5.
-
C.
36.
-
D.
37
Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
-
A.
80%
-
B.
20%
-
C.
10,8%
-
D.
89,2%
Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình electron lớp ngoài cùng của Y là
-
A.
3s23p5
-
B.
2s22p4.
-
C.
3s23p4.
-
D.
3s23p3
Cấu hình electron của nguyên tố Na (Z = 11) là:
-
A.
1s22s22p63s1.
-
B.
1s22s22p7.
-
C.
1s22p63s23p1.
-
D.
1s21p62s22p1.
Hòa tan hoàn toàn m gam hỗn hợp gồm ba kim loại bằng dung dịch HNO3 thu được 1,12 lít hỗn hợp khí X (đktc) gồm NO2 và NO. Tỉ khối hơi của X so với hiđro bằng 18,2. Thể tích tối thiểu dung dịch HNO3 37,8% (d = 1,242 g/ml) cần dùng là
-
A.
20,18 ml.
-
B.
11,12 ml.
-
C.
21,47 ml.
-
D.
36,7 ml
Tính khối lượng tuyệt đối của một nguyên tử lưu huỳnh (gồm 16 proton, 16 notron, 16 electron)
-
A.
5,7735.10-26 kg.
-
B.
7,3573.10-26 kg.
-
C.
5,3573.10-26 kg.
-
D.
3,3573.10-26 kg.
Nói về cấu tạo lớp vỏ electron của nguyên tử, phát biểu nào sau đây sai?
-
A.
Lớp thứ hai chứa tối đa 8 electron.
-
B.
Phân lớp d chứa tối đa 5 electron.
-
C.
Phân lớp p chứa tối đa 6 electron.
-
D.
Lớp thứ ba chứa tối đa 18 electron.
Lời giải và đáp án
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
-
A.
nhường đi 3e.
-
B.
nhận vào 5e.
-
C.
nhường đi 1e.
-
D.
nhận vào 7e.
Đáp án : A
Cấu hình e của Al: 1s22s22p63s23p1
=> nguyên tử Al cần cho 3e để đạt cấu hình bền vững của Ne (1s22s22p6)
Cho nguyên tố H (Z = 1) và nguyên tố S (Z = 16). Hợp chất tạo thành từ 2 nguyên tố là
-
A.
HS
-
B.
HS2.
-
C.
H2S.
-
D.
H2S3
Đáp án : C
Bước 1: Xác định cấu hình electron các nguyên tử
Bước 2: Xác định số e thiếu để đạt cấu hình bền của khí hiếm => số e góp chung = số e thiếu
Bước 3: Xác định tỉ lệ các nguyên tố dựa vào e góp chung => CTPT
H: 1s1 => góp chung 1e
S: 1s22s22p63s23p4 => góp chung 2e
=> 1 nguyên tử S liên kết với 2 nguyên tử H tạo thành hợp chất H2S
Chỉ ra nội dung sai :
-
A.
Số oxi hoá của nguyên tố trong các hợp chất bằng hoá trị của nguyên tố đó.
-
B.
Trong một phân tử, tổng số oxi hoá của các nguyên tố bằng không.
-
C.
Số oxi hoá của ion đơn nguyên tử bằng điện tích của ion đó.
-
D.
Tổng số oxi hoá của các nguyên tố trong ion đa nguyên tử bằng điện tích của ion đó.
Đáp án : A
Câu sai là: Số oxi hoá của nguyên tố trong các hợp chất bằng hoá trị của nguyên tố đó.
Vì trong hợp chất HNO3, N có số oxi hóa +5 còn hóa trị là 4
Một đơn vị khối lượng nguyên tử (u) được định nghĩa là?
-
A.
Khối lượng của 1 mol nguyên tử đồng vị cacbon 12.
-
B.
Khối lượng của 1 nguyên tử đồng vị cacbon 12.
-
C.
1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12.
-
D.
1/12 khối lượng của 1 nguyên tử cacbon.
Đáp án : C
Xem lại lí thuyết nguyên tố hóa học – đồng vị
Một đơn vị khối lượng nguyên tử (u) được định nghĩa là: 1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12.
Ion X có 18 electron và 16 proton, mang điện tích là
-
A.
18+
-
B.
2-
-
C.
18-
-
D.
2+
Đáp án : B
+) số e trong nguyên tử = số p
=> điện tích ion = tổng số e - số e trong nguyên tử
Vì X có 16p => trong nguyên tử X có 16 e
Mà trong ion X có 18 e => ion nhiều hơn nguyên tử 2 e
=> mang điện tích 2-
Nguyên tố ở chu kỳ 5, nhóm VIA có cấu hình electron hóa trị là
-
A.
4s24p4.
-
B.
4s24p5.
-
C.
5s25p5.
-
D.
5s25p4.
Đáp án : D
+) Từ chu kì => số lớp electron
+) Từ số nhóm A => số electron lớp ngoài cùng
Nguyên tố ở chu kỳ 5 => số lớp electron là 5
Nguyên tố thuộc nhóm VIA => có 6e lớp ngoài cùng
=> cấu hình electron hóa trị là 5s25p4.
Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
-
A.
tăng theo chiều tăng của điện tích hạt nhân.
-
B.
giảm theo chiều tăng của điện tích hạt nhân.
-
C.
tăng theo chiều tăng của tính kim loại.
-
D.
A và C đều đúng.
Đáp án : D
Trong một nhóm A, bán kính nguyên tử của các nguyên tố: tăng theo chiều tăng của điện tích hạt nhân hay tăng theo chiều tăng của tính kim loại.
A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Cấu hình electron A là
-
A.
1s22s22p63s2
-
B.
1s22s22p63s23p64s2
-
C.
1s22s22p3
-
D.
1s22s22p63s23p63d54s2
Đáp án : A
+) 2 nguyên tố ở 2 chu kì liên tiếp => xét ở chu kì lớn (cách nhau 18e) và chu kì nhỏ (cách nhau 8e)
Trường hợp 1: ZB - ZA = 8
Trường hợp 2: ZB - ZA = 18
A và B là hai nguyên tố ở cùng một phân nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn nên số thứ tự của chúng hơn kém nhau 8 hoặc 18 đơn vị (đúng bằng số nguyên tố trong một chu kỳ).
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; ZB = 25.
Cấu hình electron:
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
Trong bảng hệ thống tuần hoàn, trong 1 phân nhóm chính (nhóm A) theo chiều tăng dần điện tích hạt nhân thì
-
A.
độ âm điện tăng dần.
-
B.
độ âm điện không thay đổi.
-
C.
độ âm điện giảm dần.
-
D.
độ âm điện tăng lên xong giảm xuống.
Đáp án : C
Trong bảng hệ thống tuần hoàn, trong 1 phân nhóm chính (nhóm A) theo chiều tăng dần điện tích hạt nhân thì độ âm điện giảm dần
Điện hoá trị của canxi (Ca) trong CaCl2 là:
-
A.
+1.
-
B.
+2.
-
C.
-1.
-
D.
-2.
Đáp án : B
CaCl2 là hợp chất ion, vì vậy điện hóa trị của Ca bằng điện tích của ion Ca2+
- Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
- CaCl2 là hợp chất ion, điện tích của canxi trong CaCl2 là +2 => điện hóa trị là +2
Tổng số hạt cơ bản trong nguyên tử của nguyên tố X là 40. X là nguyên tố hóa học nào dưới đây?
-
A.
Na
-
B.
P
-
C.
Al
-
D.
Si
Đáp án : C
Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p
Tổng hạt = p + e + n = 40 => n = 40 – 2p
Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p
=> p ≤ 40 – 2p ≤ 1,5p => 11,42 ≤ p ≤ 13,33
=> p = 12 hoặc p = 13
Với p = 12 => n = 16 => A = 28 (loại vì Si có A = 28 nhưng p = 14)
Với p = 13 => n = 14 => A = 27 (Al)
Hợp chất M được tạo thành từ cation X+ và anion Y3-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố phi kim tạo nên. Tổng số p trong X+ là 11, trong Y3- là 47. Hai nguyên tố trong Y3- thuộc 2 chu kì kế tiếp trong bảng tuần hoàn và cách nhau 7 đơn vị. Công thức hợp chất M là
-
A.
(NH4)2CrO4
-
B.
(CH4)2SO4
-
C.
(NH4)3PO4
-
D.
(NH4)2S2O3
Đáp án : C
Đặt A, B là hai nguyên tố tạo ra cation X+
+) Từ dữ kiện tổng số p trong X+ là 11, biện luận tìm A và B
Đặt D, E là hai nguyên tố tạo ra anion Y3-
+) Từ dữ kiện số p trong Y3- là 47 và 2 nguyên tố trong Y3- thuộc 2 chu kì kế tiếp trong bảng tuần hoàn và cách nhau 7 đơn vị => lập hpt tìm số p của D, E
Đặt A, B là hai nguyên tố tạo ra cation X+
+) X+ có dạng AB4+ => pA + 4.pB = 11
=> pA = 7 (N) và pB = 1 (H), thỏa mãn NH4+, loại nghiệm pA = 3 (Li) và pB = 2 (He) do Li là kim loại và He là khí hiếm
+) Tương tự A2B3+ => 2.pA + 3.pB = 11 => vô nghiệm
Đặt D, E là hai nguyên tố tạo ra anion Y3-
+) Y3- có dạng: DE43- => pD + 4.pE = 47
Theo đề: Hai nguyên tố trong Y3- thuộc 2 chu kì kế tiếp trong bảng tuần hoàn và cách nhau 7 đơn vị
=> pD + 7 = pE hoặc pD – 7 = pE
=> pD = 15 và pE = 8
=> Y3- là PO43-
+) Làm tương tự cho D2E33-, vô nghiệm
Vậy M là (NH4)3PO4
Cho 16,3 gam hỗn hợp 2 kim loại thuộc nhóm IA và ở 2 chu kì kế tiếp vào nước dư thu được 5,6 lít H2 ở đktc và dung dịch X. Tên của 2 kim loại là:
-
A.
Li và Na
-
B.
Na và K
-
C.
K và Rb
-
D.
Li và K
Đáp án : B
đặt công thức trung bình của 2 kim loại là \(\overline{M}\)thì \(\overline{2M}+2{{H}_{2}}O\to 2\overline{M}OH+{{H}_{2}}\)
Tính số mol trung bình rồi tính được M trung bình
đặt công thức trung bình của 2 kim loại là \(\overline{M}\)thì
\(\overline{2M}+2{{H}_{2}}O\to 2\overline{M}OH+{{H}_{2}}\)
Số mol khí H2 là 5,6 :22,4 =0,25 mol
Nên số mol của \(\overline{M}\) là 0,5 mol
Suy ra \(\overline{M}\)=16,3 : 0,5=32,6
Vậy 2 kim loại là Na va K
Điều khẳng định nào sau đây là đúng ?
-
A.
Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
-
B.
Trong nguyên tử số hạt proton bằng số hạt electron.
-
C.
Số khối A bằng tổng số proton (Z) cộng tổng số electron (E).
-
D.
Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Đáp án : B
Điều khẳng định đúng là: Trong nguyên tử số hạt proton bằng số hạt electron.
A sai vì: Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton và nơtron.
C sai vì A = Z + N
D sai vì nguyên tử có cấu trúc rỗng
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Điện tích hạt nhân của X là:
-
A.
11
-
B.
12
-
C.
13
-
D.
14
Đáp án : A
+) Tổng số hạt cơ bản = p + n + e
+) Số hạt mang điện = p + e ; số hạt không mang điện = n
+) p = e
X có : p + n + e = 2p + n = 34
Và : 2p – n = 10
=> p = 11 ; n = 12
Vậy điện tích hạt nhân = 11
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
-
A.
Phân tử oxit cao nhất của R không có cực.
-
B.
Oxit cao nhất của R ở điều kiện thường là chất rắn.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3.
-
D.
Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
Đáp án : A
Gọi công thức phân tử của R với H là RHx
=>Công thức oxit cao nhất tương ứng có dạng R2O8-x
+) Từ tỉ lệ a:b => tìm ra quan hệ giữa x và R.
Thử các giá trị x từ 4;5;6 tìm R
=> tìm R và x
Gọi công thức phân tử của R với H là RHx → oxit cao nhất tương ứng có dạng R2O8-x
Ta có: Phần trăm về khối lượng của R trong công thức với Hiđro và trong công thức oxit cao nhất là: $\begin{gathered}a = \dfrac{R}{{R + x}} \cdot 100\% \,\,;\,\,b = \dfrac{{2R}}{{2R + 16.(8 - x)}} \cdot 100\% \, \hfill \\\to \dfrac{a}{b} = \dfrac{{2R + 16.(8 - x)}}{{2(R + x)}} = \dfrac{{11}}{4} \Leftrightarrow 14R + 86x = 512 \to \left\{ \begin{gathered}x = 4 \hfill \\R = 12 \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→R là cacbon. Oxit cao nhất của C là CO2 : O = C = O (phân tử không phân cực).
→ A đúng
B sai do CO2 ở điều kiện thường là chất khí.
C sai do Cacbon thuộc chu kì 2.
D sai do Cacbon (ở trạng thái cơ bản): 6C: 1s22s22p2 → có 4 electron s và 2 electron p
Hợp chất trong phân tử có liên kết ion là:
-
A.
NH4Cl.
-
B.
NH3
-
C.
HCl
-
D.
H2O
Đáp án : A
Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
A đúng vì:
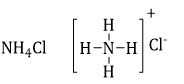
Phân tử NH4Cl chứa liên kết ion tạo thành do lực hút tĩnh điện giữa $NH_4^ + $ và $C{l^ - }$.
B, C, D sai vì liên kết trong phân tử NH3, HCl, H2O là liên kết cộng hóa trị.
Thực hiện các thí nghiệm sau
a. Nung nóng KNO3
b. Cho Fe(OH)2 vào dung dịch H2SO4 đặc nóng dư
c. Sục khí Cl2 vào dung dịch FeCl2
d. Cho dung dịch KHSO4 vào dung dịch FeCl2
e. Cho Si vào dung dịch NaOH
Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
-
A.
3
-
B.
2
-
C.
4
-
D.
5
Đáp án : C
Viết pthh
Phản ứng oxh khử là phản ứng mà chất tham gia thay đổi số oxh
(a) KNO3 KNO2 + ½ O2 → phản ứng oxh khử
(b) 2Fe(OH)2 + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 6H2O → phản ứng oxh khử
(c) Cl2 + 2FeCl2 → 2FeCl3 → phản ứng oxh khử
(d) KHSO4 + FeCl2 → không phản ứng
(e) Si + 2NaOH + H2O → Na2SiO3 + 2H2 → Phản ứng oxh khử
Số thí nghiệm xảy ra phản ứng oxi hóa khử là 4
Các nguyên tố xếp chu kỳ 6 có số lớp electron trong nguyên tử là:
-
A.
3
-
B.
5
-
C.
6
-
D.
7
Đáp án : C
Số thứ tự chu kì = số lớp electron
Những nguyên tố thuộc chu kì 6 có 6 lớp electron.
Độ âm điện của một nguyên tử đặc trưng cho:
-
A.
Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
-
B.
Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
-
C.
Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
-
D.
Khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
Đáp án : D
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
Cho X có cấu hình e: [Ne]3s23p4. Hỏi X thuộc nguyên tố nào?
-
A.
s
-
B.
p
-
C.
d
-
D.
f
Đáp án : B
Electron cuối cùng (theo phân mức năng lượng) được điền vào phân lớp nào thì nguyên tố thuộc họ đó.
Ta thấy e cuối cùng được điền vào phân lớp p nên X là nguyên tố p
Hoá trị trong hợp chất ion được gọi là :
-
A.
số oxi hoá.
-
B.
cộng hoá trị.
-
C.
điện hoá trị.
-
D.
điện tích ion.
Đáp án : C
Hóa trị trong hợp chất ion được gọi là điện hóa trị.
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
-
A.
liên kết cộng hóa trị.
-
B.
liên kết ion.
-
C.
liên kết hidro.
-
D.
liên kết kim loại.
Đáp án : A
Liên kết cộng hóa trị được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Cho 2 nguyên tố: X (Z = 14), Y (Z =17). Phát biểu nào sau đây đúng?
-
A.
Tính phi kim: X > Y.
-
B.
X, Y thuộc hai chu kì khác nhau trong bảng tuần hoàn.
-
C.
Độ âm điện: X > Y.
-
D.
Bán kính nguyên tử: X > Y.
Đáp án : D
- Xác định vị trí của X, Y trong BTH
- Dựa vào quy luật biến đổi tuần hoàn các tính chất của các nguyên tử các nguyên tố để chọn ra phát biểu đúng
+ Tính phi kim: Trong cùng một chu kì, khi đi từ trái sang phải thì tính phi kim tăng dần. Trong cùng một nhóm, khi đi từ trên xuống dưới thì tính phi kim giảm dần
+ Độ âm điện biến đổi cùng với tính phi kim
+ Bán kính: Trong cùng một chu kì, khi đi từ trái sang phải thì bán kính giảm dần. Trong cùng một nhóm, khi đi từ trên xuống dưới thì bán kính tăng dần
Cấu hình e của X và Y:
X (Z = 14): 1s22s22p63s23p2
Y (Z =17): 1s22s22p63s23p5

A. Sai vì tính phi kim X < Y
B. Sai vì X và Y thuộc cùng chu kì 3
C. Sai vì độ âm điện X < Y
D. Đúng
Trong anion X─ có tổng số hạt cơ bản là 53, số hạt mang điện chiếm 66,04%. Cấu hình electron của X─ là
-
A.
1s22s22p6.
-
B.
1s22s22p63s23p4.
-
C.
1s22s22p63s23p5.
-
D.
1s22s22p63s23p6.
Đáp án : D
Hạt p: Z
Hạt e: Z + 1
Hạt n: N
=> Tổng số hạt: 2Z + N + 1, số hạt mang điện: 2Z + 1
Dựa vào dữ kiện đề bài lập 2 phương trình 2 ẩn và giải
Hạt p: Z
Hạt e: Z + 1
Hạt n: N
=> Tổng số hạt: 2Z + N + 1, số hạt mang điện: 2Z + 1
- Trong anion X─ có tổng số hạt cơ bản là 53=> 2Z + N + 1 = 53 hay 2Z + N = 52 (1)
- Số hạt mang điện chiếm 66,04% => (2Z + 1)/(2Z + N + 1) = 0,6604 hay 0,6792Z – 0,6604N = -0,3396 (2)
Giải (1) và (2) thu được Z = 17 và N = 18
Cấu hình e của X là: 1s22s22p63s23p5
=> Cấu hình e của X-: 1s22s22p63s23p6
Phản ứng nào sau đây là phản ứng oxi hóa-khử?
-
A.
2HgO → 2Hg + O2.
-
B.
CaCO3 → CaO + CO2.
-
C.
2Al(OH)3 → Al2O3 + 3H2O.
-
D.
2NaHCO3 → Na2CO3 + CO2 + H2O.
Đáp án : A
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Chỉ có phản ứng 2HgO → 2Hg + O2 có sự thay đổi số oxi hóa
Cho các nguyên tố: X (Z= 11), Y (Z= 17). Liên kết hoá học giữa X và Y thuộc loại...
-
A.
liên kết kim loại.
-
B.
iên kết ion.
-
C.
liên kết cộng hoá trị có cực.
-
D.
liên kết cộng hoá trị không có cực.
Đáp án : B
Bước 1: Xác định tính kim loại, phi kim của X, Y
Viết cấu hình đầy đủ của X, Y. Từ cấu hình xác định vị trí của X, Y trong bảng tuần hoàn.
Bước 2: Xác định liên kết giữa X, Y
- Liên kết giữa kim loại điển hình và phi kim điển hình là liên kết ion
- Liên kết giữa 2 nguyên tử giống hệt nhau là liên kết cộng hóa trị không phân cực
- Liên kết giữa hai nguyên tố phi kim khác nhau thường thuộc liên kết CHT có cực.
Bước 1: Xác định tính kim loại, phi kim của X, Y
11X: 1s22s22p63s1 => X là kim loại điển hình (nhóm IA)
17Y: 1s22s22p63s23p5 => Y là phi kim điển hình (nhóm VIIA)
Bước 2: Xác định liên kết giữa X, Y
Như vậy liên kết giữa X và Y là liên kết ion
Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hidro và công thức oxit cao nhất là
-
A.
RH2, RO
-
B.
RH3, R2O5
-
C.
RH5, R2O3
-
D.
RH4, RO2
Đáp án : B
Tổng hóa trị của một nguyên tố trong oxit cao nhất và trong hợp chất khí với H bằng 8
R có cấu hình electron 1s22s22p3 => R có 5e ở lớp ngoài cùng => R ở nhóm VA
=> Oxit cao nhất: R2O5
=> Hợp chất khí với H: RH3
Nội dung của mô hình hiện đại về sự chuyển động của electron trong nguyên tử là:
-
A.
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân không theo quỹ đạo xác định.
-
B.
Trong nguyên tử, các lectron chuyển động xung quanh hạt nhân theo những quỹ đạo tròn.
-
C.
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân theo những quỹ đạo hình bầu dục.
-
D.
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định nhưng quỹ đạo có hình dạng bất kì.
Đáp án : A
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân không theo quỹ đạo xác định.
Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
-
A.
180.
-
B.
90
-
C.
45
-
D.
135
Đáp án : B
HS có thể giải theo cách viết PTHH hoặc theo phương pháp bảo toàn e.
Cách 1:
\(\begin{gathered}
Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \hfill \\
0,225\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,0,225\,\,\,\,\,\,\,\,\,\,\,\,\,(mol) \hfill \\
10FeS{O_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 5F{e_2}{(S{O_4})_3} + 2MnS{O_4} + {K_2}S{O_4} + 8{H_2}O \hfill \\
0,225\,\,\,\,\,\,\,\,\, \to 0,045(mol) \hfill \\
\end{gathered} \)
Cách 2:
\(Fe\xrightarrow{{{H_2}S{O_4}\,loang}}\mathop {Fe}\limits^{ + 2} \xrightarrow{{KMn{O_4}}}\mathop {Fe}\limits^{ + 3} \)
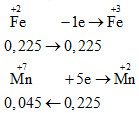
=> V dd KMnO4 = 0,045 : 0,5 = 0,09 lít = 90 ml
Vỏ nguyên tử là một thành phần của nguyên tử:
-
A.
không mang điện
-
B.
mang điện tích âm
-
C.
mang điện tích dương
-
D.
có thể mang điện hoặc không mang điện
Đáp án : B
Dựa vào cấu tạo vỏ nguyên tử để chọn đáp án đúng.
Vỏ nguyên tử được tạo thành từ các hạt electron. Do đó vỏ nguyên tử mang điện tích âm.
Cho các nhận xét sau:
(1) Một nguyên tử có điện tích hạt nhân là +1,6a.10-19 culong thì số proton trong hạt nhân là a.
(2) Trong một nguyên tử thì số proton luôn bằng số nơtron.
(3) Khi bắn phá hạt nhân người ta tìm thấy một loại hạt có khối lượng gần bằng khối lượng của proton, hạt đó là electron.
(4) Trong nguyên tử bất kì thì điện tích của lớp vỏ luôn bằng điện tích của hạt nhân nhưng ngược dấu.
Số nhận xét đúng là:
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Dựa vào đặc điểm về điện tích và khối lượng của các loại hạt proton, nơtron và electron để tìm nhận xét đúng.
+ 1 proton có điện tích là +1,6.10-19 C → Một nguyên tử có điện tích hạt nhân là +1,6.a.10-19 culong thì số proton trong hạt nhân là (1,6.a.10-19): (1,6.10-19) = a → Nhận xét (1) đúng.
+ Trong 1 nguyên tử thì số proton luôn bằng số electron → Nhận xét (2) sai.
+ Trong hạt nhân gồm proton và nơtron nên bắn phá hạt nhân sẽ không thấy hạt electron → Nhận xét (3) sai.
+ Trong 1 nguyên tử bất kì số p = số e, nếu điện tích của lớp vỏ mang điện tích âm (-Z) thì điện tích của hạt nhân là +Z → Nhận xét (4) đúng.
Vậy có 2 nhận xét đúng.
Trong anion XY32- có 30 proton. Trong nguyên tử X cũng như Y có số proton bằng số notron. X và Y là nguyên tố nào sau đây?
-
A.
C và O
-
B.
S và O
-
C.
Si và O
-
D.
C và S
Đáp án : A
Ta có: PX + 3.PY= 30.
Khi đó số proton trung bình bằng P = 30 : 4= 7,5
Do đó phải có 1 chất có số proton nhỏ hơn 7,5.
Xét các trường hợp để tìm PX và PY thích hợp.
Ta có: PX + 3.PY= 30.
Khi đó số proton trung bình bằng P = 30 : 4= 7,5
Do đó phải có 1 chất có số proton nhỏ hơn 7,5.
Thử các trường hợp ta được PX= 6 và PY= 8
Ta có PX= NX suy ra PX= NX= 6 → X là nguyên tố C
Ta có PY= NY suy ra PY= NY = 8 → Y là nguyên tố O
Trong tự nhiên, clo (Cl) có hai đồng vị bền là 35Cl và 37Cl. Mỗi đồng vị đó lần lượt chiếm 75% và 25%. Nguyên tử khối trung bình của clo là:
-
A.
35.
-
B.
35,5.
-
C.
36.
-
D.
37
Đáp án : B
Áp dụng công thức số khối trung bình
Xét 1 mol Clo thì có : 0,75 mol 35Cl và 0,25 mol 37Cl
=> Mtb(Cl) = 0,75.35 + 0,25.37 = 35,5g
=>B
Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
-
A.
80%
-
B.
20%
-
C.
10,8%
-
D.
89,2%
Đáp án : B
Áp dụng công thức tính số khối trung bình
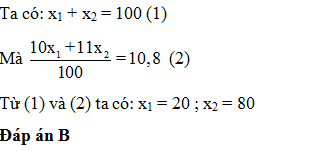
Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình electron lớp ngoài cùng của Y là
-
A.
3s23p5
-
B.
2s22p4.
-
C.
3s23p4.
-
D.
3s23p3
Đáp án : A
X có 7 electron p → viết được cấu hình e của X → pX = ?
Dựa vào dữ kiện bài toán suy ra pY = ?. Từ đó viết được cấu hình e của Y
X có 7 electron p → X: 1s22s22p63s23p1 → X có số p = 13
Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8 nên:
2py = 13.2 + 8 → py = 17
→ Y: 1s22s22p63s23p5
Cấu hình electron của nguyên tố Na (Z = 11) là:
-
A.
1s22s22p63s1.
-
B.
1s22s22p7.
-
C.
1s22p63s23p1.
-
D.
1s21p62s22p1.
Đáp án : A
- Quy ước cách viết cấu hình electron nguyên tử:
+ Số thứ tự lớp electron bằng các chữ số: 1, 2, 3
+ Phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f
+ Số electron trong phân lớp được ghi bằng chỉ số ở phía trên bên phải kí hiệu của phân lớp: s2, p6, d10…
- Cách viết cấu hình electron nguyên tử:
+ Xác định số electron của nguyên tử.
+ Các electron được phân bố theo thứ tự tăng dần các mức năng lượng AO, tuân theo các nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hun.
+ Viết cấu hình electron theo thứ tự các phân lớp trong 1 lớp và theo thứ tự của các lớp electron.
+ Lưu ý: các electron được phân bố vào các AO theo phân mức năng lượng tăng dần và có sự chèn mức năng lượng. Tuy nhiên, khi viết cấu hình electron, các phân mức năng lượng cần được sắp xếp lại theo từng lớp.
Đáp án A
Hòa tan hoàn toàn m gam hỗn hợp gồm ba kim loại bằng dung dịch HNO3 thu được 1,12 lít hỗn hợp khí X (đktc) gồm NO2 và NO. Tỉ khối hơi của X so với hiđro bằng 18,2. Thể tích tối thiểu dung dịch HNO3 37,8% (d = 1,242 g/ml) cần dùng là
-
A.
20,18 ml.
-
B.
11,12 ml.
-
C.
21,47 ml.
-
D.
36,7 ml
Đáp án : C
Gọi số mol của NO2 và NO là a, b
Lập hpt tìm a, b
Áp dụng công thức:
\(\begin{gathered}{n_{HN{O_3}}} = 2{n_{N{O_2}}} + 4{n_{NO}} \hfill \\C\% = \dfrac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100 \hfill \\d = \dfrac{{{m_{{\text{dd}}}}}}{{{v_{{\text{dd}}}}}} \hfill \\ \end{gathered} \)
Gọi số mol của NO2 và NO là a, b
Ta có: \(\left\{ \begin{gathered}a + b = 0,05 \hfill \\ \dfrac{{46a + 30b}}{{(a + b)}} = 18,2.\,\,2 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}a = 0,02 \hfill \\b = 0,03 \hfill \\ \end{gathered} \right.\)
nHNO3 = 2n NO2 + 4n NO = 0,16 mol
\({v_{{\text{dd}}}} = \dfrac{{{m_{HN{O_3}}}.100}}{{C\% .d}} = \dfrac{{0,16.\,\,63.\,\,100}}{{37,8.\,\,1,242}} = 21,47ml\)
Tính khối lượng tuyệt đối của một nguyên tử lưu huỳnh (gồm 16 proton, 16 notron, 16 electron)
-
A.
5,7735.10-26 kg.
-
B.
7,3573.10-26 kg.
-
C.
5,3573.10-26 kg.
-
D.
3,3573.10-26 kg.
Đáp án : C
mnguyên tử = Z.mp + N.mn + Z.me (với Z là số p = số e; N = số n và mp, mn, me lần lượt là khối lượng của 1 hạt p, n, e.
mtuyệt đối nguyên tử = Z.mp + N.mn + Z.me
= 16.1,6726.10-27 + 16.1,6748.10-27 + 16.9,1094.10-31
= 5,3573.10-26 kg
Nói về cấu tạo lớp vỏ electron của nguyên tử, phát biểu nào sau đây sai?
-
A.
Lớp thứ hai chứa tối đa 8 electron.
-
B.
Phân lớp d chứa tối đa 5 electron.
-
C.
Phân lớp p chứa tối đa 6 electron.
-
D.
Lớp thứ ba chứa tối đa 18 electron.
Đáp án : B
Dựa vào quy tắc số electron tối đa trong phân lớp và lớp electron:
+ Lớp thứ n có tối đa 2n2 electron.
+ Phân lớp s có tối đa 2 electron, phân lớp p có tối đa 6 electron, phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron.
Dựa vào quy tắc số electron tối đa trong phân lớp và lớp electron:
+ Lớp thứ n có tối đa 2n2 electron.
+ Phân lớp s có tối đa 2 electron, phân lớp p có tối đa 6 electron, phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron.
- Xét A: Lớp thứ hai có chứa tối đa 2.22 = 8 electron → Phát biểu A đúng.
- Xét B: Phân lớp p có tối đa 6 electron → Phát biểu C đúng.
- Xét C: Phân lớp d chứa tối đa 10 electron →Phát biểu B sai.
- Xét D: Lớp thứ ba có chứa tối đa 2.32 = 18 electron → Phát biểu D đúng.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 1 tiết Hóa 10 chương 1: Nguyên tử - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 2










Danh sách bình luận