Đề thi giữa kì 1 Hóa 10 - Đề số 4
Đề bài
Nguyên tố hóa học là tập hợp các nguyên tử có cùng:
-
A.
số khối
-
B.
điện tích hạt nhân
-
C.
số nơtron
-
D.
tổng số proton và notron
Số electron tối đa có thể phân bố trên lớp thứ 4 trong vỏ nguyên tử là
-
A.
16.
-
B.
18.
-
C.
32.
-
D.
50.
X là một nguyên tố p. Tổng số hạt trong nguyên tử của nguyên tố X là 40. Vị trí của X trong bảng tuần hoàn là
-
A.
Ô 12, chu kỳ 2, nhóm IIIA.
-
B.
Ô 13, chu kỳ 3, nhóm IIA.
-
C.
Ô 12, chu kỳ 3, nhóm IIA.
-
D.
Ô 13, chu kỳ 3, nhóm IIIA.
Công thức chung của các oxit kim loại nhóm IIA là
-
A.
R2O.
-
B.
RO2 .
-
C.
RO.
-
D.
R2O3
Phát biểu nào sau đây không đúng ?
Trong một chu kỳ, khi đi từ trái sang phải, qui luật biến thiên tuần hoàn như sau
-
A.
Hoá trị cao nhất đối với oxy tăng dần từ 1 → 8.
-
B.
Hoá trị đối với hiđro của phi kim giảm dần từ 4 → 1.
-
C.
Tính kim loại giảm dần, tính phi kim tăng dần.
-
D.
Oxit và hidroxit có tính bazơ giảm dần, tính axit tăng dần.
Nguyên tố R có hóa trị cao nhất trong oxit gấp 3 lần hóa trị trong hợp chất với hiđro. Trong hợp chất của R với hiđro có tỉ lệ khối lượng: $\frac{{{\text{m}}_{\text{R}}}}{{{\text{m}}_{\text{H}}}}\text{ }=\text{ }\frac{\text{16}}{\text{1}}$. Không dùng bảng tuần hoàn, cho biết kí hiệu của nguyên tử R.
-
A.
${}_{15}^{32}R$
-
B.
${}_{16}^{32}R$
-
C.
${}_{13}^{32}R$
-
D.
${}_{14}^{32}R$
Hòa tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kì liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro (đktc). X và Y là những nguyên tố hóa học nào sau đây ?
-
A.
Na và K.
-
B.
Li và Na.
-
C.
K và Rb.
-
D.
Rb và Cs.
Cho các nguyên tố: X (Z = 12), Y (Z = 8), R (Z = 19), T (Z = 15). Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là
-
A.
X, Y, R, T.
-
B.
Y, X, T, R.
-
C.
Y, T, X, R.
-
D.
R, T, X, Y.
Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. M là
-
A.
Cu
-
B.
Fe
-
C.
Al
-
D.
Cr
Phân tử M2X tạo thành từ M+ và X2-. Trong phân tử M2X có tổng số hạt cơ bản là 140 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của M+ lớn hơn số khối của X2- là 23. Tổng số hạt trong M+ nhiều hơn trong X2- là 31 hạt. Công thức hóa học của M2X là
-
A.
Na2O.
-
B.
K2S.
-
C.
Na2S.
-
D.
K2O.
Một nguyên tố X gồm 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % đồng vị thứ nhất gấp 3 lần % đồng vị thứ hai. Nguyên tử khối trung bình của X là:
-
A.
13,5
-
B.
13
-
C.
12,5
-
D.
14,5
Trong bảng tuần hoàn các nguyên tố , số chu kỳ nhỏ và số chu kỳ lớn là:
-
A.
4 và 4
-
B.
4 và 3
-
C.
3 và 4
-
D.
3 và 3
Các hạt tạo nên hạt nhân của hầu hết các nguyên tử là:
-
A.
Pronton và nơtron
-
B.
Nơtron, proton và electron
-
C.
Nơtron và electron
-
D.
Electron và proton
Oxit cao nhất của một nguyên tố R ứng với công thức RO2. Nguyên tố R đó là:
-
A.
Magie
-
B.
Cacbon
-
C.
Nitơ
-
D.
Photpho
Nguyên tử kali có 19 proton, 19 electron và 20 notron. Số khối của nguyên tử kali là
-
A.
20.
-
B.
19.
-
C.
38.
-
D.
39
Một cation Mn+ có cấu hình electron lớp ngoài cùng là 2p6. Hỏi lớp ngoài cùng của nguyên tử M có cấu hình electron nào sau đây
-
A.
3s1.
-
B.
3s2.
-
C.
3s23p1.
-
D.
A, B, C đều đúng.
Trong cùng một nhóm A, theo chiều điện tích hạt nhân tăng thì bán kính nguyên tử
-
A.
không đổi
-
B.
tăng dần
-
C.
giảm dần
-
D.
biến đổi không có qui luật
Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
-
A.
6
-
B.
8
-
C.
14
-
D.
16
Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 8. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 6. A và B là các nguyên tố:
-
A.
Al và Br
-
B.
Al và Cl
-
C.
Si và Cl
-
D.
Si và Ca
Nguyên tố X nằm ở chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây?
-
A.
nguyên tố f.
-
B.
nguyên tố s.
-
C.
nguyên tố p.
-
D.
nguyên tố d.
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
-
A.
Mg > S > Cl > F
-
B.
F > Cl > S > Mg
-
C.
S > Mg > Cl > F
-
D.
Cl > F > S > Mg
Vi hạt nào sau đây có số electron nhiều hơn số nơtron?
-
A.
Ion natri (\({}_{11}^{23}N{a^ + }\))
-
B.
Ion kali (\({}_{19}^{39}K^+\))
-
C.
Ion clorua (\({}_{17}^{35}C{l^ - }\))
-
D.
Ion sunfua (\({}_{16}^{32}S^{2-}\))
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p4. Số hiệu nguyên tử của X là?
-
A.
14
-
B.
32
-
C.
16
-
D.
8
X và Y là hai kim loại thuộc cùng một nhóm A trong bảng tuần hoàn các nguyên tố hóa học. Biết ZX<ZY và ZX + ZY = 24. Phát biểu nào sau đây là không đúng?
-
A.
X, Y đều có 2 electron ở phân lớp ngoài cùng.
-
B.
Bán kính nguyên tử của Y lớn hơn bán kính nguyên tử của X.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học thì X, Y đều thuộc nhóm IIA.
-
D.
Hidroxit tương ứng với oxit cao nhất của X, Y đều có tính bazo mạnh.
Nguyên tử R có cấu hình electron lớp ngoài cùng là ns2np3. Trong hợp chất khí với hidro thì hidro chiếm 17,647% về khối lượng. R là
-
A.
As.
-
B.
S.
-
C.
N.
-
D.
P.
Cho cấu hình electron nguyên tử của một số nguyên tố:
(a) 1s22s22p63s23p63d34s2
(b) 1s2
(c) 1s22s2
(d) 1s22s22p1
(e) 1s22s22p63s2
(f) 1s12s22p63s23p2
Có mấy cấu hình electron nguyên tử là của nguyên tố kim loại?
-
A.
1
-
B.
4
-
C.
2
-
D.
3
Nguyên tử nguyên tố X có tổng số các hạt p, n, e là 58, trong hạt nhân số hạt p và n hơn kém nhau 1 đơn vị. Số hiệu nguyên tử của X là:
-
A.
18
-
B.
19
-
C.
20
-
D.
21
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L. Số proton có trong nguyên tử X là:
-
A.
7
-
B.
6
-
C.
8
-
D.
5
Nguyên tử 13Al27 có:
-
A.
13p, 13e, 14n
-
B.
13p, 14e, 14n
-
C.
13p, 13e, 13n
-
D.
14p, 14e, 13n
Ở điều kiện thường crom có cấu trúc mạng lập phương tâm khối trong đó thể tích các nguyên tử chiếm 68% thể tích tinh thể. Khối lượng riêng của Cr là 7,2 g/cm3. Tính bán kính nguyên tử của crom (cho Cr = 52; coi nguyên tử Cr có dạng hình cầu).
-
A.
0,155 nm
-
B.
0,125 nm
-
C.
0,134 nm
-
D.
0,165 nm
Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
-
A.
80%
-
B.
20%
-
C.
10,8%
-
D.
89,2%
Cấu hình electron của nguyên tố Fe (Z = 26) là:
-
A.
1s22s22p63s23p63d64s2.
-
B.
1s22s22p63s23p63d8.
-
C.
1s22s22p63s23p64s24p6.
-
D.
1s22s22p63s23p63d54s24p1.
Điện tích hạt nhân của nguyên tử nguyên tố X là +8,4906.10-18 Culong. Tỉ số nơtron và số đơn vị điện tích hạt nhân của X bằng 1,3962. Số nơtron của X bằng 3,7 lần số nơtron của nguyên tử nguyên tố Y. Khi cho 4,29 gam Y tác dụng với lượng dư X thu được 18,26 gam sản phẩm có công thức XY. Số hạt proton có trong hạt nhân nguyên tử Y là?
-
A.
19
-
B.
20
-
C.
21
-
D.
22
Ion âm X2- có tổng số hạt là 26. Nguyên tử X có số khối là 16. Số hạt electron trong X2- là:
-
A.
6
-
B.
8
-
C.
16
-
D.
10
Ion dương M2+ có tổng số hạt là 91và tỉ lệ \(\frac{e}{n} = \frac{{27}}{{35}}\). Số electron trong M là:
-
A.
64
-
B.
35
-
C.
29
-
D.
27
Lời giải và đáp án
Nguyên tố hóa học là tập hợp các nguyên tử có cùng:
-
A.
số khối
-
B.
điện tích hạt nhân
-
C.
số nơtron
-
D.
tổng số proton và notron
Đáp án : B
Nguyên tố hóa học là tập hợp các nguyên tử có cùng điện tích hạt nhân.
Số electron tối đa có thể phân bố trên lớp thứ 4 trong vỏ nguyên tử là
-
A.
16.
-
B.
18.
-
C.
32.
-
D.
50.
Đáp án : C
Số electron tối đa có thể phân bố trên lớp thứ 4 = số e trên phân lớp s + số e trên phân lớp p + số e trên phân lớp d + số e trên phân lớp f = 2 + 6 + 10 + 14 = 32
X là một nguyên tố p. Tổng số hạt trong nguyên tử của nguyên tố X là 40. Vị trí của X trong bảng tuần hoàn là
-
A.
Ô 12, chu kỳ 2, nhóm IIIA.
-
B.
Ô 13, chu kỳ 3, nhóm IIA.
-
C.
Ô 12, chu kỳ 3, nhóm IIA.
-
D.
Ô 13, chu kỳ 3, nhóm IIIA.
Đáp án : D
+) Theo điều kiện bền của nguyên tử: Z ≤ N ≤ 1,52.Z => xét khoảng Z
=> xét các giá trị của Z thỏa mãn
Ta có: 2Z + N = 40 => N = 40 – 2Z
Theo điều kiện bền của nguyên tử: Z ≤ N ≤ 1,52.Z => Z ≤ 40 – 2Z ≤ 1,52.Z => 11,36 ≤ Z ≤ 13,33
=> Z = 12 hoặc Z = 13
+ Với Z = 12 => X có cấu hình e: 1s22s22p63s2 => loại vì X là nguyên tố p
+ Với Z = 13 => X có cấu hình e: 1s22s22p6s23p1 => X thuộc ô 13, chu kì 3, nhóm IIIA
Công thức chung của các oxit kim loại nhóm IIA là
-
A.
R2O.
-
B.
RO2 .
-
C.
RO.
-
D.
R2O3
Đáp án : C
Công thức chung của các oxit kim loại nhóm IIA là RO
Phát biểu nào sau đây không đúng ?
Trong một chu kỳ, khi đi từ trái sang phải, qui luật biến thiên tuần hoàn như sau
-
A.
Hoá trị cao nhất đối với oxy tăng dần từ 1 → 8.
-
B.
Hoá trị đối với hiđro của phi kim giảm dần từ 4 → 1.
-
C.
Tính kim loại giảm dần, tính phi kim tăng dần.
-
D.
Oxit và hidroxit có tính bazơ giảm dần, tính axit tăng dần.
Đáp án : A
Câu sai là: Hoá trị cao nhất đối với oxi tăng dần từ 1 → 8
=> Trong một chu kỳ, khi đi từ trái sang phải, hoá trị cao nhất đối với oxi tăng dần từ 1 → 7
Nguyên tố R có hóa trị cao nhất trong oxit gấp 3 lần hóa trị trong hợp chất với hiđro. Trong hợp chất của R với hiđro có tỉ lệ khối lượng: $\frac{{{\text{m}}_{\text{R}}}}{{{\text{m}}_{\text{H}}}}\text{ }=\text{ }\frac{\text{16}}{\text{1}}$. Không dùng bảng tuần hoàn, cho biết kí hiệu của nguyên tử R.
-
A.
${}_{15}^{32}R$
-
B.
${}_{16}^{32}R$
-
C.
${}_{13}^{32}R$
-
D.
${}_{14}^{32}R$
Đáp án : B
+) Gọi hóa trị cao nhất của R trong oxit là m, hóa trị trong hợp chất với hiđro là n.
+) tổng hóa trị m và n của các nguyên tố bằng 8 => PT (1)
Theo bài: m = 3n => Pt (2) => m và n
+) Viết công thức hợp chất R với hiđro => $\frac{{{M}_{R}}}{{{M}_{H}}}=\frac{16}{1}$
+) Từ điều kiện: P ≤ N ≤ 1,5P => khoảng giá trị của P, tìm P phù hợp
+) Gọi hóa trị cao nhất của R trong oxit là m, hóa trị trong hợp chất với hiđro là n. Ta có: m + n = 8.
Theo bài: m = 3n. Từ đây tìm được m = 6; n = 2.
+) Công thức hợp chất R với hiđro là H2R. Theo bài: $\frac{{{M}_{R}}}{{{M}_{H}}}=\frac{16}{1}$ nên R = 32.
+) Gọi tổng số hạt proton, nơtron của R là P, N. Ta có P + N = 32.
+) Ta có: P ≤ N ≤ 1,5P => P ≤ 32 – P ≤ 1,5P => 12,8 ≤ P ≤ 16
Mặt khác, R thuộc nhóm VI (hóa trị cao nhất trong oxit bằng VI) nên dựa vào cấu hình electron khi P = 13, 14, 15, 16 ta thấy P = 16 thỏa mãn.
Vậy kí hiệu của nguyên tử R là: ${}_{16}^{32}R$
Hòa tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kì liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro (đktc). X và Y là những nguyên tố hóa học nào sau đây ?
-
A.
Na và K.
-
B.
Li và Na.
-
C.
K và Rb.
-
D.
Rb và Cs.
Đáp án : B
+) Gọi kim loại trung bình là R
+) Vì 2 kim loại thuộc nhóm IA => có hóa trị I => Viết PTHH
+) \(n_R=2 n_{H_2}\)=> ${{M}_{R}}=\dfrac{m\text{ }}{n_{R}}$
+) Gọi kim loại trung bình là R
2R + 2H2O → 2ROH + H2
+) Theo phương trình: \(n_R=2 n_{H_2}\)= 2.0,01 = 0,02 mol
=> MR = 0,3 / 0,02 = 15
=> 2 kim loại kiềm cần tìm là Li và Na
Cho các nguyên tố: X (Z = 12), Y (Z = 8), R (Z = 19), T (Z = 15). Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là
-
A.
X, Y, R, T.
-
B.
Y, X, T, R.
-
C.
Y, T, X, R.
-
D.
R, T, X, Y.
Đáp án : C
Y (Z = 8) là Oxi, thuộc chu kì 2 => có bán kính nguyên tử nhỏ nhất
X (Z = 12) là Mg và T (Z = 15) là P cùng thuộc chu kì 3 => P có độ âm điện lớn hơn Mg
=> bán kính Mg lớn hơn P (X > T)
R (Z = 19) là K thuộc chu kì 4 => R có bán kính nguyên tử lớn nhất
=> Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là : Y, T, X, R.
Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. M là
-
A.
Cu
-
B.
Fe
-
C.
Al
-
D.
Cr
Đáp án : B
+) tổng số hạt cơ bản của ion M3+ => PT (1)
Trong ion M3+, số hạt mang điện là: pM và eM -3 (ion M3+ có ít hơn 3 electron so với nguyên tử M) => Pt (2)
Gọi pM , eM và nM là 3 hạt cơ bản của nguyên tố M
=> tổng số hạt cơ bản của ion M3+ là: pM + eM + nM -3 = 79
=> 2.pM + nM = 82 (1)
Trong ion M3+, số hạt mang điện là: pM và eM -3 (ion M3+ có ít hơn 3 electron so với nguyên tử M)
Mà tổng số hạt mang điện nhiều hơn không mang điện là 19
=> pM + eM - 3 - nM = 19 => 2pM – nM = 22 (2)
Từ (1) và (2) => pM = eM = 26; nM = 30
=> M là Fe
Phân tử M2X tạo thành từ M+ và X2-. Trong phân tử M2X có tổng số hạt cơ bản là 140 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của M+ lớn hơn số khối của X2- là 23. Tổng số hạt trong M+ nhiều hơn trong X2- là 31 hạt. Công thức hóa học của M2X là
-
A.
Na2O.
-
B.
K2S.
-
C.
Na2S.
-
D.
K2O.
Đáp án : D
Gọi số hạt trong M là: pM, eM và nM
Số hạt trong X là pX, eX, nX
+) Tổng số hạt cơ bản trong phân tử M2X là 140 => PT (1)
+) Trong M2X, số hạt mang điện nhiều hơn số hạt không mang điện là 44
=> PT (2)
Từ (1) và (2) => PT (3) ẩn pM và pX
+) Số khối của M+ lớn hơn số khối của X2- là 23 => PT (5)
+) Tổng số hạt trong M+ nhiều hơn trong X2- là 31 hạt
=> PT (6)
Từ (5) và (6) => PT (7) ẩn pM và pX
=> pM và pX => M và X
Gọi số hạt trong M là: pM, eM và nM
Số hạt trong X là pX, eX, nX
+) Tổng số hạt cơ bản trong phân tử M2X là 140
=> 2.(pM + eM + nM) + (pX + eX + nX) = 140
Vì pM = eM và pX = eX => 2.(2.pM + nM) + (2.pX + nX) = 140
=> 4.pM + 2.pX + 2.nM + nX = 140 (1)
+) Trong M2X, số hạt mang điện nhiều hơn số hạt không mang điện là 44
=> 2.(pM + eM) + (pX + eX) – (2.nM + nX) = 44
Vì pM = eM và pX = eX => 2.2.pM + 2.pX – 2.nM – nX = 44
=> 4.pM + 2.pX – (2.nM + nX) = 44 (2)
Từ (1) và (2) => $\left\{ \begin{gathered}4.{p_M} + 2.{p_X} = 92\,\,\,(3) \hfill \\2.{n_M} + {n_X} = 48\,\,\,(4) \hfill \\ \end{gathered} \right.$
+) Số khối của M+ lớn hơn số khối của X2- là 23 => pM + nM – (pX + nX) = 23 (5)
+) Tổng số hạt trong M+ nhiều hơn trong X2- là 31 hạt
=> pM + eM + nM -1 – (pX + eX + nX + 2) = 31
=> 2.pM + nM – 2.pX – nX = 34 (6)
Từ (5) và (6) => $\left\{ \begin{gathered}{p_M} - {p_X} = 11\,\,\,(7) \hfill \\{n_M} - {n_X} = 12 \hfill \\ \end{gathered} \right.$
Từ (3) và (7) => pM = 19; pX = 8
=> M là K và X là O
=> Công thức hợp chất cần tìm là K2O
Một nguyên tố X gồm 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % đồng vị thứ nhất gấp 3 lần % đồng vị thứ hai. Nguyên tử khối trung bình của X là:
-
A.
13,5
-
B.
13
-
C.
12,5
-
D.
14,5
Đáp án : C
+) Theo điều kiện bền của nguyên tử : p ≤ n ≤ 1,5p và tổng số hạt của đồng vị X1 => p
+) Đồng vị X1 và X2 có cùng số p => số nơtron của X2
+) Tính số khối của mỗi đồng vị và áp dụng công thức:
M = $\frac{\%{{X}_{1}}.{{A}_{{{X}_{1}}}}+\%{{X}_{2}}.{{A}_{{{X}_{2}}}}}{100}$
Xét X1 : Tổng số hạt : p + n + e = 18 => 2p + n = 18
Theo điều kiện bền của nguyên tử : p ≤ n ≤ 1,5p
=> p ≤ (18 – 2p) ≤ 1,5p => 5,1 ≤ p ≤ 6
=> p = 6 ; n1 = 6 => MX1 = 12
=> X2 có : p = 6 ; n2 = 8 => MX2 = 14
Gọi % đồng vị X2 là x => % đồng vị X1 = 3x
=> x + 3x = 100% => x = 25%
=> M = $\frac{75.12+25.14}{100}$= 12,5
Trong bảng tuần hoàn các nguyên tố , số chu kỳ nhỏ và số chu kỳ lớn là:
-
A.
4 và 4
-
B.
4 và 3
-
C.
3 và 4
-
D.
3 và 3
Đáp án : C
Trong bảng tuần hoàn các nguyên tố hóa học, số chu kì lớn: 4, số chu kì nhỏ: 3.
Các hạt tạo nên hạt nhân của hầu hết các nguyên tử là:
-
A.
Pronton và nơtron
-
B.
Nơtron, proton và electron
-
C.
Nơtron và electron
-
D.
Electron và proton
Đáp án : A
Các hạt tạo nên hạt nhân hầu hết các nguyên tử là proton và nơtron.
Oxit cao nhất của một nguyên tố R ứng với công thức RO2. Nguyên tố R đó là:
-
A.
Magie
-
B.
Cacbon
-
C.
Nitơ
-
D.
Photpho
Đáp án : B
Hóa trị của một nguyên tố nhóm A trong oxit cao nhất bằng số thứ tự nhóm của nguyên tố đó.
Trong RO2, R có hóa trị IV => R thuộc nhóm IVA => Cacbon
Nguyên tử kali có 19 proton, 19 electron và 20 notron. Số khối của nguyên tử kali là
-
A.
20.
-
B.
19.
-
C.
38.
-
D.
39
Đáp án : D
Trong một nguyên tử trung hòa về điện:
Số p = Số e = Z; Số n = N
Số khối: A = Z + N
Nguyên tử kali có 19 proton, 19 electron và 20 notron
Số p = Số e = Z = 19; Số n = N = 20
Số khối: A = Z + N = 19 + 20 = 39
Một cation Mn+ có cấu hình electron lớp ngoài cùng là 2p6. Hỏi lớp ngoài cùng của nguyên tử M có cấu hình electron nào sau đây
-
A.
3s1.
-
B.
3s2.
-
C.
3s23p1.
-
D.
A, B, C đều đúng.
Đáp án : D
Kim loại là những nguyên tố có 1, 2 hoặc 3 electron lớp ngoài cùng (trừ 1H, 2He, 5B).
Do đó kim loại có thể nhường 1, 2, 3 e lớp ngoại cùng.
Kim loại là những nguyên tố có 1, 2 hoặc 3 electron lớp ngoài cùng (trừ 1H, 2He, 5B).
+ Nếu ion là M+ => Cấu hình M: 3s1
+ Nếu ion là M2+ => Cấu hình M: 3s2
+ Nếu ion là M3+ => Cấu hình M: 3s23p1
Trong cùng một nhóm A, theo chiều điện tích hạt nhân tăng thì bán kính nguyên tử
-
A.
không đổi
-
B.
tăng dần
-
C.
giảm dần
-
D.
biến đổi không có qui luật
Đáp án : B
Trong cùng một nhóm A, theo chiều điện tích hạt nhân tăng dần số lớp e tăng nên bán kính tăng dần
Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
-
A.
6
-
B.
8
-
C.
14
-
D.
16
Đáp án : D
Dựa vào dữ kiện về đặc điểm phân bố e của X để viết cấu hình e.
Cấu hình e nguyên tử X là: 1s22s22p63s23p4 => ZX = 16
Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 8. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 6. A và B là các nguyên tố:
-
A.
Al và Br
-
B.
Al và Cl
-
C.
Si và Cl
-
D.
Si và Ca
Đáp án : C
Viết cấu hình e của nguyên tử nguyên tố A sao cho tổng số e trong phân lớp p bằng 8.
=> ZA => A
Số hạt mang điện của B nhiều hơn số hạt mang điện của A là 6 => 2ZB – 2ZA = 6 => ZB
=> số hiệu nguyên tử của B => B
Cấu hình e của nguyên tử nguyên tố A là: 1s22s22p63s23p2
=> ZA = 14 => A là Si
Số hạt mang điện của B nhiều hơn số hạt mang điện của A là 6 => 2ZB – 2ZA = 6 hay ZB – ZA = 3
=> ZB = 17 => B là Cl
Nguyên tố X nằm ở chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây?
-
A.
nguyên tố f.
-
B.
nguyên tố s.
-
C.
nguyên tố p.
-
D.
nguyên tố d.
Đáp án : C
Chu kì => số lớp e
Nhóm => số e lớp ngoài cùng
Viết cấu hình e của X, e cuối cùng được điền vào phân lớp nào thì nguyên tố thuộc họ đó
Chu kì 3 => có 3 lớp e
Nhóm VIA => có 6e lớp ngoài cùng
Cấu hình e của X là 1s22s22p63s23p4
Electron cuối cùng được điền vào phân lớp p nên X là nguyên tố p
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
-
A.
Mg > S > Cl > F
-
B.
F > Cl > S > Mg
-
C.
S > Mg > Cl > F
-
D.
Cl > F > S > Mg
Đáp án : A
1. Viết cấu hình e nguyên tử các nguyên tố
2. Từ cấu hình e suy ra vị trí của các nguyên tố trong bảng tuần hoàn
3. Dựa vào sự thay đổi của bán kính trong một nhóm và một chu kì để sắp xếp bán kính theo chiều giảm dần:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
- Cấu hình e và vị trí của các nguyên tố:
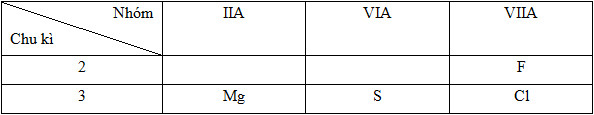
12Mg: 1s22s22p63s2=> Chu kì 3, nhóm IIA
16S: 1s22s22p63s23p4 => Chu kì 3, nhóm VIA
17Cl: 1s22s22p63s23p5 => Chu kì 3, nhóm VIIA
9F: 1s22s22p5 => Chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tử các nguyên tố trong bảng tuần hoàn:
* Sự biến đổi bán kính trong bảng tuần hoàn:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Như vậy bán kính nguyên tử các nguyên tố được sắp xếp như sau: Mg > S > Cl > F
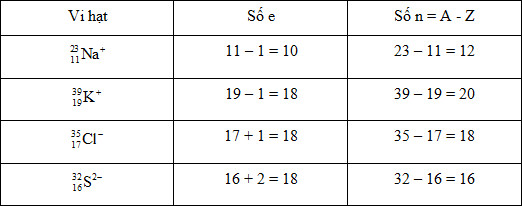
Vi hạt nào sau đây có số electron nhiều hơn số nơtron?
-
A.
Ion natri (\({}_{11}^{23}N{a^ + }\))
-
B.
Ion kali (\({}_{19}^{39}K^+\))
-
C.
Ion clorua (\({}_{17}^{35}C{l^ - }\))
-
D.
Ion sunfua (\({}_{16}^{32}S^{2-}\))
Đáp án : D
Xác định số e và số p của từng vi hạt và so sánh.
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p4. Số hiệu nguyên tử của X là?
-
A.
14
-
B.
32
-
C.
16
-
D.
8
Đáp án : C
Một nguyên tử ở trạng thái trung hòa có số hiệu nguyên tử bằng tổng số các electron.
Một nguyên tử ở trạng thái trung hòa có số hiệu nguyên tử bằng tổng số các electron.
Số hiệu nguyên tử của X là 2 + 2 + 6 + 2 + 4 = 16
X và Y là hai kim loại thuộc cùng một nhóm A trong bảng tuần hoàn các nguyên tố hóa học. Biết ZX<ZY và ZX + ZY = 24. Phát biểu nào sau đây là không đúng?
-
A.
X, Y đều có 2 electron ở phân lớp ngoài cùng.
-
B.
Bán kính nguyên tử của Y lớn hơn bán kính nguyên tử của X.
-
C.
Trong bảng tuần hoàn các nguyên tố hóa học thì X, Y đều thuộc nhóm IIA.
-
D.
Hidroxit tương ứng với oxit cao nhất của X, Y đều có tính bazo mạnh.
Đáp án : D
TH1: X, Y cách nhau 1 chu kì nhỏ
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 8 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 8 \hfill \\
{Z_Y} = 16 \hfill \\
\end{gathered} \right.\) loại do X, Y không phải là kim loại
TH2: X, Y cách nhau 1 chu kì lớn
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 18 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 3 \hfill \\
{Z_Y} = 21 \hfill \\
\end{gathered} \right.\) loại
TH3: X, Y cách nhau 2 chu kì nhỏ
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 8.2 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 4(Be) \hfill \\
{Z_Y} = 20(Ca) \hfill \\
\end{gathered} \right.\)
Be: 1s22s2
Ca: 1s22s22p63s23p64s2
A, B, C đúng
D sai vì Be(OH)2 có tính bazơ yếu
Nguyên tử R có cấu hình electron lớp ngoài cùng là ns2np3. Trong hợp chất khí với hidro thì hidro chiếm 17,647% về khối lượng. R là
-
A.
As.
-
B.
S.
-
C.
N.
-
D.
P.
Đáp án : C
Hợp chất khí của R với H là: RH3
\(\begin{gathered}
\% {m_H} = \dfrac{3}{{R + 3}}.100\% = 17,647\% \hfill \\
\to R = 14(N) \hfill \\
\end{gathered} \)
Cho cấu hình electron nguyên tử của một số nguyên tố:
(a) 1s22s22p63s23p63d34s2
(b) 1s2
(c) 1s22s2
(d) 1s22s22p1
(e) 1s22s22p63s2
(f) 1s12s22p63s23p2
Có mấy cấu hình electron nguyên tử là của nguyên tố kim loại?
-
A.
1
-
B.
4
-
C.
2
-
D.
3
Đáp án : D
Kim loại là những nguyên tử có 1, 2, 3 electron lớp ngoài cùng (trừ H, He, B)
Kim loại là những nguyên tử có 1, 2, 3 electron lớp ngoài cùng (trừ H, He, B).
Các kim loại là: (a) (c) (e)
Nguyên tử nguyên tố X có tổng số các hạt p, n, e là 58, trong hạt nhân số hạt p và n hơn kém nhau 1 đơn vị. Số hiệu nguyên tử của X là:
-
A.
18
-
B.
19
-
C.
20
-
D.
21
Đáp án : B
Lập hệ phương trình với chú ý số proton = số electron.
Xét 2 trường hợp: P-N=1 hoặc N- P= 1
Giải hệ trên ta tìm được số proton trong nguyên tử X. Số hiệu nguyên tử chính là số proton trong X.
Vì nguyên tử nguyên tố X có tổng số các hạt p, n, e là 58 nên P + E + N = 58 suy ra 2P + N= 58 (1)
Vì trong hạt nhân số hạt p và n hơn kém nhau 1 đơn vị nên –P + N=1 (2) hoặc P – N=1 (3)
Giải hệ (1) và (2) ta có P= 19 và N= 20
Giải hệ (1) và (3) ta có: P= 19,67 (Loại) và N= 18,67 (Loại)
Vậy P = 19 và N= 20
Vậy số hiệu nguyên tử của X là 19.
Có thể lí luận và xét luôn trường hợp N-P=1 vì số notron luôn lớn hơn hoặc bằng số notron.
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L. Số proton có trong nguyên tử X là:
-
A.
7
-
B.
6
-
C.
8
-
D.
5
Đáp án : B
Từ đề bài suy ra cấu hình electron của nguyên tử. Khi đó xác định được tổng số electron của nguyên tử X.
Từ đó suy ra số proton của nguyên tử X.
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai).
Vậy cấu hình electron nguyên tử của X là 1s22s22p2.
Nguyên tử X có 6 electron nên nguyên tử X có 6 proton.
Nguyên tử 13Al27 có:
-
A.
13p, 13e, 14n
-
B.
13p, 14e, 14n
-
C.
13p, 13e, 13n
-
D.
14p, 14e, 13n
Đáp án : A
ZXA : Z = số E và A = số P + số N = Số E + số N
=> Số e = 13 = số p : A = 27 = Số E + số N
=> Số n = 27 – 13 = 14
Ở điều kiện thường crom có cấu trúc mạng lập phương tâm khối trong đó thể tích các nguyên tử chiếm 68% thể tích tinh thể. Khối lượng riêng của Cr là 7,2 g/cm3. Tính bán kính nguyên tử của crom (cho Cr = 52; coi nguyên tử Cr có dạng hình cầu).
-
A.
0,155 nm
-
B.
0,125 nm
-
C.
0,134 nm
-
D.
0,165 nm
Đáp án : B
Từ đề bài tìm được thể tích của 1 nguyên tử crom. Mà nguyên tử crom có dạng hình cầu nên thể tích nguyên tử tính theo công thức \(V = \frac{{4\pi {R^3}}}{3}\) từ đó ta tính được giá trị R với R là bán kính nguyên tử.
Xét 1 mol nguyên tử crom có số nguyên tử crom bằng 6,022.1023 nguyên tử và khối lượng là 52 gam.
Thể tích của 1 mol nguyên tử crom là: \(V = \dfrac{{52}}{{7,2}} = 7,22(c{m^3}) = 7,{22.10^{ - 6}}({m^3})\)
Thể tích thực của 1 nguyên tử crom là: \(V = \dfrac{{7,{{22.10}^{ - 6}}.0,68}}{{6,{{022.10}^{23}}}} = 8,{16.10^{30}}({m^3})\)
Do coi nguyên tử Cr có dạng hình cầu nên thể tích nguyên tử được tính theo công thức:
\(V = \dfrac{{4\pi {R^3}}}{3}\) suy ra R = 0,125.10-9 m= 0,125 nm
Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
-
A.
80%
-
B.
20%
-
C.
10,8%
-
D.
89,2%
Đáp án : B
Áp dụng công thức tính số khối trung bình
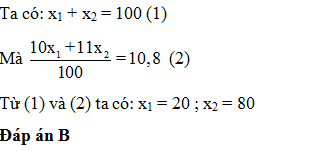
Cấu hình electron của nguyên tố Fe (Z = 26) là:
-
A.
1s22s22p63s23p63d64s2.
-
B.
1s22s22p63s23p63d8.
-
C.
1s22s22p63s23p64s24p6.
-
D.
1s22s22p63s23p63d54s24p1.
Đáp án : A
Cách viết cấu hình electron:
1. Xác định số electron của nguyên tử.
2. Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 4s 3d 4p 5s …) và tuân theo quy tắc sau: phân lớp s chứa tối đa 2e; phân lớp p chứa tối đa 6e; phân lớp d chứa tối đa 10e; phân lớp f chứa tối đa 14e.
3.Viết cấu hình electron theo thứ tự các phân lớp trong 1 lớp và theo thứ tự của các lớp electron (1s 2s 2p 3s 3p 3d 4s 4p…).
Cấu hình e của Fe (Z = 26) là: 1s22s22p63s23p63d64s2.
Các electron được phân bố vào các AO theo phân mức năng lượng tăng dần và có sự chèn mức năng lượng. Tuy nhiên, khi viết cấu hình electron, các phân mức năng lượng cần được sắp xếp lại theo từng lớp.
Điện tích hạt nhân của nguyên tử nguyên tố X là +8,4906.10-18 Culong. Tỉ số nơtron và số đơn vị điện tích hạt nhân của X bằng 1,3962. Số nơtron của X bằng 3,7 lần số nơtron của nguyên tử nguyên tố Y. Khi cho 4,29 gam Y tác dụng với lượng dư X thu được 18,26 gam sản phẩm có công thức XY. Số hạt proton có trong hạt nhân nguyên tử Y là?
-
A.
19
-
B.
20
-
C.
21
-
D.
22
Đáp án : A
Từ điện tích hạt nhân của X suy ra số p trong nguyên tử X.
Khi đó tính được số n của X, suy ra số khối của X.
Từ số n của X suy ra số n của Y
Từ phản ứng tìm được số khối của Y, từ đó tính được số proton trong Y.
Vì điện tích hạt nhân của nguyên tử nguyên tố X là +8,4906.10-19 Culong nên số hạt proton có trong hạt nhân nguyên tử X là (+8,4906.10-18) : (+1,602.10-19)= 53
Tỉ số nơtron và số đơn vị điện tích hạt nhân X bằng 1,3962 nên số notron trong X bằng 1,3962.53= 74.
Số khối của A bằng PX + NX= 53 + 74= 127. Vậy X là nguyên tố I.
Vì số nơtron của X bằng 3,7 lần số nơtron của nguyên tử nguyên tố Y nên NY= 74 : 3,7= 20.
X + Y → XY
4,29 18,26
Vậy \({Y \over {4,29}} = {{X + Y} \over {18,26}} \to {Y \over {4,29}} = {{127 + Y} \over {18,26}}\) → Y = 39
Ta có AY= NY + Py → PY= 39 – 20= 19
Số hạt proton có trong hạt nhân nguyên tử Y là 19.
Ion âm X2- có tổng số hạt là 26. Nguyên tử X có số khối là 16. Số hạt electron trong X2- là:
-
A.
6
-
B.
8
-
C.
16
-
D.
10
Đáp án : D
Gọi p, n, e là số proton, notron, electron của nguyên tử X.
Ion âm X2- có tổng số hạt là S ⟹ p + n + e + 2 = S ⟹ 2p + n = S – 2. (1)
X có số khối là A = p + n. (2)
Giải hệ 2 phương trình (1) và (2) ⟹ p, n, e.
⟹ Số e trong X2-
Gọi số hạt trong X lần lượt là p, n, e
Ion dương X2- có tổng số hạt là 26 ⟹ p + n + (e + 2) = 26 ⟹ 2p + n = 24 (1)
Nguyên tử X có số khối là 16: p + n = 16 (2)
Từ (1) và (2): p = n = 8 ⟹ Số hạt e trong Xlà 8 ⟹ số hạt e trong X2- là 8 + 2=10.
Ion dương M2+ có tổng số hạt là 91và tỉ lệ \(\frac{e}{n} = \frac{{27}}{{35}}\). Số electron trong M là:
-
A.
64
-
B.
35
-
C.
29
-
D.
27
Đáp án : C
Gọi p, n, e là số proton, notron, electron của nguyên tử M.
Ion dương M2+ có tổng số hạt là S ⟹ p + n + e – 2 = S ⟹ 2p + n = S + 2. (1)
Tỉ lệ \(\frac{e}{n} = B\). (2) Giải hệ 2 phương trình (1) và (2) ⟹ p, n, e.
⟹ Số e trong M2+
Gọi số hạt trong M lần lượt là p, n, e
Ion dương M2+ có tổng số hạt là 91 ⟹ p + n + (e – 2) = 91 ⟹ 2p + n =93 (1)
tỉ lệ \(\frac{{e - 2}}{n} = \frac{{27}}{{35}}\) mà p = e nên \(\frac{{p - 2}}{n} = \frac{{27}}{{35}} \Rightarrow 35p - 27n = 70\) (2)
Từ (1) và (2): p = 29, n = 35 ⟹ Số hạt e trong M là 29.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 1 tiết Hóa 10 chương 1: Nguyên tử - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 2
- Đề kiểm tra 15 phút Hóa 10 chương 6: Oxi - Lưu huỳnh - Đề số 1
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 3
- Đề kiểm tra 15 phút Hóa 10 chương 5: Nhóm Halogen - Đề số 2










Danh sách bình luận