Đề thi học kì 1 Hóa 11 - Đề số 1
Đề bài
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
-
A.
(b).
-
B.
(a).
-
C.
(d).
-
D.
(c).
Tính pH của 300ml dung dịch (gồm 100 ml Ba(OH)2 0,1M và 200 ml NaOH 0,05M)
-
A.
12
-
B.
13
-
C.
10
-
D.
11
CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
-
A.
đám cháy do xăng, dầu.
-
B.
đám cháy nhà cửa, quần áo.
-
C.
đám cháy do magie hoặc nhôm.
-
D.
đám cháy do khí ga.
Dãy sắp xếp các dung dịch loãng có nồng độ mol/l như nhau theo thứ tự pH tăng dần là
-
A.
KHSO4, HF, H2SO4, Na2CO3.
-
B.
HF, H2SO4, Na2CO3, KHSO4.
-
C.
H2SO4, KHSO4, HF, Na2CO3.
-
D.
HF, KHSO4, H2SO4, Na2CO3.
Cặp công thức của liti nitrua và nhôm nitrua là
-
A.
LiN3 và Al3N
-
B.
Li3N và AlN
-
C.
Li2N3 và Al2N3
-
D.
Li3N2 và Al3N2
Phản ứng nào sau đây không phải là phản ứng trao đổi?
-
A.
FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
-
B.
NH4Cl + NaOH → NaCl + NH3 + H2O.
-
C.
Na2SO4 + BaCl2 → BaSO4 + 2NaCl.
-
D.
2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O.
Một chất Y có tính chất sau:
- Không màu, rất độc.
- Cháy trong không khí với ngọn lửa màu xanh và sinh ra chất khí làm đục nước vôi trong. Y là:
-
A.
H2.
-
B.
CO.
-
C.
Cl2.
-
D.
CO2.
Dung dịch nào sau đây làm quì tím chuyển sang màu đỏ?
-
A.
NH4Cl
-
B.
NaOH
-
C.
NaCl
-
D.
Na2CO3
Dãy các chất điện li mạnh?
-
A.
AgCl, CH3COONa, HBr, NaOH.
-
B.
NaCl, CH3COOH, HCl, KOH.
-
C.
NaCl, CH3COOH, HCl, Ba(OH)2.
-
D.
CuSO4, H2S, H2SO4, NaOH.
Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
-
A.
21.
-
B.
15.
-
C.
19.
-
D.
8.
Tính bazơ của NH3 là do
-
A.
trên nguyên tử N còn cặp e tự do.
-
B.
phân tử có 3 liên kết cộng hóa trị phân cực.
-
C.
NH3 tan nhiều trong nước.
-
D.
NH3 tác dụng với nước tạo thành NH4OH.
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
-
A.
C và CuO
-
B.
CO2 và NaOH.
-
C.
CO và Fe2O3.
-
D.
C và H2O.
Cấu tạo hoá học là
-
A.
số lượng liên kết giữa các nguyên tử trong phân tử.
-
B.
các loại liên kết giữa các nguyên tử trong phân tử.
-
C.
thứ tự liên kết giữa các nguyên tử trong phân tử.
-
D.
bản chất liên kết giữa các nguyên tử trong phân tử.
Các nguyên tử thuộc nhóm IVA có cấu hình e lớp ngoài cùng là
-
A.
ns2np2.
-
B.
ns2 np3.
-
C.
ns2np4.
-
D.
ns2np5.
Chất nào trong các chất sau là chất điện li?
-
A.
Nước cất.
-
B.
Benzen.
-
C.
Axit clohiric.
-
D.
Glucozo.
Photpho trắng có cấu trúc mạng tinh thể
-
A.
phân tử
-
B.
nguyên tử.
-
C.
ion.
-
D.
phi kim.
Các loại phân lân đều cung cấp cho cây trồng nguyên tố
-
A.
kali.
-
B.
photpho
-
C.
nitơ
-
D.
cacbon
Hợp chất hữu cơ là hợp chất của nguyên tố
-
A.
cacbon
-
B.
oxi
-
C.
silic
-
D.
nitơ
Một dung dịch chứa x mol Na+, y mol Ca2+, z mol HCO3-, t mol Cl-. Hệ thức quan hệ giữa x, y , z, t được xác định là:
-
A.
x + 2z = y + 2t.
-
B.
z + 2x = y + t.
-
C.
x + 2y = z + 2t.
-
D.
x + 2y = z + t.
Chất nào dưới đây vừa phản ứng được với dung dịch HCl vừa phản ứng được với dung dịch NaOH?
-
A.
Na2CO3
-
B.
NH4Cl
-
C.
NH3
-
D.
NaHCO3
Hòa tan hoàn toàn m gam Al2(SO4)3 vào nước thu được dung dịch A chứa 0,6 mol Al3+
-
A.
102,6 gam.
-
B.
68,4 gam.
-
C.
34,2 gam.
-
D.
51,3 gam.
Dung dịch K2SO4 0,05M có nồng độ mol ion K+ bằng
-
A.
0,05M
-
B.
0,1M
-
C.
0,025M
-
D.
1M
Hòa tan 0,62 gam Na2O vào 7,2 gam NaOH vào nước được 2 lít dung dịch A. pH của dung dịch A bằng
-
A.
1
-
B.
2
-
C.
12
-
D.
13
Cho muối X vào dung dịch NaOH đun nhẹ thấy có khí mùi khai bay ra. Mặt khác, cho muối X vào dung dịch H2SO4 loãng sau đó cho Cu vào thấy Cu tan ra và có khí không màu bay lên và hóa nâu ngoài không khí. X có thể là
-
A.
NH4Cl.
-
B.
NaNO3.
-
C.
(NH4)2SO4.
-
D.
NH4NO3.
Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
-
A.
33,33%
-
B.
66,67%
-
C.
61,61%
-
D.
50,00%
Có 5 lọ mất nhãn đựng 5 chất bột màu trắng: NaCl, Na2CO3, Na2SO4, BaCO3, BaSO4. Chỉ dùng nước và khí CO2 thì có thể nhận được mấy chất
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,80 lít khí CO2 ; 2,80 lít N2 (các thể tích đo ở đktc) và 20,25 gam H2O. CTPT của X là :
-
A.
C4H9N.
-
B.
C3H7N.
-
C.
C2H7N.
-
D.
C3H9N.
Chất nào sau đây có đồng phân hình học?
-
A.
2-clopropen.
-
B.
But-2-en.
-
C.
1,2-đicloetan.
-
D.
But-2-in.
Hòa tan hoàn toàn 21,38 gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 và FeCl2 (trong đó nguyên tố oxi chiếm 14,967% về khối lượng) vào dung dịch chứa HCl và 0,16 mol NaNO3, thu được dung dịch Y chỉ chứa 47,82 gam muối của kim loại và hỗn hợp hai khí có tỉ khối so với H2 là 17 (trong đó có một khí hóa nâu trong không khí). Cho Y phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được 115,54 gam kết tủa. Phần trăm khối lượng của FeCl2 trong X có giá trị gần nhất với giá trị nào sau đây?
-
A.
34
-
B.
35
-
C.
36
-
D.
37
Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
-
A.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{1}{1}$
-
B.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{11}{9}$
-
C.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{8}{11}$
-
D.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{9}{10}$
Lời giải và đáp án
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
-
A.
(b).
-
B.
(a).
-
C.
(d).
-
D.
(c).
Đáp án : D
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc.
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm.
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Tính pH của 300ml dung dịch (gồm 100 ml Ba(OH)2 0,1M và 200 ml NaOH 0,05M)
-
A.
12
-
B.
13
-
C.
10
-
D.
11
Đáp án : B
Từ số mol của Ba(OH)2 và NaOH \( \to {n_{O{H^ - }}} = 2{n_{Ba{{(OH)}_2}}} + {n_{NaOH}}\)
\( \to {\text{[}}O{H^ - }{\text{] = }}\dfrac{{{n_{O{H^ - }}}}}{{0,3}}\)
Mà [OH-].[H+] = 10-14
\( \to [{H^ + }] \to pH\)
\({n_{Ba{{(OH)}_2}}} = 0,1.0,1 = 0,01\,\,mol;{n_{NaOH}} = 0,2.0,05 = 0,01\,\,mol\)
\( \to {n_{OH - }} = 2{n_{Ba{{(OH)}_2}}} + {n_{NaOH}} = 2.0,01 + 0,01 = 0,03\,\,mol\)
\( \to [O{H^ - }] = \dfrac{{0,03}}{{0,3}} = 0,1\,\,M\)
Mà [OH-].[H+] = 10-14
\( \to [{H^ + }] = \dfrac{{{{10}^{ - 14}}}}{{0,1}} = {10^{ - 13}}\)
\( \to pH = - \log {10^{ - 13}} = 13\)
CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
-
A.
đám cháy do xăng, dầu.
-
B.
đám cháy nhà cửa, quần áo.
-
C.
đám cháy do magie hoặc nhôm.
-
D.
đám cháy do khí ga.
Đáp án : C
Không dùng CO2 để dập tắt đám cháy Mg vì có phản ứng: CO2 + 2Mg $\xrightarrow{{{t}^{o}}}$ 2MgO + C
C sinh ra dễ cháy làm đám cháy to hơn
Dãy sắp xếp các dung dịch loãng có nồng độ mol/l như nhau theo thứ tự pH tăng dần là
-
A.
KHSO4, HF, H2SO4, Na2CO3.
-
B.
HF, H2SO4, Na2CO3, KHSO4.
-
C.
H2SO4, KHSO4, HF, Na2CO3.
-
D.
HF, KHSO4, H2SO4, Na2CO3.
Đáp án : C
pH tỉ lệ nghịch với nồng độ ion H+ và tỉ lệ thuận với nồng độ ion OH- => pH tăng dần khi tính axit giảm và tính bazơ tăng.
pH tăng dần tức tính axit giảm dần và tính bazơ tăng dần
+) Tính axit giảm dần khi nồng độ ion H+ trong dung dịch giảm dần => dd HF có tính axit yếu nhất và dd H2SO4 có tính axit mạnh nhất
+) Dung dịch có pH cao nhất là dung dịch có tính bazơ => Na2CO3
Cặp công thức của liti nitrua và nhôm nitrua là
-
A.
LiN3 và Al3N
-
B.
Li3N và AlN
-
C.
Li2N3 và Al2N3
-
D.
Li3N2 và Al3N2
Đáp án : B
N2 tác dụng với kim loại thể hiện số oxi hóa -3 => N có hóa trị III
Liti nitrua: Li3N
Nhôm nitrua: AlN
Phản ứng nào sau đây không phải là phản ứng trao đổi?
-
A.
FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
-
B.
NH4Cl + NaOH → NaCl + NH3 + H2O.
-
C.
Na2SO4 + BaCl2 → BaSO4 + 2NaCl.
-
D.
2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O.
Đáp án : D
Phản ứng trao đổi là phản ứng hóa học, trong đó các chất trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi số oxi hóa. Từ sự trao đổi này, tạo ra các sản phẩm mới.
Phản ứng: 2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O là phản ứng oxi hóa khử, không phải pư trao đổi, vì số oxi hóa của các nguyên tố trước và sau phản ứng thay đổi
Một chất Y có tính chất sau:
- Không màu, rất độc.
- Cháy trong không khí với ngọn lửa màu xanh và sinh ra chất khí làm đục nước vôi trong. Y là:
-
A.
H2.
-
B.
CO.
-
C.
Cl2.
-
D.
CO2.
Đáp án : B
CO là khí có những tính chất thỏa mãn với đề bài:
- Không màu, rất độc
- Cháy trong không khí với ngọn lửa màu xanh và sinh ra khí làm đục nước vôi trong:
2CO + O2 → 2CO2 (nhiệt độ)
CO2+ Ca(OH)2 → CaCO3 + H2O
Dung dịch nào sau đây làm quì tím chuyển sang màu đỏ?
-
A.
NH4Cl
-
B.
NaOH
-
C.
NaCl
-
D.
Na2CO3
Đáp án : A
Dung dịch có môi trường axit làm quỳ tím chuyển đỏ.
Cách đánh giá môi trường của một dung dịch muối:
- Muối được tạo từ axit mạnh + bazơ mạnh => Môi trường trung tính
- Muối được tạo bởi axit mạnh + bazơ yếu => Môi trường axit
- Muối được tạo bởi axit yếu + bazơ mạnh => Mối trường bazơ
Chú ý: Không có môi trường lưỡng tính
NH4Cl được tạo bởi bazơ yếu (NH3) và axit mạnh HCl nên có môi trường axit => làm quỳ tím chuyển đỏ.
Dãy các chất điện li mạnh?
-
A.
AgCl, CH3COONa, HBr, NaOH.
-
B.
NaCl, CH3COOH, HCl, KOH.
-
C.
NaCl, CH3COOH, HCl, Ba(OH)2.
-
D.
CuSO4, H2S, H2SO4, NaOH.
Đáp án : A
Các chất điện li mạnh là các axit mạnh, bazo mạnh, các muối
A. Đúng
B,C Loại CH3COOH là chất điện li yếu
D. Loại H2S là chất điện li yếu
Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
-
A.
21.
-
B.
15.
-
C.
19.
-
D.
8.
Đáp án : D
+) Coi Fe và S trogn 1 chất có tổng số oxi hóa là 0
+) Xác định các nguyên tố có số oxi hóa thay đổi
+) Viết quá trình cho - nhận e => xác định hệ số cân bằng
Coi Fe và S ban đầu có trong chất có số oxi hóa là 0
$\begin{align}& {{\overset{0}{\mathop{FeS}}\,}_{2}}+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O \\ & \,\,1.|{{\overset{0}{\mathop{FeS}}\,}_{2}}\to \,\,\overset{+3}{\mathop{Fe}}\,\,\,+\,\,2\overset{+6}{\mathop{S}}\,\,\,+\,\,15e \\ & 5.|\overset{+5}{\mathop{N}}\,\,+\,\,3e\,\,\to \,\,\overset{+2}{\mathop{N}}\, \\ \end{align}$
=> PTHH: FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
=> hệ số của HNO3 là 8
Tính bazơ của NH3 là do
-
A.
trên nguyên tử N còn cặp e tự do.
-
B.
phân tử có 3 liên kết cộng hóa trị phân cực.
-
C.
NH3 tan nhiều trong nước.
-
D.
NH3 tác dụng với nước tạo thành NH4OH.
Đáp án : A
- Tính bazơ của NH3 là do trên nguyên tử N còn cặp e tự do không tham gia liên kết.
- Theo thuyết bronsted , bazo là chất nhận proton
- Theo thuyết areniut, bazo là chất tan trong nước phân li ra ion OH-
H2O + NH3 ⇌ OH– + NH4+
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
-
A.
C và CuO
-
B.
CO2 và NaOH.
-
C.
CO và Fe2O3.
-
D.
C và H2O.
Đáp án : D
Ta có: C + H2O → CO + H2 hoặc C + 2H2O → CO2 + 2H2
=> Sản phẩm đều là chất khí
Cấu tạo hoá học là
-
A.
số lượng liên kết giữa các nguyên tử trong phân tử.
-
B.
các loại liên kết giữa các nguyên tử trong phân tử.
-
C.
thứ tự liên kết giữa các nguyên tử trong phân tử.
-
D.
bản chất liên kết giữa các nguyên tử trong phân tử.
Đáp án : C
Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hoá trị và theo một thứ tự nhất định. Thứ tự liên kết đó được gọi là cấu tạo hoá học.
Các nguyên tử thuộc nhóm IVA có cấu hình e lớp ngoài cùng là
-
A.
ns2np2.
-
B.
ns2 np3.
-
C.
ns2np4.
-
D.
ns2np5.
Đáp án : A
Các nguyên tử thuộc nhóm IVA có cấu hình e lớp ngoài cùng là ns2np2.
Chất nào trong các chất sau là chất điện li?
-
A.
Nước cất.
-
B.
Benzen.
-
C.
Axit clohiric.
-
D.
Glucozo.
Đáp án : C
Chất điện li là chất khi tan trong nước phân li thành các ion.
Axit clohidric khi tan trong nước phân li hoàn toàn thành các ion nên là chất điện li.
HCl → H+ + Cl-
Photpho trắng có cấu trúc mạng tinh thể
-
A.
phân tử
-
B.
nguyên tử.
-
C.
ion.
-
D.
phi kim.
Đáp án : A
Photpho trắng có cấu trúc mạng tinh thể phân tử.
Các loại phân lân đều cung cấp cho cây trồng nguyên tố
-
A.
kali.
-
B.
photpho
-
C.
nitơ
-
D.
cacbon
Đáp án : B
Ghi nhớ các loại phân bón hóa học
Phân lân: cung cấp P
Phân đạm: cung cấp N
Phân kali: cung cấp K
Phân lân cung cấp cho cây trồng nguyên tố photpho
Hợp chất hữu cơ là hợp chất của nguyên tố
-
A.
cacbon
-
B.
oxi
-
C.
silic
-
D.
nitơ
Đáp án : A
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, HCN, muối cacbonat, muối xianua, muối cacbua…).
Một dung dịch chứa x mol Na+, y mol Ca2+, z mol HCO3-, t mol Cl-. Hệ thức quan hệ giữa x, y , z, t được xác định là:
-
A.
x + 2z = y + 2t.
-
B.
z + 2x = y + t.
-
C.
x + 2y = z + 2t.
-
D.
x + 2y = z + t.
Đáp án : D
Áp dụng định luật bảo toàn điện tích.
Áp dụng định luật bảo toàn điện tích trong một dung dịch ta có:
n (+) = n (-) => \({n_{N{a^ + }}} + 2{n_{C{a^{2 + }}}} = {n_{HCO_3^ - }} + {n_{C{l^ - }}}\)
=> x + 2y = z + t
Chất nào dưới đây vừa phản ứng được với dung dịch HCl vừa phản ứng được với dung dịch NaOH?
-
A.
Na2CO3
-
B.
NH4Cl
-
C.
NH3
-
D.
NaHCO3
Đáp án : D
Chất vừa phản ứng được với dung dịch HCl vừa phản ứng được với dung dịch NaOH là NaHCO3
Hòa tan hoàn toàn m gam Al2(SO4)3 vào nước thu được dung dịch A chứa 0,6 mol Al3+
-
A.
102,6 gam.
-
B.
68,4 gam.
-
C.
34,2 gam.
-
D.
51,3 gam.
Đáp án : A
Dựa vào phương trình điện ly tính được số mol Al2(SO4)
Từ đó tính được \({m_{A{l_2}{{(S{O_4})}_3}}}\)
\(A{l_2}{(S{O_4})_3} \to 2{\text{A}}{l^{3 + }} + 3{\text{S}}O_4^{2 - }\)
Theo phương trình điện ly: \({n_{A{l_2}{{(S{O_4})}_3}}} = \dfrac{1}{2}.{n_{A{l^{3 + }}}} = 0,3\,\,mol\)
\( \to {m_{A{l_2}{{(S{O_4})}_3}}} = 0,3.342 = 102,6\,\,gam\)
Dung dịch K2SO4 0,05M có nồng độ mol ion K+ bằng
-
A.
0,05M
-
B.
0,1M
-
C.
0,025M
-
D.
1M
Đáp án : B
Phương trình điện ly: \({K_2}S{O_4} \to 2{K^ + } + SO_4^{2 - }\)
Theo phương trình điện ly: \({\rm{[}}{{\rm{K}}^ + }{\rm{]}} = 2.{\rm{[}}{K_2}S{O_4}{\rm{]}}\)
Phương trình điện ly: \({K_2}S{O_4} \to 2{K^ + } + SO_4^{2 - }\)
Theo phương trình điện ly: \({\rm{[}}{{\rm{K}}^ + }{\rm{]}} = 2.{\rm{[}}{K_2}S{O_4}{\rm{] = 2}}{\rm{.0,05 = 0,1}}\,\,{\rm{M}}\)
Hòa tan 0,62 gam Na2O vào 7,2 gam NaOH vào nước được 2 lít dung dịch A. pH của dung dịch A bằng
-
A.
1
-
B.
2
-
C.
12
-
D.
13
Đáp án : D
\({n_{N{a_2}O}} = \dfrac{{0,62}}{{62}} = 0,01\,\,mol\)
\({n_{NaOH}} = \dfrac{{7,2}}{{40}} = 0,18\,\,mol\)
PTHH: \(N{a_2}O + {H_2}O \to 2NaOH\)
Theo phương trình: \({n_{NaOH}} = 2{n_{N{a_2}O}} = 0,02\,\,mol\)
\( \to \sum {{n_{NaOH}}} = 0,02 + 0,18 = 0,2\,\,mol \to {n_{O{H^ - }}} = {n_{NaOH}} = 0,2\,\,mol\)
\( \to {\rm{[}}O{H^ - }{\rm{]}} = \dfrac{{0,2}}{2} = 0,1\,\,M \to pH = 14 + \log 0,1 = 13\)
Cho muối X vào dung dịch NaOH đun nhẹ thấy có khí mùi khai bay ra. Mặt khác, cho muối X vào dung dịch H2SO4 loãng sau đó cho Cu vào thấy Cu tan ra và có khí không màu bay lên và hóa nâu ngoài không khí. X có thể là
-
A.
NH4Cl.
-
B.
NaNO3.
-
C.
(NH4)2SO4.
-
D.
NH4NO3.
Đáp án : D
Hướng dẫn giải
+) Cho muối X vào dung dịch NaOH đun nhẹ thấy có khí mùi khai bay ra => X là muối amoni
+) Cho muối X vào dung dịch H2SO4 loãng sau đó cho Cu vào thấy Cu tan ra và có khí không màu bay lên và hóa nâu ngoài không khí => khí đó là NO => muối X chứa ion NO3-
=> X là muối NH4NO3.
Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
-
A.
33,33%
-
B.
66,67%
-
C.
61,61%
-
D.
50,00%
Đáp án : C
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
+) Bảo toàn e: 2.nZn = 8.nNH4NO3
+) Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO
nZn(NO3)2 = 0,6 mol; nNH4NO3 = 0,1 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,1 = 0,4 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,6 – 0,4 = 0,2 mol
\( = > \,\,\% {m_{Zn}} = \frac{{0,4.65}}{{0,4.65 + 0,2.81}}.100\% = 61,61\% \)
Có 5 lọ mất nhãn đựng 5 chất bột màu trắng: NaCl, Na2CO3, Na2SO4, BaCO3, BaSO4. Chỉ dùng nước và khí CO2 thì có thể nhận được mấy chất
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : D
|
|
NaCl |
Na2CO3 |
Na2SO4 |
BaCO3 |
BaSO4 |
|
Nước |
tan |
tan |
tan |
Không tan |
Không tan |
|
CO2 |
Không ht |
Không ht |
Không ht |
Hòa tan kết tủa, tạo dung dịch Ba(HCO3)2 trong suốt |
Không ht |
|
Ba(HCO3)2 |
Không ht |
↓ trắng, tan khi sục CO2 |
↓ trắng, không tan khi sục CO2 |
|
|
Vậy dùng nước và CO2 ta có thể nhận biết được cả 5 dung dịch
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,80 lít khí CO2 ; 2,80 lít N2 (các thể tích đo ở đktc) và 20,25 gam H2O. CTPT của X là :
-
A.
C4H9N.
-
B.
C3H7N.
-
C.
C2H7N.
-
D.
C3H9N.
Đáp án : D
+) Bảo toàn nguyên tố C: ${{n}_{C}}={{n}_{C{{O}_{2}}}}$
+) Bảo toàn nguyên tố H: $\,{{n}_{H}}=2.{{n}_{{{H}_{2}}O}}$
+) Bảo toàn nguyên tố N: ${{n}_{N}}=2.{{n}_{{{N}_{2}}}}$
+) Tính $ {{n}_{C}}:{{n}_{H}}:{{n}_{N}}$ => CTPT
Bảo toàn nguyên tố C: ${{n}_{C}}={{n}_{C{{O}_{2}}}}=\frac{16,8}{22,4}=0,75\,\,mol$
Bảo toàn nguyên tố H: $\,{{n}_{H}}=2.{{n}_{{{H}_{2}}O}}=2.\frac{20,25}{18}=2,25\,\,mol$
Bảo toàn nguyên tố N: ${{n}_{N}}=2.{{n}_{{{N}_{2}}}}=2.\frac{2,8}{22,4}=0,25\,\,mol$
$\Rightarrow {{n}_{C}}:{{n}_{H}}:{{n}_{N}}=0,75:2,25:0,25=3:9:1$
Căn cứ vào các phương án ta thấy CTPT của X là C3H9N
Chất nào sau đây có đồng phân hình học?
-
A.
2-clopropen.
-
B.
But-2-en.
-
C.
1,2-đicloetan.
-
D.
But-2-in.
Đáp án : B
2-clopropen: CH2=CCl-CH3 => không có đồng phân hình học
but-2-en: CH3-CH=CH-CH3 => có đồng phân hình học
1,2-đicloetan: CHCl2-CHCl2 => không có đồng phân hình học
But-2-in: CH≡C-CH-CH3 => không có đphh
Hòa tan hoàn toàn 21,38 gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 và FeCl2 (trong đó nguyên tố oxi chiếm 14,967% về khối lượng) vào dung dịch chứa HCl và 0,16 mol NaNO3, thu được dung dịch Y chỉ chứa 47,82 gam muối của kim loại và hỗn hợp hai khí có tỉ khối so với H2 là 17 (trong đó có một khí hóa nâu trong không khí). Cho Y phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được 115,54 gam kết tủa. Phần trăm khối lượng của FeCl2 trong X có giá trị gần nhất với giá trị nào sau đây?
-
A.
34
-
B.
35
-
C.
36
-
D.
37
Đáp án : C
Quy đổi hỗn hợp thành Fe, CO2, O và Cl
Sử dụng bảo toàn e, bảo toàn nguyên tố
\({m_O} = \dfrac{{14,967\% .21,38}}{{100}} = 3,2\,\,gam \to {n_{O(X)}} = \dfrac{{3,2}}{{16}} = 0,2\,\,mol\)
Hỗn hợp 2 khí chắc chắn có CO2, khí còn lại hóa nâu trong không khí → khí còn lại là NO

Quy đổi hỗn hợp
\(21,38\,(g)\left\{ \matrix{
C{O_2}:2a \hfill \cr
Fe:b \hfill \cr
O:(0,2 - 4a) \hfill \cr
Cl:c \hfill \cr} \right. + \left\{ \matrix{
HCl:d \hfill \cr
NaN{O_3}:0,16 \hfill \cr} \right.\buildrel {} \over
\longrightarrow \left\{ \matrix{
\left\{ \matrix{
NO:5a \hfill \cr
C{O_2}:2a \hfill \cr} \right. \hfill \cr
47,82(g)\left\{ \matrix{
F{e^{2 + }},F{e^{3 + }},N{a^ + } \hfill \cr
N{O_3}^ - ,C{l^ - } \hfill \cr} \right.\buildrel { + AgN{O_3}\,du} \over
\longrightarrow \left\{ \matrix{
\overbrace {Ag,AgCl \downarrow }^{115,54(g)} \hfill \cr
F{e^{3 + }},N{a^ + },N{O_3}^ - \hfill \cr} \right. \hfill \cr
{H_2}O:0,5d \hfill \cr} \right.\)
Sau tất cả ta có:
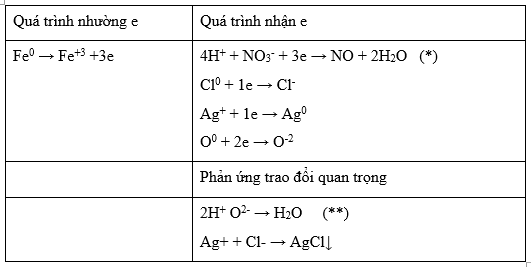
Ta có: mX = 2.44a + 56b + (0,2-4a).16 + 35,5c = 21,38 → 24a + 56b +35,5c = 18,18 (1)
\({n_{{H^ + }}} = 4{n_{NO}} + 2{n_O}\) → d = 4.5a + 2.(0,2- 4a)→ 12a -d = -0,4 (2)
\({n_{{H_2}O}} = \dfrac{1}{2}.{n_{{H^ + }}}\) = 0,5d (mol)
BTKL ta có:
mX + mHCl + \({m_{NaN{{\text{O}}_3}}}\) = mmuối + mkhí + \({m_{{H_2}O}}\)
→ 21,38 + 36,5d + 0,16.85 = 47,82 + 2a.44 + 5a.30 + 0,5d.18
→ 238a - 27,5d = -12,84 (3)
BTNT "Cl": nAgCl = \({n_{C{l^ - }}}\) = c + d (mol)
Bảo toàn e ta có: 3nFe = 2nO + 3nNO + \({n_{C{l^ - }}}\) + nAg
→ 3b = 2(0,2 - 4a) + 3.5a + c + nAg
→ nAg = 3b - 7a - c - 0,4 (mol)
Có: m↓ = mAgCl + mAg → 143,5(c + d) + 108(3b - 7a - c - 0,4) = 115,54
→ -756a + 324b + 35,5c + 143,5d = 158,74 (4)
giải hệ (1), (2), (3), (4) ra được a = 0,02 ; b = 0,24; c = 0,12; d = 0,64
→ \({n_{F{\text{e}}C{l_2}}} = \dfrac{c}{2}\) = 0,06 (mol)
% FeCl2 = \(\dfrac{{0,06.127}}{{21,38}}.100\% \) = 35,64% gần nhất với 36%
Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
-
A.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{1}{1}$
-
B.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{11}{9}$
-
C.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{8}{11}$
-
D.
$\frac{{{{\text{V}}_1}}}{{{{\text{V}}_2}}} = \frac{9}{10}$
Đáp án : B
+ V1 dung dịch axit có pH = 5 => nH+
+ V2 dung dịch bazơ có pH = 9 => pOH => nOH-
+ Dung dịch thu được có pH = 6 < 7 => môi trường axit. Vậy H+ dư sau phản ứng
=> tính toán PT theo OH−
+ V1 dung dịch axit có pH = 5
${\text{ = > [}}{{\text{H}}^ + }{\text{]}} = {10^{ - 5}}M = > {\text{ }}{n_{{H^ + }}}{\text{ = 1}}{{\text{0}}^{ - 5}}.{V_1}{\text{ }}(mol)$
+ V2 dung dịch bazơ có pH = 9 => pOH = 14 − 9 = 5
${\text{ = > [O}}{{\text{H}}^ - }{\text{]}} = {10^{ - 5}}M = > {\text{ }}{n_{O{H^ - }}} = {\text{ }}{10^{ - 5}}.{V_2}{\text{ (mol)}}$
+ Dung dịch thu được có pH = 6 < 7 => môi trường axit. Vậy H+ dư sau phản ứng
H+ + OH− → H2O
Ban đầu (mol) 10−5V1 10−5V2
Phản ứng ( mol) 10−5V2 10−5V2
Sau (mol) 10−5 (V1 −V2) −
+ Ta có : pH = 6 => [H+] dư = 10−6
$\frac{{{{10}^{ - 5}}({V_1} - {\text{ }}{V_2})}}{{{V_1} + {V_2}}} = {10^{ - 6}} = > \frac{{{V_1}}}{{{V_2}}} = \frac{{11}}{9}$
Các bài khác cùng chuyên mục
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1

















