Đề kiểm tra 1 tiết Hóa 11 chương 2: Nito - Photpho - Đề số 1
Đề bài
Tính bazơ của NH3 là do
-
A.
trên nguyên tử N còn cặp e tự do.
-
B.
phân tử có 3 liên kết cộng hóa trị phân cực.
-
C.
NH3 tan nhiều trong nước.
-
D.
NH3 tác dụng với nước tạo thành NH4OH.
Các dạng thù hình quan trọng của P là
-
A.
P trắng và P đen.
-
B.
P trắng và P đỏ.
-
C.
P đỏ và P đen.
-
D.
P trắng, P đỏ và P đen.
Số loại ion có trong dung dịch axit photphoric là bao nhiêu nếu không tính đến sự điện li của nước?
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
Hòa tan 142 gam P2O5 vào 500 gam dung dịch H3PO4 24,5%. Nồng độ % của H3PO4 trong dung dịch thu được là
-
A.
49,61%.
-
B.
56,32%.
-
C.
48,86%.
-
D.
68,75%.
Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
-
A.
21.
-
B.
15.
-
C.
19.
-
D.
8.
Nhóm nitơ gồm những nguyên tố nào ?
-
A.
N, P, Mg, Sb, Bi.
-
B.
N, P, As, Sb, Bi.
-
C.
N, P, As, Ni.
-
D.
N, P, Ca, Cs, Sb.
Trong các loại phân bón hoá học sau loại nào là phân đạm ?
-
A.
KCl.
-
B.
Ca3(PO4)2
-
C.
K2SO4
-
D.
(NH2)2CO
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là
-
A.
O2 < F2 < N2.
-
B.
O2 < N2 < F2.
-
C.
N2 < O2 < F2.
-
D.
N2 < F2 < O2.
Trong công nghiệp, để thu được axit photphoric có độ tinh khiết và nồng độ cao hơn, người ta điều chế bằng phản ứng :
-
A.
Ca5F(PO4)3 + 5H2SO4 $\xrightarrow{{{t}^{o}}}$ 5CaSO4↓ + 3H3PO4 + HF
-
B.
Ca(H2PO4)2 + H2SO4 → CaSO4↓ + 2H3PO4
-
C.
P2O5 + 3H2O → 2H3PO4
-
D.
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
Hoà tan hết 5,4 gam kim loại M trong HNO3 dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2 và N+4 là sản phẩm khử của N+5
-
A.
Fe
-
B.
Al
-
C.
Zn
-
D.
Mg
Phân bón nitrophotka (NPK) là hỗn hợp của
-
A.
(NH4)2HPO4, KNO3
-
B.
(NH4)2HPO4, NaNO3
-
C.
(NH4)3PO4, KNO3
-
D.
NH4H2PO4, KNO3
Nitơ phản ứng với chất nào sau đây ở điều kiện thường ?
-
A.
Mg.
-
B.
O2.
-
C.
Cl2.
-
D.
Li.
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau :
$Quặng -photphorit\xrightarrow{{{t}^{0}},Si{{O}_{2}},C}P\xrightarrow{{{t}^{0}}}{{P}_{2}}{{O}_{5}}\to {{H}_{3}}P{{O}_{4}}$
Biết hiệu suất chung của quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần khối lượng quặng photphorit chứa 73% Ca3(PO4)2 là
-
A.
1,18 tấn.
-
B.
1,81 tấn.
-
C.
1,23 tấn.
-
D.
1,32 tấn.
Phân kali cung cấp kali cho cây dưới dạng ion:
-
A.
NO3- và NH4+
-
B.
K+
-
C.
photphat (PO43-)
-
D.
K+ và NH4+
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì :
-
A.
Tạo ra khí có màu nâu.
-
B.
Tạo ra dung dịch có màu vàng.
-
C.
Tạo ra kết tủa có màu vàng.
-
D.
Tạo ra khí không màu, hoá nâu trong không khí.
Sau quá trình tổng hợp NH3 từ H2 và N2 $({{n}_{{{H}_{2}}}}:{{n}_{{{N}_{2}}}}=3:1)$, áp suất trong bình giảm đi 10% so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của N2, H2, NH3 trong hỗn hợp khí thu được sau phản ứng lần lượt là :
-
A.
25% ; 25% ; 50%.
-
B.
30% ; 25% ; 45%.
-
C.
22,22% ; 66,67% ; 11,11%.
-
D.
20% ; 40% ; 40% .
Nhiệt phân một lượng AgNO3 được chất rắn X và hỗn hợp khí Y. Dẫn toàn bộ Y vào một lượng dư H2O, thu được dung dịch Z. Cho toàn bộ X vào Z, X chỉ tan một phần và thoát ra khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của X đã phản ứng là
-
A.
70%.
-
B.
25%.
-
C.
60%.
-
D.
75%.
Sử dụng dung dịch Ba(OH)2 có thể phân biệt dãy dung dịch muối nào sau đây:
-
A.
MgCl2, NH4Cl, Na2SO4, NaNO3.
-
B.
AlCl3, ZnCl2, NH4Cl, NaCl.
-
C.
NH4Cl, (NH4)2SO4, Na2SO4, NaNO3.
-
D.
NH4NO3, NH4Cl, Na2SO4, NaCl.
Cho muối X vào dung dịch NaOH đun nhẹ thấy có khí mùi khai bay ra. Mặt khác, cho muối X vào dung dịch H2SO4 loãng sau đó cho Cu vào thấy Cu tan ra và có khí không màu bay lên và hóa nâu ngoài không khí. X có thể là
-
A.
NH4Cl.
-
B.
NaNO3.
-
C.
(NH4)2SO4.
-
D.
NH4NO3.
Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
-
A.
Dung dịch NaCl.
-
B.
Dung dịch NaOH.
-
C.
Dung dịch ancol etylic
-
D.
Dung dịch Ba(OH)2.
Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu, hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có mùi khai thoát ra. Chất X là
-
A.
amophot.
-
B.
ure.
-
C.
natri nitrat.
-
D.
amoni nitrat.
Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
-
A.
14,76.
-
B.
16,2.
-
C.
13,8.
-
D.
15,40.
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
-
A.
(NH4)3PO4
-
B.
NH4HCO3
-
C.
CaCO3
-
D.
NaCl
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
-
A.
(b).
-
B.
(a).
-
C.
(d).
-
D.
(c).
Axit HNO3 là một axit
-
A.
yếu.
-
B.
mạnh.
-
C.
rất yếu.
-
D.
trung bình.
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
-
A.
19,2 gam
-
B.
20,1 gam
-
C.
27,0 gam
-
D.
20,7 gam
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
-
A.
màu tím.
-
B.
màu đỏ.
-
C.
màu hồng.
-
D.
màu xanh.
Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
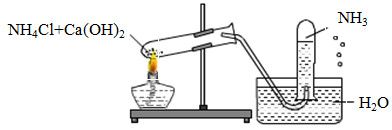
-
A.
NH3 không được điều chế từ NH4Cl và Ca(OH)2.
-
B.
NH3 không được thu bằng phương pháp đẩy nước mà là đẩy không khí.
-
C.
Thí nghiệm trên xảy ra ở điều kiện thường nên không cần nhiệt độ.
-
D.
Ống nghiệm phải để hướng xuống chứ không phải hướng lên.
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
-
A.
2,24 lít.
-
B.
11,2 lít.
-
C.
4,48 lít.
-
D.
6,72 lít.
Photpho trắng được bảo quản bằng cách ngâm trong:
-
A.
benzen.
-
B.
ete.
-
C.
dầu hoả.
-
D.
nước.
Lời giải và đáp án
Tính bazơ của NH3 là do
-
A.
trên nguyên tử N còn cặp e tự do.
-
B.
phân tử có 3 liên kết cộng hóa trị phân cực.
-
C.
NH3 tan nhiều trong nước.
-
D.
NH3 tác dụng với nước tạo thành NH4OH.
Đáp án : A
- Tính bazơ của NH3 là do trên nguyên tử N còn cặp e tự do không tham gia liên kết.
- Theo thuyết bronsted , bazo là chất nhận proton
- Theo thuyết areniut, bazo là chất tan trong nước phân li ra ion OH-
H2O + NH3 ⇌ OH– + NH4+
Các dạng thù hình quan trọng của P là
-
A.
P trắng và P đen.
-
B.
P trắng và P đỏ.
-
C.
P đỏ và P đen.
-
D.
P trắng, P đỏ và P đen.
Đáp án : B
2 dạng thù hình quan trọng của P là P trắng và P đỏ
Số loại ion có trong dung dịch axit photphoric là bao nhiêu nếu không tính đến sự điện li của nước?
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
Đáp án : C
Trong dung dịch H3PO4 phân li thuận nghịch theo 3 nấc:
Nấc 1: H3PO4 $\underset{{}}{\overset{{}}{\longleftrightarrow}}$ H+ + H2PO4-
Nấc 2: H2PO4- $\underset{{}}{\overset{{}}{\longleftrightarrow}}$ H+ + HPO42-
Nấc 3: HPO42- $\underset{{}}{\overset{{}}{\longleftrightarrow}}$ H+ + PO43-
=> trong dung dịch axit photphoric có 4 loại ion
Hòa tan 142 gam P2O5 vào 500 gam dung dịch H3PO4 24,5%. Nồng độ % của H3PO4 trong dung dịch thu được là
-
A.
49,61%.
-
B.
56,32%.
-
C.
48,86%.
-
D.
68,75%.
Đáp án : A
P2O5 + 3H2O → 2H3PO4
+) Tính tổng số mol H3PO4 trong dung dịch thu được
+) mdung dịch thu được = mP2O5 + mdung dịch ban đầu
nP2O5 = 1 mol; nH3PO4 ban đầu = 1,25 mol
P2O5 + 3H2O → 2H3PO4
1 mol → 2 mol
=> tổng số mol H3PO4 trong dung dịch thu được = 2 + 1,25 = 3,25 mol
=> mH3PO4 = 318,5 gam
mdung dịch thu được = mP2O5 + mdung dịch ban đầu = 142 + 500 = 642 gam
=> C% = 318,5 / 642 . 100% = 49,61%
Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
-
A.
21.
-
B.
15.
-
C.
19.
-
D.
8.
Đáp án : D
+) Coi Fe và S trogn 1 chất có tổng số oxi hóa là 0
+) Xác định các nguyên tố có số oxi hóa thay đổi
+) Viết quá trình cho - nhận e => xác định hệ số cân bằng
Coi Fe và S ban đầu có trong chất có số oxi hóa là 0
$\begin{align}& {{\overset{0}{\mathop{FeS}}\,}_{2}}+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O \\ & \,\,1.|{{\overset{0}{\mathop{FeS}}\,}_{2}}\to \,\,\overset{+3}{\mathop{Fe}}\,\,\,+\,\,2\overset{+6}{\mathop{S}}\,\,\,+\,\,15e \\ & 5.|\overset{+5}{\mathop{N}}\,\,+\,\,3e\,\,\to \,\,\overset{+2}{\mathop{N}}\, \\ \end{align}$
=> PTHH: FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
=> hệ số của HNO3 là 8
Nhóm nitơ gồm những nguyên tố nào ?
-
A.
N, P, Mg, Sb, Bi.
-
B.
N, P, As, Sb, Bi.
-
C.
N, P, As, Ni.
-
D.
N, P, Ca, Cs, Sb.
Đáp án : B
Xem lại lí thuyết nitơ
Nhóm nitơ gồm N, P, As, Sb, Bi.
Trong các loại phân bón hoá học sau loại nào là phân đạm ?
-
A.
KCl.
-
B.
Ca3(PO4)2
-
C.
K2SO4
-
D.
(NH2)2CO
Đáp án : D
Phân đạm là phân chứa N => (NH2)2CO
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là
-
A.
O2 < F2 < N2.
-
B.
O2 < N2 < F2.
-
C.
N2 < O2 < F2.
-
D.
N2 < F2 < O2.
Đáp án : C
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là: N2 < O2 < F2.
Trong công nghiệp, để thu được axit photphoric có độ tinh khiết và nồng độ cao hơn, người ta điều chế bằng phản ứng :
-
A.
Ca5F(PO4)3 + 5H2SO4 $\xrightarrow{{{t}^{o}}}$ 5CaSO4↓ + 3H3PO4 + HF
-
B.
Ca(H2PO4)2 + H2SO4 → CaSO4↓ + 2H3PO4
-
C.
P2O5 + 3H2O → 2H3PO4
-
D.
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
Đáp án : C
Để sản xuất axit H3PO4 có độ tinh khiết và nồng độ cao hơn, người ta đốt cháy photpho để thu được P2O5, rồi cho P2O5 tác dụng với nước
\(4P + 5{{\text{O}}_2}\xrightarrow{{{t^0}}}2{P_2}{O_5}\)
P2O5 + 3H2O \( \to\) 2H3PO4
Hoà tan hết 5,4 gam kim loại M trong HNO3 dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2 và N+4 là sản phẩm khử của N+5
-
A.
Fe
-
B.
Al
-
C.
Zn
-
D.
Mg
Đáp án : B
Gọi nNO = x mol; nNO2 = y mol => nhỗn hợp khí = PT(1)
$\bar{M}=\frac{30x+46y}{x+y}=21.2$ => PT(2)
+) Viết quá trình cho – nhận e và áp dụng bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2
=> mối liên hệ M và n
Gọi nNO = x mol; nNO2 = y mol
=> nhỗn hợp khí = x + y = 0,4 mol (1)
$\bar{M}=\frac{30x+46y}{x+y}=21.2$ (2)
Từ (1) và (2) => x = 0,1; y = 0,3
Quá trình cho – nhận e:
$\begin{align}& \overset{0}{\mathop{M}}\,\to \overset{+n}{\mathop{M}}\,\,+\,ne;\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 1}e\to \overset{+4} {\mathop{\,N}}\,{{O}_{2}} \\ \end{align}$
Bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 = 0,6
$=>\,\,\frac{5,4}{M}.n=0,6\,\,=>\,\,M=9n$
Với n = 3 => M = 27 => M là Al
Phân bón nitrophotka (NPK) là hỗn hợp của
-
A.
(NH4)2HPO4, KNO3
-
B.
(NH4)2HPO4, NaNO3
-
C.
(NH4)3PO4, KNO3
-
D.
NH4H2PO4, KNO3
Đáp án : A
Phân bón nitrophotka (NPK) là hỗn hợp của (NH4)2HPO4, KNO3
Nitơ phản ứng với chất nào sau đây ở điều kiện thường ?
-
A.
Mg.
-
B.
O2.
-
C.
Cl2.
-
D.
Li.
Đáp án : D
Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua.
6Li + N2 $\to $ 2Li3N
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau :
$Quặng -photphorit\xrightarrow{{{t}^{0}},Si{{O}_{2}},C}P\xrightarrow{{{t}^{0}}}{{P}_{2}}{{O}_{5}}\to {{H}_{3}}P{{O}_{4}}$
Biết hiệu suất chung của quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần khối lượng quặng photphorit chứa 73% Ca3(PO4)2 là
-
A.
1,18 tấn.
-
B.
1,81 tấn.
-
C.
1,23 tấn.
-
D.
1,32 tấn.
Đáp án : A
+) Viết sơ đồ chuyển hóa rút gọn: Ca3(PO4)2 → 2H3PO4
+) Tính nCa3(PO4)2 lí thuyết theo số mol H3PO4
+) mCa3(PO4)2 thực tế dùng = mCa3(PO4)2 lí thuyết / H => mquặng
mH3PO4 = 1.49 / 100 = 0,49 tấn
Ca3(PO4)2 → 2H3PO4
310 196
0,775 tấn ← 0,49 tấn
=> mCa3(PO4)2 thực tế dùng = 0,775.100 / 90 = 31/36 tấn
=> mquặng = 31/36 . 100/73 = 1,18 tấn
Phân kali cung cấp kali cho cây dưới dạng ion:
-
A.
NO3- và NH4+
-
B.
K+
-
C.
photphat (PO43-)
-
D.
K+ và NH4+
Đáp án : B
Phân kali cung cấp kali cho cây dưới dạng ion K+
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì :
-
A.
Tạo ra khí có màu nâu.
-
B.
Tạo ra dung dịch có màu vàng.
-
C.
Tạo ra kết tủa có màu vàng.
-
D.
Tạo ra khí không màu, hoá nâu trong không khí.
Đáp án : D
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì tạo ra khí không màu, hoá nâu trong không khí.
Sau quá trình tổng hợp NH3 từ H2 và N2 $({{n}_{{{H}_{2}}}}:{{n}_{{{N}_{2}}}}=3:1)$, áp suất trong bình giảm đi 10% so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của N2, H2, NH3 trong hỗn hợp khí thu được sau phản ứng lần lượt là :
-
A.
25% ; 25% ; 50%.
-
B.
30% ; 25% ; 45%.
-
C.
22,22% ; 66,67% ; 11,11%.
-
D.
20% ; 40% ; 40% .
Đáp án : C
Theo giả thiết \({n_{{H_2}}}:{n_{{N_2}}} = 3:1\) nên ta giả sử lúc đầu có 1 mol N2 và 3 mol H2.
Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí : $\frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{{p_2}}} = \frac{{{p_1}}}{{90\% {p_1}}}$
Gọi số mol N2 và H2 phản ứng là x và 3x mol. Sau phản ứng số mol khí giảm bằng một nửa lượng phản ứng tức là giảm 2x mol.
Ta có : nN2, H2 ban đầu - nkhí giảm = nN2, H2, NH3 sau phản ứng
Theo giả thiết \({n_{{H_2}}}:{n_{{N_2}}} = 3:1\) nên ta giả sử lúc đầu có 1 mol N2 và 3 mol H2.
Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí :
$\frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{{p_2}}} = \frac{{{p_1}}}{{90\% {p_1}}}$ \( \Rightarrow \) nhỗn hợp khí sau phản ứng = \({n_2}\)= $4.\frac{{90}}{{100}} = 3,6\,\,mol$
Cách 1 : Tính số mol của các chất sau phản ứng dựa vào phản ứng
Phương trình phản ứng hoá học:
N2 + 3H2 $ \rightleftarrows $ 2NH3 (1)
bđ: 1 3 0 : mol
pư: x 3x 2x : mol
dư: 1–x 3–3x 2x : mol
Theo (1) ta thấy : nhỗn hợp khí sau phản ứng = (1 – x) + (3 – 3x) + 2x = 4 – 2x = 3,6 \( \Rightarrow \) x = 0,2
Vậy phần trăm về thể tích của các khí là :
$\% {V_{{N_2}}} = \frac{{1 - 0,2}}{{3,6}}.100\% = 22,22\% ;\,\,\% {V_H}_{_2} = \frac{{3 - 3.0,2}}{{3,6}}.100\% = 66,67\% ;\,\,\,\% {V_{N{H_3}}} = 11,11\% .$
Cách 2 : Dựa vào sự tăng giảm thể tích khí
Gọi số mol N2 và H2 phản ứng là x và 3x mol. Sau phản ứng số mol khí giảm bằng một nửa lượng phản ứng tức là giảm 2x mol.
Ta có : ${n_{({N_2},\,\,{H_2})\,\,ban\,\,đầu}} - {n_{khí\,\,gỉam}} = {n_{({N_2},\,\,{H_2},\,\,N{H_3})\,\,sau\,\,phản\,\,ứng}} \Rightarrow 4 - 2x = 3,6 \Rightarrow x = 0,2\,\,mol.$
Nhiệt phân một lượng AgNO3 được chất rắn X và hỗn hợp khí Y. Dẫn toàn bộ Y vào một lượng dư H2O, thu được dung dịch Z. Cho toàn bộ X vào Z, X chỉ tan một phần và thoát ra khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của X đã phản ứng là
-
A.
70%.
-
B.
25%.
-
C.
60%.
-
D.
75%.
Đáp án : D
2AgNO3 $\xrightarrow{{{t}^{o}}}$ 2Ag + 2NO2 + O2
4NO2 + O2 + 2H2O → 4HNO3
=> nAg = nHNO3
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
2AgNO3 $\xrightarrow{{{t}^{o}}}$ 2Ag + 2NO2 + O2
x → x → x → 0,5x
4NO2 + O2 + 2H2O → 4HNO3
x → 0,25x → x
=> nAg = nHNO3 = x mol
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
0,75x ← x
=> %mAg phản ứng = 75%
Sử dụng dung dịch Ba(OH)2 có thể phân biệt dãy dung dịch muối nào sau đây:
-
A.
MgCl2, NH4Cl, Na2SO4, NaNO3.
-
B.
AlCl3, ZnCl2, NH4Cl, NaCl.
-
C.
NH4Cl, (NH4)2SO4, Na2SO4, NaNO3.
-
D.
NH4NO3, NH4Cl, Na2SO4, NaCl.
Đáp án : C
|
|
NH4Cl |
(NH4)2SO4 |
Na2SO4 |
NaNO3. |
|
Ba(OH)2 |
Tạo khí mùi khai |
Tạo kết tủa trắng và khí mùi khai |
Tạo kết tủa trắng |
Không hiện tượng |
Loại A vì không phân biệt được MgCl2 và Na2SO4 vì đều tạo kết tủa trắng
Loại B vì không phân biệt được AlCl3 và ZnCl2 vì đều tạo kết tủa trắng rồi tan hết
Loại D vì không phân biệt được NH4NO3 và NH4Cl vì đều tạo khí mùi khai
Cho muối X vào dung dịch NaOH đun nhẹ thấy có khí mùi khai bay ra. Mặt khác, cho muối X vào dung dịch H2SO4 loãng sau đó cho Cu vào thấy Cu tan ra và có khí không màu bay lên và hóa nâu ngoài không khí. X có thể là
-
A.
NH4Cl.
-
B.
NaNO3.
-
C.
(NH4)2SO4.
-
D.
NH4NO3.
Đáp án : D
Hướng dẫn giải
+) Cho muối X vào dung dịch NaOH đun nhẹ thấy có khí mùi khai bay ra => X là muối amoni
+) Cho muối X vào dung dịch H2SO4 loãng sau đó cho Cu vào thấy Cu tan ra và có khí không màu bay lên và hóa nâu ngoài không khí => khí đó là NO => muối X chứa ion NO3-
=> X là muối NH4NO3.
Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
-
A.
Dung dịch NaCl.
-
B.
Dung dịch NaOH.
-
C.
Dung dịch ancol etylic
-
D.
Dung dịch Ba(OH)2.
Đáp án : B
Ta dùng NaOH vì
|
|
NH4Cl |
Na2SO4 |
Ba(HCO3)2 |
|
NaOH |
Tạo khí mùi khai |
Không hiện tượng |
Kết tủa trắng |
Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu, hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có mùi khai thoát ra. Chất X là
-
A.
amophot.
-
B.
ure.
-
C.
natri nitrat.
-
D.
amoni nitrat.
Đáp án : D
Khí X không màu là NO, khí mùi khai là NH3. Từ sản phẩm thu được suy ngược lại thành phần của X
Cu và H2SO4 tác dụng với chất X có khí không màu, hóa nâu trong không khí là NO => Trong X có nhóm NO3-
Khi X tác dụng với dd NaOH → khí mùi khai → khí đó là NH3
Vậy công thức của X là NH4NO3: amoni nitrat
PTHH: Cu + 4H2SO4 + 8NH4NO3 → 4(NH4)2SO4 + 3Cu(NO3)2 + 4H2O + 2NO↑
NaOH + NH4NO3 → NaNO3 + NH3↑(mùi khai) + H2O
Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
-
A.
14,76.
-
B.
16,2.
-
C.
13,8.
-
D.
15,40.
Đáp án : A
X + HNO3 → Muối + NO + H2O
BTKL: mH2O = mX + mHNO3 - m muối - mNO = ? => nH2O
BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => nNH4+
BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => nNO3-
BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O => nO(X)
=> m = mKL = mX - mO(X)
X + HNO3 → Muối + NO + H2O
BTKL: mH2O = mX + mHNO3 - m muối - mNO = 18,6 + 0,98.63 - 68,88 - 0,1.30 = 8,46 gam
=> nH2O = 0,47 mol
BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => 0,98 = 4nNH4+ + 2.0,47 => nNH4+ = 0,01 mol
BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => 0,98 = nNO3- + 0,01 + 0,1 => nNO3- = 0,87 mol
BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O
=> nO(X) + 3.0,98 = 3.0,87 + 0,1 + 0,47 => nO(X) = 0,24 mol
=> m = mKL = mX - mO(X) = 18,6 - 0,24.16 = 14,76 gam
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
-
A.
(NH4)3PO4
-
B.
NH4HCO3
-
C.
CaCO3
-
D.
NaCl
Đáp án : B
NH4HCO3 dễ bị nhiệt phân hủy, sinh ra nhiều muối nên được sử dụng làm bột nở, tạo độ xốp cho bánh.
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
-
A.
(b).
-
B.
(a).
-
C.
(d).
-
D.
(c).
Đáp án : D
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc.
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm.
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Axit HNO3 là một axit
-
A.
yếu.
-
B.
mạnh.
-
C.
rất yếu.
-
D.
trung bình.
Đáp án : B
Axit HNO3 là một axit mạnh
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
-
A.
19,2 gam
-
B.
20,1 gam
-
C.
27,0 gam
-
D.
20,7 gam
Đáp án : D
Trong phòng thí nghiệm người ta điều chế N2 bằng phản ứng:
NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O
- Tính toán theo PTHH.
NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O
Theo PTHH: nNaNO2 = nN2 = 6,72:22,4 = 0,3 mol
=> mNaNO2 = 0,3.69 = 20,7 gam
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
-
A.
màu tím.
-
B.
màu đỏ.
-
C.
màu hồng.
-
D.
màu xanh.
Đáp án : D
Dung dịch NH3 có môi trường bazơ nên làm quỳ tím chuyển sang màu xanh.
Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:

-
A.
NH3 không được điều chế từ NH4Cl và Ca(OH)2.
-
B.
NH3 không được thu bằng phương pháp đẩy nước mà là đẩy không khí.
-
C.
Thí nghiệm trên xảy ra ở điều kiện thường nên không cần nhiệt độ.
-
D.
Ống nghiệm phải để hướng xuống chứ không phải hướng lên.
Đáp án : B
Dựa vào tính tan của NH3
NH3 tan nhiều trong nước nên ta không sử dụng phương pháp đẩy nước để thu khí.
Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
-
A.
2,24 lít.
-
B.
11,2 lít.
-
C.
4,48 lít.
-
D.
6,72 lít.
Đáp án : C
Do Fe dư nên tạo thành muối Fe2+
Sử dụng định luật bảo toàn e: 2nFe = 3nNO => nNO = ?
Do Fe dư nên tạo thành muối Fe2+
nFe = (20 – 3,2)/56 = 0,3 mol
BTe ta có: 2nFe = 3nNO => nNO = 2.0,3/3 = 0,2 mol
=> V = 4,48 lít
Photpho trắng được bảo quản bằng cách ngâm trong:
-
A.
benzen.
-
B.
ete.
-
C.
dầu hoả.
-
D.
nước.
Đáp án : D
P trắng được bảo quản bằng cách ngâm trong nước
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1









