Trắc nghiệm Bài 42. Nồng độ dung dịch - Hóa học 8
Đề bài
Nồng độ phần trăm là nồng độ cho biết
-
A.
số gam chất tan có trong 100 gam dung dịch.
-
B.
số gam chất tan có trong 100 gam dung dịch bão hòa.
-
C.
số gam chất tan có trong 100 gam nước.
-
D.
số gam chất tan có trong 1 lít dung dịch.
Để tính nồng độ mol của dung dịch NaOH người ta làm thế nào?
-
A.
Tính số gam NaOH có trong 100 gam dung dịch.
-
B.
Tính số gam NaOH có trong 1 lít dung dịch.
-
C.
Tính số gam NaOH có trong 1000 gam dung dịch.
-
D.
Tính số mol NaOH có trong 1 lít dung dịch.
Công thức tính nồng độ phần trăm là
-
A.
$C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%$
-
B.
$C\%=\frac{n}{V}.100\%$
-
C.
$C\%=\frac{{{m}_{dd}}}{{{m}_{ct}}}.100\%$
-
D.
$C\%=\frac{V}{n}$
Tính khối lượng NaOH có trong 200 gam dung dịch NaOH 15%
-
A.
20 gam.
-
B.
30 gam.
-
C.
40 gam.
-
D.
50 gam.
Hoà tan 20 gam muối vào nước được dung dịch có nồng độ 10%
Khối lượng dung dịch nước muối thu được là
-
A.
200 gam.
-
B.
300 gam.
-
C.
400 gam.
-
D.
500 gam.
Tính khối lượng nước cần dựng cho sự pha chế
-
A.
100 gam.
-
B.
120 gam.
-
C.
130 gam.
-
D.
180 gam.
Số mol chất tan có trong 400 ml NaOH 6M là
-
A.
1,2 mol
-
B.
2,4 mol
-
C.
1,5 mol
-
D.
4 mol
Trong 200 ml dung dịch có hoà tan 16 gam NaOH. Tính nồng độ mol của dung dịch.
-
A.
1,2M.
-
B.
1,2%.
-
C.
2M.
-
D.
2%.
Tính khối lượng của Ba(OH)2 có trong 300 ml dung dịch Ba(OH)2 0,4M.
-
A.
27,36 gam
-
B.
2,052 gam
-
C.
20,52 gam
-
D.
9,474 gam
Hòa tan 10,6 gam Na2CO3 vào 456 ml nước thu được dung dịch A. Nồng độ mol của dung dịch A là
-
A.
0,32M
-
B.
0,129M
-
C.
0,2M
-
D.
0,219M
Cho dung dịch HCl 25% có D = 1,198 g/ml. Tính nồng độ mol của dung dịch đã cho
-
A.
8M
-
B.
8,2M
-
C.
7,9M
-
D.
6,5M
Cho dung dịch NaOH 4M có D = 1,43 g/ml. Tính C% của dung dịch NaOH đã cho.
-
A.
11,88%.
-
B.
12,20%
-
C.
11,19%
-
D.
11,79%
Hòa tan 75 gam HCl vào 225 gam nước thu được dung dịch B. C% của dung dịch B là
-
A.
25%.
-
B.
30%.
-
C.
35%.
-
D.
40%.
Cho 200 gam dung dịch FeCl2 9,525%. Tính số mol FeCl2 có trong dung dịch
-
A.
0,12 mol.
-
B.
0,20 mol.
-
C.
0,30 mol.
-
D.
0,15 mol.
Cần lấy bao nhiêu gam dung dịch HNO3 2,52% để có 3,78 gam HNO3 làm thí nghiệm?
-
A.
120 gam.
-
B.
150 gam.
-
C.
160 gam.
-
D.
100 gam.
Với một lượng chất xác định, khi tăng thể tích dung môi thì:
-
A.
Nồng độ phần trăm C% tăng, nồng độ mol CM tăng.
-
B.
Nồng độ phần trăm C% giảm, nồng độ mol CM giảm.
-
C.
Nồng độ phần trăm C% tăng, nồng độ mol CM giảm.
-
D.
Nồng độ phần trăm C% giảm, nồng độ mol CM tăng.
Hòa tan 124 gam natri oxit vào 876 ml nước (\({d_{{H_2}O}} = 1\,\,g/ml\)), phản ứng sinh ra natri hiđroxit. Nồng độ phần trăm của dung dịch thu được là:
-
A.
16%.
-
B.
17%.
-
C.
18%.
-
D.
19%.
Hòa tan 12,5 gam CuSO4.5H2O vào 8,75 ml nước. Xác định nồng độ phần trăm dung dịch thu được. (Biết DH2O = 1 g/ml)
-
A.
36,65%
-
B.
35,65%
-
C.
21,65%
-
D.
37,65%
Xác định nồng độ phần trăm của 10 ml dung dịch HCl 10,81M có khối lượng riêng d=1,19 gam/ml
-
A.
33, 16%
-
B.
33,18%
-
C.
46,16%
-
D.
37%
Dung dịch HCl bán trên thị trường có nồng độ phần trăm cao nhất là 37%, khối lượng riêng D = 1,19 g/ml. Hãy tính nồng độ mol/l của 10 ml dung dịch trên
-
A.
12,06 M
-
B.
6,06M
-
C.
11,02 M
-
D.
12,96M
Cho 23 g Na tan hoàn toàn trong 100 g H2O thu được dung dịch A và khí B. Nồng độ phần trăm của chất tan có trong dung dịch A là:
-
A.
32,87%
-
B.
32,78%
-
C.
18,7%
-
D.
17,8%
Trong 150 ml dd có hoà tan 8 gam NaOH. Nồng độ mol của dung dịch là:
-
A.
0,2M
-
B.
2M
-
C.
2,5M
-
D.
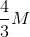
4/3M
Hòa tan 4,7g K2O vào 195,3 g nước. Nồng độ phần trăm dung dịch thu được là
-
A.
2,35%
-
B.
4,7%
-
C.
2,8%
-
D.
1,4%
Trộn 150g dung dịch NaOH có nồng độ 20% với 50g dung dịch NaOH có nồng độ 5%.
Tính nồng độ phần trăm của dung dịch thu được.
-
A.
12,8 %
-
B.
15,5 %
-
C.
12,6 %
-
D.
16,25 %
Để hoà tan m gam kẽm cần vừa đủ 50 gam dd HCl 7,3%. Khối lượng muối tạo thành sau phản ứng
-
A.
6,8 g
-
B.
12,5 g
-
C.
12,6 g
-
D.
28,9 g
Một bình đựng dung dịch có ghi “ dung dịch HCl 2M”. Phát biểu nào sau đây là đúng:
-
A.
Có 2 mol HCl trong 1 lít dung dịch.
-
B.
Có 2 gam HCl trong 1 lít dung dịch.
-
C.
Có 2 mol HCl trong 100 gam dung dịch.
-
D.
Có 2 gam HCl trong 100 gam dung dịch.
Câu nào sau đây đúng khi nói về nồng độ phần trăm?
Nồng độ phần trăm cho biết:
-
A.
Số gam chất tan có trong 100g dung dịch
-
B.
Số gam chất tan có trong 100g dung dịch bão hòa.
-
C.
Số gam chất tan có trong 100g nước
-
D.
Số gam chất tan có trong 1 lít dung dịch.
Dung dịch H2SO4 0,5M cho biết:
-
A.
Trong 1 lít dung dịch có hòa tan 0,5 mol H2SO4.
-
B.
Trong 1 lít dung môi có hòa tan 0,5 mol H2SO4.
-
C.
Trong 1 lít nước có hòa tan 0,5 mol H2SO4.
-
D.
Trong 1 lít nước có hòa tan 0,5 lít H2SO4.
Chất có khả năng hòa tan chất khác để tạo thành dung dịch gọi là
-
A.
Chất gây nghiện
-
B.
Dung môi
-
C.
Chất tan
-
D.
Chất tạo màu
Phương pháp nào dưới đây là đơn giản nhất để tách cát lẫn trong nước?
-
A.
Lọc.
-
B.
Dùng máy li tâm.
-
C.
Chiết.
-
D.
Cô cạn.
Làm bay hơi 20 gam nước từ dung dịch có nồng độ 15% thu được dung dịch có nồng độ 20%. Dung dịch ban đầu có khối lượng:
-
A.
90 gam.
-
B.
60 gam.
-
C.
70 gam.
-
D.
80 gam.
Hòa tan 2 mol NaCl vào nước ta thu được 4 lít dung dịch. Nồng độ mol/lít của dung dịch là
-
A.
1M.
-
B.
0,5M.
-
C.
0,1M.
-
D.
0,2M.
Lời giải và đáp án
Nồng độ phần trăm là nồng độ cho biết
-
A.
số gam chất tan có trong 100 gam dung dịch.
-
B.
số gam chất tan có trong 100 gam dung dịch bão hòa.
-
C.
số gam chất tan có trong 100 gam nước.
-
D.
số gam chất tan có trong 1 lít dung dịch.
Đáp án : A
Xem lại định nghĩa nồng độ phần trăm
Nồng độ phần trăm là nồng độ cho biết số gam chất tan có trong 100 gam dung dịch.
Để tính nồng độ mol của dung dịch NaOH người ta làm thế nào?
-
A.
Tính số gam NaOH có trong 100 gam dung dịch.
-
B.
Tính số gam NaOH có trong 1 lít dung dịch.
-
C.
Tính số gam NaOH có trong 1000 gam dung dịch.
-
D.
Tính số mol NaOH có trong 1 lít dung dịch.
Đáp án : D
Xem lại định nghĩa nồng độ mol dung dịch.
Để tính nồng độ mol của dung dịch NaOH, người ta tính số mol NaOH có trong 1 lít dung dịch.
Công thức tính nồng độ phần trăm là
-
A.
$C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%$
-
B.
$C\%=\frac{n}{V}.100\%$
-
C.
$C\%=\frac{{{m}_{dd}}}{{{m}_{ct}}}.100\%$
-
D.
$C\%=\frac{V}{n}$
Đáp án : A
Xem lại công thức tính nồng độ phần trăm
Công thức tính nồng độ phần trăm là: $C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%$
Tính khối lượng NaOH có trong 200 gam dung dịch NaOH 15%
-
A.
20 gam.
-
B.
30 gam.
-
C.
40 gam.
-
D.
50 gam.
Đáp án : B
Công thức tính khối lượng chất tan: ${{m}_{ct}}=\frac{{{m}_{dd}}.C\%}{100\%}$
Áp dụng công thức tính khối lượng chất tan: ${{m}_{ct}}=\frac{{{m}_{dd}}.C\%}{100\%}$
=> mNaOH = $\frac{200.15\%}{100\%}$= 30 gam
Hoà tan 20 gam muối vào nước được dung dịch có nồng độ 10%
Khối lượng dung dịch nước muối thu được là
-
A.
200 gam.
-
B.
300 gam.
-
C.
400 gam.
-
D.
500 gam.
Đáp án: A
Áp dụng công thức: ${{m}_{dd}}=\frac{{{m}_{ct}}.100\%}{C\%}$
Áp dụng công thức: ${{m}_{dd}}=\frac{{{m}_{ct}}.100\%}{C\%}=\frac{20.100\%}{10\%}=200\,gam$
Tính khối lượng nước cần dựng cho sự pha chế
-
A.
100 gam.
-
B.
120 gam.
-
C.
130 gam.
-
D.
180 gam.
Đáp án: D
Khối lượng dung dịch = khối lượng nước + khối lượng chất tan (muối)
Khối lượng dung dịch = khối lượng nước + khối lượng chất tan (muối)
=> mnước = mdd – mmuối = 200 - 20 = 180 gam
Số mol chất tan có trong 400 ml NaOH 6M là
-
A.
1,2 mol
-
B.
2,4 mol
-
C.
1,5 mol
-
D.
4 mol
Đáp án : B
Áp dụng công thức tính số mol chất tan: n = CM . V
Đổi 400 ml = 0,4 lít
+ Công thức tính số mol chất tan: n = CM . V
=> nNaOH = 6.0,4 = 2,4 mol
Trong 200 ml dung dịch có hoà tan 16 gam NaOH. Tính nồng độ mol của dung dịch.
-
A.
1,2M.
-
B.
1,2%.
-
C.
2M.
-
D.
2%.
Đáp án : C
Áp dụng công thức tính nồng độ mol của dung dịch: \({{C}_{M}}=\frac{n}{{{V}_{dd}}}\)
Đổi: 200 ml = 0,2 lít
nNaOH = $\frac{16}{40}=0,4\,mol$
Áp dụng công thức tính nồng độ mol của dung dịch: \({{C}_{M}}=\frac{n}{{{V}_{dd}}}=\frac{0,4}{0,2}=2M\)
Tính khối lượng của Ba(OH)2 có trong 300 ml dung dịch Ba(OH)2 0,4M.
-
A.
27,36 gam
-
B.
2,052 gam
-
C.
20,52 gam
-
D.
9,474 gam
Đáp án : C
+ Công thức tính số mol chất tan: n = CM . V => số mol Ba(OH)2 => khối lượng
Đổi 300 ml = 0,3 lít
+ Công thức tính số mol chất tan: n = CM . V
=> ${{n}_{Ba{{(OH)}_{2}}}}=0,4.0,3=0,12\,mol$
=> Khối lượng Ba(OH)2 có trong dung dịch là: ${{m}_{Ba{{(OH)}_{2}}}}=0,12.171=20,52\,gam$
Hòa tan 10,6 gam Na2CO3 vào 456 ml nước thu được dung dịch A. Nồng độ mol của dung dịch A là
-
A.
0,32M
-
B.
0,129M
-
C.
0,2M
-
D.
0,219M
Đáp án : D
+) tính số mol Na2CO3
+) Áp dụng công thức tính nồng độ mol: \({{C}_{M}}=\frac{n}{{{V}_{dd}}}\)
Đổi 456 ml = 0,456 lít
Số mol Na2CO3 là: ${{n}_{N{{a}_{2}}C{{O}_{3}}}}=\frac{10,6}{106}=0,1\,mol$
Áp dụng công thức tính nồng độ mol: \({{C}_{M}}=\frac{n}{{{V}_{dd}}}=\frac{0,1}{0,456}=0,219M\)
Cho dung dịch HCl 25% có D = 1,198 g/ml. Tính nồng độ mol của dung dịch đã cho
-
A.
8M
-
B.
8,2M
-
C.
7,9M
-
D.
6,5M
Đáp án : B
+) Áp dụng công thức:
\[{{\rm{C}}_{\rm{M}}}{\rm{ = }}\frac{{{\rm{C\% }}{\rm{.10}}{\rm{.D}}}}{{\rm{M}}}\]
+) Áp dụng công thức chuyển từ nồng độ phần trăm sang nồng độ mol:
\[{{\rm{C}}_{\rm{M}}}{\rm{ = }}\frac{{{\rm{C\% }}{\rm{.10}}{\rm{.D}}}}{{\rm{M}}}\]
=> Nồng độ mol dd đã cho là:
\[{{\rm{C}}_{\rm{M}}}{\rm{ = }}\frac{{{\rm{C\% }}{\rm{.10}}{\rm{.D}}}}{{\rm{M}}}{\rm{ = }}\frac{{{\rm{25\% }}{\rm{.10}}{\rm{.1,198}}}}{{{\rm{36,5}}}}{\rm{ = 8,2(M)}}\]
Cho dung dịch NaOH 4M có D = 1,43 g/ml. Tính C% của dung dịch NaOH đã cho.
-
A.
11,88%.
-
B.
12,20%
-
C.
11,19%
-
D.
11,79%
Đáp án : C
+) Đổi đơn vị của D sang g/lít
+) Áp dụng công thức chuyển từ nồng độ mol sang nồng độ phần trăm: \(C\%=\frac{{{C}_{M}}.M}{{{D}_{dd}}}.100\%\)
+) Đổi D = 1,43 g/ml = 1430 g/lít
+) Áp dụng công thức chuyển từ nồng độ mol sang nồng độ phần trăm: \(C\%=\frac{{{C}_{M}}.M}{{{D}_{dd}}}.100\%\)
=> \(C\%=\frac{4.40}{1430}.100\%=11,19\%\)
Hòa tan 75 gam HCl vào 225 gam nước thu được dung dịch B. C% của dung dịch B là
-
A.
25%.
-
B.
30%.
-
C.
35%.
-
D.
40%.
Đáp án : A
+) Tính khối lượng dung dịch: mdd = mct + mnước
+) Áp dụng công thức: $C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%$
Khối lượng dung dịch thu được là: mdd = mct + mnước = 75 + 225 = 300 gam
Áp dụng công thức: $C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%=\frac{75}{300}.100\%=25\%$
Cho 200 gam dung dịch FeCl2 9,525%. Tính số mol FeCl2 có trong dung dịch
-
A.
0,12 mol.
-
B.
0,20 mol.
-
C.
0,30 mol.
-
D.
0,15 mol.
Đáp án : D
Áp dụng công thức tính khối lượng chất tan: ${{m}_{ct}}=\frac{C\%.{{m}_{dd}}}{100\%}$=> khối lượng FeCl2 => số mol
Áp dụng công thức tính khối lượng chất tan: ${{m}_{ct}}=\frac{C\%.{{m}_{dd}}}{100\%}$
=> Khối lượng FeCl2 có trong dung dịch là: ${{m}_{F\text{e}C{{l}_{2}}}}=\frac{9,525\%.200}{100\%}=19,05\,gam$
=> số mol FeCl2 là: ${{n}_{F\text{e}C{{l}_{2}}}}=\frac{19,05}{127}=0,15\,mol$
Cần lấy bao nhiêu gam dung dịch HNO3 2,52% để có 3,78 gam HNO3 làm thí nghiệm?
-
A.
120 gam.
-
B.
150 gam.
-
C.
160 gam.
-
D.
100 gam.
Đáp án : B
Áp dụng công thức tính khối lượng dung dịch: ${{m}_{dd}}=\frac{{{m}_{ct}}.100\%}{C\%}$
Khối lượng chất tan là: ${{m}_{HN{{O}_{3}}}}=3,78\,gam$
Áp dụng công thức tính khối lượng dung dịch: ${{m}_{dd}}=\frac{{{m}_{ct}}.100\%}{C\%}$
=> Khối lượng dung dịch HNO3 cần lấy là: ${{m}_{dd}}=\frac{3,78.100\%}{2,52\%}=150\,gam$
Với một lượng chất xác định, khi tăng thể tích dung môi thì:
-
A.
Nồng độ phần trăm C% tăng, nồng độ mol CM tăng.
-
B.
Nồng độ phần trăm C% giảm, nồng độ mol CM giảm.
-
C.
Nồng độ phần trăm C% tăng, nồng độ mol CM giảm.
-
D.
Nồng độ phần trăm C% giảm, nồng độ mol CM tăng.
Đáp án : B
Ghi nhớ: công thức tính nồng độ phần trăm: \(C\% = \dfrac{{m\,c\tan }}{{m\,d\,d}}.100\% \)
Công thức tính nồng độ mol: \({C_M} = \dfrac{n}{V}\)
Từ đó suy luận được
Cùng một lượng chất xác định => khối lượng chất và số mol chất không thay đổi
Khi tăng thể tích dung môi => Thể tích dung môi tăng, khối lượng dung môi tăng
Nồng độ phần trăm:\(C\% = \dfrac{{m\,c\tan }}{{m\,d\,d}}.100\% \) mẫu số tăng lên khi khối lượng dung dịch tăng, còn mctan vẫn giữ nguyên => C% giảm
Nồng độ mol/lít: \({C_M} = \dfrac{n}{V}\) mẫu số V tăng, số mol n giữ nguyên => CM giảm
Hòa tan 124 gam natri oxit vào 876 ml nước (\({d_{{H_2}O}} = 1\,\,g/ml\)), phản ứng sinh ra natri hiđroxit. Nồng độ phần trăm của dung dịch thu được là:
-
A.
16%.
-
B.
17%.
-
C.
18%.
-
D.
19%.
Đáp án : A
Viết PTHH xảy ra, tính toán mol các chất theo số mol của Na2O
PTHH: Na2O + H2O → 2NaOH
mdd sau= mNa2O + mH2O = ? (g)
\(C\% NaOH = \dfrac{{{m_{NaOH}}}}{{m{\,_{dd\,sau}}}}.100\% = ?\% \)
nNa2O = 124: 62 = 2 (mol)
PTHH: Na2O + H2O → 2NaOH
Khối lượng H2O : mH2O = VH2O.d = 876.1 = 876 (g)
mdd sau= mNa2O + mH2O = 124 + 876 = 1000 (g)
Theo PTHH: nNaOH = 2nNa2O = 2.2 = 4 (mol) => mNaOH = 4. 40 = 160 (g)
\(C\% NaOH = \dfrac{{{m_{NaOH}}}}{{m{\,_{dd\,sau}}}}.100\% = \dfrac{{160}}{{1000}}.100 = 16\% \)
Hòa tan 12,5 gam CuSO4.5H2O vào 8,75 ml nước. Xác định nồng độ phần trăm dung dịch thu được. (Biết DH2O = 1 g/ml)
-
A.
36,65%
-
B.
35,65%
-
C.
21,65%
-
D.
37,65%
Đáp án : D
Khối lượng của nước là: mH2O = 8,75 . 1 = 8,75(g)
MCuSO4.5H2O = 64 + 32 + 16 . 4 + 5 . (1. 2 + 16) = 250(g/mol)
⟹nCuSO4.5H2O = 12,5 : 250 = 0,05(mol)
⟹nCuSO4= nCuSO4.5H2O = 0,05(mol) ⟹mCuSO4 = 0,05 . 160 = 8(g)
Khối lượng dung dịch sau là: mdd sau= 12,5 + 8,75 = 21,25(g)
\(C{\% _{CuS{O_4}}} = \frac{8}{{21,25}}.100\% = 37,65\% \)
Xác định nồng độ phần trăm của 10 ml dung dịch HCl 10,81M có khối lượng riêng d=1,19 gam/ml
-
A.
33, 16%
-
B.
33,18%
-
C.
46,16%
-
D.
37%
Đáp án : A
10ml = 0,01 (lít)
Số mol của HCl là: nHCl = CM. V= 10,81. 0,01 = 0,1081(mol).
⟹ mHCl = 0,1081. 36,5 = 3,94565(g)
Khối lượng dung dịch HCl là: mdd HCl= V.d= 10. 1,19=11,9 (g)a
\(C\% = \frac{{{m_{HCl}}}}{{{m_{{\rm{dd}}HCl}}}}.100\% = \frac{{3,94565}}{{11,9}}.100\% = 33,16\% \)
Dung dịch HCl bán trên thị trường có nồng độ phần trăm cao nhất là 37%, khối lượng riêng D = 1,19 g/ml. Hãy tính nồng độ mol/l của 10 ml dung dịch trên
-
A.
12,06 M
-
B.
6,06M
-
C.
11,02 M
-
D.
12,96M
Đáp án : A
Khối lượng dung dịch HCl 37% là: mdd HCl= 1,19 . 10 = 11,9 (g)
Khối lượng chất tan có trong 11,9 g dung dịch HCl 37% là:
\({m_{HCl}} = \frac{{{m_{dd\,HCl}}}}{{100\% }}.37\% = \frac{{11,9}}{{100}}.37 = 4,403\,(g) \Rightarrow {n_{HCl}} = \frac{{4,403}}{{36,5}} = 0,12063\,(mol)\)
⟹CM = n : V = 0,12063 : 0,01 = 12,06 M
Cho 23 g Na tan hoàn toàn trong 100 g H2O thu được dung dịch A và khí B. Nồng độ phần trăm của chất tan có trong dung dịch A là:
-
A.
32,87%
-
B.
32,78%
-
C.
18,7%
-
D.
17,8%
Đáp án : B
nNa= 23: 23=1 (mol)
Na+ H2O → NaOH + \(\frac{1}{2}\)H2
Theo phương trình:
nNaOH = nNa = 1(mol)
n H2 = 1 : 2 = 0,5 (mol)
⟹mNaOH= 1.40 = 40(g)
Khối lương dung dịch sau: mdd SAU = m Na + m H2O - H2 = 122(g)
Nồng độ phần trăm của NaOH là: \(C{\% _{NaOH}} = \frac{{40}}{{122}}.100\% = 32,78\% \)
Trong 150 ml dd có hoà tan 8 gam NaOH. Nồng độ mol của dung dịch là:
-
A.
0,2M
-
B.
2M
-
C.
2,5M
-
D.
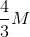
4/3M
Đáp án : D
Đổi: 150ml = 0,15lit
nNaOH = 8 : 40 = 0,2 mol
CM = n : V = 0,2 : 0,15 = 4/3M
Hòa tan 4,7g K2O vào 195,3 g nước. Nồng độ phần trăm dung dịch thu được là
-
A.
2,35%
-
B.
4,7%
-
C.
2,8%
-
D.
1,4%
Đáp án : C
nK2O= 4,7:94=0,05(mol)
Khối lượng dung dịch sau là: 4,7+ 195,3=200(g)
K2O + H2O → 2KOH
Theo phương trình: nKOH= 2nK2O= 2.0,05=0,1(mol)
Khối lượng KOH là: mKOH=0,1.56=5,6(mol)
\(C{\% _{KOH}} = \frac{{{m_{KOH}}}}{{{m_{{\rm{dd}}sau}}}}.100\% = \frac{{5,6}}{{200}}.100\% = 2,8\% \)
Trộn 150g dung dịch NaOH có nồng độ 20% với 50g dung dịch NaOH có nồng độ 5%.
Tính nồng độ phần trăm của dung dịch thu được.
-
A.
12,8 %
-
B.
15,5 %
-
C.
12,6 %
-
D.
16,25 %
Đáp án : D
Áp dụng công thức:
\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% .\)
- Khối lượng NaOH có trong 150g dung dịch 20%:
\({m_{ct(dd1)}} = \frac{{C\% .{m_{dd1}}}}{{100\% }} = \frac{{20.150}}{{100}} = 30(g).\)
- Khối lượng muối ăn có trong 50g dung dịch 5%:
\({m_{ct(dd2)}} = \frac{{C\% .{m_{dd2}}}}{{100\% }} = \frac{{5.50}}{{100}} = 2,5(g).\)
- mdd3 = 150 + 50 = 200(g).
- mct = 30 + 2,5 = 32,5(g).
Nồng độ phần trăm của dung dịch mới thu được là: 16,25%.
Để hoà tan m gam kẽm cần vừa đủ 50 gam dd HCl 7,3%. Khối lượng muối tạo thành sau phản ứng
-
A.
6,8 g
-
B.
12,5 g
-
C.
12,6 g
-
D.
28,9 g
Đáp án : A
Zn + 2HCl → ZnCl2 + H2
mHCl = (C% . mdd) : 100
= (50 . 7,3) : 100
= 3,65 gam
⟹ nHCl = 3,65:36,5
= 0,1 mol
Theo PTPƯ:
nZnCl2 = 1/2 . nHC l= 0,1 : 2 = 0,05 mol
⟹ mZnCl2 = 0,05 . 136= 6,8 gam
Một bình đựng dung dịch có ghi “ dung dịch HCl 2M”. Phát biểu nào sau đây là đúng:
-
A.
Có 2 mol HCl trong 1 lít dung dịch.
-
B.
Có 2 gam HCl trong 1 lít dung dịch.
-
C.
Có 2 mol HCl trong 100 gam dung dịch.
-
D.
Có 2 gam HCl trong 100 gam dung dịch.
Đáp án : A
Dựa vào kiến thức học về nồng độ mol trong sgk hóa 8 – trang 144
Dung dịch HCl 2M có nghĩa là có 2 mol HCl trong 1 lít dung dịch.
Câu nào sau đây đúng khi nói về nồng độ phần trăm?
Nồng độ phần trăm cho biết:
-
A.
Số gam chất tan có trong 100g dung dịch
-
B.
Số gam chất tan có trong 100g dung dịch bão hòa.
-
C.
Số gam chất tan có trong 100g nước
-
D.
Số gam chất tan có trong 1 lít dung dịch.
Đáp án : A
Nồng độ phần trăm: \(C\% = \frac{{{m_{chat\,\tan }}}}{{m{\,_{dung\,dich}}}}.100\% \) cho biết: số gam chất tan có trong 100g dung dịch
Dung dịch H2SO4 0,5M cho biết:
-
A.
Trong 1 lít dung dịch có hòa tan 0,5 mol H2SO4.
-
B.
Trong 1 lít dung môi có hòa tan 0,5 mol H2SO4.
-
C.
Trong 1 lít nước có hòa tan 0,5 mol H2SO4.
-
D.
Trong 1 lít nước có hòa tan 0,5 lít H2SO4.
Đáp án : A
Dung dịch H2SO4 0,5M cho biết: Trong 1 lít dung dịch có hòa tan 0,5 mol H2SO4.
Chất có khả năng hòa tan chất khác để tạo thành dung dịch gọi là
-
A.
Chất gây nghiện
-
B.
Dung môi
-
C.
Chất tan
-
D.
Chất tạo màu
Đáp án : B
Dung môi là chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Phương pháp nào dưới đây là đơn giản nhất để tách cát lẫn trong nước?
-
A.
Lọc.
-
B.
Dùng máy li tâm.
-
C.
Chiết.
-
D.
Cô cạn.
Đáp án : A
Phương pháp lọc dùng để tách chất rắn không tan ra khỏi hỗn hợp lỏng ⇒ Cát là chất rắn lẫn trong nước nên ta sử dụng phương pháp lọc để tách cát ra khỏi nước.
Làm bay hơi 20 gam nước từ dung dịch có nồng độ 15% thu được dung dịch có nồng độ 20%. Dung dịch ban đầu có khối lượng:
-
A.
90 gam.
-
B.
60 gam.
-
C.
70 gam.
-
D.
80 gam.
Đáp án : D
Gọi khối lượng dung dịch ban đầu là m (g)
\(\begin{array}{l}C\% = \frac{{mc\tan }}{{m\,dd\,sau}}.100\% \\ = > 20\% = \frac{{0,15m}}{{m - 20}}.100\% \\ = > m = ?\,(gam)\end{array}\)
Gọi khối lượng dung dịch ban đầu là m (g)
Khối lượng chất tan ban đầu là: 0,15m (g)
Sau khi làm bay hơi 20 gam nước thì khối lượng dung dịch sau là: m – 20 (g)
Nồng độ phần trăm sau phản ứng:
\(\begin{array}{l}C\% = \frac{{mc\tan }}{{m\,dd\,sau}}.100\% \\ = > 20\% = \frac{{0,15m}}{{m - 20}}.100\% \\ = > m = 80\,(gam)\end{array}\)
Hòa tan 2 mol NaCl vào nước ta thu được 4 lít dung dịch. Nồng độ mol/lít của dung dịch là
-
A.
1M.
-
B.
0,5M.
-
C.
0,1M.
-
D.
0,2M.
Đáp án : B
áp dụng công thức tính nồng độ mol: CM = n: V
Nồng độ mol/lít của NaCl = nNaCl : Vdd = 2 : 4 = 0,5 (M)
Luyện tập và củng cố kiến thức Bài 43. Pha chế dung dịch Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập pha trộn 2 dung dịch không xảy ra phản ứng Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập pha trộn 2 dung dịch có xảy ra phản ứng Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập hòa tan một chất vào nước và vào dung dịch cho sẵn Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập hòa tan kim loại và chất rắn vào dung dịch axit Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 41. Độ tan của một chất trong nước Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 40. Dung dịch Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Tổng hợp bài tập hòa tan kim loại và chất rắn vào dung dịch axit - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập hòa tan một chất vào nước và vào dung dịch cho sẵn - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch có xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch không xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Bài 43. Pha chế dung dịch - Hóa học 8










Danh sách bình luận