Trắc nghiệm Bài 19. Chuyển đổi giữa khối lượng, thể tích và lượng chất - Hóa học 8
Đề bài
Số mol phân tử N2 có trong 280 gam khí Nitơ là
-
A.
9 mol
-
B.
10 mol
-
C.
11 mol
-
D.
12 mol
Trong 24 gam MgO có bao nhiêu phân tử MgO?
-
A.
2,612.1023 phân tử
-
B.
3,612.1023 phân tử
-
C.
3,01.1023 phân tử
-
D.
4,2.1023 phân tử
Tính khối lượng nước biết trong đó có số phân tử bằng số phân tử có trong 20 gam NaOH?
-
A.
8 gam
-
B.
9 gam
-
C.
10 gam
-
D.
18 gam
Số mol nguyên tử hiđro có trong 36 gam nước là:
-
A.
1 mol
-
B.
1,5 mol
-
C.
2 mol
-
D.
4 mol
Phải lấy bao nhiêu gam sắt để có số nguyên tử nhiều gấp 2 lần số nguyên tử có trong 8 gam lưu huỳnh?
-
A.
29 gam
-
B.
28,5 gam
-
C.
28 gam
-
D.
56 gam
Thể tích của 280 gam khí nitơ ở đktc là:
+) Khí nitơ có công thức hóa học là N2
+) Tính khối lượng mol N2
+) \({n_{{N_2}}} = \frac{m}{M}\)
+) \({V_{{N_2}}} = n*22,4\)
-
A.
112 lít
-
B.
336 lít
-
C.
168 lít
-
D.
224 lít
Phải lấy bao nhiêu lít khí CO2 ở đktc để có 3,01.1023 phân tử CO2?
-
A.
11,2 lít
-
B.
33,6 lít
-
C.
16,8 lít
-
D.
22,4 lít
Lấy 1 mol mỗi mẫu chất sau: H2O, HCl, Fe2O3, C6H12O6. Mẫu chất có khối lượng lớn nhất là
-
A.
H2O
-
B.
HCl
-
C.
Fe2O3
-
D.
C6H12O6
Tìm dãy kết quả tất cả đúng về lượng chất (mol) của những khối lượng chất (gam) sau: 4 gam C; 62 gam P; 11,5 gam Na; 42 gam Fe
-
A.
0,33 mol C; 2 mol P; 0,5 mol Na; 0,75 mol Fe
-
B.
0,33 mol C; 2 mol P; 0,196 mol Na; 0,65 mol Fe
-
C.
0,33 mol C; 2 mol P; 0,196 mol Na; 0,75 mol Fe
-
D.
0,33 mol C; 3 mol P; 0,5 mol Na; 0,75 mol Fe
Tìm dãy tất cả kết quả đúng về số mol của những khối lượng chất sau: 15 gam CaCO3; 9,125 gam HCl; 100 gam CuO
-
A.
0,35 mol CaCO3, 0,25 mol HCl, 1,25 mol CuO
-
B.
0,25 mol CaCO3, 0,25 mol HCl, 1,25 mol CuO
-
C.
0,15 mol CaCO3, 0,25 mol HCl, 1,25 mol CuO
-
D.
0,15 mol CaCO3, 0,75 mol HCl, 1,25 mol CuO
Công thức đúng chuyển đổi giữa thể tích chất khí (đktc) và lượng chất là:
-
A.
22,4.n.V =1
-
B.
V = n.22,4
-
C.
n = 22,4.V
-
D.
V=22,4.N
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
-
A.
11, 2 lit
-
B.
22,4 lit
-
C.
4,48 lit
-
D.
15,68 lit
Số mol chứa trong 3.10 23 phân tử nước là:
-
A.
0,2 mol
-
B.
0,3 mol
-
C.
0,4 mol
-
D.
0,5 mol
Dãy kết quả tất cả đúng về khối lượng (g) của những chất sau là: 0,1 mol CH4; 0,15 mol CH3CHO; 0,3 mol HCOOC2H5.
-
A.
mCH4 = 1,6 g; mCH3CHO = 6,6 g; mHCOOC2H5 = 11,1 (g)
-
B.
mCH4 = 3,2 g; mCH3CHO = 6,6 g; mHCOOC2H5 = 11,1 (g)
-
C.
mCH4 = 1,6 g; mCH3CHO = 6,6 g; mHCOOC2H5 = 22,2 (g)
-
D.
mCH4 = 1,6 g; mCH3CHO = 5,5 g; mHCOOC2H5 = 22,2 (g)
Hỗn hợp X gồm 4 gam metan (CH4) và 7 gam etilen (C2H4) có thể tích là
-
A.
1,12 lít
-
B.
2,24 lít
-
C.
11,2 lít
-
D.
22,4 lít.
3,36 lít khí axetilen (C2H2) ở điều kiện tiêu chuẩn có khối lượng là
-
A.
3,9 gam
-
B.
3,7 gam
-
C.
3,8 gam
-
D.
2,4 gam
0,2 mol C2H5CHO có khối lượng là
-
A.
10,6 gam
-
B.
11,6 gam
-
C.
12,15 gam
-
D.
16,1 gam
4,48 lít khí X ở điều kiện tiêu chuẩn chiếm số mol là
-
A.
0,2 (mol)
-
B.
0,3 (mol)
-
C.
0,15 (mol)
-
D.
0,25 (mol)
Biết 0,125 mol X có khối lượng 20 gam. Khối lượng mol phân tử của chất X là
-
A.
30 (g/mol).
-
B.
80 (g/mol).
-
C.
160 (g/mol).
-
D.
120 (g/mol).
Ở cùng điều kiện nhiệt độ và áp suất, so sánh thể tích của 4 gam CH4 và 1 gam H2 ta có:
-
A.
Thể tích của khí CH4 lớn hơn
-
B.
Thể tích của H2 lớn hơn
-
C.
Bằng nhau
-
D.
Không thể so sánh được
1 mol khí SO2 ở điều kiện tiêu chuẩn có thể tích là:
-
A.
22,4 lít
-
B.
33,6 lít
-
C.
11,2 lít
-
D.
Không xác định được
Trong 16g CuSO4 có chứa bao nhiêu gam đồng?
-
A.
6,4g
-
B.
6,3g
-
C.
6,2g
-
D.
6,1g
Tính khối lượng khí H2 có trong 6,72 lít khí H₂(đo ở đktc)?
-
A.
0,6g
-
B.
24,5g
-
C.
52,5g
-
D.
25,5g
Tính số mol phân tử có trong 50 gam CaCO₃?
-
A.
1mol
-
B.
0,5mol
-
C.
1,2 mol
-
D.
1,5mol
0,75 mol phân tử hyđro(đo ở đktc) chiếm thể tích bao nhiêu lít?
-
A.
22,4 lít
-
B.
24 lít
-
C.
11,2 lít
-
D.
16,8 lít
Lời giải và đáp án
Số mol phân tử N2 có trong 280 gam khí Nitơ là
-
A.
9 mol
-
B.
10 mol
-
C.
11 mol
-
D.
12 mol
Đáp án : B
+) Khí Nitơ có công thức phân tử là N2
+) Tính khối lượng mol phân tử N2 => số mol N2 : $n = \dfrac{m}{M}$
Khối lượng mol phân tử N2 là: 14.2 = 28 g/mol
=> số mol N2 là : $n = \dfrac{m}{M}\, = \dfrac{{280}}{{28}} = 10\,(mol)$
Trong 24 gam MgO có bao nhiêu phân tử MgO?
-
A.
2,612.1023 phân tử
-
B.
3,612.1023 phân tử
-
C.
3,01.1023 phân tử
-
D.
4,2.1023 phân tử
Đáp án : B
+) Tính khối lượng mol của MgO=> số mol MgO là: $n = \dfrac{m}{M}$
=> số phân tử MgO là: n.6,02.1023
Khối lượng của MgO là: m = 24 g/mol
Khối lượng mol của MgO là: M = 24 + 16 = 40 gam
=> số mol MgO là: $n = \dfrac{m}{M}\, = \dfrac{{24}}{{40}} = 0,6\,(mol)$
=> số phân tử MgO là: 0,6.6,02.1023 = 3,612.1023 (phân tử)
Tính khối lượng nước biết trong đó có số phân tử bằng số phân tử có trong 20 gam NaOH?
-
A.
8 gam
-
B.
9 gam
-
C.
10 gam
-
D.
18 gam
Đáp án : B
+) Tính khối lượng mol của NaOH => số mol NaOH là: $n = \frac{m}{M}\, $
=> số mol của H2O
+) Tính Khối lượng mol của H2O => khối lượng nước là: m = n . M
Khối lượng mol của NaOH là: M = 23 + 16 + 1 = 40 g/mol
=> số mol NaOH là: $n = \frac{m}{M}\, = \frac{{20}}{{40}} = 0,5\,(mol)$
=> số mol của H2O là 0,5 mol
Khối lượng mol của H2O là: M = 2 + 16 = 18 g/mol
=> khối lượng nước là: m = n . M = 0,5.18 = 9 gam
Số mol nguyên tử hiđro có trong 36 gam nước là:
-
A.
1 mol
-
B.
1,5 mol
-
C.
2 mol
-
D.
4 mol
Đáp án : D
Khối lượng của H2O là: 36 gam
Khối lượng mol của H2O : M = 2.1 + 16 = 18 g/mol
=> số mol của H2O là: $n = \frac{m}{M}\, = \frac{{36}}{{18}} = 2\,(mol)$
Trong 1 phân tử H2O có 2 nguyên tử H
=> trong 2 mol phân tử H2O có: 2.2 = 4 mol nguyên tử H
Phải lấy bao nhiêu gam sắt để có số nguyên tử nhiều gấp 2 lần số nguyên tử có trong 8 gam lưu huỳnh?
-
A.
29 gam
-
B.
28,5 gam
-
C.
28 gam
-
D.
56 gam
Đáp án : C
Khối lượng của S là: m = 8 gam
Khối lượng mol của S là: M = 32 g/mol
=> số mol của S là: $n = \frac{m}{M}\, = \frac{8}{{32}} = 0,25\,(mol)$
Vì số nguyên tử của sắt nhiều gấp 2 lần số nguyên tử S => số mol sắt nhiều gấp 2 lần số mol S
=> số mol sắt là: 0,25.2 = 0,5 mol
Khối lượng mol của sắt là M = 56 g/mol
=> khối lượng sắt cần lấy là: m = n. M = 0,5.56 = 28 gam
Thể tích của 280 gam khí nitơ ở đktc là:
+) Khí nitơ có công thức hóa học là N2
+) Tính khối lượng mol N2
+) \({n_{{N_2}}} = \frac{m}{M}\)
+) \({V_{{N_2}}} = n*22,4\)
-
A.
112 lít
-
B.
336 lít
-
C.
168 lít
-
D.
224 lít
Đáp án : D
Khối lượng mol của khí N2 là: M = 2.14 = 28 g/mol
=> số mol khí N2 là: $n = \frac{m}{M}\, = \frac{{280}}{{28}} = 10\,(mol)$
=> thể tích cảu 280 gam khí nitơ là: V = n.22,4 = 10.22,4 = 224 lít
Phải lấy bao nhiêu lít khí CO2 ở đktc để có 3,01.1023 phân tử CO2?
-
A.
11,2 lít
-
B.
33,6 lít
-
C.
16,8 lít
-
D.
22,4 lít
Đáp án : A
1 mol CO2 chứa 6,02.1023 phân tử
=> $\dfrac{{3,{{01.10}^{23}}}}{{6,{{02.10}^{23}}}} = 0,5$ mol CO2 chứa 3,01.1023 phân tử
=> thể tích khí CO2 là: V = n.22,4 = 0,5.22,4 = 11,2 lít
Lấy 1 mol mỗi mẫu chất sau: H2O, HCl, Fe2O3, C6H12O6. Mẫu chất có khối lượng lớn nhất là
-
A.
H2O
-
B.
HCl
-
C.
Fe2O3
-
D.
C6H12O6
Đáp án : D
Vì cùng lấy 1 mol chất => chất có khối lượng lớn nhất cũng là chất có khối lượng mol lớn nhất
Khối lượng mol của H2O là: M = 2.1 + 16 = 18 g/mol
Khối lượng mol của HCl là: M = 1 + 35,5 = 36,5 g/mol
Khối lượng mol của Fe2O3 là M = 56.2 + 16.3 = 160 g/mol
Khối lượng mol của C6H12O6 là: M = 12.6 + 12 + 16.6 = 180 g/mol
=> chất có khối lượng lớn nhất là C6H12O6
Tìm dãy kết quả tất cả đúng về lượng chất (mol) của những khối lượng chất (gam) sau: 4 gam C; 62 gam P; 11,5 gam Na; 42 gam Fe
-
A.
0,33 mol C; 2 mol P; 0,5 mol Na; 0,75 mol Fe
-
B.
0,33 mol C; 2 mol P; 0,196 mol Na; 0,65 mol Fe
-
C.
0,33 mol C; 2 mol P; 0,196 mol Na; 0,75 mol Fe
-
D.
0,33 mol C; 3 mol P; 0,5 mol Na; 0,75 mol Fe
Đáp án : A
Số mol của 4 gam C là: $n = \frac{m}{M} = \frac{4}{{12}} = 0,33\,mol$
Số mol của 62 gam P là: $n = \frac{m}{M} = \frac{{62}}{{31}} = 2\,mol$
Số mol của 11,5 gam Na là: $n = \frac{m}{M} = \frac{{11,5}}{{23}} = 0,5\,mol$
Số mol của 42 gam Fe là: $n = \frac{m}{M} = \frac{{42}}{{56}} = 0,75\,mol$
Tìm dãy tất cả kết quả đúng về số mol của những khối lượng chất sau: 15 gam CaCO3; 9,125 gam HCl; 100 gam CuO
-
A.
0,35 mol CaCO3, 0,25 mol HCl, 1,25 mol CuO
-
B.
0,25 mol CaCO3, 0,25 mol HCl, 1,25 mol CuO
-
C.
0,15 mol CaCO3, 0,25 mol HCl, 1,25 mol CuO
-
D.
0,15 mol CaCO3, 0,75 mol HCl, 1,25 mol CuO
Đáp án : C
Chuyển đổi giữa lượng chất và khối lượng chất
Khối lượng mol của CaCO3 là: M = 40 + 12 + 16.3 = 100 g/mol
=> số mol của CaCO3 là: $n = \dfrac{m}{M} = \dfrac{{15}}{{100}} = 0,15\,mol$
Khối lượng mol của HCl là: M = 1 + 35,5 = 36,5 g/mol
=> số mol của HCl là: $n = \dfrac{m}{M} = \dfrac{{9,125}}{{36,5}} = 0,25\,mol$
Khối lượng mol của CuO là: M = 64 + 16 = 80 g/mol
=> số mol của CuO là: $n = \dfrac{m}{M} = \dfrac{{100}}{{80}} = 1,25\,mol$
Công thức đúng chuyển đổi giữa thể tích chất khí (đktc) và lượng chất là:
-
A.
22,4.n.V =1
-
B.
V = n.22,4
-
C.
n = 22,4.V
-
D.
V=22,4.N
Đáp án : B
Công thức chuyển đổi giữa thể tích chất khí(đktc) và chất lượng là: V= n. 22,4
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
-
A.
11, 2 lit
-
B.
22,4 lit
-
C.
4,48 lit
-
D.
15,68 lit
Đáp án : D
V =22,4 n
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
V = (0,5 +0,2).22,4 =15,68 lít
Số mol chứa trong 3.10 23 phân tử nước là:
-
A.
0,2 mol
-
B.
0,3 mol
-
C.
0,4 mol
-
D.
0,5 mol
Đáp án : D
N = 6.1023 .n
Số mol chứa trong 3.10 23 phân tử nước là:
3.1023 : (6.1023) = 0,5 mol
Dãy kết quả tất cả đúng về khối lượng (g) của những chất sau là: 0,1 mol CH4; 0,15 mol CH3CHO; 0,3 mol HCOOC2H5.
-
A.
mCH4 = 1,6 g; mCH3CHO = 6,6 g; mHCOOC2H5 = 11,1 (g)
-
B.
mCH4 = 3,2 g; mCH3CHO = 6,6 g; mHCOOC2H5 = 11,1 (g)
-
C.
mCH4 = 1,6 g; mCH3CHO = 6,6 g; mHCOOC2H5 = 22,2 (g)
-
D.
mCH4 = 1,6 g; mCH3CHO = 5,5 g; mHCOOC2H5 = 22,2 (g)
Đáp án : C
Tính phân tử khối của các chất sau đó áp dụng công thức: m = n×M (g)
MCH4 = MC + 4MH = 12 + 4.1 = 16 (g/mol) ⟹ mCH4 = nCH4×MCH4 = 0,1×16 = 1,6 (g)
MCH3CHO = 2MC + 4MH + MO = 2.12 + 4.1 + 16 = 44 (g/mol) ⟹ mCH3CHO = nCH3CHO×MCH3CHO = 0,15×44=6,6 (g)
MHCOOC2H5 = 3MC + 6MH + 2MO = 3,12 + 6.1 + 2.16 = 74 (g/mol)
⟹ mHCOOC2H5 = nHCOOC2H5×MHCOOC2H5 = 0,3×74 = 22,2 (g)
Hỗn hợp X gồm 4 gam metan (CH4) và 7 gam etilen (C2H4) có thể tích là
-
A.
1,12 lít
-
B.
2,24 lít
-
C.
11,2 lít
-
D.
22,4 lít.
Đáp án : C
Bước 1: Tính MCH4 = MC + 4MH ⟹ nCH4 = mCH4/MCH4
Bước 2: Tính MC2H4 = 2MC + 4MH ⟹ nC2H4 = mC2H4/MC2H4
Bước 3: Tính ∑nCH4+C2H4 =nCH4 + nC2H4. Từ đó tính được Vhh = ∑nCH4+C2H4 ×2,24
MCH4 = MC + 4MH = 12 + 4.1 = 16 (g/mol) \( \Rightarrow {n_{C{H_4}}} = \frac{{{m_{C{H_4}}}}}{{{M_{C{H_4}}}}} = \frac{4}{{16}} = 0,25\,(mol)\)
MC2H4 = 2MC + 4MH = 2.12 + 4.1 = 28 (g/mol) \( \Rightarrow {n_{{C_2}{H_4}}} = \frac{{{m_{{C_2}{H_4}}}}}{{{M_{{C_2}{H_4}}}}} = \frac{7}{{28}} = 0,25\,(mol)\)
⟹ ∑nCH4+C2H4 = 0,25 + 0,25 = 0,5 (mol)
Thể tích của hỗn hợp X là: Vx (đktc) = ∑nCH4+C2H4 ×2,24 = 0,5×2,24 =11,2 (lít)
3,36 lít khí axetilen (C2H2) ở điều kiện tiêu chuẩn có khối lượng là
-
A.
3,9 gam
-
B.
3,7 gam
-
C.
3,8 gam
-
D.
2,4 gam
Đáp án : A
Bước 1: Đổi số mol C2H2 theo công thức: n = V/22,4
Bước 2: Tính phân tử khối của C2H2 = 2MC + 2MH
Bước 3: Tính mC2H2 = nC2H2×MC2H2 = ?
Bước 1: Tính số mol: \(n = \frac{V}{{22,4}} = \frac{{3,36}}{{22,4}} = 0,15\,(mol)\)
Bước 2: Tính phân tử khối C2H2: MC2H2 = 2MC + 6M2= 2.12 + 2.1 = 26 (g/mol)
Bước 3: Tính: mC2H2 = nC2H2×MC2H2 = 0,15×26 = 3,9 (g)
0,2 mol C2H5CHO có khối lượng là
-
A.
10,6 gam
-
B.
11,6 gam
-
C.
12,15 gam
-
D.
16,1 gam
Đáp án : B
Bước 1: Tính MC2H5CHO = 3MC + 6MH + MO = ?
Bước 2: Tính mC2H5OH = nC2H5OH×MC2H5CHO = ?
Xét C2H5CHO = 3C + 6H + 1O = 3.12 + 6.1 + 1.16 = 58 (g/mol)
⟹ mC2H5CHO = n×M = 0,2×58 = 11,6 (g).
4,48 lít khí X ở điều kiện tiêu chuẩn chiếm số mol là
-
A.
0,2 (mol)
-
B.
0,3 (mol)
-
C.
0,15 (mol)
-
D.
0,25 (mol)
Đáp án : A
áp dụng công thức: \(n = \frac{V}{{22,4}} = ?\)
áp dụng công thức: \(n = \frac{V}{{22,4}} = \frac{{4,48}}{{22,4}} = 0,2\,(mol)\)
Biết 0,125 mol X có khối lượng 20 gam. Khối lượng mol phân tử của chất X là
-
A.
30 (g/mol).
-
B.
80 (g/mol).
-
C.
160 (g/mol).
-
D.
120 (g/mol).
Đáp án : C
áp dụng công thức: \(M = \frac{m}{n}\,\, = ?\,(g/mol)\)
áp dụng công thức: \(M = \frac{m}{n}\,\, = \frac{{20}}{{0,125}} = 160\,\,(g/mol)\)
Ở cùng điều kiện nhiệt độ và áp suất, so sánh thể tích của 4 gam CH4 và 1 gam H2 ta có:
-
A.
Thể tích của khí CH4 lớn hơn
-
B.
Thể tích của H2 lớn hơn
-
C.
Bằng nhau
-
D.
Không thể so sánh được
Đáp án : B
Cùng điều kiện nhiệt độ áp suất tỉ lệ số mol bằng tỉ lệ thể tích
nCH4 = 4 : 16 =0,25 mol
nH2 =0,5 mol
Vì nH2 > nCH4 nên VH2 > VCH4
1 mol khí SO2 ở điều kiện tiêu chuẩn có thể tích là:
-
A.
22,4 lít
-
B.
33,6 lít
-
C.
11,2 lít
-
D.
Không xác định được
Đáp án : A
Công thức tính thể tích của 1 chất ở đktc là: V = n ×22,4 = ? (lít)
Ở điều kiện tiêu chuẩn 1 mol khí bất kì có thể tích là 22,4 lít
Trong 16g CuSO4 có chứa bao nhiêu gam đồng?
-
A.
6,4g
-
B.
6,3g
-
C.
6,2g
-
D.
6,1g
Đáp án : A
nCuSO4 = mCuSO4 : MCuSO4 = 16 : 160 = 0,1 mol
Trong 1mol CuSO4 có 1 mol Cu
=> 0,1 mol CuSO4 có 0,1 mol Cu
=> mCu = nCu . MCu = 0,1 . 64 = 6,4g
Tính khối lượng khí H2 có trong 6,72 lít khí H₂(đo ở đktc)?
-
A.
0,6g
-
B.
24,5g
-
C.
52,5g
-
D.
25,5g
Đáp án : A

Tính số mol phân tử có trong 50 gam CaCO₃?
-
A.
1mol
-
B.
0,5mol
-
C.
1,2 mol
-
D.
1,5mol
Đáp án : B
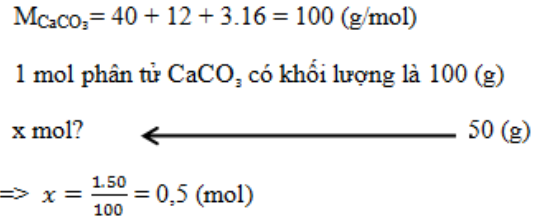
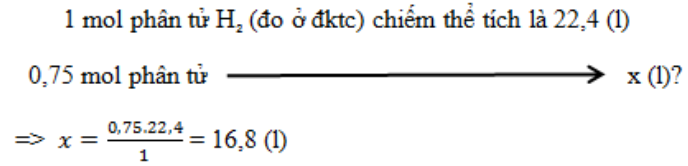
0,75 mol phân tử hyđro(đo ở đktc) chiếm thể tích bao nhiêu lít?
-
A.
22,4 lít
-
B.
24 lít
-
C.
11,2 lít
-
D.
16,8 lít
Đáp án : D
Luyện tập và củng cố kiến thức Bài 20. Tỉ khối của chất khí Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 21. Tính theo công thức hóa học Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 22. Tính theo phương trình hóa học Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập tính lượng chất dư, chất hết Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 18. Mol Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Tổng hợp bài tập hòa tan kim loại và chất rắn vào dung dịch axit - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập hòa tan một chất vào nước và vào dung dịch cho sẵn - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch có xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch không xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Bài 43. Pha chế dung dịch - Hóa học 8













Danh sách bình luận