Trắc nghiệm Bài tập lập công thức hóa học dựa vào thành phần phân tử MÔN HÓA Lớp 8 Sách cũ
Đề bài
Cho hợp chất A chứa 3 nguyên tố: Ca, C, O với tỉ lệ khối lượng là 40% Ca, 12%C, 48%O. Xác định CTHH của X.
-
A.
CaCO.
-
B.
CaC3O.
-
C.
CaCO3.
-
D.
CaCO2.
Phân tử đồng sunfat được tao bởi các nguyên tố Cu, S, O trong đó % khối lượng các nguyên tố đó: 40%, 20%, 40%. Xác định công thức phân tử của đồng sunfat.
-
A.
Cu4SO.
-
B.
CuSO4.
-
C.
Cu2S2O.
-
D.
CuSO3.
Phân tích một hợp chất vô cơ A, người ta nhận được % về khối lượng K là 45,95%; % về khối lượng N là 16,45%; % về khối lượng O là 37,6%. Công thức hóa học của A là
-
A.
KNO3.
-
B.
KNO.
-
C.
K2NO3.
-
D.
KNO2.
Cho hợp chất tạo bởi 2 nguyên tố Kali và Oxi trong đó K chiếm 82,98% về khối lượng. Biết phân tử khối là 94. Công thức hóa học của hợp chất trên là
-
A.
KO.
-
B.
K2O.
-
C.
KO2.
-
D.
K3O.
Tìm công thức hóa học của một oxit sắt gồm 2 nguyên tố Fe và O. Biết phân tử khối là 160. Tỉ số khối lượng của Fe và O là 7 : 3.
-
A.
Fe3O4.
-
B.
FeO.
-
C.
Fe2O3.
-
D.
Fe3O2.
Một hợp chất gồm 2 nguyên tố C và O. Tỉ số khối lượng của C và O là 3 : 4. Biết phân tử khối là 28. Tìm CTHH của hợp chất đó.
-
A.
CO.
-
B.
CO3.
-
C.
CO2.
-
D.
CO4.
Một hợp chất của nguyên tố M (hóa trị II) và O có phân tử khối là 40. CTHH của hợp chất đó là
-
A.
MgO.
-
B.
CuO.
-
C.
FeO.
-
D.
ZnO.
A là hợp chất của nguyên tố M (hóa trị I) và O, trong đó M chiếm 74,2% về khối lượng. Xác định CTHH của A
-
A.
KO
-
B.
Cu2O
-
C.
K2O
-
D.
Na2O
Muối ăn gồm 2 nguyên tố hóa học là Na và Cl. Biết phân tử khối của muối ăn gấp 29,25 lần phân tử khối của khí hiđro. Công thức hóa học của muối ăn là
-
A.
Na2Cl.
-
B.
NaCl2.
-
C.
NaCl.
-
D.
Na2Cl3.
Hợp chất A tạo bởi H và nhóm nguyên tử (XOy) hóa trị III. Biết rằng phân tử khối của A nặng bằng phân tử khối H2SO4 và nguyên tố oxi chiếm 65,31% về khối lượng của A. Công thức hóa học của hợp chất A là
-
A.
H3SO4.
-
B.
H3PO3.
-
C.
H3PO4.
-
D.
H3ClO4.
Trong số 4 loại phân đạm: Ure (NH2)2CO, Amoni sunfat (NH4)2SO4; Canxi nitrat Ca(NO3)2; Amoni nitrat NH4NO3. Loại phân đạm có hàm lượng nguyên tố Nitơ nhiều nhất là:
-
A.
Ure.
-
B.
Amoni sunfat.
-
C.
Canxi nitrat.
-
D.
Amoni nitrat.
Công thức hoá học của Sắt (III) oxit Fe2O 3 , thành phần % theo khối lượng của Fe là:
-
A.
70%
-
B.
60%
-
C.
50%
-
D.
40%
Biết Al có hóa trị III, nhóm (SO4) có hóa trị II. Công thức hóa học đúng là
-
A.
Al2(SO4)3.
-
B.
Al(SO4)3.
-
C.
Al2SO4.
-
D.
Al3(SO4)2.
Một hợp chất được tạo nên từ Al(III) và SO4(II) vậy công thức đúng là:
-
A.
Al2SO4.
-
B.
Al2(SO4)3.
-
C.
AlSO4.
-
D.
Al3SO4.
Lời giải và đáp án
Cho hợp chất A chứa 3 nguyên tố: Ca, C, O với tỉ lệ khối lượng là 40% Ca, 12%C, 48%O. Xác định CTHH của X.
-
A.
CaCO.
-
B.
CaC3O.
-
C.
CaCO3.
-
D.
CaCO2.
Đáp án : C
Bước 1: Lập công thức hóa học tổng quát của hợp chất dạng AxByCz
Bước 2: Dựa vào phần trăm khối lượng, xét tỉ lệ x : y : z
Bước 3: Kết luận công thức hóa học.
Gọi CTHH của A là ${\text{C}}{{\text{a}}_{\text{x}}}{C_y}{O_z}$
Ta có: $x:y:z = \dfrac{{\% {m_{Ca}}}}{{{M_{Ca}}}}:\dfrac{{\% {m_C}}}{{{M_C}}}:\dfrac{{\% {m_O}}}{{{M_O}}} = \dfrac{{40\% }}{{40}}:\dfrac{{12\% }}{{12}}:\dfrac{{48\% }}{{16}}$
$ \Rightarrow $ x : y : z = 1 : 1 : 3
$ \Rightarrow $ Công thức hóa học của A là: $CaC{O_3}$
Phân tử đồng sunfat được tao bởi các nguyên tố Cu, S, O trong đó % khối lượng các nguyên tố đó: 40%, 20%, 40%. Xác định công thức phân tử của đồng sunfat.
-
A.
Cu4SO.
-
B.
CuSO4.
-
C.
Cu2S2O.
-
D.
CuSO3.
Đáp án : B
Bước 1: Lập công thức hóa học tổng quát của hợp chất dạng AxByCz
Bước 2: Dựa vào phần trăm khối lượng, xét tỉ lệ x : y : z
Bước 3: Kết luận công thức hóa học.
Gọi CTHH của đồng sunfat là ${\text{C}}{{\text{u}}_{\text{x}}}{S_y}{O_z}$
Xét tỉ lệ : $x:y:z = \frac{{\% {m_{Cu}}}}{{{M_{Cu}}}}:\frac{{\% {m_S}}}{{{M_S}}}:\frac{{\% {m_O}}}{{{M_O}}} = \frac{{40\% }}{{64}}:\frac{{20\% }}{{32}}:\frac{{40\% }}{{16}}$ = 0,625 : 0,625 : 2,5
$ \Rightarrow $ x : y : z = 1 : 1 : 4
$ \Rightarrow $Công thức hóa học của phân tử đồng sunfat là: $CuS{O_4}$
Phân tích một hợp chất vô cơ A, người ta nhận được % về khối lượng K là 45,95%; % về khối lượng N là 16,45%; % về khối lượng O là 37,6%. Công thức hóa học của A là
-
A.
KNO3.
-
B.
KNO.
-
C.
K2NO3.
-
D.
KNO2.
Đáp án : D
Bước 1: Biện luận các nguyên tố có trong A
Bước 2: Lập công thức hóa học tổng quát của hợp chất là KxNyOz
Bước 3: Dựa vào phần trăm khối lượng, xét tỉ lệ x : y : z
Bước 4: Kết luận công thức hóa học.
Vì %K + %N + %O = 45,95% + 16,45% + 37,6% = 100% nên A chỉ chứa K, N, O
Gọi công thức của A là KxNyOz, ta có:
x : y : z = $\frac{{45,95}}{{39}}:\frac{{16,45}}{{14}}:\frac{{37,6}}{{16}}$ = 1,17 : 1,17 : 2,35 = 1 : 1 : 2
=> Công thức hóa học của hợp chất A là: KNO2
Cho hợp chất tạo bởi 2 nguyên tố Kali và Oxi trong đó K chiếm 82,98% về khối lượng. Biết phân tử khối là 94. Công thức hóa học của hợp chất trên là
-
A.
KO.
-
B.
K2O.
-
C.
KO2.
-
D.
K3O.
Đáp án : B
Bước 1: Lập công thức hóa học tổng quát của hợp chất là KxOy
Bước 2: Dựa vào phần trăm khối lượng của K, lập phương trình (1) theo ẩn x và y
Bước 3: Từ phân tử khối của hợp chất => lập phương trình (2)
Bước 4: Từ (1) và (2) giải x và y => kết luận công thức hóa học.
Gọi công thức hóa học cần tìm có dạng KxOy
K chiếm 82,98% về khối lượng => $\% {m_K} = \dfrac{{x.{M_K}}}{{x.{M_K} + y.{M_O}}}.100\% $
$ = > \dfrac{{39{\text{x}}}}{{39{\text{x}} + 16y}}.100\% = 82,98\% $
=> 39x = 0,8298.(39x + 16y)
=> 6,6378x = 13,2768y => x = 2y (1)
Phân tử khối của hợp chất là 94 => ${M_{{K_x}{O_y}}} = 39{\text{x}} + 16y = 94$ (2)
Thay (1) vào (2), ta có: ${M_{{K_x}{O_y}}} = 39.2y + 16y = 94 \Rightarrow y = 1 \Rightarrow x = 2$
Vậy công thức hóa học của hợp chất là K2O
Tìm công thức hóa học của một oxit sắt gồm 2 nguyên tố Fe và O. Biết phân tử khối là 160. Tỉ số khối lượng của Fe và O là 7 : 3.
-
A.
Fe3O4.
-
B.
FeO.
-
C.
Fe2O3.
-
D.
Fe3O2.
Đáp án : C
Bước 1: Lập công thức hóa học tổng quát của hợp chất là FexOy
Bước 2: Từ phân tử khối của hợp chất => lập phương trình (1)
Bước 3: Dựa vào tỉ lệ khối lượng của Fe và O, lập phương trình (2) theo ẩn x và y
Bước 4: Từ (1) và (2) giải x và y => kết luận công thức hóa học.
Cách 1:
Gọi CTHH của oxit sắt là $F{e_{\text{x}}}{O_y}$
${M_{F{e_{\text{x}}}{O_y}}} = 160 \Leftrightarrow 56x + 16y = 160$ (1)
$ \Leftrightarrow \frac{{{m_{Fe}}}}{{{m_O}}} = \frac{7}{3} \Leftrightarrow \frac{{56x}}{{16y}} = \frac{7}{3} \Leftrightarrow 56x = \frac{7}{3} \cdot 16y$ (2)
Thay (2) và (1), ta được:
$\frac{7}{3} \cdot 16y + 16y = 160 \Leftrightarrow y = 3 \Rightarrow x = 2$
$ \Rightarrow $Công thức hóa học của oxit sắt là: $F{e_2}{O_3}$
Cách 2:
Gọi CTHH của oxit sắt là $F{e_{\text{x}}}{O_y}$
Giả sử ${m_O} + {m_{Fe}} = 3a + 7a = 10a = 160 \Leftrightarrow a = 16$
$ \Rightarrow \left\{ \begin{gathered}{m_O} = 3.16 = 48 \hfill \\{m_{Fe}} = 7.16 = 112 \hfill \\ \end{gathered} \right.$
$ \Rightarrow \left\{ \begin{gathered}x = \frac{{{m_{Fe}}}}{{56}} = \frac{{112}}{{56}} = 2 \hfill \\y = \frac{{{m_O}}}{{16}} = \frac{{48}}{{16}} = 3 \hfill \\ \end{gathered} \right.$
Một hợp chất gồm 2 nguyên tố C và O. Tỉ số khối lượng của C và O là 3 : 4. Biết phân tử khối là 28. Tìm CTHH của hợp chất đó.
-
A.
CO.
-
B.
CO3.
-
C.
CO2.
-
D.
CO4.
Đáp án : A
Bước 1: Lập công thức hóa học tổng quát của hợp chất là CxOy
Bước 2: Từ phân tử khối của hợp chất => lập phương trình (1)
Bước 3: Dựa vào tỉ lệ khối lượng của C và O, lập phương trình (2) theo ẩn x và y
Bước 4: Từ (1) và (2) giải x và y => kết luận công thức hóa học.
Gọi CTHH của hợp chất là ${C_{\text{x}}}{O_y}$
${M_{{C_{\text{x}}}{O_y}}} = 28 \Leftrightarrow 12x + 16y = 28$ (1)
$ \Leftrightarrow \frac{{{m_C}}}{{{m_O}}} = \frac{3}{4} \Leftrightarrow \frac{{12x}}{{16y}} = \frac{3}{4} \Leftrightarrow 12x = \frac{3}{4} \cdot 16y$ (2)
Thay (2) và (1), ta được:
$\begin{gathered}\frac{3}{4} \cdot 16y + 16y = 28 \hfill \\\Leftrightarrow y = 1,x = 1 \hfill \\ \end{gathered} $
$ \Rightarrow $ Công thức hóa học của hợp chất là: CO
Một hợp chất của nguyên tố M (hóa trị II) và O có phân tử khối là 40. CTHH của hợp chất đó là
-
A.
MgO.
-
B.
CuO.
-
C.
FeO.
-
D.
ZnO.
Đáp án : A
Bước 1: Lập công thức hóa học của nguyên tố M (hóa trị II) với O
Bước 2: Lập phương trình tính phân tử khối của hợp chất => tính nguyên tử khối của M
Bước 3: Tìm M và kết luận CTHH
Theo bài ra, M có hóa trị II CTHH của hợp chất cần tìm có dạng: MO
Ta có: ${M_M} + {M_O} = 40$
$ \Leftrightarrow {M_M} = 40 - 16 = 24$
$ \Rightarrow $ M là Mg
$ \Rightarrow $ Công thức hóa học của hợp chất cần tìm là: MgO
A là hợp chất của nguyên tố M (hóa trị I) và O, trong đó M chiếm 74,2% về khối lượng. Xác định CTHH của A
-
A.
KO
-
B.
Cu2O
-
C.
K2O
-
D.
Na2O
Đáp án : D
Bước 1: Lập công thức hóa học của nguyên tố M (hóa trị I) với O
Bước 2: Lập phương trình tính phần trăm khối lượng của M => tính nguyên tử khối của M
Bước 3: Tìm M và kết luận CTHH
Theo bài ra, M có hóa trị I CTHH của hợp chất A có dạng: ${M_2}O$
Ta có: $\% {m_M} = \frac{{{m_M}}}{{{m_A}}}.100\% => \frac{{2{M_M}}}{{2{M_M} + 16}} = \frac{{74,2}}{{100}}$
$ \Leftrightarrow {M_M} = 23$
$ \Rightarrow $ M là Na
$ \Rightarrow $ Công thức hóa học của hợp chất cần tìm là:$N{a_2}O$
Muối ăn gồm 2 nguyên tố hóa học là Na và Cl. Biết phân tử khối của muối ăn gấp 29,25 lần phân tử khối của khí hiđro. Công thức hóa học của muối ăn là
-
A.
Na2Cl.
-
B.
NaCl2.
-
C.
NaCl.
-
D.
Na2Cl3.
Đáp án : C
Bước 1: Gọi công thức hóa học tổng quát của muối ăn
Bước 2: Tính phân tử khối của muối ăn dựa vào phân tử khối của H
Bước 3: Lập bảng, biện luận giá trị => CTHH
Gọi công thức hóa học của muối ăn là NaxCly
Phân tử khối của khí H2 là 2 => phân tử khối của muối ăn là: 29,25.2 = 58,5
Hay: ${M_{N{a_x}C{l_y}}} = 23{\text{x}} + 35,5y = 58,5$
Ta có bảng xét giá trị sau:
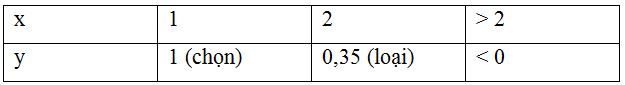
=> x = 1 và y = 1
=> CTHH của muối ăn là: NaCl
Hợp chất A tạo bởi H và nhóm nguyên tử (XOy) hóa trị III. Biết rằng phân tử khối của A nặng bằng phân tử khối H2SO4 và nguyên tố oxi chiếm 65,31% về khối lượng của A. Công thức hóa học của hợp chất A là
-
A.
H3SO4.
-
B.
H3PO3.
-
C.
H3PO4.
-
D.
H3ClO4.
Đáp án : C
B1: Viết CTHH của hợp chất A theo quy tắc hóa trị
B2: Tính phân tử khối của H2SO4
B3: Tính phân tử khối của A theo MX và y và cho bằng phân tử khối của H2SO4 => được PT(1)
B4: Vì guyên tố oxi chiếm 65,31% khối lượng của A => $\% {m_O} = \dfrac{{y.{M_O}}}{{{M_{{H_3}X{O_y}}}}}.100\% $ => tìm y sau đó thay vào (1) được MX
H có hóa trị I và nhóm nguyên tử (XOy) hóa trị III => công thức hóa học của hợp chất A có dạng: H3XOy
Ta có: ${M_{{H_2}S{O_4}}} = 2.1 + 32 + 16.4 = 98$
=> Phân tử khối của A là: ${M_{{H_3}X{O_y}}} = 3.1 + {M_X} + 16.y = 98 = > {M_X} + 16y = 95$ (1)
Nguyên tố oxi chiếm 65,31% khối lượng của A => $\% {m_O} = \dfrac{{y.{M_O}}}{{{M_{{H_3}X{O_y}}}}}.100\% $
$ \Rightarrow \dfrac{{16y}}{{98}}.100\% = 65,31\% = > y = 4$
Thay y = 4 vào (1) ta có: MX + 16.4 = 95 => MX = 31
Dựa vào bảng nguyên tố SGK – trang 42, nguyên tố có nguyên tử khối 31 là P
=> Công thức hóa học của hợp chất A là: H3PO4
Trong số 4 loại phân đạm: Ure (NH2)2CO, Amoni sunfat (NH4)2SO4; Canxi nitrat Ca(NO3)2; Amoni nitrat NH4NO3. Loại phân đạm có hàm lượng nguyên tố Nitơ nhiều nhất là:
-
A.
Ure.
-
B.
Amoni sunfat.
-
C.
Canxi nitrat.
-
D.
Amoni nitrat.
Đáp án : A
Công thức tính phần trăm của nguyên tử N trong chất A
\(\% N = \dfrac{{{m_N}}}{{{m_A}}}.100\% = ?\)
Ta thấy trong tất cả các chất đều có 2 nguyên tử N \( \to\) mN trong các chất bằng nhau
\( \to\) Tính xem chất nào có MA nhỏ nhất thì chất đó chứa hàm lượng N lớn nhất
Xét 1 mol mỗi chất
M(NH2)2CO = (14 + 1.2).2 + 12 + 16 = 60 đvC \( \Rightarrow \% N = \dfrac{{28}}{60} \times 100\% = 46,67\% \)
M(NH4)2SO4 = (14 + 1.4).2 + 32 + 16.4 = 132 đvC \( \Rightarrow \% N = \dfrac{{28}}{132} \times 100\% = 21,21\% \)
MCa(NO3)2 = 40 + (14 + 16.3).2 = 164 đvC \( \Rightarrow \% N = \dfrac{{28}}{164} \times 100\% = 17,07\% \)
MNH4NO3 = 14 + 1.4 + 14 + 16.3= 80 đvC \( \Rightarrow \% N = \dfrac{{28}}{80} \times 100\% = 35\% \)
Vậy hàm lượng nitơ có trong phân Ure nhiều nhất
Công thức hoá học của Sắt (III) oxit Fe2O 3 , thành phần % theo khối lượng của Fe là:
-
A.
70%
-
B.
60%
-
C.
50%
-
D.
40%
Đáp án : A
\(\% {m_{Fe}} = \dfrac{{2.56}}{{2.56 + 16.3}}.100\% = 70\% \)
Biết Al có hóa trị III, nhóm (SO4) có hóa trị II. Công thức hóa học đúng là
-
A.
Al2(SO4)3.
-
B.
Al(SO4)3.
-
C.
Al2SO4.
-
D.
Al3(SO4)2.
Đáp án : A
Công thức chung : Alx(SO4)y
Áp dụng quy tắc hóa trị x ×III = y× II
Suy ra tỉ lệ x : y => x, y =?
=> công thức hóa học là = ?
Al có hóa trị III, nhóm (SO4) có hóa trị II
Công thức chung : Alx(SO4)y
Theo quy tắc hóa trị: x ×III = y× II
Chyển thành tỉ lệ: \(\dfrac{x}{y} = \dfrac{{II}}{{III}} = \dfrac{2}{3}\)
Vậy lấy x = 2 và y = 3
=> công thức hóa học là: Al2(SO4)3
Một hợp chất được tạo nên từ Al(III) và SO4(II) vậy công thức đúng là:
-
A.
Al2SO4.
-
B.
Al2(SO4)3.
-
C.
AlSO4.
-
D.
Al3SO4.
Đáp án : B
Gọi công thức của hợp chất là: \({\mathop {Al}\limits^{III} _x}{(\mathop {S{O_4}}\limits^{II} )_y}\)
Áp dụng quy tắc hóa trị ta có: III×x = II×y
Từ đây suy ra được x, y
Gọi công thức của hợp chất là: \({\mathop {Al}\limits^{III} _x}{(\mathop {S{O_4}}\limits^{II} )_y}\)
Áp dụng quy tắc hóa trị ta có:
\(\eqalign{
& III.x = II.y \cr
& \Rightarrow {x \over y} = {{II} \over {III}} = {2 \over 3} \cr} \)
Chọn x =2 và y =3 => Công thức của hợp chất là: Al2(SO4)3
Luyện tập và củng cố kiến thức Tổng hợp bài tập tính phân tử khối Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Công thức hóa học Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 6. Đơn chất và hợp chất - Phân tử Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 5. Nguyên tố hóa học Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 4. Nguyên tử Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2. Chất Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Tổng hợp bài tập hòa tan kim loại và chất rắn vào dung dịch axit - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập hòa tan một chất vào nước và vào dung dịch cho sẵn - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch có xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch không xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Bài 43. Pha chế dung dịch - Hóa học 8










Danh sách bình luận