Trắc nghiệm Bài 4. Nguyên tử - Hóa học 8
Đề bài
Nguyên tử được tạo bởi các loại hạt
-
A.
Electron.
-
B.
Electron, proton, nơtron.
-
C.
Proton, nơtron.
-
D.
Nơtron.
Chọn đán án đúng nhất
-
A.
Trong nguyên tử có số p = số e
-
B.
Hạt nhân tạo bởi proton và electron
-
C.
Electron không chuyển động quanh hạt nhân
-
D.
Eletron chuyển động hỗn loạn và không sắp xếp theo từng lớp
Chọn đáp án sai
-
A.
Khối lượng của hạt nhân được coi là khối lượng của nguyên tử
-
B.
Trong nguyên tử có số proton và số electron bằng nhau.
-
C.
Hạt nhân tạo bởi proton và notron
-
D.
Oxi có số p khác số e
Đường kính của nguyên tử là
-
A.
10-8 cm
-
B.
10-9 cm
-
C.
10-8 m
-
D.
10-9 m
Vì sao nguyên tử có khả năng liên kết với nhau?
-
A.
Do có electron
-
B.
Do có notron
-
C.
Tự dưng có sẵn
-
D.
Do khối lượng hạt nhân bằng khối lượng nguyên tử
Vì sao khối lượng nguyên tử được coi bằng khối lượng hạt nhân?
-
A.
Do proton và notron có cùng khối lượng còn electron có khối lượng rất bé
-
B.
Do số p = số e
-
C.
Do hạt nhân tạo bởi proton và notron
-
D.
Do notron không mang điện
Trong khoảng không gian giữa hạt nhân và lớp vỏ electron của nguyên tử có những gì?
-
A.
Electron
-
B.
Notron
-
C.
Proton
-
D.
Không có gì
Hạt nhân được cấu tạo bởi:
-
A.
Notron và electron
-
B.
Proton và electron
-
C.
Proton và notron
-
D.
Electron
Nguyên tử Cacbon có điện tích hạt nhân là 6+. Số electron lớp ngoài cùng của Cacbon là:
-
A.
6
-
B.
4
-
C.
2
-
D.
1
Để biểu thị khối lượng của một nguyên tử, người ta dùng đơn vị
-
A.
miligam
-
B.
gam
-
C.
kilogam
-
D.
đvC
Nguyên tử nguyên tố A có 3 hạt proton trong hạt nhân. Vậy số hạt electron trong nguyên tử nguyên tố A là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Nguyên tử trung hòa về điện vì
-
A.
Số proton bằng số nơtron
-
B.
Số proton xấp xỉ số electron
-
C.
Có cùng số proton
-
D.
Số proton bằng số electron
Một nguyên tử có 17 electron, cấu tạo của nguyên tử đó có bao nhiêu lớp electron?
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Trong nguyên tử, hạt mang điện là
-
A.
hạt proton, hạt nơtron
-
B.
hạt proton, hạt electron
-
C.
hạt nhân, proton và hạt electron
-
D.
hạt nhân
Hạt nhân nguyên tử có cấu tạo bởi các loại hạt:
-
A.
Electron, Proton.
-
B.
Proton, Nơtron.
-
C.
Nơtron, Electron.
-
D.
Electron, Proton, Nơtron.
Số proton trong hạt nhân của nguyên tử Fe là:
-
A.
25
-
B.
26
-
C.
27
-
D.
24
Khẳng định nào sau đây đúng?
-
A.
Nguyên tử là những hạt vô cùng nhỏ gồm proton mang điện tích dương và các electron mang điện tích âm
-
B.
Nguyên tử là những hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử tạo bởi các electron mang điện tích âm.
-
C.
Hạt nhân nguyên tử gồm các hạt proton, notron, electron.
-
D.
Trong mỗi nguyên tử số proton bằng số electron cộng với số notron.
Số……..là số đặc trưng của một nguyên tố hóa học
-
A.
Proton
-
B.
Notron
-
C.
Electron
-
D.
Nơtron và electron
Nguyên tử oxi có 8 electron. Nguyên tử oxi có :
-
A.
8p; 2 lớp e; 6 e ở lớp ngoài cùng
-
B.
8p; 3 lớp e; 6 e ở lớp ngoài cùng.
-
C.
8p; 2 lớp e; 7 e ở lớp ngoài cùng.
-
D.
9p; 2 lớp e; 6 e ở lớp ngoài cùng.
Hoàn thành bảng sau và cho biết nhận định nào không chính xác trong các nhận định sau:
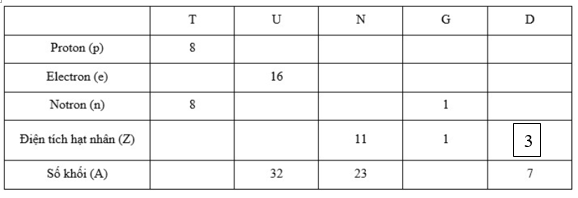
-
A.
T: số e = 8; Z = 8; A = 16 ; U: số p = 16 ; số n = 16; Z = 16
-
B.
N: số p = 11; số e = 11; số n = 12; G: số p = 1; số e = 1; A = 2
-
C.
T: số e = 8; Z = 8; A = 16 ; D: số p = 4; số e = 4; số n = 3; số Z = 4
-
D.
G: số p = 1; số e = 1; A = 2; D: số p = 3; số e = 3; số n = 4; số Z = 3
Tổng số hạt p,n,e trong 2 nguyên tử kim loại A và B là 177. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 47. Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 8. Số proton của A là:
-
A.
27
-
B.
26
-
C.
28
-
D.
23
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Điện tích hạt nhân của X là:
-
A.
18
-
B.
17
-
C.
15
-
D.
16
Ngtử của nguyên tố Y được cấu tạo bởi 36 hạt .Trong hạt nhân, hạt mang điện dương bằng số hạt không mang điện. Số proton có trong hạt nhân nguyên tử A là?
-
A.
12
-
B.
11
-
C.
13
-
D.
14
Nguyên tử của một nguyên tố A có tổng số hạt proton, nơtron, electron là 48, trong đó số hạt mang điện gấp hai lần số hạt không mang điện. Số hạt mỗi loại là:
-
A.
15,15,15.
-
B.
15,16,17.
-
C.
15,15, 16.
-
D.
16,16,16.
Tổng số hạt trong nguyên tử là 36, trong đó số hạt không mang điện chiếm xấp xỉ 50%. Số proton có trong nguyên tử là:
-
A.
9
-
B.
11
-
C.
24
-
D.
10
Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tổng số hạt p và n có trong nguyên tử M là:
-
A.
24.
-
B.
12
-
C.
34
-
D.
23
Nguyên tử Nhôm có điện tích hạt nhân là 13+. Trong nguyên tử nhôm, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số hạt notron của nhôm là?
-
A.
15
-
B.
14
-
C.
13
-
D.
12
Nguyên tử B có tổng số hạt là 28. Số hạt không mang điện chiếm 35,7%. Số proton, notron trong B lần lượt là:
-
A.
9,10.
-
B.
10,9.
-
C.
9,9.
-
D.
9,11
Mệnh đề nào sau đây không đúng ?
(1) Số điện tích hạt nhân đặc trưng cho 1 nguyên tố.
(2) Chỉ có hạt nhân nguyên tử oxi mới có 8 proton.
(3) Chỉ có hạt nhân nguyên tử oxi mới có 8 nơtron.
(4) Chỉ có trong nguyên tử oxi mới có 8 electron.
-
A.
3 và 4
-
B.
1 và 3
-
C.
4
-
D.
3
Lời giải và đáp án
Nguyên tử được tạo bởi các loại hạt
-
A.
Electron.
-
B.
Electron, proton, nơtron.
-
C.
Proton, nơtron.
-
D.
Nơtron.
Đáp án : B
Nguyên tử được tạo bởi các loại hạt electron, proton, nơtron.
Chọn đán án đúng nhất
-
A.
Trong nguyên tử có số p = số e
-
B.
Hạt nhân tạo bởi proton và electron
-
C.
Electron không chuyển động quanh hạt nhân
-
D.
Eletron chuyển động hỗn loạn và không sắp xếp theo từng lớp
Đáp án : A
Đáp án đúng là A. Trong nguyên tử có số p = số e
B sai vì hạt nhân tạo bởi proton và nơtron
C sai vì các e chuyển động rất nhanh và sắp xếp thành từng lớp từ trong ra ngoài, có một số electron nhất định.
D sai.
Chọn đáp án sai
-
A.
Khối lượng của hạt nhân được coi là khối lượng của nguyên tử
-
B.
Trong nguyên tử có số proton và số electron bằng nhau.
-
C.
Hạt nhân tạo bởi proton và notron
-
D.
Oxi có số p khác số e
Đáp án : D
Đáp án sai là: oxi có số p khác số e
Đường kính của nguyên tử là
-
A.
10-8 cm
-
B.
10-9 cm
-
C.
10-8 m
-
D.
10-9 m
Đáp án : A
Đường kính của nguyên tử là 10-8 cm
Vì sao nguyên tử có khả năng liên kết với nhau?
-
A.
Do có electron
-
B.
Do có notron
-
C.
Tự dưng có sẵn
-
D.
Do khối lượng hạt nhân bằng khối lượng nguyên tử
Đáp án : A
Nguyên tử có khả năng liên kết với nhau do các lớp electron chuyển động xung quanh hạt nhân
Vì sao khối lượng nguyên tử được coi bằng khối lượng hạt nhân?
-
A.
Do proton và notron có cùng khối lượng còn electron có khối lượng rất bé
-
B.
Do số p = số e
-
C.
Do hạt nhân tạo bởi proton và notron
-
D.
Do notron không mang điện
Đáp án : A
Khối lượng của hạt: \({{m}_{p}}={{m}_{n}}=1,{{6726.10}^{-27}}kg\) , \({{m}_{e}}=9,{{1094.10}^{-31}}kg\)
Như vậy, khối lượng của electron nhỏ hơn nhiều khối lượng proton và notron. Nên khi tính khối lượng tương đối của nguyên tử có thể bỏ qua khối lượng của electron.
Trong khoảng không gian giữa hạt nhân và lớp vỏ electron của nguyên tử có những gì?
-
A.
Electron
-
B.
Notron
-
C.
Proton
-
D.
Không có gì
Đáp án : D
Nguyên tử có cấu tạo rỗng => có khoảng không gian trống giữa hạt nhân và lớp vỏ electron của nguyên tử
Hạt nhân được cấu tạo bởi:
-
A.
Notron và electron
-
B.
Proton và electron
-
C.
Proton và notron
-
D.
Electron
Đáp án : C
Hạt nhân được cấu tạo bởi: Proton và notron
Nguyên tử Cacbon có điện tích hạt nhân là 6+. Số electron lớp ngoài cùng của Cacbon là:
-
A.
6
-
B.
4
-
C.
2
-
D.
1
Đáp án : B
C có 6+ e hạt nhân \( \to\) lớp vỏ ngoài cùng có 4 electron
Để biểu thị khối lượng của một nguyên tử, người ta dùng đơn vị
-
A.
miligam
-
B.
gam
-
C.
kilogam
-
D.
đvC
Đáp án : D
Khối lượng của một nguyên tử thường được sử dụng đơn vị là đvC
Để biểu thị khối lượng của một nguyên tử, người ta thường dùng đơn vị đvC
Nguyên tử nguyên tố A có 3 hạt proton trong hạt nhân. Vậy số hạt electron trong nguyên tử nguyên tố A là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Vì nguyên tử trung hòa về điện nên số proton bằng số electron
Vì nguyên tử trung hòa về điện nên số electron bằng số hạt proton và bằng 3
Nguyên tử trung hòa về điện vì
-
A.
Số proton bằng số nơtron
-
B.
Số proton xấp xỉ số electron
-
C.
Có cùng số proton
-
D.
Số proton bằng số electron
Đáp án : D
Vì trong nguyên tử, số proton = số electron. Mà proton mang điện tích dương, electron mang điện tích âm => Nguyên tử trung hòa về điện
Một nguyên tử có 17 electron, cấu tạo của nguyên tử đó có bao nhiêu lớp electron?
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Đáp án : B
Trong nguyên tử, các electron chuyển động rất nhanh và sắp xếp thhành từng lớp từ trong ra ngoài, có một số electron nhất định
+ Lớp 1 có tối đa 2e
+ Lớp 2, 3, 4… có tối đa 8e
Vì nguyên tử có 17e nên sẽ phân bố vào các lớp như sau
+ Lớp 1: 2e (1s2)
+ Lớp 2: 8e (2s22p6)
+ Lớp 3: 7e (3s23p5)
Vậy nguyên tử có 3 lớp electron
Trong nguyên tử, hạt mang điện là
-
A.
hạt proton, hạt nơtron
-
B.
hạt proton, hạt electron
-
C.
hạt nhân, proton và hạt electron
-
D.
hạt nhân
Đáp án : B
Trong nguyên tử, hạt mang điện là hạt proton và hạt electron
Hạt nhân nguyên tử có cấu tạo bởi các loại hạt:
-
A.
Electron, Proton.
-
B.
Proton, Nơtron.
-
C.
Nơtron, Electron.
-
D.
Electron, Proton, Nơtron.
Đáp án : B
Đọc lại cấu tạo hạt nhân nguyên tử
Hạt nhân cấu tạo bởi: Proton, Nơtron.
Học sinh có thể nhầm lẫn cấu tạo nguyên tử mà chọn đáp án 3 loại hạt Electron, Proton, Nơtron.
Số proton trong hạt nhân của nguyên tử Fe là:
-
A.
25
-
B.
26
-
C.
27
-
D.
24
Đáp án : B
Từ hình vẽ cho thấy Fe có tổng 26 e → hạt nhân của Fe có 26 hạt proton
Khẳng định nào sau đây đúng?
-
A.
Nguyên tử là những hạt vô cùng nhỏ gồm proton mang điện tích dương và các electron mang điện tích âm
-
B.
Nguyên tử là những hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử tạo bởi các electron mang điện tích âm.
-
C.
Hạt nhân nguyên tử gồm các hạt proton, notron, electron.
-
D.
Trong mỗi nguyên tử số proton bằng số electron cộng với số notron.
Đáp án : B
A. chưa rõ ràng và đầy đủ
B. đúng
C. sai vì hạt nhân nguyên tử gồm các hạt proton, notron
D. sai vì trong mỗi nguyên tử số proton bằng số electron
Số……..là số đặc trưng của một nguyên tố hóa học
-
A.
Proton
-
B.
Notron
-
C.
Electron
-
D.
Nơtron và electron
Đáp án : A
Số Proton là số đặc trưng của một nguyên tố hóa học
Nguyên tử oxi có 8 electron. Nguyên tử oxi có :
-
A.
8p; 2 lớp e; 6 e ở lớp ngoài cùng
-
B.
8p; 3 lớp e; 6 e ở lớp ngoài cùng.
-
C.
8p; 2 lớp e; 7 e ở lớp ngoài cùng.
-
D.
9p; 2 lớp e; 6 e ở lớp ngoài cùng.
Đáp án : A
Dựa vào kiến thức về nguyên tử SGK Hóa 8 trang 15
Nguyên tử oxi có 8 proton
Nguyên tử oxi có 2 lớp e trong đó có 6 e ở lớp ngoài cùng
Hoàn thành bảng sau và cho biết nhận định nào không chính xác trong các nhận định sau:

-
A.
T: số e = 8; Z = 8; A = 16 ; U: số p = 16 ; số n = 16; Z = 16
-
B.
N: số p = 11; số e = 11; số n = 12; G: số p = 1; số e = 1; A = 2
-
C.
T: số e = 8; Z = 8; A = 16 ; D: số p = 4; số e = 4; số n = 3; số Z = 4
-
D.
G: số p = 1; số e = 1; A = 2; D: số p = 3; số e = 3; số n = 4; số Z = 3
Đáp án : C
Số proton(p) = số electron (e)
Điên tích hạt nhân (Z) = số proton
Số khối (A) = số proton(p) + số notron (n)
Dựa vào mối quan hệ trên, các đại lượng nào chưa biết thì đi tìm dựa vào đại lượng đã
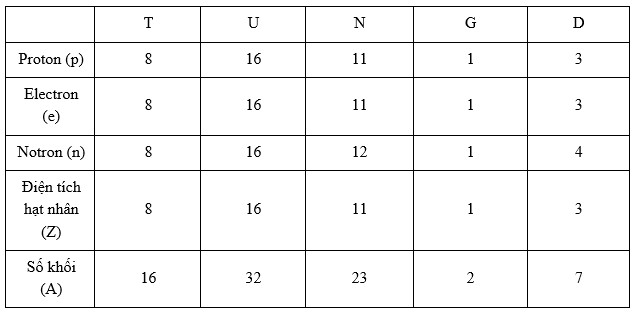
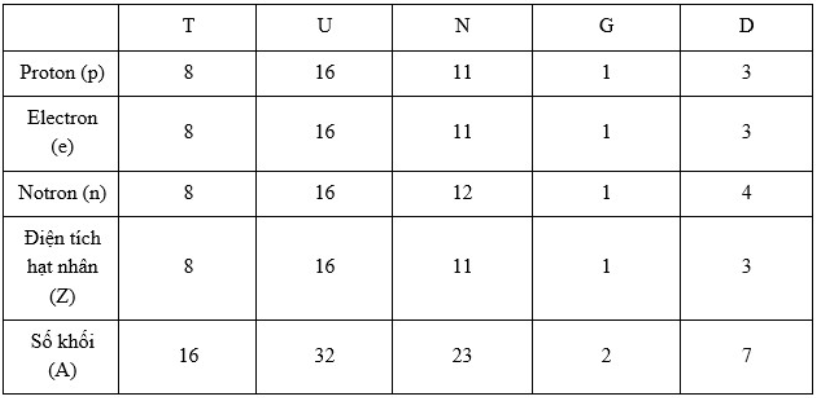
=> A, B, D đúng còn C sai
Tổng số hạt p,n,e trong 2 nguyên tử kim loại A và B là 177. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 47. Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 8. Số proton của A là:
-
A.
27
-
B.
26
-
C.
28
-
D.
23
Đáp án : B
Đặt số proton, notron của A lần lượt là pA, nA
Đặt số proton, notron của A lần lượt là pB, nB
Nguyên tử trung hòa về điện nên số proton = số notron → eA = pA ; eB = pB
Lập phương trình với dữ kiện 177; 47; 8. Sử dụng kiến thức toán học kết hợp 2 phương trình sẽ giải được tổng
(pA + pB) và (nA + nB).
Sau đó giải ra được riêng pA; pB = ?
Đặt số proton, notron của A lần lượt là pA, nA
Đặt số proton, notron của A lần lượt là pB, nB
Nguyên tử trung hòa về điện nên số proton = số notron → eA = pA ; eB = pB
Tổng số hạt p,n,e trong 2 nguyên tử A, B là 142 nên ta có phương trình:
(pA + eA + nA) + (pB + eB + nB) = 177
→ 2pA + nA + 2pB + nB = 177
→ 2pA + 2pB + nA + nB = 177 (1)
Trong A, B số hạt mang điện nhiều hơn số hạt không mang điện là 47 nên ta có phương trình
(pA + eA + pB + eB) – (nA + nB) = 47
→ (2pA + 2pB) – (nA + nB) = 47 (2)
Số hạt mang điện của B nhiều hơn A là 8 nên ta có phương trình
(pB + eB) – (pA + eA) = 8
→ 2pB – 2pA = 8
→ pB – pA = 4 (3)
Từ (1) và (2) ta có hệ phương trình:
\(\left\{ \begin{array}{l}(2{p_A} + 2{p_B}) + ({n_A} + {n_B}) = 177\\(2{p_A} + 2{p_B}) - ({n_A} + {n_B}) = 47\end{array} \right. \Rightarrow \left\{ \begin{array}{l}2{p_A} + 2{p_B} = 112\,(4)\\{n_A} + {n_B} = 65\end{array} \right.\)
Từ (3) và (4) kết hợp ta có hệ phương trình:
\(\left\{ \begin{array}{l} - {p_A} + {p_B} = 4\,(3)\\2{p_A} + 2{p_B} = 112\,(4)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{p_A} = 26\\{p_B} = 30\end{array} \right.\)
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Điện tích hạt nhân của X là:
-
A.
18
-
B.
17
-
C.
15
-
D.
16
Đáp án : D
Bước 1: Lập pt tổng số hạt = p + n + e = 2p + n (do p = e) (1)
Bước 2: Lập pt mỗi liên hệ giữa số hạt mang điện (p+e) và không mang điện (n)
n =53,125% (p+e) (2)
Bước 3: Giải hệ pt (1) (2) tìm p, n
Bước 1: Lập pt số hạt cơ bản
Tổng số hạt cơ bản trong X là 49 nên ta có: p + e + n = 49 => 2p + n = 49 (do p = e) (1)
Bước 2: Lập pt mỗi liên hệ giữa số hạt mang điện (p+e) và không mang điện (n)
Số hạt không mang điện bằng 53,125% số hạt mang điện => \(n = \frac{{53,125\% }}{{100\% }}(p + e)\,hay\,n = \frac{{53,125\% }}{{100\% }}.2p\,(2)\)
Bước 3: Giải hệ pt (1) (2) tìm p, n
Từ (1) và (2) ta có hệ phương trình: \(\left\{ \begin{array}{l}2p + n = 49\\0,53125.2p - n = 0\end{array} \right. \Rightarrow \left\{ \begin{array}{l}p = 16\\n = 17\end{array} \right.\)
Số điện tích hạt nhân: Z = số p = 16
Ngtử của nguyên tố Y được cấu tạo bởi 36 hạt .Trong hạt nhân, hạt mang điện dương bằng số hạt không mang điện. Số proton có trong hạt nhân nguyên tử A là?
-
A.
12
-
B.
11
-
C.
13
-
D.
14
Đáp án : A
Tổng số hạt của nguyên tử là p, n, e → lập phương trình với dữ kiện 36
Trong hạt nhân, hạt không mang điện là n; hạt mang điện là p → lập được phương trình hóa học hai hạt bằng nhau.
giải ra được p và n.
Từ đó tính được: Z = số p ; số khối A = p + n =?
Đặt số proton, notron của nguyên tử Y lần lượt là p và n
Nguyên tử trung hòa về điện nên số e = số p = p (hạt)
Tổng số hạt trong Y là 36 → p + e + n = 36 hay 2p + n = 36 (1)
Trong hạt nhân, hạt mang điện dương bằng hạt không mang điện nên: p = n (2)
Từ (1) và (2) ta có hệ phương trình: \(\left\{ \begin{array}{l}2p + n = 36\\p = n\end{array} \right. \Rightarrow p = n = \frac{{36}}{3} = 12\) (hạt)
Nguyên tử của một nguyên tố A có tổng số hạt proton, nơtron, electron là 48, trong đó số hạt mang điện gấp hai lần số hạt không mang điện. Số hạt mỗi loại là:
-
A.
15,15,15.
-
B.
15,16,17.
-
C.
15,15, 16.
-
D.
16,16,16.
Đáp án : D
Trong A, tổng số hạt là 48 → p + e + n = 48
Số hạt mang điện gấp hai số hạt không mang điện → (p+e) = 2n
Nguyên tử trung hòa về điện nên số e = số p. Thế vào 2 PTHH trên giải được ra p, n = ?
Đặt số proton, notron lần lượt là p và n (hạt)
Nguyên tử trung hòa về điện nên số electron = số proton = p (hạt)
Trong A, tổng số hạt là 48 → p + e + n = 48 hay 2p + n = 48 (1)
Số hạt mang điện gấp hai số hạt không mang điện → (p+e) = 2n hay 2p =2n → p = n (2)
Từ (1) và (2) ta có hệ phương trình:\(\left\{ \begin{array}{l}2p + n = 48\\p - n = 0\end{array} \right. \Rightarrow p = n = 16\)
Vậy số hạt proton, electron, notron đều là 16 hạt
Tổng số hạt trong nguyên tử là 36, trong đó số hạt không mang điện chiếm xấp xỉ 50%. Số proton có trong nguyên tử là:
-
A.
9
-
B.
11
-
C.
24
-
D.
10
Đáp án : A
Hạt không mang điện là notron, chiếm 50% → n = ?
Dựa vào dữ kiện tổng số hạt là 36 tìm được nốt p = e = (36-n)/2 =?
Hạt không mang điện là notron, chiếm 50% \( \Rightarrow n = 36 \times \frac{{50\% }}{{100\% }} = 18\)(hạt)
Tổng số hạt proton và electron còn lại là: 36 – 18 = 18 (hạt)
Nguyên tử trung hòa về điện nên số proton = số electron = 18/2 = 9 (hạt)
Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tổng số hạt p và n có trong nguyên tử M là:
-
A.
24.
-
B.
12
-
C.
34
-
D.
23
Đáp án : D
Lập phương trình với dữ kiện 1
Lập phương trình với dữ kiện 10
giải hệ được p, n =?
Từ đó tìm được số khối: A = p+n
Đặt số proton, notron lần lượt là p và n (hạt)
Nguyên tử trung hòa về điện nên số electron = số proton = p (hạt)
Trong M, số notron nhiều hơn số proton là 1 → n – p = 1 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 10 → p + e – n = 10 hay 2p – n = 10 (2)
Từ (1) và (2) ta có hệ phương trình:\(\left\{ \begin{array}{l}n - p = 1\,\\ - n + 2p = 10\end{array} \right. \Rightarrow \left\{ \begin{array}{l}n = 12\\p = 11\end{array} \right.\)
Tổng số hạt p và n có trong nguyên tử M là: p + n = 11 + 12 = 23
Nguyên tử Nhôm có điện tích hạt nhân là 13+. Trong nguyên tử nhôm, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số hạt notron của nhôm là?
-
A.
15
-
B.
14
-
C.
13
-
D.
12
Đáp án : B
Bước 1: Tính số p, e của nhôm
Số p = số e = ZAl
Bước 2: Lập pt mối quan hệ giữa số hạt mang điện (p + e) và không mang điện (n)
Bước 3: Tìm n
Bước 1: Tính số p, e của nhôm
Số p = số e = ZAl = 13
Bước 2:
Số hạt mang điện (p+e) nhiều hơn số hạt không mang điện (n) 12 hạt
=> (p+e) - n = 12 => 26 - n = 12 => n = 14
Nguyên tử B có tổng số hạt là 28. Số hạt không mang điện chiếm 35,7%. Số proton, notron trong B lần lượt là:
-
A.
9,10.
-
B.
10,9.
-
C.
9,9.
-
D.
9,11
Đáp án : A
Hạt không mang điện là notron, chiếm 35,7% → n = ?
Dựa vào dữ kiện tổng số hạt là 36 tìm được nốt p = e = (28-n)/2 =?
Hạt không mang điện là notron, chiếm 35,7% \( \Rightarrow n = 28 \times \frac{{35,7\% }}{{100\% }} = 10\,\)(hạt)
Tổng số hạt proton và electron còn lại là: 28 – 10 = 18 (hạt)
Nguyên tử trung hòa về điện nên số proton = số electron = 18/2 = 9 (hạt)
Mệnh đề nào sau đây không đúng ?
(1) Số điện tích hạt nhân đặc trưng cho 1 nguyên tố.
(2) Chỉ có hạt nhân nguyên tử oxi mới có 8 proton.
(3) Chỉ có hạt nhân nguyên tử oxi mới có 8 nơtron.
(4) Chỉ có trong nguyên tử oxi mới có 8 electron.
-
A.
3 và 4
-
B.
1 và 3
-
C.
4
-
D.
3
Đáp án : A
Dựa vào kiến thức học về nguyên tử.
(1) đúng
(2) đúng
(3) sai vì có thể đồng vị của nitơ cũng có 8 nơtron
(4) sai
Luyện tập và củng cố kiến thức Bài 5. Nguyên tố hóa học Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 6. Đơn chất và hợp chất - Phân tử Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Công thức hóa học Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Tổng hợp bài tập tính phân tử khối Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2. Chất Hóa học 8 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Tổng hợp bài tập hòa tan kim loại và chất rắn vào dung dịch axit - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập hòa tan một chất vào nước và vào dung dịch cho sẵn - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch có xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Tổng hợp bài tập pha trộn 2 dung dịch không xảy ra phản ứng - Hóa học 8
- Trắc nghiệm Bài 43. Pha chế dung dịch - Hóa học 8










Danh sách bình luận