Đề thi học kì 1 Hóa 8 - Đề số 4
Đề bài
Vì sao nguyên tử có khả năng liên kết với nhau?
-
A.
Do có electron
-
B.
Do có notron
-
C.
Tự dưng có sẵn
-
D.
Do khối lượng hạt nhân bằng khối lượng nguyên tử
Kí hiệu hóa học của nguyên tố sắt là
-
A.
S
-
B.
Fe
-
C.
fE
-
D.
FE
Cho nguyên tử khối của Bari là 137 đvC. Khối lượng thực nguyên tố trên là
-
A.
mBa = 2,275.10-22 kg
-
B.
mBa = 2,234.10-24 gam
-
C.
mBa = 1,345.10-23 kg
-
D.
mBa = 2,275.10-22 gam
Dựa vào dấu hiệu nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
-
A.
Hình dạng của phân tử.
-
B.
Kích thước của phân tử.
-
C.
Số lượng nguyên tử trong phân tử.
-
D.
Nguyên tử của cùng nguyên tố hay khác nguyên tố.
Chọn đáp án sai
-
A.
CO là phân tử gồm nguyên tố C và nguyên tố O.
-
B.
Ca là công thức hóa học của canxi.
-
C.
Al2O3 có 2 nguyên tử nhôm và 2 nguyên tử oxi trong phân tử.
-
D.
Fe3O4 gồm 3 nguyên tử Fe và 4 nguyên tử O
Từ công thức hóa học của CuSO4 có thể suy ra được những gì?
-
A.
CuSO4 do 3 nguyên tố Cu, O, S tạo nên.
-
B.
Có 4 nguyên tử oxi trong phân tử.
-
C.
Phân tử khối là 160 đvC.
-
D.
Tất cả đáp án.
Dấu hiệu của phản ứng hóa học
-
A.
Thay đổi màu sắc
-
B.
Tạo chất bay hơi hoặc chất kết tủa
-
C.
Tỏa nhiệt hoặc phát sáng
-
D.
Tất cả đáp án
Cho phương trình hóa học: aP2O5 + bH2O → cH3PO4. Sau khi cân bằng phương trình phản ứng thì giá trị của b là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Thể tích 1 mol của hai chất khí bằng nhau nếu được đo ở
-
A.
cùng nhiệt độ
-
B.
cùng áp suất
-
C.
cùng nhiệt độ và khác áp suất
-
D.
cùng điều kiện nhiệt độ và áp suất
Dãy gồm các chất khí nhẹ hơn không khí là
-
A.
CO2, H2, O3.
-
B.
SO2, Cl2, N2.
-
C.
NO2, H2, SO3.
-
D.
NH3, H2, CH4.
Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là
-
A.
72,4%.
-
B.
68,8%.
-
C.
76%.
-
D.
62,5%.
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
-
A.
11,2 lít.
-
B.
3,36 lít.
-
C.
2,24 lít.
-
D.
4,48 lít.
A là hợp chất của nguyên tố M (hóa trị I) và O, trong đó M chiếm 74,2% về khối lượng. Xác định CTHH của A
-
A.
KO
-
B.
Cu2O
-
C.
K2O
-
D.
Na2O
Cho 13,2g hỗn hợp gồm magie, sắt và kẽm cháy trong khí oxi, thu được 18g hỗn hợp chất rắn. Khối lượng oxi tham gia phản ứng là:
-
A.
3,2g.
-
B.
4,8g.
-
C.
9,6g.
-
D.
12,8g.
Trong một phản ứng hóa học, giữa các sản phẩm với các chất phản ứng không có sự thay đổi về
-
A.
số nguyên tử của mỗi chất.
-
B.
số nguyên tố của mỗi chất.
-
C.
số nguyên tử của mỗi nguyên tố.
-
D.
số phân tử của mỗi chất.
Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là:
-
A.
N2O.
-
B.
NO.
-
C.
NO2.
-
D.
N2O5.
Việc hiểu biết tính chất của chất có lợi gì?
-
A.
Giúp phân biệt chất này với chất khác, tức nhận biết được chất
-
B.
Biết cách sử dụng chất
-
C.
Biết ứng dụng chất thích hợp trong đời sống và sản xuất
-
D.
Cả ba ý trên
Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
-
A.
2 chất trở lên
-
B.
3 chất
-
C.
4 chất
-
D.
2 chất
Mỗi công thức hóa học của một chất cho chúng ta biết
-
A.
nguyên tố nào tạo ra chất
-
B.
số nguyên tử của mỗi nguyên tố có trong một phân tử của chất
-
C.
phân tử khối của chất
-
D.
Cả ba ý trên
Hợp chất B trong phân tử gồm có 1X, 1S, 4O liên kết với nhau (X là nguyên tố chưa biết), biết nguyên tử X có khối lượng bằng 2 lần phân tử khí nitơ. Tìm CTHH của B.
-
A.
MgSO4
-
B.
BaSO4
-
C.
FeSO4
-
D.
CaSO4
Cho các câu sau:
a) Than chì là chất dùng làm lõi bút chì
b) Xe đạp được chế tạo từ sắt, nhôm, cao su….
Trong 2 câu trên vật thể là:
-
A.
Than chì; sắt, nhôm, cao su
-
B.
Than chì, xe đạp
-
C.
Lõi bút chì, xe đạp
-
D.
Lõi bút chì; sắt, nhôm, cao su
Đốt cháy hoàn toàn m (g) CH4 cần dùng 0,4 (g) khí O2 thu được 1,4 (g) CO2 và 1,6(g) H2O. m có giá trị là:
-
A.
2,6g
-
B.
2,5g
-
C.
1,7g
-
D.
1,6g
Cho PƯHH: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
-
A.
Đúng
-
B.
Sai
-
C.
Thiếu sản phẩm
-
D.
Thừa sản phẩm
0,5 mol nguyên tử hyđro có chứa bao nhiêu nguyên tử hyđro?
-
A.
6. 10²³ nguyên tử
-
B.
6. 10²³ phân tử
-
C.
3. 10²³ nguyên tử
-
D.
3. 10²³ phân tử
0,25 mol phân tử Al₂O₃ có khối lượng là bao nhiêu?
-
A.
10,2g
-
B.
24,5g
-
C.
52,5g
-
D.
25,5g
Kim loại M tạo ra hiđroxit M(OH)3. Phân tử khối của hiđroxit là 107 đvC. Nguyên tử khối của M là:
-
A.
24.
-
B.
27
-
C.
56
-
D.
64
Hạt nhân nguyên tử có cấu tạo bởi các loại hạt:
-
A.
Electron, Proton.
-
B.
Proton, Nơtron.
-
C.
Nơtron, Electron.
-
D.
Electron, Proton, Nơtron.
Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tổng số hạt p và n có trong nguyên tử M là:
-
A.
24.
-
B.
12
-
C.
34
-
D.
23
Dãy nào gồm các chất là đơn chất?
-
A.
CaO; Cl2; CO; CO2
-
B.
Cl2; N2; Mg; Al
-
C.
CO2; NaCl; CaCO3; H2O
-
D.
Cl2; CO2; Ca(OH)2; CaSO4
Dãy nào gồm các chất là hợp chất?
-
A.
CaO; Cl2; CO; CO2
-
B.
Cl2; N2; Mg; Al
-
C.
CO2; NaCl; CaCO3; H2O
-
D.
Cl2; CO2; Ca(OH)2; CaSO4
Cho biết CTHH của X với H là H3X, của Y với O là YO.Chọn CTHH nào đúng cho hợp chất X và Y:
-
A.
XY3
-
B.
.X3Y
-
C.
X2Y3
-
D.
X2Y2
Hòa tan vôi sống (CaO) vào nước được vôi tôi canxi hiđroxit (Ca(OH)2). Đây là hiện tượng
-
A.
hòa tan
-
B.
vật lí
-
C.
hóa học
-
D.
Tất cả đều sai
Cho phương trình hóa học: (NH4)2Cr2O7 \(\xrightarrow{{{t^0}}}\) Cr2O3 + N2 + H2O
Tổng hệ số các chất trong phương trình hóa học trên sau khi cân bằng là:
-
A.
7
-
B.
8
-
C.
9
-
D.
10
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2
Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
-
A.
4:2:7:1
-
B.
2:2:2:1
-
C.
4:2:8:1
-
D.
4:2:9:1
Ở cùng điều kiện nhiệt độ và áp suất, so sánh thể tích của 4 gam CH4 và 1 gam H2 ta có:
-
A.
Thể tích của khí CH4 lớn hơn
-
B.
Thể tích của H2 lớn hơn
-
C.
Bằng nhau
-
D.
Không thể so sánh được
Lời giải và đáp án
Vì sao nguyên tử có khả năng liên kết với nhau?
-
A.
Do có electron
-
B.
Do có notron
-
C.
Tự dưng có sẵn
-
D.
Do khối lượng hạt nhân bằng khối lượng nguyên tử
Đáp án : A
Nguyên tử có khả năng liên kết với nhau do các lớp electron chuyển động xung quanh hạt nhân
Kí hiệu hóa học của nguyên tố sắt là
-
A.
S
-
B.
Fe
-
C.
fE
-
D.
FE
Đáp án : B
Kí hiệu hóa học của nguyên tố sắt là Fe
Cho nguyên tử khối của Bari là 137 đvC. Khối lượng thực nguyên tố trên là
-
A.
mBa = 2,275.10-22 kg
-
B.
mBa = 2,234.10-24 gam
-
C.
mBa = 1,345.10-23 kg
-
D.
mBa = 2,275.10-22 gam
Đáp án : D
1 đvC =$\dfrac{1}{{12}}$ khối lượng nguyên tử C = $\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$
Nguyên tử khối của Bari là 137 đvC
Mà 1 đvC = $\dfrac{1}{{12}}$ khối lượng nguyên tử C = $\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$
=> 137 đvC = $137.\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$ = 2,275.10-22 gam
Dựa vào dấu hiệu nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
-
A.
Hình dạng của phân tử.
-
B.
Kích thước của phân tử.
-
C.
Số lượng nguyên tử trong phân tử.
-
D.
Nguyên tử của cùng nguyên tố hay khác nguyên tố.
Đáp án : D
Để phân biệt phân tử của đơn chất với phân tử của hợp chất ta dựa vào nguyên tử của cùng nguyên tố hay khác nguyên tố:
- Phân tử gồm những nguyên tử cùng loại là đơn chất
- Phân tử gồm những nguyên tử khác loại là hợp chất
Chọn đáp án sai
-
A.
CO là phân tử gồm nguyên tố C và nguyên tố O.
-
B.
Ca là công thức hóa học của canxi.
-
C.
Al2O3 có 2 nguyên tử nhôm và 2 nguyên tử oxi trong phân tử.
-
D.
Fe3O4 gồm 3 nguyên tử Fe và 4 nguyên tử O
Đáp án : C
Đáp án sai là: Al2O3 có 2 nguyên tử nhôm và 2 nguyên tử oxi trong phân tử.
=> sửa lại: Al2O3 có 2 nguyên tử nhôm và 3 nguyên tử oxi trong phân tử.
Từ công thức hóa học của CuSO4 có thể suy ra được những gì?
-
A.
CuSO4 do 3 nguyên tố Cu, O, S tạo nên.
-
B.
Có 4 nguyên tử oxi trong phân tử.
-
C.
Phân tử khối là 160 đvC.
-
D.
Tất cả đáp án.
Đáp án : D
Xem lại lí thuyết công thức hóa học của hợp chất và cách tính phân tử khối
Từ công thức hóa học của CuSO4 có thể suy ra được:
- CuSO4 do 3 nguyên tố Cu, O, S tạo nên => A đúng
- Có 4 nguyên tử oxi trog phân tử => B đúng
- Phân tử khối = 64 + 32 + 16.4 = 160 (đvC) => C đúng
Dấu hiệu của phản ứng hóa học
-
A.
Thay đổi màu sắc
-
B.
Tạo chất bay hơi hoặc chất kết tủa
-
C.
Tỏa nhiệt hoặc phát sáng
-
D.
Tất cả đáp án
Đáp án : D
Dấu hiệu của phản ứng hóa học là
- Có thể thay đổi màu sắc, trạng thái, mùi.
- Tỏa nhiệt, thu nhiệt hoặc phát sáng.
- Tạo ra kết tủa, bay hơi, hoặc đổi màu
Cho phương trình hóa học: aP2O5 + bH2O → cH3PO4. Sau khi cân bằng phương trình phản ứng thì giá trị của b là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
aP2O5 + bH2O → cH3PO4
Ở bên phải có 3 nguyên tử H, bên trái có 2 nguyên tử H => thêm 2 vào trước H3PO4 để làm chẵn số H
aP2O5 + bH2O → 2H3PO4
ở bên phải có 6 nguyên tử H và 2 nguyên tử P => bên trái cần thêm 3 vào H2O và không cần thêm hệ số trước P2O5
=> phương trình hóa học: P2O5 + 3H2O → 2H3PO4
Thể tích 1 mol của hai chất khí bằng nhau nếu được đo ở
-
A.
cùng nhiệt độ
-
B.
cùng áp suất
-
C.
cùng nhiệt độ và khác áp suất
-
D.
cùng điều kiện nhiệt độ và áp suất
Đáp án : D
Thể tích 1 mol của hai chất khí bằng nhau nếu được đo ở cùng điều kiện nhiệt độ và áp suất.
Dãy gồm các chất khí nhẹ hơn không khí là
-
A.
CO2, H2, O3.
-
B.
SO2, Cl2, N2.
-
C.
NO2, H2, SO3.
-
D.
NH3, H2, CH4.
Đáp án : D
Xem lại công thức tính tỉ khối của khí A so với không khí
Không khí có M = 29 g/mol => chất nhẹ hơn không khí là chất có M < 29 g/mol
+) Loại A vì: ${M_{C{O_2}}} = 12 + 16.2 = 44$ > 29 => khí CO2 nặng hơn không khí
+) Loại B vì: ${M_{S{O_2}}} = 32 + 16.2 = 64$ > 29 => khí SO2 nặng hơn không khí
+) Loại C vì: ${M_{N{O_2}}} = 14 + 16.2 = 46$ > 29 => khí NO2 nặng hơn không khí
Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là
-
A.
72,4%.
-
B.
68,8%.
-
C.
76%.
-
D.
62,5%.
Đáp án : A
+) Tính ${M_{F{{\text{e}}_3}{O_4}}}$
+) Trong 1mol Fe3O4 có 3 mol nguyên tử Fe và 4 mol nguyên tử O
=> %mFe = $\dfrac{{3.{M_{F{\text{e}}}}.100\% }}{{{M_{F{{\text{e}}_3}{O_4}}}}}$
${M_{F{{\text{e}}_3}{O_4}}} = 3.56 + 4.16 = 232$
Trong 1mol Fe3O4 có 3 mol nguyên tử Fe và 4 mol nguyên tử O
=> %mFe = $\dfrac{{3.{M_{F{\text{e}}}}.100\% }}{{{M_{F{{\text{e}}_3}{O_4}}}}}$=72,4%
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
-
A.
11,2 lít.
-
B.
3,36 lít.
-
C.
2,24 lít.
-
D.
4,48 lít.
Đáp án : C
+) Tính số mol Zn : ${n_{Zn}} = \dfrac{{13}}{{65}}$
PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO
Tỉ lệ theo PT: 2mol 1mol 2mol
0,2mol ? mol
Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2}$ => Thể tích O2 là: V = n.22,4
Số mol Zn là: ${n_{Zn}} = \dfrac{{13}}{{65}} = 0,2\,mol$
PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO
Tỉ lệ theo PT: 2mol 1mol 2mol
0,2mol ? mol
Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2} = 0,1\,mol$
=> Thể tích O2 là: V = n.22,4 = 0,1.22,4 = 2,24 lít
A là hợp chất của nguyên tố M (hóa trị I) và O, trong đó M chiếm 74,2% về khối lượng. Xác định CTHH của A
-
A.
KO
-
B.
Cu2O
-
C.
K2O
-
D.
Na2O
Đáp án : D
Bước 1: Lập công thức hóa học của nguyên tố M (hóa trị I) với O
Bước 2: Lập phương trình tính phần trăm khối lượng của M => tính nguyên tử khối của M
Bước 3: Tìm M và kết luận CTHH
Theo bài ra, M có hóa trị I CTHH của hợp chất A có dạng: ${M_2}O$
Ta có: $\% {m_M} = \frac{{{m_M}}}{{{m_A}}}.100\% => \frac{{2{M_M}}}{{2{M_M} + 16}} = \frac{{74,2}}{{100}}$
$ \Leftrightarrow {M_M} = 23$
$ \Rightarrow $ M là Na
$ \Rightarrow $ Công thức hóa học của hợp chất cần tìm là:$N{a_2}O$
Cho 13,2g hỗn hợp gồm magie, sắt và kẽm cháy trong khí oxi, thu được 18g hỗn hợp chất rắn. Khối lượng oxi tham gia phản ứng là:
-
A.
3,2g.
-
B.
4,8g.
-
C.
9,6g.
-
D.
12,8g.
Đáp án : B
Áp dụng định luật bảo toàn khối lượng ta có:
mmagie,sắt,kẽm + moxi = mhh rắn
\( \to\) 13,2 + moxi = 18 \( \to\) moxi = ?
Magie, sắt, kẽm + oxi → hỗn hợp rắn
Áp dụng định luật bảo toàn khối lượng ta có:
mmagie,sắt,kẽm + moxi = mhh rắn
\( \to\) 13,2 + moxi = 18
\( \to\) moxi = 18 – 13,2 = 4,8 (g)
Trong một phản ứng hóa học, giữa các sản phẩm với các chất phản ứng không có sự thay đổi về
-
A.
số nguyên tử của mỗi chất.
-
B.
số nguyên tố của mỗi chất.
-
C.
số nguyên tử của mỗi nguyên tố.
-
D.
số phân tử của mỗi chất.
Đáp án : C
Số nguyên tử của mỗi nguyên tố của các chất trước và sau phản ứng được bảo toàn
Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là:
-
A.
N2O.
-
B.
NO.
-
C.
NO2.
-
D.
N2O5.
Đáp án : B
Dùng quy tắc hóa trị để lập công thức: \(\mathop A\limits^a x\mathop B\limits^b y\)
Theo quy tắc hóa trị thì: a× x = b× y
=> lập tỉ lệ \(\dfrac{x}{y} = \dfrac{a}{b} = ?\)
=> từ đó tìm được công thức
Gọi công thức là: \(\mathop N\limits^{II} x\mathop O\limits^{II} y\)
Theo quy tắc hóa trị ta có: II× x = II× y
=> \(\dfrac{x}{y} = \dfrac{{II}}{{II}} = \dfrac{1}{1}\)
=> chọn x = 1 và y = 1 => công thức cấu tạo là NO
Việc hiểu biết tính chất của chất có lợi gì?
-
A.
Giúp phân biệt chất này với chất khác, tức nhận biết được chất
-
B.
Biết cách sử dụng chất
-
C.
Biết ứng dụng chất thích hợp trong đời sống và sản xuất
-
D.
Cả ba ý trên
Đáp án : D
Hiểu các tính chất của chất chúng ta có thể
+ Phân biệt chất này với chất khác
+ Biết sử dụng chất an toàn
+ Biết ứng dụng chất thích hợp trong đời sống và sản xuất
Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
-
A.
2 chất trở lên
-
B.
3 chất
-
C.
4 chất
-
D.
2 chất
Đáp án : A
Hỗn hợp là 2 hay nhiều chất trộn lại với nhau. Mỗi chất trong hỗn hợp được gọi là 1 chất thành phần
Mỗi công thức hóa học của một chất cho chúng ta biết
-
A.
nguyên tố nào tạo ra chất
-
B.
số nguyên tử của mỗi nguyên tố có trong một phân tử của chất
-
C.
phân tử khối của chất
-
D.
Cả ba ý trên
Đáp án : D
Mỗi công thức hóa học chỉ 1 phân tử của chất, cho biết
+ Nguyên tố nào tạo ra chất
+ Số nguyên tử của mỗi nguyên tố trong 1 phân tử chất
+ Phân tử khối của chất
Hợp chất B trong phân tử gồm có 1X, 1S, 4O liên kết với nhau (X là nguyên tố chưa biết), biết nguyên tử X có khối lượng bằng 2 lần phân tử khí nitơ. Tìm CTHH của B.
-
A.
MgSO4
-
B.
BaSO4
-
C.
FeSO4
-
D.
CaSO4
Đáp án : C
+ B trong phân tử gồm có 1X, 1S, 4O liên kết với nhau => được chỉ số chân của các nguyên tử trong hợp chất
+ Phân tử khối của X = 2 phân tử khối của nito => MX = 2. MN2 = ?
Hợp chất B gồm có 1X, 1S, 4O liên kết với nhau => CTHH chung của B là: XSO4
MX = 2.MN2 => MX = 2 . 28 = 56 -> X là sắt (Fe)
=> CTHH của A là FeSO4
Cho các câu sau:
a) Than chì là chất dùng làm lõi bút chì
b) Xe đạp được chế tạo từ sắt, nhôm, cao su….
Trong 2 câu trên vật thể là:
-
A.
Than chì; sắt, nhôm, cao su
-
B.
Than chì, xe đạp
-
C.
Lõi bút chì, xe đạp
-
D.
Lõi bút chì; sắt, nhôm, cao su
Đáp án : C
Trong 2 câu trên vật thể là: Lõi bút chì, xe đạp
Đốt cháy hoàn toàn m (g) CH4 cần dùng 0,4 (g) khí O2 thu được 1,4 (g) CO2 và 1,6(g) H2O. m có giá trị là:
-
A.
2,6g
-
B.
2,5g
-
C.
1,7g
-
D.
1,6g
Đáp án : A
Áp dụng định luật bảo toàn khối lượng:
\( \to m = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}} = 1,4 + 1,6 - 0,4 = 2,6\,\,gam\)
Cho PƯHH: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
-
A.
Đúng
-
B.
Sai
-
C.
Thiếu sản phẩm
-
D.
Thừa sản phẩm
Đáp án : A
PƯHH: 2HCl + CaCO3 → CaCl2 + H2O + CO2. đúng
0,5 mol nguyên tử hyđro có chứa bao nhiêu nguyên tử hyđro?
-
A.
6. 10²³ nguyên tử
-
B.
6. 10²³ phân tử
-
C.
3. 10²³ nguyên tử
-
D.
3. 10²³ phân tử
Đáp án : C
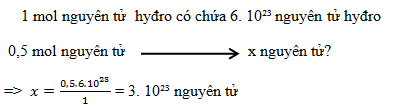
0,25 mol phân tử Al₂O₃ có khối lượng là bao nhiêu?
-
A.
10,2g
-
B.
24,5g
-
C.
52,5g
-
D.
25,5g
Đáp án : D

Kim loại M tạo ra hiđroxit M(OH)3. Phân tử khối của hiđroxit là 107 đvC. Nguyên tử khối của M là:
-
A.
24.
-
B.
27
-
C.
56
-
D.
64
Đáp án : C
Từ phương trình:
\({M_{M{{(OH)}_3}}} = 107 \Rightarrow {M_M} = ?\)
Theo bài ta có phương trình:
\(\begin{array}{l}{M_{M{{(OH)}_3}}} = 107\\ \Rightarrow {M_M} + ({M_O} + {M_H}) \times 3 = 107\\ \Rightarrow {M_M} + (16 + 1) \times 3 = 107\\ \Rightarrow {M_M} + 17 \times 3 = 107\\ \Rightarrow {M_M} = 107 - 51\\ \Rightarrow {M_M} = 56\,(dvC)\end{array}\)
Hạt nhân nguyên tử có cấu tạo bởi các loại hạt:
-
A.
Electron, Proton.
-
B.
Proton, Nơtron.
-
C.
Nơtron, Electron.
-
D.
Electron, Proton, Nơtron.
Đáp án : B
Đọc lại cấu tạo hạt nhân nguyên tử
Hạt nhân cấu tạo bởi: Proton, Nơtron.
Học sinh có thể nhầm lẫn cấu tạo nguyên tử mà chọn đáp án 3 loại hạt Electron, Proton, Nơtron.
Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tổng số hạt p và n có trong nguyên tử M là:
-
A.
24.
-
B.
12
-
C.
34
-
D.
23
Đáp án : D
Lập phương trình với dữ kiện 1
Lập phương trình với dữ kiện 10
giải hệ được p, n =?
Từ đó tìm được số khối: A = p+n
Đặt số proton, notron lần lượt là p và n (hạt)
Nguyên tử trung hòa về điện nên số electron = số proton = p (hạt)
Trong M, số notron nhiều hơn số proton là 1 → n – p = 1 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 10 → p + e – n = 10 hay 2p – n = 10 (2)
Từ (1) và (2) ta có hệ phương trình:\(\left\{ \begin{array}{l}n - p = 1\,\\ - n + 2p = 10\end{array} \right. \Rightarrow \left\{ \begin{array}{l}n = 12\\p = 11\end{array} \right.\)
Tổng số hạt p và n có trong nguyên tử M là: p + n = 11 + 12 = 23
Dãy nào gồm các chất là đơn chất?
-
A.
CaO; Cl2; CO; CO2
-
B.
Cl2; N2; Mg; Al
-
C.
CO2; NaCl; CaCO3; H2O
-
D.
Cl2; CO2; Ca(OH)2; CaSO4
Đáp án : B
Dựa vào khái niệm đơn chất và hợp chất – sgk hóa 8 – trang 22
A chỉ có chứa Cl2 là đơn chất
B chỉ chứa đơn chất
C chỉ chứa hợp chất
D chứa Cl2 là đơn chất
Dãy nào gồm các chất là hợp chất?
-
A.
CaO; Cl2; CO; CO2
-
B.
Cl2; N2; Mg; Al
-
C.
CO2; NaCl; CaCO3; H2O
-
D.
Cl2; CO2; Ca(OH)2; CaSO4
Đáp án : C
Dựa vào khái niệm đơn chất và hợp chất – sgk hóa 8 – trang 22
A có chứa Cl2 là đơn chất
B chỉ chứa đơn chất
C chỉ chứa hợp chất
D chứa Cl2 là đơn chất
Cho biết CTHH của X với H là H3X, của Y với O là YO.Chọn CTHH nào đúng cho hợp chất X và Y:
-
A.
XY3
-
B.
.X3Y
-
C.
X2Y3
-
D.
X2Y2
Đáp án : C
Áp dụng quy tắc hóa trị tính được hóa trị của X trong H3X là a
Áp dụng quy tắc hóa trị tính được hóa trị của Y trong YO là b
Sau đó thành lập công thức hóa học của X(a) với Y(b)
Theo quy tắc hóa trị cho H3X thì hóa trị của X là \({{I.3} \over 1} = III\)
Theo quy tắc hóa trị cho YO thì hóa trị của Y là \({{II.1} \over 1} = II\)
Đặt công thức hóa học cho X và Y là XxYy
Theo quy tắc hóa trị thì III.x = II.y suy ra \({x \over y} = {{II} \over {III}} = {2 \over 3}\)
Chọn x=2 và y=3
CTHH phù hợp là X2Y3
Hòa tan vôi sống (CaO) vào nước được vôi tôi canxi hiđroxit (Ca(OH)2). Đây là hiện tượng
-
A.
hòa tan
-
B.
vật lí
-
C.
hóa học
-
D.
Tất cả đều sai
Đáp án : C
Đây là hiện tượng hóa học
Cho phương trình hóa học: (NH4)2Cr2O7 \(\xrightarrow{{{t^0}}}\) Cr2O3 + N2 + H2O
Tổng hệ số các chất trong phương trình hóa học trên sau khi cân bằng là:
-
A.
7
-
B.
8
-
C.
9
-
D.
10
Đáp án : A
Sử dụng phương pháp cân bằng kim loại – phi kim
+ Cân bằng theo thứ tự Cr → N → H → O
- Ta thấy các nguyên tố Cr, N hai vế đã bằng nhau nên ta bắt đầu cân bằng từ nguyên tố H
- Ta thấy VT có 8 nguyên tử H trong (NH4)2Cr2O7 trong khi VP có 2 nguyên tử H trong H2O → Đặt hệ số 4 trước H2O
=> (NH4)2Cr2O7 \(\xrightarrow{{{t^0}}}\) Cr2O3 + N2 + 4H2O
- Kiểm tra O ta thấy 2 vế đều đã bằng nhau, vậy PTHH trên đã cân bằng.
→ Tổng hệ số các chất trong phương trình là: 1 + 1+ 1+ 4 = 7
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2
Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
-
A.
4:2:7:1
-
B.
2:2:2:1
-
C.
4:2:8:1
-
D.
4:2:9:1
Đáp án : B
Cân bằng theo thứ tự O, Ag, N.
PTHH: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2
- Đầu tiên ta cân bằng nguyên tố O
- Ta thấy ở VP có tổng 4 nguyên tử trong NO2 và O2 còn VT có 3 nguyên tử O trong AgNO3 → cần làm chẵn số nguyên tử O ở VT bằng cách đặt 2 trước AgNO3.
=> 2AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2
- Tiếp theo ta thấy VT có 2 nguyên tử Ag trong AgNO3 còn VP chỉ có 1 nguyên tử Ag → Đặt hệ số 2 trước Ag.
=> 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + NO2 + O2
- Tương tự ta thấy VT có 2 nguyên tử N trong AgNO3 còn VP chỉ có 1 nguyên tử N → Đặt hệ số 2 trước NO2.
=> 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + 2NO2 + O2
Vậy sau khi cân bằng hệ số các chất trong phương trình lần lượt là 2:2:2:1
Ở cùng điều kiện nhiệt độ và áp suất, so sánh thể tích của 4 gam CH4 và 1 gam H2 ta có:
-
A.
Thể tích của khí CH4 lớn hơn
-
B.
Thể tích của H2 lớn hơn
-
C.
Bằng nhau
-
D.
Không thể so sánh được
Đáp án : B
Cùng điều kiện nhiệt độ áp suất tỉ lệ số mol bằng tỉ lệ thể tích
nCH4 = 4 : 16 =0,25 mol
nH2 =0,5 mol
Vì nH2 > nCH4 nên VH2 > VCH4
>> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 8 chương 2: Phản ứng hóa học - Đề số 1
- Đề kiểm tra 15 phút Hóa 8 chương 2: Phản ứng hóa học - Đề số 2
- Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 1
- Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 2
- Đề kiểm tra 1 tiết Hóa 8 chương 1: Chất - Nguyên tử - Phân tử - Đề số 1










Danh sách bình luận