 Giải bài tập hóa học 8, Hóa 8 - Để học tốt hóa học 8
Giải bài tập hóa học 8, Hóa 8 - Để học tốt hóa học 8
 ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 8
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 8
Đề cương ôn tập học kỳ 2 hóa học lớp 8
Tổng hợp kiến thức cần nắm vững, các dạng bài tập và câu hỏi có khả năng xuất hiện trong đề thi HK2 môn hoá học sắp tới
CHƯƠNG IV: OXI – KHÔNG KHÍ
I/ TÍNH CHẤT CỦA OXI:
1/ Tính chất vật lý: Oxi là chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí. Oxi hóa lỏng ở -183 0C . Oxi lỏng có màu xanh nhạt.
2/ Tính chất hóa học: Khí oxi là 1 đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
VD: S + O2 → SO2; 3Fe + 2O2 → Fe3O4
II/ SỰ OXI HÓA – PHẢN ỨNG HOÁ HỢP - ỨNG DỤNG CỦA OXI:
- Sự tác dụng của oxi với 1 chất là sự oxi hóa
- Phản ứng hoá hợp là phản ứng hóa học trong đó chỉ có 1 chất mới (sản phẩm) được tạo thành từ hai hay nhiều chất ban đầu.
VD: CaO+H2O → Ca(OH)2
- Ứng dụng của oxi: Khí oxi cần cho sự hô hấp của người và động vật, cần để đốt nhiên liệu trong đời sống và sản xuất.
III/ OXIT:
1.Định nghĩa oxit: Oxit là hợp chất của 2 nguyên tố, trong đó có 1 nguyên tố là oxi
Vd: K2O, Fe2O3, SO3, CO2….
2.Công thức dạng chung của oxit MxOy
- M: kí hiệu một nguyên tố khác (có hóa trị n)
- Công thức MxOy theo đúng quy tắc về hóa trị.
=> n.x = II.y
3. Phân loại: Gồm 2 loại chính: oxit axit và oxit bazơ
Vd:Oxit axit: CO2, SO3, P2O5…
. Oxit bazơ: K2O,CaO, ZnO…
(*) Cách gọi tên oxit :
a. Oxit bazơ:
Tên oxit = tên kim loại(kèm theo hóa trị) + oxit.
VD: CuO: đồng (II) oxit
b. Oxit axit
Tên oxit = tên phi kim (kèm tiền tố chỉ số nguyên tử phi kim) + oxit (kèm tiền tố chỉ số nguyên tử oxi)
VD: : Đinito pentaoxit: N2O5
IV/ ĐIỀU CHẾ OXI – PHẢN ỨNG PHÂN HỦY:
|
1/ Điều chế khí oxi trong phòng thí nghiệm:
|
2KClO3 \(\xrightarrow{{{t}^{o}}}\)2KCl+3O2
2/ Sản xuất khí oxi trong công nghiệp: dùng nước hoặc không khí.
- Cách điều chế:
+ Hoá lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lỏng bay hơi sẽ thu được khí nitơ ở -1960C sau đó là khí oxi ở -1830C
+ Điện phân nước- \(2{{H}_{2}}O\xrightarrow{dp}2{{H}_{2}}+{{O}_{2}}\)
V/ KHÔNG KHÍ – SỰ CHÁY:
1.Thành phần của không khí: không khí là hỗn hợp nhiều chất khí. Thành phần theo thể tích của không
khí là: 78 % khí nitơ, 21% khí oxi, 1% các chất khí khác ( khí cacbonic, hơi nước, khí hiếm…)
2. Sự cháy: là sự oxi hóa có tỏa nhiệt và phát sáng
3. Sự oxi hoá chậm: là sự oxi hóa có tỏa nhiệt nhưng không phát sáng
CHƯƠNG V: HIĐRO – NƯỚC
I/ TÍNH CHẤT CỦA HIĐRO :
1/ Tính chất vật lý: Hiđro là chất khí, không màu, không mùi, tan rất ít trong nước, nhẹ nhất trong các khí
2/ Tính chất hóa học: Khí hiđro có tính khử, ở nhiệt độ thích hợp, hiđro không những kết hợp được với đơn chất oxi, mà nó còn có thể kết hợp với nguyên tố oxi trong 1 số oxit kim loại. Các phản ứng này đều tỏa nhiều nhiệt.
2H2 +O2\(\xrightarrow{{{t}^{0}}}\)2H2O
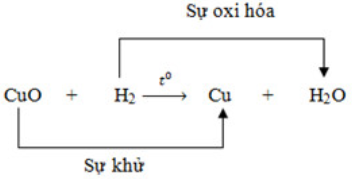
H2(k) +CuO(r) \(\xrightarrow{{{t}^{0}}}\)Cu(r) +H2O(h)
II/ PHẢN ỨNG OXI HÓA KHỬ:
- Sự khử là sự tách oxi ra khỏi hợp chất.
- Sự oxi hóa là sự tác dụng của oxi với 1 chất
- Chất chiếm oxi của chất khác là chất khử. Chất nhường oxi cho chất khác là chất oxi hóa.
- Phản ứng oxi hóa – khử là phản ứng hoá học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
III/ ĐIỀU CHẾ KHÍ HIĐRO – PHẢN ỨNG THẾ:
1/ Trong phòng thí nghiệm:Khí H2 được điều chế bằng cách cho axit ( HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm)
PTHH: Zn+2HCl → H2 +ZnCl2
- Thu khí H2 bằng cách đẩy nước hay đầy không khí.
- Nhận ra khí H2 bằng que đóm đang cháy, H2 cháy với ngọn lửa màu xanh
2/ Trong công nghiệp:
- Điện phân nước:
\(2{{H}_{2}}O\xrightarrow{dp}2{{H}_{2}}+{{O}_{2}}\)
- Khử oxi của nước trong khí than
H2O+ C \(\xrightarrow{{{t}^{o}}}\) CO+H2
3/Phản ứng thế: Là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay
thế nguyên tử của 1 nguyên tố khác trong hợp chất
VD: Fe + H2SO4 → FeSO4+ H2
IV/ NƯỚC:
1/ Thành phần hóa học của nước:
Nước là hợp chất tạo bởi 2 nguyên tố là hiđro và oxi.
+ Theo tỉ lệ về thể tích là 2 phần hiđro và 1 phần oxi
+ Theo tỉ lệ về khối lượng là 1 phần hiđro và 8 phần oxi
2/ Tính chất của nước:
a/ Tính chất vật lý: Nước là chất lỏng, không màu, không mùi, không vị, sôi ở 1000C, hóa rắn ở 00C, d=1g/ml, hòa tan được nhiều chất rắn, lỏng, khí
b/ Tính chất hóa học:
* Tác dụng với kim loại: Nước tác dụng với 1 số kim loại ở nhiệt độ thường ( như Na, K, Ca,…) tạo thành bazơ và hiđro.
2Na + 2H2O→2NaOH + H2
* Tác dụng với 1 số oxit bazơ
- Nước tác dụng với 1 số oxit bazơ tạo thành bazơ. Dung dịch bazơ làm đổi màu quì tím thành xanh.
VD: CaO + H2O→Ca(OH)2
*/ Tác dụng với 1 số oxit axit:
- Nước tác dụng với 1 số oxit axit tạo thành axit. Dung dịch axit làm đổi màu quì tím thành đỏ.
VD: P2O5 + 3H2O→2H3PO4
V/ AXIT – BAZƠ – MUỐI:
1/ AXIT:
1/ Định nghĩa: Axit là hợp chất mà phân tử gồm 1 hay nhiều nguyên tử hiđro liên kết với gốc axit
2/ Phân loại và gọi tên:
a/ Axit không có oxi: HCl, HBr, HF…
Tên axit = Axit + tên phi kim + hiđric
VD: HCl: axit clohiđric
b/ Axit có oxi: H2SO4, HNO3, H3PO4, H2CO3…..
** Axit có nhiều nguyên tử oxi:
Tên axit = Axit + tên phi kim + ic
VD:H2SO4: axit sunfuric
** Axit có ít nguyên tử oxi:
Tên axit = Axit + tên phi kim + ơ
VD: H2SO3: axit sunfurơ
2/ BAZƠ:
1/ Định nghĩa: Bazơ là hợp chất mà phân tử gồm 1 nguyên tử kim loại liên kết với 1 hay nhiều nhóm hiđroxit (- OH)
2/ Phân loại và gọi tên:
- Dựa vào tính tan trong nước, bazơ chia làm 2 loại:
+ Bazơ tan gọi là kiềm ( Vd: NaOH, KOH, ,…..)
+ Bazơ không tan (Vd: Cu(OH)2, Mg(OH)2, Al(OH)3,…..)
- Tên bazơ = tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + hiđrôxit.
VD: NaOH : natri hiđroxit
3/ MUỐI
1/ Định nghĩa: Muối là hợp chất mà phân tử gồm có nguyên tử kim loại liên kết với gốc axit
2/ Phân loại và gọi tên:
- Dựa vào thành phần phân tử, muối chia làm 2 loại:
+ Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hiđro (Vd: NaCl,CaCO3,…)
+ Muối axit: là muối mà trong gốc axit còn có nguyên tử hiđro (Vd:NaH2PO4, Na2HPO4,…)
- Tên muối = tên kim loại (kèm hóa trị nếu kim loại nhiều hóa trị) + tên gốc axit
VD: Al2(SO4)3: nhôm sunfat
I/ DUNG DỊCH:
- Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan
- Ở nhiệt độ xác định:
+ Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan
+ Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan
- Muốn chất rắn tan nhanh trong nước, ta thực hiện 1, 2 hoặc cả 3 biện pháp sau:khuấy dung dịch, đun nóng dung dịch, nghiền nhỏ chất rắn.
II/ ĐỘ TAN CỦA MỘT CHẤT TRONG NƯỚC:
- Độ tan (S) của 1 chất là số gam chất đó tan được trong 100g nước để tạo thành dung dịch bão hòa ở 1 nhiệt độ xác định.
- Độ tan của chất rắn sẽ tăng nếu tăng nhiệt độ. Độ tan của chất khí sẽ tăng nếu giảm nhiệt độ và tăng áp suất
III/ NỒNG ĐỘ DUNG DỊCH:
- Nồng độ phần trăm cho biết số gam chất tan có trong 100g dung dịch:
- Nồng độ mol cho biết số mol chất tan trong 1 lít dung dịch:
Nguồn: Sưu tầm
Loigiaihay.com
Các bài khác cùng chuyên mục












Danh sách bình luận