Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 2
Đề bài
1 mol nước (H2O) chứa số phân tử là:
-
A.
6,02.1023
-
B.
12,04.1023
-
C.
18,06.1023
-
D.
24,08.1023
Thể tích của 280 gam khí nitơ ở đktc là:
+) Khí nitơ có công thức hóa học là N2
+) Tính khối lượng mol N2
+) \({n_{{N_2}}} = \frac{m}{M}\)
+) \({V_{{N_2}}} = n*22,4\)
-
A.
112 lít
-
B.
336 lít
-
C.
168 lít
-
D.
224 lít
Tỉ khối của hỗn hợp X chứa 3,36 lít khí H2 và 6,72 lít khí N2 (đều đo ở đktc) so với khí heli là:
-
A.
4,83
-
B.
19,33
-
C.
33,18
-
D.
33,19
Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
-
A.
6,4 gam.
-
B.
12,8 gam.
-
C.
19,2 gam.
-
D.
25,6 gam.
Số Avogadro có giá trị bằng:
-
A.
6.10-23.
-
B.
6.10-24.
-
C.
6.1023.
-
D.
6.1024.
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
-
A.
Fe là chất hết.
-
B.
HCl là chất hết.
-
C.
Cả 2 chất cùng hết.
-
D.
Cả 2 chất cùng dư.
Hỗn hợp khí SO2 và O2 có tỉ khối so với CH4 là 3. Thể tích khí O2 cần thêm vào 4,48 lít hỗn hợp trên (đktc) để có tỉ khối so với CH4 giảm còn 2,8 là:
-
A.
2,24 lít
-
B.
1,12 lít
-
C.
11,2 lít
-
D.
22,4 lít
Trong các hợp chất sau, hợp chất nào có hàm lượng sắt cao nhất?
a. FeO b. Fe2O3 c. Fe3O4 d. FeSO4 e. FeS2.
-
A.
FeO
-
B.
Fe3O4
-
C.
FeSO4
-
D.
FeS2 và Fe3O4
Một mol nguyên tử Nhôm có chứa bao nhiêu nguyên tử nhôm?
-
A.
56 nguyên tử
-
B.
3.1023 nguyên tử
-
C.
12 nguyên tử
-
D.
6.1023 nguyên tử.
Cho biết công thức tính số mol, khi đề bài cho biết khối lượng ( m):
-
A.
m = n. M
-
B.
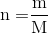
-
C.
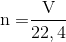
-
D.
n = V. 22,4
Cho hình vẽ thu khí như sau: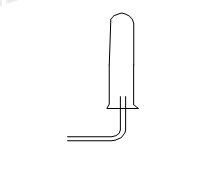
Những khí nào trong số các khí H2, N2, NH3 ,O2, Cl2, CO2,HCl, SO2, H2S có thể thu được theo cách trên?
-
A.
Chỉ có khí H2
-
B.
H2, N2, NH3
-
C.
O2, N2, H2,Cl2, CO2
-
D.
Tất cả các khí trên.
Cho hình vẽ về cách thu khí dời nước như sau:
Hình vẽ bên có thể áp dụng để thu được khí nào trong các khí sau đây?
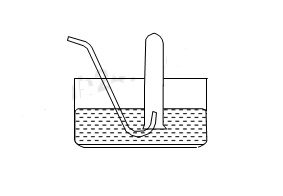
-
A.
H2, HCl, H2S
-
B.
H2, CO2
-
C.
NH3, HCl
-
D.
H2, NH3
Lời giải và đáp án
1 mol nước (H2O) chứa số phân tử là:
-
A.
6,02.1023
-
B.
12,04.1023
-
C.
18,06.1023
-
D.
24,08.1023
Đáp án : A
Dựa vào khái niệm mol để tính 1 mol nước chứa bao nhiêu phân tử:
Mol là lượng chất chứa 6,02 . 1023 nguyên tử (phân tử)
Vì 1 mol chứa 6,02 . 1023 nguyên tử (phân tử)
=> 1 mol H2O chứa: 1 x 6,02 . 1023= 6,02 . 1023 phân tử
Thể tích của 280 gam khí nitơ ở đktc là:
+) Khí nitơ có công thức hóa học là N2
+) Tính khối lượng mol N2
+) \({n_{{N_2}}} = \frac{m}{M}\)
+) \({V_{{N_2}}} = n*22,4\)
-
A.
112 lít
-
B.
336 lít
-
C.
168 lít
-
D.
224 lít
Đáp án : D
Khối lượng mol của khí N2 là: M = 2.14 = 28 g/mol
=> số mol khí N2 là: $n = \frac{m}{M}\, = \frac{{280}}{{28}} = 10\,(mol)$
=> thể tích cảu 280 gam khí nitơ là: V = n.22,4 = 10.22,4 = 224 lít
Tỉ khối của hỗn hợp X chứa 3,36 lít khí H2 và 6,72 lít khí N2 (đều đo ở đktc) so với khí heli là:
-
A.
4,83
-
B.
19,33
-
C.
33,18
-
D.
33,19
Đáp án : A
+) Tính số mol khí H2 và N2 theo công thức: $n = \dfrac{V}{{22,4}}$
+) ${\bar M_X} = \dfrac{{{a_{{H_2}}}.{M_{{H_2}}} + {a_{{N_2}}}.{M_{{N_2}}}}}{{{a_{{H_2}}} + {a_{{N_2}}}}}$
+) tỉ khối của X so với He: ${d_{X/He}} = \dfrac{{{M_X}}}{{{M_{He}}}}$
Số mol khí H2 là: ${n_{{H_2}}} = \frac{V}{{22,4}} = \frac{{3,36}}{{22,4}} = 0,15\,mol$
Số mol khí N2 là: ${n_{{N_2}}} = \frac{V}{{22,4}} = \frac{{6,72}}{{22,4}} = 0,3\,mol$
=> khối lượng trung bình của hỗn hợp X là:
${\bar M_X} = \frac{{2.0,15 + 28.0,3}}{{0,15 + 0,3}} = 19,33$
Khí He có M = 4
=> tỉ khối của X so với He là: ${d_{X/He}} = \frac{{{M_X}}}{{{M_{He}}}} = \frac{{19,33}}{4} = 4,83$
Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
-
A.
6,4 gam.
-
B.
12,8 gam.
-
C.
19,2 gam.
-
D.
25,6 gam.
Đáp án : B
+) Tính số mol Fe và số mol CuSO4
+) Viết PTHH
+) So sánh tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1}$ và $\dfrac{{{n_{CuS{O_4}}}}}{1}$ => chất hết, chất dư => tính khối lượng Cu theo chất hết
Số mol Fe là: ${n_{F{\text{e}}}} = \dfrac{{11,2}}{{56}} = 0,2\,mol$
Số mol CuSO4 là: ${n_{CuS{O_4}}} = \dfrac{m}{M} = \dfrac{{40}}{{64 + 32 + 16.4}} = 0,25\,mol$
PTHH: Fe + CuSO4 → FeSO4 + Cu
Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1} = \dfrac{{0,2}}{1} = 0,2$ và $\dfrac{{{n_{CuS{O_4}}}}}{1} = \dfrac{{0,25}}{1} = 0,25$
Vì 0,2 < 0,25 => Fe phản ứng hết, CuSO4 dư
=> tính khối lượng Cu theo Fe
PTHH: Fe + CuSO4 → FeSO4 + Cu
1mol 1mol
0,2 mol → 0,2 mol
=> khối lượng Cu thu được sau phản ứng là: mCu = 0,2.64 = 12,8 gam
Số Avogadro có giá trị bằng:
-
A.
6.10-23.
-
B.
6.10-24.
-
C.
6.1023.
-
D.
6.1024.
Đáp án : C
Số Avogadro có giá trị bằng: 6.1023
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
-
A.
Fe là chất hết.
-
B.
HCl là chất hết.
-
C.
Cả 2 chất cùng hết.
-
D.
Cả 2 chất cùng dư.
Đáp án : B
Tính số mol Fe : nFe = mFe : MFe = ? (mol)
Dựa vào phương trình so sánh xem Fe và HCl chất nào phản ứng hết.
nFe = 5,6 : 56 = 0,1 (mol)
Fe + 2HCl \( \to\) FeCl2 + H2
Theo phương trình 1 2 (mol)
Theo đề bài: 0,1 0,15 (mol)
Ta thấy : \(\dfrac{{0,1}}{1} > \dfrac{{0,15}}{2}\). Do vậy HCl là chất phản ứng hết, Fe là chất còn dư.
Hỗn hợp khí SO2 và O2 có tỉ khối so với CH4 là 3. Thể tích khí O2 cần thêm vào 4,48 lít hỗn hợp trên (đktc) để có tỉ khối so với CH4 giảm còn 2,8 là:
-
A.
2,24 lít
-
B.
1,12 lít
-
C.
11,2 lít
-
D.
22,4 lít
Đáp án : B
Gọi số mol của SO2 và O2 lần lượt là a, b (mol)
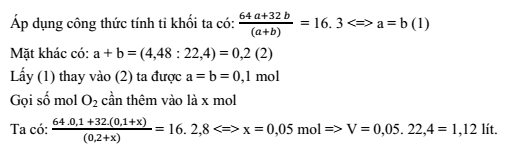
Trong các hợp chất sau, hợp chất nào có hàm lượng sắt cao nhất?
a. FeO b. Fe2O3 c. Fe3O4 d. FeSO4 e. FeS2.
-
A.
FeO
-
B.
Fe3O4
-
C.
FeSO4
-
D.
FeS2 và Fe3O4
Đáp án : A

Một mol nguyên tử Nhôm có chứa bao nhiêu nguyên tử nhôm?
-
A.
56 nguyên tử
-
B.
3.1023 nguyên tử
-
C.
12 nguyên tử
-
D.
6.1023 nguyên tử.
Đáp án : D
Một mol nguyên tử Nhôm có chứa 6.1023 nguyên tử nhôm
Cho biết công thức tính số mol, khi đề bài cho biết khối lượng ( m):
-
A.
m = n. M
-
B.
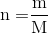
-
C.
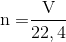
-
D.
n = V. 22,4
Đáp án : B
Cho biết công thức tính số mol, khi đề bài cho biết khối lượng ( m):
n = m/M
Cho hình vẽ thu khí như sau:
Những khí nào trong số các khí H2, N2, NH3 ,O2, Cl2, CO2,HCl, SO2, H2S có thể thu được theo cách trên?
-
A.
Chỉ có khí H2
-
B.
H2, N2, NH3
-
C.
O2, N2, H2,Cl2, CO2
-
D.
Tất cả các khí trên.
Đáp án : B
Để thu khí bằng úp ngược bình thì khí đấy phải nhẹ hơn không khí
→ chọn khí H2, N2, NH3
Cho hình vẽ về cách thu khí dời nước như sau:
Hình vẽ bên có thể áp dụng để thu được khí nào trong các khí sau đây?

-
A.
H2, HCl, H2S
-
B.
H2, CO2
-
C.
NH3, HCl
-
D.
H2, NH3
Đáp án : B
Khí thu bằng phương pháp đẩy nước phải chọn những khí ít hoặc không tan trong nước
→ chọn B có CO2 ít tan trong nước và H2 không tan trong nước
>> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 8 chương 2: Phản ứng hóa học - Đề số 1
- Đề kiểm tra 15 phút Hóa 8 chương 2: Phản ứng hóa học - Đề số 2
- Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 1
- Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 2
- Đề kiểm tra 1 tiết Hóa 8 chương 1: Chất - Nguyên tử - Phân tử - Đề số 1










Danh sách bình luận