Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 1
Đề bài
1 mol nước (H2O) chứa số phân tử là:
-
A.
6,02.1023
-
B.
12,04.1023
-
C.
18,06.1023
-
D.
24,08.1023
Trong 1 mol CO2 có bao nhiêu phân tử?
-
A.
6,02.1023
-
B.
6,04.1023
-
C.
12,04.1023
-
D.
18,06.1023
Lấy 1 mol mỗi mẫu chất sau: H2O, HCl, Fe2O3, C6H12O6. Mẫu chất có khối lượng lớn nhất là
-
A.
H2O
-
B.
HCl
-
C.
Fe2O3
-
D.
C6H12O6
Khí N2 nhẹ hơn khí nào sau đây?
-
A.
H2.
-
B.
NH3.
-
C.
C2H2.
-
D.
O2.
Tỉ khối của hỗn hợp chứa 4 gam metan (CH4) và 7 gam khí etilen (C2H4) so với không khí là:
-
A.
$\dfrac{{22}}{{28}}$
-
B.
$\dfrac{{22}}{{29}}$
-
C.
$\dfrac{{29}}{{21}}$
-
D.
$\dfrac{{29}}{{22}}$
Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
-
A.
6,4 gam.
-
B.
12,8 gam.
-
C.
19,2 gam.
-
D.
25,6 gam.
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
-
A.
10 lần.
-
B.
12 lần.
-
C.
8 lần.
-
D.
14 lần.
Số Avogadro có giá trị bằng:
-
A.
6.10-23.
-
B.
6.10-24.
-
C.
6.1023.
-
D.
6.1024.
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
-
A.
Fe là chất hết.
-
B.
HCl là chất hết.
-
C.
Cả 2 chất cùng hết.
-
D.
Cả 2 chất cùng dư.
Trong các hợp chất sau, hợp chất nào có hàm lượng nitơ cao nhất?
-
A.
NO
-
B.
NO2
-
C.
N2O
-
D.
NH4NO3
Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là:
-
A.
n =V. 22,4
-
B.
n= 22,4/V
-
C.
n = V/ 22,4
-
D.
n. V = 22,4
Cho hình vẽ về cách thu khí dời nước như sau:
Hình vẽ bên có thể áp dụng để thu được khí nào trong các khí sau đây?
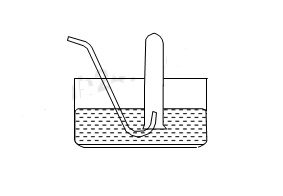
-
A.
H2, HCl, H2S
-
B.
H2, CO2
-
C.
NH3, HCl
-
D.
H2, NH3
Lời giải và đáp án
1 mol nước (H2O) chứa số phân tử là:
-
A.
6,02.1023
-
B.
12,04.1023
-
C.
18,06.1023
-
D.
24,08.1023
Đáp án : A
Dựa vào khái niệm mol để tính 1 mol nước chứa bao nhiêu phân tử:
Mol là lượng chất chứa 6,02 . 1023 nguyên tử (phân tử)
Vì 1 mol chứa 6,02 . 1023 nguyên tử (phân tử)
=> 1 mol H2O chứa: 1 x 6,02 . 1023= 6,02 . 1023 phân tử
Trong 1 mol CO2 có bao nhiêu phân tử?
-
A.
6,02.1023
-
B.
6,04.1023
-
C.
12,04.1023
-
D.
18,06.1023
Đáp án : A
1 mol chứa số nguyên tử là: 6,02.1023 => trong 1 mol CO2 có 6,02.1023 phân tử
Lấy 1 mol mỗi mẫu chất sau: H2O, HCl, Fe2O3, C6H12O6. Mẫu chất có khối lượng lớn nhất là
-
A.
H2O
-
B.
HCl
-
C.
Fe2O3
-
D.
C6H12O6
Đáp án : D
Vì cùng lấy 1 mol chất => chất có khối lượng lớn nhất cũng là chất có khối lượng mol lớn nhất
Khối lượng mol của H2O là: M = 2.1 + 16 = 18 g/mol
Khối lượng mol của HCl là: M = 1 + 35,5 = 36,5 g/mol
Khối lượng mol của Fe2O3 là M = 56.2 + 16.3 = 160 g/mol
Khối lượng mol của C6H12O6 là: M = 12.6 + 12 + 16.6 = 180 g/mol
=> chất có khối lượng lớn nhất là C6H12O6
Khí N2 nhẹ hơn khí nào sau đây?
-
A.
H2.
-
B.
NH3.
-
C.
C2H2.
-
D.
O2.
Đáp án : D
Xem lại công thức tính tỉ khối
Ta có: ${d_{{N_2}/{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{H_2}}}}} = \frac{{28}}{2} = 14 > 1$ => khí N2 nặng hơn khí H2
${d_{{N_2}/N{H_3}}} = \frac{{{M_{{N_2}}}}}{{{M_{N{H_3}}}}} = \frac{{28}}{{17}} = 1,647 > 1$ => khí N2 nặng hơn NH3
${d_{{N_2}/{C_2}{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{C_2}{H_2}}}}} = \frac{{28}}{{26}} = 1,07 > 1$ => khí N2 nặng hơn khí C2H2
${d_{{N_2}/{O_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{O_2}}}}} = \frac{{28}}{{32}} = 0,875 < 1$ => khí N2 nhẹ hơn khí O2
Tỉ khối của hỗn hợp chứa 4 gam metan (CH4) và 7 gam khí etilen (C2H4) so với không khí là:
-
A.
$\dfrac{{22}}{{28}}$
-
B.
$\dfrac{{22}}{{29}}$
-
C.
$\dfrac{{29}}{{21}}$
-
D.
$\dfrac{{29}}{{22}}$
Đáp án : B
+) Tính số mol của CH4 và C2H4 theo CT: $n = \frac{m}{M}$
+) Tính khối lượng trung bình của hỗn hợp khí: $\bar M = \frac{{{n_{C{H_4}}}.{M_{C{H_4}}} + {n_{{C_2}{H_4}}}.{M_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}}$
+) tỉ khối của hỗn hợp so với không khí là: ${d_{X/kk}} = \frac{{\bar M}}{{{M_{kk}}}}$
Số mol của CH4 là: ${n_{C{H_4}}} = \frac{4}{{16}} = 0,25\,mol$
Số mol của C2H4 là: ${n_{{C_2}{H_4}}} = \frac{7}{{28}} = 0,25\,mol$
=> khối lượng trung bình của hỗn hợp khí là:
$\bar M = \frac{{{n_{C{H_4}}}.{M_{C{H_4}}} + {n_{{C_2}{H_4}}}.{M_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}} = \frac{{{m_{C{H_4}}} + {m_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}} = \frac{{4 + 7}}{{0,25 + 0,25}} = 22$
=> tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}} = \frac{{22}}{{29}}$
Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
-
A.
6,4 gam.
-
B.
12,8 gam.
-
C.
19,2 gam.
-
D.
25,6 gam.
Đáp án : B
+) Tính số mol Fe và số mol CuSO4
+) Viết PTHH
+) So sánh tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1}$ và $\dfrac{{{n_{CuS{O_4}}}}}{1}$ => chất hết, chất dư => tính khối lượng Cu theo chất hết
Số mol Fe là: ${n_{F{\text{e}}}} = \dfrac{{11,2}}{{56}} = 0,2\,mol$
Số mol CuSO4 là: ${n_{CuS{O_4}}} = \dfrac{m}{M} = \dfrac{{40}}{{64 + 32 + 16.4}} = 0,25\,mol$
PTHH: Fe + CuSO4 → FeSO4 + Cu
Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1} = \dfrac{{0,2}}{1} = 0,2$ và $\dfrac{{{n_{CuS{O_4}}}}}{1} = \dfrac{{0,25}}{1} = 0,25$
Vì 0,2 < 0,25 => Fe phản ứng hết, CuSO4 dư
=> tính khối lượng Cu theo Fe
PTHH: Fe + CuSO4 → FeSO4 + Cu
1mol 1mol
0,2 mol → 0,2 mol
=> khối lượng Cu thu được sau phản ứng là: mCu = 0,2.64 = 12,8 gam
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
-
A.
10 lần.
-
B.
12 lần.
-
C.
8 lần.
-
D.
14 lần.
Đáp án : D
Lấy phân tử khối của N2 chia cho phân tử khối của H2
Phân tử khối của N2 = 14×2 = 28 (gam/mol)
Phân tử khối của H2 = 2×1 = 2 (gam/mol)
Suy ra
\({d_{{N_2}/{H_2}}} =\dfrac{{28}}{2}= 14\)
Vậy N2 nặng hơn H2 14 lần
Số Avogadro có giá trị bằng:
-
A.
6.10-23.
-
B.
6.10-24.
-
C.
6.1023.
-
D.
6.1024.
Đáp án : C
Số Avogadro có giá trị bằng: 6.1023
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
-
A.
Fe là chất hết.
-
B.
HCl là chất hết.
-
C.
Cả 2 chất cùng hết.
-
D.
Cả 2 chất cùng dư.
Đáp án : B
Tính số mol Fe : nFe = mFe : MFe = ? (mol)
Dựa vào phương trình so sánh xem Fe và HCl chất nào phản ứng hết.
nFe = 5,6 : 56 = 0,1 (mol)
Fe + 2HCl \( \to\) FeCl2 + H2
Theo phương trình 1 2 (mol)
Theo đề bài: 0,1 0,15 (mol)
Ta thấy : \(\dfrac{{0,1}}{1} > \dfrac{{0,15}}{2}\). Do vậy HCl là chất phản ứng hết, Fe là chất còn dư.
Trong các hợp chất sau, hợp chất nào có hàm lượng nitơ cao nhất?
-
A.
NO
-
B.
NO2
-
C.
N2O
-
D.
NH4NO3
Đáp án : C
Tư duy nhanh: hợp chất của N với O có càng nhiều nguyên tử N thì hàm lượng nito càng cao
\(\mathop N\limits^1 \mathop O\limits^1 \) \(\mathop N\limits^1 {\mathop O\limits^2 _2}\) \(\mathop {{N_2}}\limits^2 \mathop O\limits^1 \) \(\mathop {{N_2}}\limits^2 \mathop {{H_4}}\limits^{} \mathop {{O_3}}\limits^3 \)
Ta thấy tỉ lệ 2:1 trong hợp chất N2O là lớn nhất. Do vậy hàm lượng nitơ trong N2O là cao nhất.
Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là:
-
A.
n =V. 22,4
-
B.
n= 22,4/V
-
C.
n = V/ 22,4
-
D.
n. V = 22,4
Đáp án : C
Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là: n = V/ 22,4
Cho hình vẽ về cách thu khí dời nước như sau:
Hình vẽ bên có thể áp dụng để thu được khí nào trong các khí sau đây?

-
A.
H2, HCl, H2S
-
B.
H2, CO2
-
C.
NH3, HCl
-
D.
H2, NH3
Đáp án : B
Khí thu bằng phương pháp đẩy nước phải chọn những khí ít hoặc không tan trong nước
→ chọn B có CO2 ít tan trong nước và H2 không tan trong nước
>> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề kiểm tra 15 phút Hóa 8 chương 2: Phản ứng hóa học - Đề số 1
- Đề kiểm tra 15 phút Hóa 8 chương 2: Phản ứng hóa học - Đề số 2
- Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 1
- Đề kiểm tra 15 phút Hóa 8 chương 3: Mol và tính toán hóa học - Đề số 2
- Đề kiểm tra 1 tiết Hóa 8 chương 1: Chất - Nguyên tử - Phân tử - Đề số 1










Danh sách bình luận