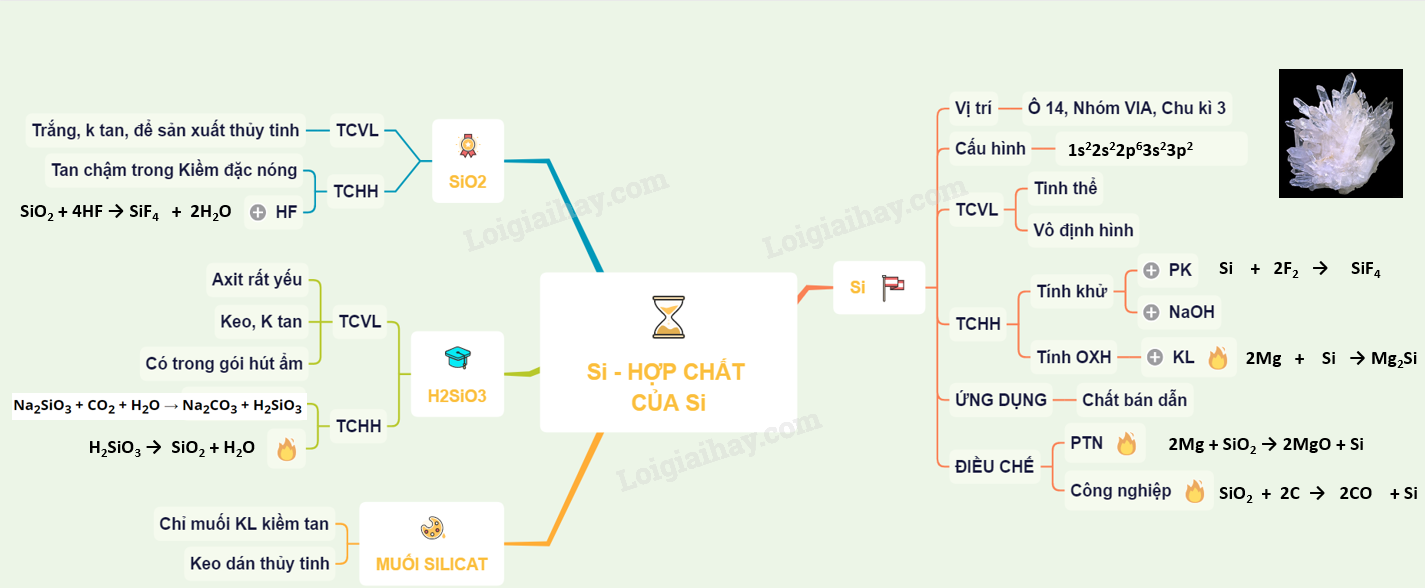
Lý thuyết silic và hợp chất của silic
Trong bảng tuần hoàn silic ở ô
A. SILIC
I. VỊ TRÍ
Trong bảng tuần hoàn silic ở ô thứ 14, nhóm IVA, chu kì 3. Cấu hình electron: 1s22s22p63s23p2.
II. TÍNH CHẤT VẬT LÍ
Có các dạng thù hình là silic tinh thể và silic vô định hình
- Silic tinh thể có cấu trúc giống kim cương, màu xám, có ánh kim và có tính bán dẫn
- Silic vô định hình là chất bột màu nâu
III. TÍNH CHẤT HÓA HỌC
- Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
- Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
1. Tính khử
a) Tác dụng với phi kim:
Si + 2F2 → SiF4
Si + O2 \(\xrightarrow{{{t}^{o}}}\) SiO2
b) Tác dụng với hợp chất:
2NaOH + Si + H2O → Na2SiO3 + 2H2
2. Tính OXH
- Tác dụng với một số kim loại mạnh ở nhiệt độ cao:
2Mg + Si \(\xrightarrow{{{t}^{o}}}\) Mg2Si
IV. ỨNG DỤNG
- Silic siêu tinh khiết là chất bán dẫn dùng trong kỹ thuật vô tuyến và điện tử như chế tạo tế bào quang điện, bộ khuếch đại,...
- Trong luyện kim silic được dùng để tách oxi ra khỏi kim loại nóng chảy
V. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
2Mg + SiO2 \(\xrightarrow{{{t}^{o}}}\) 2MgO + Si (900oC)
2. Trong công nghiệp
SiO2 + 2C \(\xrightarrow{{{t}^{o}}}\) 2CO + Si (1800oC)
B. HỢP CHẤT CỦA SILLIC
I. SiO2
1. Tính chất vật lý
Ở dạng tinh thể nguyên tử màu trắng rất cứng, không tan trong nước, có tso và tnco rất cao, tồn tại ở dạng cát và thạch anh là nguyên liệu quan trọng để sản xuất thủy tinh.
2. Tính chất hóa học
a) Tan chậm trong dung dịch kiềm đặc nóng, tan nhanh trong kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy
SiO2 + 2NaOH \(\xrightarrow{{{t}^{o}}}\) Na2SiO3 + H2O
SiO2 + Na2CO3 \(\xrightarrow{{{t}^{o}}}\) Na2SiO3 + CO2
b) Tác dụng với HF ( dùng phản ứng này để khắc chữ, tranh lên thủy tinh)
SiO2 + 4HF → SiF4 + 2H2O
II. H2SiO3
1. Tính chất vật lý
Là axit rất yếu (yếu hơn H2CO3) , ở dạng keo, không tan trong nước. Khi bị mất nước thì tạo thành xốp silicagen, thường được dùng để hút ẩm trong các thùng hàng hóa
2. Tính chất hóa học
a) Phản ứng nhiệt phân:
H2SiO3 \(\xrightarrow{{{t}^{o}}}\) SiO2 + H2O
b) Tác dụng được với axit cacbonic :
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3
III. MUỐI SILICAT
- Chỉ có muối của kim loại kiềm tan được trong nước.
Na2SiO3 + 2H2O ↔ 2NaOH + H2SiO3
- Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng, dùng để chế tạo keo dán thủy tinh và sứ,...
Sơ đồ tư duy: Silic và hợp chất của silic
Loigiaihay.com













Danh sách bình luận