20 bài tập về nhiều kim loại tác dụng với nhiều muối có lời giải
Làm đề thiCâu hỏi 1 :
Cho hỗn hợp gồm 0,045 mol Mg và 0,05 mol Fe tác dụng với V ml dung dịch chứa Cu(NO3)2 0,5M và AgNO3 0,3M. Sau phản ứng thu được dung dịch Y và hỗn hợp kim loại Z. Cho toàn bộ hỗn hợp Z tác dụng với dung dịch HCl dư thu được 0,672 lít khí H2 (đktc). Cho biết các phản ứng xảy ra hoàn toàn. Giá trị của V là:
- A 150
- B 100
- C 120
- D 200
Đáp án: B
Lời giải chi tiết:

Câu hỏi 2 :
Cho hỗn hợp gồm 0,1 mol Zn và 0,2 mol Mg vào 400ml dung dịch chứa đồng thời Cu(NO3)21M và AgNO31M. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn X. Hòa tan hoàn toàn X trong lượng dư dung dịch HNO3, thu được V lít khí NO (sản phẩm khử duy nhất N+5, đktc). Giá trị của Vlà
- A 6,72.
- B 5,6.
- C 2,24.
- D 4,48.
Đáp án: D
Lời giải chi tiết:
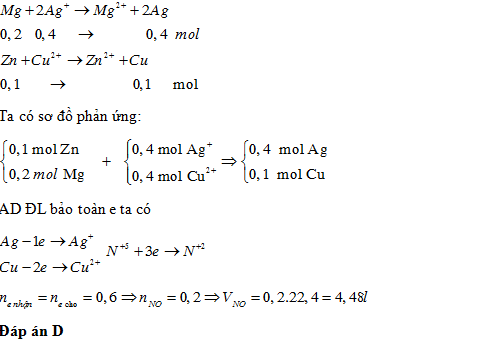
Câu hỏi 3 :
Dung dịch X có chứa AgNO3 và Cu(NO3)2 có cùng nồng độ mol . Thêm 1 hỗn hợp gồm 0,03 mol Al và 0,05 mol Fe vào 100 ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại . Cho m gam Y vào HCl dư giải phóng 0,07g khí. Nồng độ của 2 muối ban đầu là :
- A 0,3M
- B 0,4M
- C 0,42M
- D 0,45M
Đáp án: B
Lời giải chi tiết:
Chất rắn Y gồm 3 kim loại => Gồm Ag,Cu,Fe
Khi cho Y + HCl => nH2 = nFe(Y) = 0,035 mol
=> Số mol Fe phản ứng là 0,05 – 0,035 = 0,015 mol
Gọi nồng độ mol 2 muối ban đầu là x M
=> 2nCu2+ + nAg+ = 2nFe pứ + 3nAl
=> 0,1.(2x + x) = 2.0,015 + 3.0,03
=> x = 0,4M
Đáp án B
Câu hỏi 4 :
Cho hỗn hợp X gồm Al và Mg tác dụng với 1 lít dung dịch gồm AgNO3 a mol/l và Cu(NO3)2 2a mol/l, thu được 14,0 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng (dư), thu được 2,24 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
- A 0,15.
- B 0,10.
- C 0,05.
- D 0,20.
Đáp án: B
Phương pháp giải:
Khi cho hh X + AgNO3 và Cu(NO3)2:
→ Chất rắn Y thu được sẽ chứa các kim loại: Ag có thể có Cu và cũng có thể có thêm Mg, Al nếu 2 kim loại này dư.
→ Y có nhiều khả năng khác nhau có thể xảy ra. Ở đây ta nên tập trung xét khả năng xảy ra nhiều nhất là hh rắn chỉ có Ag và Cu (có nghĩa là Mg, Al phản ứng hết)
Lời giải chi tiết:
Theo đề bài: nAg+ bđ = a (mol) và nCu2+ bđ = 2a (mol)
Giả sử hỗn hợp Y chứa Cu và Ag.
→ nAg = nAg+ bđ = a mol (do Ag+ pư hết)
Gọi số mol Cu là b mol. Số mol Cu tạo thành phải nhỏ hơn hoặc bằng Cu2+ ban đầu nên b ≤ 2a (*)
+) m(hh Y) = mAg + mCu = 108a + 64b = 14 (1)
+) Cho Y + H2SO4: ne trao đổi = nAg + 2nCu = 2nSO2 → a + 2b = 2.0,1 = 0,2 (2)
Giải (1) và (2): a = 0,1 và b = 0,05 → Thỏa mãn (*)
Kết luận: a = 0,1
Đáp án B
Câu hỏi 5 :
Cho hỗn hợp X gồm Al và Mg tác dụng với 1 lít dung dịch gồm AgNO3 a mol/l và Cu(NO3)2 2a mol/l, thu được 14,0 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng (dư), thu được 2,24 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
- A 0,15.
- B 0,10.
- C 0,05.
- D 0,20.
Đáp án: B
Phương pháp giải:
Khi cho hh X + AgNO3 và Cu(NO3)2 :
→ chất rắn Y thu được sẽ chứa các kim loại: Ag có thể có Cu và cũng có thể có thêm Mg, Al nếu 2 kim loại này dư.
→ Y có nhiều khả năng khác nhau có thể xảy raỞ đây ta nên tập trung xét khả năng xảy ra nhiều nhất là hh rắn chỉ có Ag và Cu (có nghĩa là Mg, Al phản ứng hết)
Lời giải chi tiết:
m(hh Y) = mCu + mAg = 64 . nCu + 108 . nAg = 14 (1)
Cho Y + H2SO4:
Số mol e trao đổi = 2nCu + 1nAg = 2nSO2 = 2.0,1 = 0,2 (2)
Giải (1) và (2) : nAg = 0,1 mol; nCu = 0,05 mol
Theo bài cho nồng độ Cu(NO3)2 gấp 2 lần AgNO3 như vậy lượng Cu(NO3)2vẫn còn dư sau phản ứng.
→ kết quả trên là hợp lí, hỗn hợp Mg, Al đã phản ứng hết với Ag+, đến lượt Cu2+ thì mới phản ứng được 0,05 mol thì hết, còn lại 0,15 mol dư.
Như vậy ta có nAgNO3 = nAg = 0,1 mol a = 0,1 mol
Đáp án B
Câu hỏi 6 :
Hòa tan hết hỗn hợp gồm 7,2 gam Mg và 22,4 gam Fe trong 500 ml dung dịch Fe(NO3)3 x mol/l và Cu(NO3)2 y mol/l thu được dung dịch X và 31,2 gam chất rắn Y gồm 2 kim loại. Để tác dụng tối đa với dung dịch X cần dung dung dịch chứa 2,0 mol NaOH (không có không khí). Giá trị x, y là:
- A 0,4M và 0,8M.
- B 0,6M và 0,45M.
- C 0,8M và 0,8M.
- D 0,8M và 0,6M.
Đáp án: C
Phương pháp giải:
Do Y gồm 2 kim loại (Cu, Fe) nên Mg hết, Fe dư, Fe(NO3)3 hết; Cu(NO3)2 hết sau phản ứng thu được Mg(NO3)2 và Fe(NO3)2.
+ nNaOH=2nMg(NO3)2+2nFe(NO3)2 => nFe(NO3)2
+ BTNT N: 3nFe(NO3)3+2nCu(NO3)2=2nMg(NO3)2+2nFe(NO3)2
Lời giải chi tiết:
nMg=0,3 mol; nFe=0,4 mol; nFe(NO3)3=0,5x mol; nCu(NO3)2=0,5y
Do Y gồm 2 kim loại (Cu, Fe) nên Mg hết, Fe dư, Fe(NO3)3 hết; Cu(NO3)2 hết
+ X gồm: 0,3 mol Mg(NO3)2 và a mol Fe(NO3)2
nNaOH=2nMg(NO3)2+2nFe(NO3)2=>2=2.0,3+2.a=>a=0,7mol
+ Y gồm (Cu: 0,5y mol; Fe dư: 0,5x+0,4-0,7=0,5x-0,3 mol) => 64.0,5y+56.(0,5x-0,3)=31,2 (1)
+ BTNT N: 3nFe(NO3)3+2nCu(NO3)2=2nMg(NO3)2+2nFe(NO3)2 => 3.0,5x+2.0,5y=2.0,3+2.0,7 (2)
Giải (1) và (2) => x=0,8M; y=0,8M
Đáp án C
Câu hỏi 7 :
Cho 10,4 gam hỗn hợp gồm Fe và Mg vào lọ chứa 200 ml dung dịch Cu(NO3)2 1M và AgNO3 1M (phản ứng xảy ra hoàn toàn và vừa đủ). Khối Fe và Mg trong hỗn hợp là:
- A 5,6 gam và 4,8 gam
- B 8,4 gam và 2,0 gam
- C 2,8 gam và 7,6 gam
- D 4,8 gam và 5,6 gam
Đáp án: A
Lời giải chi tiết:
Đặt số mol Fe và Mg lần lượt là x, y.
+ m hỗn hợp = mFe + mMg => 56x + 24y = 10,4 (1)
+ BT e: 2nFe + 2nMg = 2nCu2+ + nAg+ => 2x + 2y = 2.0,2 + 0,2 (2)
Giải (1) và (2) => x = 0,1; y = 0,2
Vậy mFe = 5,6 gam; mMg = 4,8 gam
Đáp án A
Câu hỏi 8 :
Hòa tan một hỗn hợp chứa 0,1 mol Mg và 0,1 mol Al vào dung dịch hỗn hợp chứa 0,1 mol Cu(NO3)2 và 0,35 mol AgNO3. Khi phản ứng xảy ra hoàn toàn thì khối lượng chất rắn thu được bằng :
- A 21,6 gam.
- B 37,8 gam.
- C 42,6 gam.
- D 44,2 gam.
Đáp án: C
Phương pháp giải:
Mg - 2e→ Mg2+
0,1 0,2
Al -3e → Al3+
0,1 0,3
Ag+ +1e →Ag
0,35 0,35 0,35
Cu2+ +2e→Cu
x 2x x
Bảo toàn e => 0,2+0,3 = 0,35+2x => x
=> mrắn = mAg + mCu
Lời giải chi tiết:
Mg - 2e→ Mg2+
0,1 0,2
Al -3e → Al3+
0,1 0,3
Ag+ +1e →Ag
0,35 0,35 0,35
Cu2+ +2e→Cu
x 2x x
Bảo toàn e => 0,2+0,3 = 0,35+2x => x=0,075< 0,1 => Cu(NO3)2 dư
=> mrắn = mAg + mCu = 0,35.108 + 0,075.64=42,6 gam
Đáp án C
Câu hỏi 9 :
Dung dịch X có chứa AgNO3 và Cu(NO3)2 có cùng nồng độ. Thêm một lượng hỗn hợp gồm 0,03 mol Al và 0,05 mol Fe vào 100 ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Cho Y vào HCl dư giải phóng 0,07 gam khí. Nồng độ của hai muối là:
- A 0,3M
- B 0,4M
- C 0,42M
- D 0,45M
Đáp án: B
Phương pháp giải:
Chất rắn Y Ag, Cu, Fe dư
Fe -2e →Fe 2+
Al -3e → Al3+
Ag+ +1e →Ag
x x x
Cu2+ +2e→Cu
x 2x x
2H+ +2e→H2
Bảo toàn e => 3x+0,07= 1,9 =>x
=> CM
Lời giải chi tiết:
Chất rắn Y Ag, Cu, Fe dư
nFe dư = nH2 = 0,035 mol
Fe -2e →Fe 2+
0,05 0,1
Al -3e → Al3+
0,03 0,09
Ag+ +1e →Ag
x x x
Cu2+ +2e→Cu
x 2x x
2H+ +2e→H2
0,07 0,035
Bảo toàn e => 3x+0,07= 1,9 =>x=0,04 mol
=> CM = 0,4M
Đáp án B
Câu hỏi 10 :
Cho 0,015 mol Mg và 0,025 mol Fe tác dụng với V lít dung dịch X chứa Cu(NO3)2 0,1M và AgNO3 0,3M. Sau phản ứng thu được dung dịch Y và hỗn hợp kim loại Z. Cho Z tác dụng với dung dịch HCl dư thu được 0,336 lít H2 (đktc). Cho biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
- A 0,12
- B 0,2
- C 0,15
- D 0,1
Đáp án: D
Lời giải chi tiết:
Đáp án D
Câu hỏi 11 :
Dung dịch X có chứa AgNO3 và Cu(NO3)2 có cùng nồng độ mol. Thêm một lượng hỗn hợp gồm 0,03 mol Al và 0,05 mol Fe vào 100 ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Cho Y vào HCl dư giải phóng 0,07 gam khí. Nồng độ mol/lít của hai muối là:
- A 0,30.
- B 0,40.
- C 0,63.
- D 0,42.
Đáp án: B
Phương pháp giải:
Chất rắn Y gồm 3 kim loại là Ag; Cu và Fe dư
Fedư + 2HCl → FeCl2 + H2
Ta có: nFe dư = nH2 = ?
→ Số mol Fe đã phản ứng với dung dịch X
Đặt nAgNO3 = nCu(NO3)2 = a mol
Áp dụng định luật bảo toàn electron để giải.
Lời giải chi tiết:
Chất rắn Y gồm 3 kim loại là Ag; Cu và Fe dư
Fedư+ 2HCl → FeCl2+ H2
Ta có: nFe dư = nH2 = 0,07 : 2 = 0,035 mol → Số mol Fe đã phản ứng với dung dịch X là 0,05 - 0,035 = 0,015 mol
Đặt nAgNO3 = nCu(NO3)2 = a mol
Áp dụng định luật bảo toàn electron:
QT cho e:
Al → Al3++ 3e
0,03 → 0,09 mol
Fe → Fe2++ 2e
0,015 → 0,03 mol
QT nhận e:
Ag++ 1e → Ag
a → a mol
Cu2++ 2e→ Cu
a → 2 a mol
→ 0,09 + 0,03 = a+ 2a → a = 0,04 mol → Nồng độ mol của hai muối làÁp dụng định luật bảo toàn e ta có: Tổng số mol e cho = Tổng số mol e nhận
CM = 0,04: 0,1 = 0,4 mol/l
Đáp án B
Câu hỏi 12 :
Cho 1,57 gam hỗn hợp X gồm Zn và Al vào 100 ml dung dịch Y gồm Cu(NO3)2 0,3M và AgNO3 0,1M đến khi phản ứng xảy ra hoàn toàn, thu được m gam chất rắn T và dung dịch Z chỉ chứa 2 muối. Ngâm T trong H2SO4 loãng không thấy có khí thoát ra. Phần trăm khối lượng của Zn trong hỗn hợp X là?
- A 41,40%
- B 58,60%
- C 82,80%
- D 53,27%
Đáp án: C
Phương pháp giải:
Liệt kê các kim loại: Al; Zn; Cu; Ag
Dung dịch Z chỉ chứa 2 muối → Dung dịch Z chứa Al(NO3)3, Zn(NO3)2
Chất rắn T chứa Ag; Cu; T không chứa Al, Zn vì khi ngâm T trong H2SO4 loãng không thấy có khí thoát ra.
Lời giải chi tiết:
Ta có: nAgNO3 = 0,01 mol; nCu(NO3)2 = 0,03 mol
Liệt kê các kim loại: Al; Zn; Cu; Ag
Dung dịch Z chỉ chứa 2 muối → Dung dịch Z chứa Al(NO3)3, Zn(NO3)2
Chất rắn T chứa Ag; Cu; T không chứa Al, Zn vì khi ngâm T trong H2SO4 loãng không thấy có khí thoát ra.
Đặt nZn = y mol; nAl = x mol → 27x+ 65y = 1,57 gam (1)
Áp dụng định luật bảo toàn electron:
QT cho e:
Al → Al3++ 3e
x → 3x mol
Zn → Zn2++ 2e
y→ 2y mol
QT nhận e:
Ag++ 1e → Ag
0,01 → 0,01 mol
Cu2++ 2e→ Cu
0,03 → 0,06 mol
→ 3x + 2y = 0,01+ 0,06 = 0,07 (2)Áp dụng định luật bảo toàn e ta có: Tổng số mol e cho = Tổng số mol e nhận
Giải hệ (1), (2) ta có: x = 0,01 và y = 0,02 → mZn = 0,02.65 = 1,3 gam→ %mZn = 82,80%
Đáp án C
Câu hỏi 13 :
Cho hỗn hợp X gồm Al và Zn tác dụng với 1 lít dung dịch gồm Cu(NO3)2 1,5a mol/lít và AgNO3 2a mol/lít, thu được 59,04 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc nóng dư thu được 8,96 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
- A 0,18
- B 0,20
- C 0,22
- D 0,24
Đáp án: C
Phương pháp giải:
nSO2 = 0,4 mol
- Nếu chất rắn chỉ có Ag max:
BTe cho pư của chất rắn và H2SO4 đặc => nAg = 2nSO2
Tính khối lượng chất rắn khi đó m1
- Nếu chất rắn có Ag max, Cu max:
nAg = 2a (mol) và nCu = 1,5a (mol)
BTe cho pư của chất rắn và H2SO4 đặc tìm được a
Tính khối lượng chất rắn khi đó m2
So sánh thấy m2 < mchất rắn < m1
⟹ chất rắn chứa Ag max (2a mol) và Cu chưa max (b mol)
Lập hệ phương trình về khối lượng chất rắn và bảo toàn e được a, b
Lời giải chi tiết:
nSO2 = 0,4 mol
- Nếu chất rắn chỉ có Ag max:
BTe cho pư của chất rắn và H2SO4 đặc: nAg = 2nSO2 = 0,8 mol
Khối lượng chất rắn khi đó là: m1 = 0,8.108 = 86,4 gam
- Nếu chất rắn có Ag max, Cu max:
nAg = 2a (mol) và nCu = 1,5a (mol)
BTe cho pư của chất rắn và H2SO4 đặc: 2nCu + nAg = 2nSO2 ⇔ 2.1,5a + 2a = 2.0,4 ⇔ a = 0,16
Khối lượng chất rắn khi đó là: m2 = 2a.108 + 1,5a.64 = 49,92 gam
Ta thấy: m2 < mchất rắn < m1
⟹ chất rắn chứa Ag max (2a mol) và Cu chưa max (b mol)
Ta có hệ pt: \(\left\{ \begin{array}{l}108.2{\rm{a}} + 64b = 59,04\\2{\rm{a}} + 2b = 2.0,4\end{array} \right. \to \left\{ \begin{array}{l}a = 0,22\\b = 0,18\end{array} \right.\)
Kết luận: a = 0,22
Đáp án C
Câu hỏi 14 :
Cho 12,1 gam hỗn hợp X gồm Zn và Ni tác dụng với 200 ml dung dịch Y chứa AgNO3 1M và Cu(NO3)2 0,5M đến khi phản ứng hoàn toàn, thu được dung dịch Z chứa 2 muối và chất rắn T gồm 2 kim loại. Phần trăm khối lượng của Zn trong X là
- A 73,14%.
- B 80,58%.
- C 26,86%.
- D 19,42%.
Đáp án: C
Phương pháp giải:
Vận dụng định luật bảo toàn electron.
Lời giải chi tiết:
Ta có: nAgNO3 = 0,2 mol; nCu(NO3)2 = 0,1 mol
Quá trình cho - nhận e:
QT cho e:
Zn→ Zn2++ 2e (1)
x 2x mol
Ni→ Ni2++ 2e (2)
y 2y mol
QT nhận e:
Ag++ 1e → Ag
0,2 0,2 mol
Cu2++ 2e → Cu
0,1 0,2 mol
Dung dịch Z chứa 2 muối là Zn2+, Ni2+ và chất rắn T gồm 2 kim loại là Ag và Cu → Cả Zn, Ni, Ag+, Cu2+ phản ứng hết
Theo định luật bảo toàn electron ta có: 2x + 2y = 0,2 + 0,2 = 0,4 mol
Ta có: mX = 65x + 59 y = 12,1
Giải hệ ta có: x = 0,05; y = 0,15 → %mZn = 26,86%
Đáp án C
Câu hỏi 15 :
Dung dịch X có chứa AgNO3 và Cu(NO3)2 có cùng nồng độ mol. Thêm 1 hỗn hợp gồm 0,03 mol Al và 0,05 mol Fe vào 100 ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Cho m gam Y vào HCl dư giải phóng 0,07g khí. Nồng độ của 2 muối ban đầu là:
- A 0,3M
- B 0,4M
- C 0,42M
- D 0,45M
Đáp án: B
Phương pháp giải:
- Thứ tự phản ứng của muối: AgNO3, Cu(NO3)2
- Thứ tự phản ứng của KL: Al, Fe
Do sau phản ứng thu được 3 KL nên suy ra 3 KL đó là Ag, Cu, Fe dư.
Lời giải chi tiết:
- Thứ tự phản ứng của muối: AgNO3, Cu(NO3)2
- Thứ tự phản ứng của KL: Al, Fe
Do sau phản ứng thu được 3 KL nên suy ra 3 KL đó là Ag, Cu, Fe dư.
Khi Y + HCl chỉ có Fe phản ứng: Fe + 2HCl → FeCl2 + H2 (nH2 = 0,07 : 2 = 0,035 mol)
Xét toàn bộ quá trình:
Quá trình nhường e:
Al → Al3+ + 3e
Fe → Fe2+ + 2e
=> n e nhường = 3nAl + 2nFe
Quá trình nhận e:
Ag+ + 1e → Ag
Cu2+ + 2e → Cu
2H+ + 2e → H2
=> n e nhận = nAg + 2nCu + 2nH2
BTe: n e nhường = n e nhận => 3nAl + 2nFe = nAg + 2nCu + 2nH2 => 3.0,03 + 0,05.2 = x + 2x + 0,035.2
=> x = 0,04 mol => CM = n : V = 0,04 : 0,1 = 0,4M
Đáp án B
Câu hỏi 16 :
Khuấy 7,85 gam hỗn hợp bột kim loại Zn và Al vào 100 ml dung dịch gồm FeCl2 1M và CuCl2 0,75M thì thấy phản ứng vừa đủ với nhau. % khối lượng của Al trong hỗn hợp là:
- A 21,7%.
- B 12,7%.
- C 27,1%.
- D 17,2%.
Đáp án: D
Phương pháp giải:
Phản ứng vừa đủ nên cả hh kim loại và hh muối cùng phản ứng hết.
Đặt số mol Zn và Al lần lượt là x và y (mol)
Lập hệ phương trình với khối lượng và bảo toàn e giải được x, y
Từ đó tính được %mAl = ?
Lời giải chi tiết:
100 ml = 0,1 (lít)
nFeCl2 = V.CM = 0,1.1 = 0,1 (mol)
nCuCl2 = V.CM = 0,1.0,75 = 0,075 (mol)
Đặt trong 7,85 gam hh Zn và Al có số mol lần lượt là x và y (mol)
→ mhh = 65x + 27y = 7,85 (I)
Quá trình nhường e
Zn → Zn+2 + 2e
x → 2x (mol)
Al → Al+3 + 3e
y → 3y (mol)
quá trình nhận e
Fe+2 + 2e → Fe
0,1 → 0,2 (mol)
Cu+2 + 2e → Cu
0,075 → 0,15 (mol)
Bảo toàn e ta có: ∑ ne nhường = ∑ ne nhận → 2x + 3y = 0,2 + 0,15 (II)
Giải hệ (I) và (II) ta có: x = 0,1 và y = 0,05
\(\% mAl = \frac{{{m_{Al}}}}{{{m_{hh}}}}.100\% = \frac{{0,05.27}}{{7,85}}.100\% \approx 17,2\% \)
Đáp án D
Câu hỏi 17 :
Hỗn hợp X gồm Al, Fe. Cho m gam X vào dung dịch KOH dư, thu được 6,72 lít H2 (đktc). Biết m gam X phản ứng tối đa với 0,45 mol Cl2. Cho m gam X vào dung dịch chứa 0,4 mol AgNO3 và 0,15 mol Cu(NO3)2 thu được x gam chất không tan. Các phản ứng hoàn toàn. Giá trị tương ứng của m và x là:
- A 11 và 55,6.
- B 11 và 47,2.
- C 13,7 và 47,2.
- D 14,2 và 55,6.
Đáp án: A
Lời giải chi tiết:
- Khi X + NaOH chỉ có Al phản ứng:
Bảo toàn e → nAl = 2/3.nH2 = 2/3.0,3 = 0,2 mol
- Khi X + Cl2:
Bảo toàn e → 3nAl + 3nFe = 2nCl2 → 3.0,2 + 3nFe = 2.0,45 → nFe = 0,1 mol
⟹ m = 0,2.27 + 0,1.56 = 11 gam
- Cho X {0,2 mol Al và 0,1 mol Fe} tác dụng với 0,4 mol Ag+ và 0,15 mol Cu2+:
Ta thấy: 3nAl + 2nFe > nAg+ + 2nCu2+ > 3nAl (so sánh các mốc mol electron)
⟹ Al hết, Fe dư, Ag+ hết, Cu2+ hết
Bảo toàn e → 3nAl + 2nFe pư = nAg+ + 2nCu2+
→ 3.0,2 + 2.nFe pư = 0,4 + 2.0,15
→ nFe pư = 0,05 mol
Vậy chất rắn gồm: Ag (0,4 mol); Cu (0,15 mol) và Fe dư (0,1 - 0,05 = 0,05 mol)
→ x = 0,4.108 + 0,15.64 + 0,05.56 = 55,6 gam
Đáp án A
Câu hỏi 18 :
Cho 9,2 gam hỗn hợp bột X gồm Mg, Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2, sau phản ứng thu được chất rắn Y chứa ba kim loại và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 (đặc, nóng, dư) thu được 6,384 lít khí SO2 (đktc). Cho dung dịch NaOH dư vào dung dịch Z, thu được kết tủa T. Nung T trong không khí đến khi khối lượng không đổi thu được 8,4 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm theo khối lượng của Mg trong hỗn hợp X là:
- A 39,13%.
- B 60,87%.
- C 16,06%.
- D 83,94%.
Đáp án: A
Câu hỏi 19 :
Cho m gam hỗn hợp gồm bột Fe và Mg có tỉ lệ mol tương ứng 3 : 1 vào dung dịch chứa Cu(NO3)2 1,2M và AgNO3 0,8M. Kết thúc phản ứng thu được dung dịch X và 22,84 gam rắn Y. Để tác dụng tối đa các chất tan có trong dung dịch X cần dùng dung dịch chứa 0,36 mol NaOH. Giá trị m là
- A 14,40 gam
- B 12,48 gam
- C 9,60 gam
- D 11,52 gam
Đáp án: B
Phương pháp giải:
nCu(NO3)2 : nAgNO3 = 1,2 : 0,8 = 3/2
Đặt nCu(NO3)2 = 3x và nAgNO3 = 2x (mol)
X tác dụng với lượng tối đa NaOH tạo thành NaNO3 => nNaNO3 = nNaOH
BTNT “N”: 2nCu(NO3)2 + nAgNO3 = nNaNO3 => x
=> nCu(NO3)2 và nAgNO3
Ta thấy: mCu max + mAg max < 22,84 gam
=> Cu(NO3)2 và AgNO3 hết, KL dư
ĐặtnFe = 3y và nMg = y (mol)
TH1: Mg dư, Fe chưa phản ứng
TH2: Mg hết, Fe dư
Lời giải chi tiết:
nCu(NO3)2 : nAgNO3 = 1,2 : 0,8 = 3/2
Đặt nCu(NO3)2 = 3x và nAgNO3 = 2x (mol)
X tác dụng với lượng tối đa NaOH tạo thành NaNO3 => nNaNO3 = nNaOH = 0,36 mol
BTNT “N”: 2nCu(NO3)2 + nAgNO3 = nNaNO3
=> 2.3x + 2x = 0,36 => x = 0,045
=> nCu(NO3)2 = 0,135 mol và nAgNO3 = 0,09 mol
Ta thấy: 0,135.64 + 0,09.108 = 18,36 gam < 22,84 gam
=> Cu(NO3)2 và AgNO3 hết, KL dư
ĐặtnFe = 3y và nMg = y (mol)
TH1: Mg dư, Fe chưa phản ứng
BTe: 2nMg = 2nCu + nAg => 2nMg pư = 2.0,135 + 0,09 => nMg pư = 0,18 mol
=> nMg dư = y – 0,18 mol (y > 0,18 mol)
m rắn = mMg dư + mFe + mCu + mAg => 22,84 = 24(y-0,18) + 56.3y + 18,36 => y = 11/240 < 0,18 (loại)
TH2: Mg hết, Fe dư
m rắn = m Cu + mAg + mFe dư => mFe dư = m rắn – (mCu + mAg) = 22,84 – 18,36 = 4,48 gam
=> nFe dư = 0,08 mol => nFe pư = 3y – 0,08 (mol)
BTe: 2nMg + 2nFe = 2nCu + nAg => 2.y + 2.(3y – 0,08) = 2.0,135 + 0,09
=> y = 0,065
=> nFe = 0,195 mol và nMg = 0,065 mol
=> m = 0,195.56 + 0,065.24 = 12,48 gam
Đáp án B
Câu hỏi 20 :
Cho 3,72 gam hỗn hợp gồm Mg và Al vào V ml dung dịch chứa AgNO3 x (mol/l) và Cu(NO3)2 y (mol/l). Sau khi kết thúc phản ứng, thu được dung dịch X và 20 gam chất rắn Y. Cho dung dịch NaOH dư vào X, thấy lượng NaOH phản ứng là 18,4 gam. Lọc lấy kết tủa, nung ngoài không khí đến khối lượng không đổi, thu được 7,6 gam hỗn hợp gồm hai oxit. Tỉ lệ x : y là
- A 4 : 5
- B 2 : 3
- C 1 : 1
- D 1 : 3
Đáp án: A
Phương pháp giải:
Do cho X tác dụng với NaOH dư sau đó nung kết tủa thu được 2 oxit nên 2 oxit là MgO và CuO
=> Trong phản ứng đầu Mg, Al hết, Cu(NO3)2 dư
Sơ đồ:
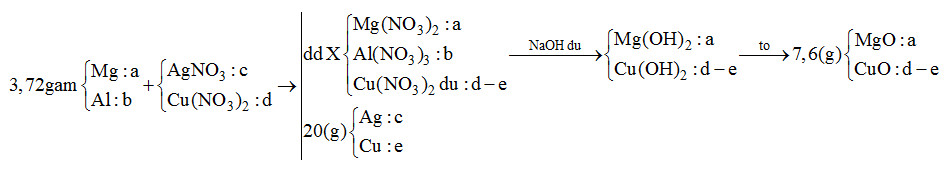
mMg + mAl = 24a + 27b = 3,72 (1)
mAg + mCu = 108c + 64e = 20 (2)
nNaOH = 2nMg2+ + 4nAl3+ + 2nCu2+ => 2a + 4b + 2(d-e) = 0,46 (3)
mMgO + mCuO = 40a + 80 (d-e) = 7,6 (4)
BTe: 2nMg + 3nAl = nAg + 2nCu => 2a + 3b = c + 2e (5)
Giải hệ thu được a, b, c, d, e
=> x : y = c : d
Lời giải chi tiết:
Do cho X tác dụng với NaOH dư sau đó nung kết tủa thu được 2 oxit nên 2 oxit là MgO và CuO
=> Trong phản ứng đầu Mg, Al hết, Cu(NO3)2 dư
Sơ đồ:
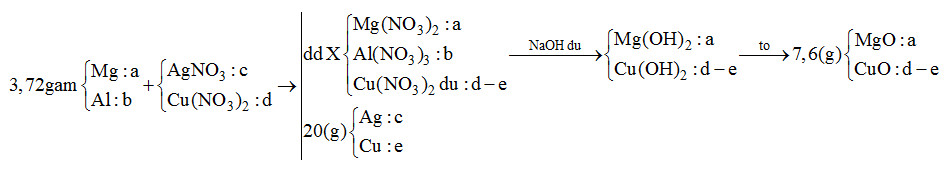
mMg + mAl = 24a + 27b = 3,72 (1)
mAg + mCu = 108c + 64e = 20 (2)
nNaOH = 2nMg2+ + 4nAl3+ + 2nCu2+ => 2a + 4b + 2(d-e) = 0,46 (3)
mMgO + mCuO = 40a + 80 (d-e) = 7,6 (4)
BTe: 2nMg + 3nAl = nAg + 2nCu => 2a + 3b = c + 2e (5)
Giải 5 phương trình trên thu được a = 0,11; b = 0,04; c = 0,12; d = 0,15; e = 0,11
=> x : y = c : d = 0,12 : 0,15 = 4 : 5
Đáp án A
20 bài tập về kim loại tác dụng với axit (HCl, H2SO4 loãng) đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
20 bài tập về kim loại tác dụng với HNO3, H2SO4 đặc đầy đủ trắc nghiệm và tự luận từ dễ đến khó có đáp án và lời giải chi tiết
Tổng hợp 30 bài tập vận dụng cao về tính chất hóa học của kim loại đầy đủ trắc nghiệm và tự luận có đáp án và giải chi tiết
20 bài tập về hợp kim của kim loại đầy đủ các dạng từ dễ đến khó, trắc nghiệm và tự luận có đáp án và lời giải chi tiết
20 bài tập về nhiều kim loại tác dụng với một muối đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết
30 bài tập một kim loại tác dụng với nhiều muối đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết
20 bài tập kim loại tác dụng với một muối đầy đủ tự luận và trắc nghiệm có đáp án và lời giải chi tiết (phần 1)
50 câu hỏi lý thuyết mức độ thông hiểu về tính chất - dãy điện hóa của kim loại đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết
Tổng hợp 50 câu hỏi mức độ nhận biết về dãy điện hóa của kim loại đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết (phần 1)
50 câu hỏi lý thuyết mức độ nhận biết về tính chất hóa học của kim loại đầy đủ tự luận và trắc nghiệm có đáp án và lời giải chi tiết (phần 1)
40 câu hỏi lý thuyết có tính chất vật lý của kim loại đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 15 bài toán cho từ từ axit vào muối cacbonat có lời giải
- 15 bài toán cho từ từ muối cacbonat vào axit có lời giải
- 50 bài tập CO2 tác dụng với dung dịch kiềm và muối cacbonat có lời giải
- 20 bài tập CO2 tác dụng với dung dịch kiềm thổ có lời giải
- 15 bài toán CO2 tác dụng với dung dịch kiềm, muối cacbonat có lời giải
- 50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giải
- 50 câu hỏi lý thuyết mức độ thông hiểu về ôn tập chương 6 có lời giải
- 20 bài tập mức độ vận dụng cao nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 30 bài tập mức độ vận dụng nhôm, kim loại kiềm và hợp chất tác dụng với nước có lời giải
- 20 bài tập axit tác dụng với muối aluminat có lời giải









